 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: sickle cell anemia, cardiopulmonary bypass, exchange transfusion
En pacientes con anemia falciforme, el circuito de circulación extracorpórea promueve la polimerización de la hemoglobina y la formación de drepanocitos. La exanguinotransfusión reduce los niveles circulantes de hemoglobina S. Reportamos el manejo de un niño con anemia falciforme homocigótica que requirió cirugía de cierre de comunicación interauricular. Se realizó exanguinotransfusión parcial intraoperatoria disminuyendo los niveles de hemoglobina S de 89% a 23%. La circulación extracorpórea fue conducida en normotermia utilizando cardiología fría, realizando el procedimiento quirúrgico en paro sinusal.
La anemia falciforme es la enfermedad hematológica hereditaria más común que afecta los humanos1. Consiste en una mutación genética donde se sustituye timina por adenina, codificando valina en lugar de ácido glutámico en la sexta posición de la cadena beta de la hemoglobina2. Este cambio de un aminoácido polar por uno no polar, altera la solubilidad de la hemoglobina y conlleva a la polimerización de la hemoglobina mientras esta se desoxigena, eventualmente deformando al eritrocito de forma irreversible3. El eritrocito defectuoso disminuye su vida media a tan solo un 10% de lo normal y aumenta de 2 a 10 veces su adherencia al endotelio, contribuyendo a un estado hipercoagulable1. Es clásico que tales determinantes de los síntomas clínicos de la enfermedad (anemia hemolítica crónica y daño orgánico por oclusión vascular) sean desencadenados por hipoxia, hipotermia, acidosis e inflamación4, representando así un gran reto para el tratamiento de pacientes con anemia falciforme que han de ser sometidos a cirugía cardíaca y al circuito de circulación extracorpórea (CEC).
Los pacientes con anemia falciforme que requieren cirugía cardíaca con circulación extracorpórea no son numerosos6, por lo que no existen estudios concluyentes para trazar las pautas adecuadas en estos pacientes. En algunos centros, se realiza de manera rutinaria exanguinotransfusión previa a la cirugía cardíaca7; sin embargo, se han reportado diversas estrategias para su abordaje 7,8,9,10,11,12,13,14,15,16,17. A las medidas generales tales como evitar acidosis, disminución del volumen intravascular y bajo gasto se le añaden elementos sobre el mantenimiento o no de normotermia, la temperatura utilizada en la cardioplegia y la exanguinotransfusión preoperatoria.
Se presenta el caso de un paciente con anemia falciforme homocigota en el que se utilizó una técnica con la que se puede descender la cantidad de hemoglobina S (HbS) hasta <25%.
Se trata de un paciente masculino de 5 años de edad, 17 kg de peso y 110 cm de talla, diagnosticado por ecocardiograma transtorácico con comunicación interauricular tipo Ostium Secundum de 23 mm (1,8 x 1 cm), que se presenta para cirugía de corrección completa. Es producto de un parto prematuro, naciendo con <37 semanas. Con ambos padres portadores, el niño es diagnosticado de anemia falciforme homocigota (hemoglobina S de 88%).
La electroforesis pre-quirúrgica reportó niveles de HbS de 88,7% de un total de hemoglobina (Hb) de 9,8 g/dL. Es admitido a cirugía sin exanguinotransfusión pre-operatoria.
El paciente se mantuvo en ayuno por 11 horas previo a la cirugía. La anestesia fue inducida con sevoflurano y FiO2 al 100% y vecuronio IV por vía periférica a 0,1 mg/kg. Se colocó un tubo endotraqueal No 5,0, línea arterial y línea central por vía yugular. Se ventila hasta alcanzar normocapnia con FiO2 al 100%. Se administra fentanil a 1 mcg/kg previo a la incisión de la piel y se utiliza cefazolina como antibiótico profiláctico.
Para el mantenimiento anestésico se administra oxígeno al 100% y vecuronio hasta que se instaura la circulación extracorpórea. Al destete de circulación extracorpórea el O2 se mantiene en 100% y luego se desciende a 80%, ventilando normalmente. Como analgesia, se administra 0,1 mg/kg de morfina. El tiempo anestésico total fue de 3 horas y 30 minutos.
El circuito de circulación extracorpórea es previamente cebado con solución cristaloide de cloruro de sodio al 0,9% (1.000 mL), 50 mL de albúmina al 20%, 1 mg/kg de furosemida, 2 g de bicarbonato de sodio y 6.000 unidades de heparina. El cebado se hace circular por todo el circuito para eliminar el aire del sistema a la vez que se calienta dicho cebado a una temperatura de 37oC, midiendo ésta última con termómetros colocados en la salida de la línea arterial y la entrada de la línea venosa y oxigenándolo con un litro de oxígeno al 100%. Se circula el cebado por un tiempo de 10 minutos y se procede a añadir 1.000 mL de sangre fresca compatible al circuito, la que se hace circular por el hemoconcentrador con la finalidad de ultrafiltrar y lavar la sangre donada, recolectando en un recipiente el volumen de la ultrafiltración y cerciorándonos de que dicho volumen sea igual al volumen de cristaloide añadido (1.000 mL), el proceso se repite con 2.000 mL adicionales, esta vez con una mezcla de cloruro de sodio al 0,9% y cloruro de sodio al 0,45% para cuidar que los niveles de sodio no superen los 140 mEq/L. Una vez finalizada la ultrafiltración se pinzan las líneas arterial y venosa y se conecta una bolsa transfer a un puerto con Luer de la línea venosa anterior a la pinza.
Una vez canulado el paciente, se procede a realizar una exanguinotransfusión dejando que el volumen sanguíneo del paciente drene a la bolsa transfer a través de la línea venosa e infundiendo el volumen del reservorio del oxigenador a un ritmo lo suficientemente rápido como para evitar variaciones en la hemodinamia del paciente. Luego de haber recolectado unos 500 mL de la volemia del paciente, la bolsa transfer es pinzada y descartada, la pinza de la línea venosa es retirada y se comienza la circulación extracorpórea alcanzando un flujo de 2,8 L por m2 de superficie corporal. Se procede a pinzar la aorta y administrar solución cardiopléjica fría, produciéndose un paro electromecánico. El paciente es mantenido en todo momento a una temperatura de 37oC, con un flujo de aire de un litro y una fracción inspirada de oxígeno (FIO2) de 85%. Se realiza ultrafiltración convencional durante todo el procedimiento. Una vez reparado el defecto y corregido los gases arteriales, se despinza la aorta, reanudándose la actividad cardíaca a ritmo sinusal. Tras haber revisado la inexistencia de algún inconveniente, se comienza a ventilar al paciente y se inicia el destete de la circulación extracorpórea.
Una vez alcanzada estabilidad hemodinámica el paciente es destetado exitosamente y se inicia de inmediato la ultrafiltración modificada (MUF, por sus siglas en inglés) por unos 10 minutos, terminada la misma, se infunde todo el volumen restante del circuito a través de la cánula arterial, se retiran las cánulas venosas, se drena la línea venosa y el volumen es infundido al paciente. Se procede a administrar protamina y llegado al 50% de la cantidad, los aspiradores de la bomba se detienen y una vez administrado el total de la protamina se retira la cánula aórtica.
Los tiempos de pinzamiento aórtico y de circulación extracorpórea fueron 10 minutos y 25 minutos respectivamente. El hematocrito más bajo durante la circulación extracorpórea fue de 26% y el final fue de 32% (Ver Tabla I).
| Inicial | Final | |
| pH | 7,45 | 7,35 |
| PaCO2 (mmHg) | 31 | 45,7 |
| PaO2 (mmHg) | 281 | 118 |
| CO2 (mmol/L) | 23 | 27 |
| SatO2 (%) | 100 | 98 |
| HCO3 (mEq/L) | 22 | 25,5 |
| BE (mmol/L) | -2 | 0 |
| Htco | 26% | 32% |
Tabla I. Gases arteriales durante la circulación extracorpórea.
El paciente es extubado en la Unidad de Cuidados Intensivos una vez el pH, O2, ventilación y temperatura son optimizados. El tiempo de ventilación mecánica fue de 2 horas y 20 minutos; se mantuvo 24 horas en la Unidad de Cuidados Intensivos y es dado de alta domiciliaria 4 días luego de la cirugía sin presentar complicaciones. Durante su estancia hospitalaria se realizó electroforesis de hemoglobina al paciente a las 24 horas, 48 horas y 72 horas siguientes a la cirugía; el valor de la HbS fue de 22,9%, 23,4% y de 29,3% respectivamente (Ver Tabla II y Figura1).
Pre-Qx | Post-quirúrgico | |||
| 24 horas | 48 horas | 72 horas | ||
| Hgb A | 9,7% | 74,4% | 73,5% | 67,4% |
| Hgb F | 0,0% | 0,0% | 0,0% | 0,0% |
| Hgb S/D/G | 88,7% | 22,9% | 23,4% | 29,3% |
| Hgb A2/C/E | 1,7% | 2,7% | 3,1% | 3,3% |
Tabla II. Electroforesis de hemoglobina perioperatoria.
Figura 1. Niveles perioperatorios de HgbA y Hgb S/D/G.
Los determinantes de la polimerización de la HbS son la tensión de oxígeno, la concentración de HbS, la temperatura y la presencia de otras hemoglobinas diferentes de la S1. El principio de la técnica presentada está basado en el control de dichos factores para evitar el desarrollo de alguna crisis que pudiera comprometer la vida del paciente.
Sugerimos la exanguinotransfusión parcial intraoperatoria que intercambia exitosamente los niveles de HbS por hemoglobina A (HbA). De manera general se evitó la acidosis, pues esta decrece la solubilidad de la HbS y se mantuvo un buen flujo de oxígeno en todo momento (FiO2 no menor al 85%). El paciente se mantuvo en normotermia para ayudar a evitar la respuesta motora vaso-oclusiva. Se utilizó cardioplejia cristaloide fría por ser la opción más segura ya que brinda mayor protección miocárdica que la cardioplejia tibia, aunque hay opiniones controvertidas al respecto 7,13,18.
La ultrafiltración previo a la CEC se efectuó ya que corrige los niveles de glicemia y proporciona balance al estado ácido base y electrolítico de la sangre colocada en el cebado8. Se realizó además ultrafiltación convencional en todo momento pues se ha observado mediante ésta la reducción significativa de los principales mediadores inflamarorios tales como C3a, C5a, IL-6 y TNF-a9. Consideramos, basados en la literatura revisada que tales medidas contribuyen a un mejor pronóstico post-operatotio.
La exanguinotransfusión como terapia agresiva (disminuyendo los niveles de HbS a <30% o menos) es considerada para pacientes que serán sometidos a cirugía de alto riesgo10. Sin embargo, dicha guía está basada en pacientes adultos y no toma en cuenta el tipo de intervención quirúrgica a la cual será sometido el paciente. Por tanto, diversos autores han publicado protocolos distintos para este grupo de pacientes. La exanguinotransfusión realizada 24 horas previas a la operación requiere de planificación y control muy estricto que no siempre es factible y además, no es completamente efectiva removiendo la HbS y sustituyéndola por HbA. Para realizar este cambio con éxito, se ha utilizado exanguinotransfusión preoperatoria e intraoperatoria en conjunto, pero esta medida puede requerir un gran volumen de transfusiones y producir coagulopatía dilusional la cual requiere tratamiento con plasma y plaquetas heterólogas5,9. Quizá por esta razón, muchos autores, basado en evidencia reciente, evitan totalmente el uso de exanguinotransfusión4. Sin embargo, estas medidas han sido reportadas exitosas sólo en pacientes falcémicos heterocigotos, con niveles intermedios de hemoglobina.
Sigue siendo imperativo disminuir los niveles de HbS en los pacientes homocigotos. Hemos descrito un manejo exitoso para pacientes que con valores muy altos de hemoglobina S pueden ser sometidos al circuito de circulación extracorpórea sin requerir exanguinotransfusión preoperatoria.
El autor ha completado el formulario de declaración de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declara no haber recibido financiamiento para la realización del artículo/investigación; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. El formulario puede ser solicitado contactando al autor responsable.
Los autores adjuntan declaración de consentimiento de la madre del paciente descrito en este estudio, documento donde ella acepta que la información de su hijo sea reportada en el artículo publicado por Medwave.

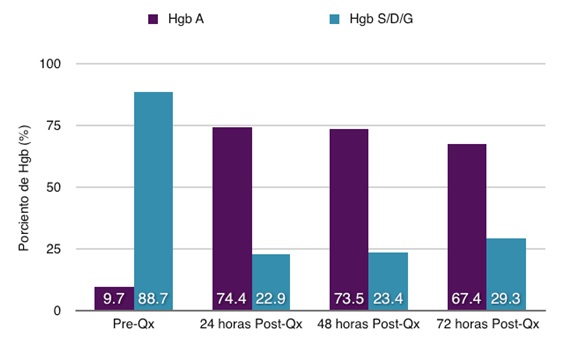 Figura 1. Niveles perioperatorios de HgbA y Hgb S/D/G.
Figura 1. Niveles perioperatorios de HgbA y Hgb S/D/G.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

In patients with sickle cell anemia, the extracorporeal circulation circuit promotes the polymerization of hemoglobin and sickle cell formation. Exchange transfusion reduces circulating levels of hemoglobin S. We report the management of a child with homozygous sickle cell anemia who required surgical closure of atrial septal defect. Partial intraoperative exchange transfusion was performed that decreased hemoglobin S levels from 89% to 23%. Cardiopulmonary bypass was conducted at normothermia with cold blood cardioplegia and the surgical procedure was performed in sinus arrest.
 Autor:
Deyvis Cruz[1]
Autor:
Deyvis Cruz[1]

Citación: Cruz D. Partial exchange transfusion in a patient with homozygous sickle cell disease undergoing heart surgery with cardiopulmonary bypass: a case report. Medwave 2012 Nov;12(10):e5554 doi: 10.5867/medwave.2012.10.5554
Fecha de envío: 8/8/2012
Fecha de aceptación: 24/9/2012
Fecha de publicación: 1/11/2012
Origen: no solicitado
Tipo de revisión: con revisión externa por 2 revisores
Citaciones asociadas
1. Impressum Nov;12(10) Medwave: cuerpo editorial de este número | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Adamko DJ, Agarwal N, Alter BP, Andrews NC, Ansell SM, et al. Wintrobe’s Clinical Hematology. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2009.
Adamko DJ, Agarwal N, Alter BP, Andrews NC, Ansell SM, et al. Wintrobe’s Clinical Hematology. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2009.  Redding-Lallinger R, Knoll C. Sickle cell disease--pathophysiology and treatment. Curr Probl Pediatr Adolesc Health Care. 2006 Nov-Dec;36(10):346-76. | CrossRef | PubMed |
Redding-Lallinger R, Knoll C. Sickle cell disease--pathophysiology and treatment. Curr Probl Pediatr Adolesc Health Care. 2006 Nov-Dec;36(10):346-76. | CrossRef | PubMed | Hemming AE. Pro: Exchange transfusion is required for sickle cell trait patients undergoing cardiopulmonary bypass. J Cardiothorac Vasc Anesth. 2004 Oct;18(5):663-5. | CrossRef | PubMed |
Hemming AE. Pro: Exchange transfusion is required for sickle cell trait patients undergoing cardiopulmonary bypass. J Cardiothorac Vasc Anesth. 2004 Oct;18(5):663-5. | CrossRef | PubMed | Messent M. Con: Exchange transfusion is not required for sickle cell trait patients undergoing cardiopulmonary bypass. J Cardiothorac Vasc Anesth. 2004 Oct;18(5):666-7. | CrossRef | PubMed |
Messent M. Con: Exchange transfusion is not required for sickle cell trait patients undergoing cardiopulmonary bypass. J Cardiothorac Vasc Anesth. 2004 Oct;18(5):666-7. | CrossRef | PubMed | Bocchieri KA, Scheinerman SJ, Graver LM. Exchange transfusion before cardiopulmonary bypass in sickle cell disease. Ann Thorac Surg. 2010 Jul;90(1):323-4. | CrossRef | PubMed |
Bocchieri KA, Scheinerman SJ, Graver LM. Exchange transfusion before cardiopulmonary bypass in sickle cell disease. Ann Thorac Surg. 2010 Jul;90(1):323-4. | CrossRef | PubMed | Harban FM, Connor P, Crook R, Bingham R. Cardiopulmonary bypass for surgical correction of congenital heart disease in children with sickle cell disease: a case series. Anaesthesia. 2008 Jun; 63(6):648-51. | CrossRef | PubMed |
Harban FM, Connor P, Crook R, Bingham R. Cardiopulmonary bypass for surgical correction of congenital heart disease in children with sickle cell disease: a case series. Anaesthesia. 2008 Jun; 63(6):648-51. | CrossRef | PubMed | Adhikari RK, Maddali MM, Zacharias S. Preoperative exchange transfusion for sickle cell disease patients undergoing open-heart surgery: an exception to the rule. J Card Surg. 2010 Nov;25(6):691-3. | CrossRef | PubMed |
Adhikari RK, Maddali MM, Zacharias S. Preoperative exchange transfusion for sickle cell disease patients undergoing open-heart surgery: an exception to the rule. J Card Surg. 2010 Nov;25(6):691-3. | CrossRef | PubMed | Grist G. To wash or not to wash: controlling sodium, glucose and osmolarity in a pediatric extracorporeal circuit blood prime. The virtual textbook of extracorporeal technology. Perfline.com, 2006:1-7. [on line] | Link |
Grist G. To wash or not to wash: controlling sodium, glucose and osmolarity in a pediatric extracorporeal circuit blood prime. The virtual textbook of extracorporeal technology. Perfline.com, 2006:1-7. [on line] | Link | Sutton SW, Hunley EK, Duncan MA, Rodriguez R, Meyers TP. Sickle cell disease and aortic valve replacement: use of cardiopulmonary bypass, partial exchange transfusion, platelet sequestration, and continuous hemofiltration. Tex Heart Inst J. 1999;26(4):283-8. | PubMed | PMC |
Sutton SW, Hunley EK, Duncan MA, Rodriguez R, Meyers TP. Sickle cell disease and aortic valve replacement: use of cardiopulmonary bypass, partial exchange transfusion, platelet sequestration, and continuous hemofiltration. Tex Heart Inst J. 1999;26(4):283-8. | PubMed | PMC | Lottenberg R, Hassell KL. An evidence-based approach to the treatment of adults with sickle cell disease. Hematology Am SocHematolEduc Program. 2005:58-65. | CrossRef | PubMed |
Lottenberg R, Hassell KL. An evidence-based approach to the treatment of adults with sickle cell disease. Hematology Am SocHematolEduc Program. 2005:58-65. | CrossRef | PubMed | Singh J, Mehta S, Sharma R, Rana SS, Thingnam SK, Dhaliwal RS. Cardiopulmonary bypass in sickle cell disease. Asian Cardiovasc Thorac Ann. 2006 Oct;14(5):445-6. | PubMed |
Singh J, Mehta S, Sharma R, Rana SS, Thingnam SK, Dhaliwal RS. Cardiopulmonary bypass in sickle cell disease. Asian Cardiovasc Thorac Ann. 2006 Oct;14(5):445-6. | PubMed | Usman S, Saiful FB, DiNatale J, McGinn JT. Warm, beating heart aortic valve replacement in a sickle cell patient. Interact Cardiovasc Thorac Surg. 2010 Jan;10(1):67-8.
| CrossRef | PubMed |
Usman S, Saiful FB, DiNatale J, McGinn JT. Warm, beating heart aortic valve replacement in a sickle cell patient. Interact Cardiovasc Thorac Surg. 2010 Jan;10(1):67-8.
| CrossRef | PubMed | Yousafzai SM, Ugurlucan M, Al Radhwan OA, Al Otaibi AL, Canver CC. Open heart surgery in patients with sickle cell hemoglobinopathy. Circulation. 2010 Jan 5;121(1):14-9. | CrossRef | PubMed |
Yousafzai SM, Ugurlucan M, Al Radhwan OA, Al Otaibi AL, Canver CC. Open heart surgery in patients with sickle cell hemoglobinopathy. Circulation. 2010 Jan 5;121(1):14-9. | CrossRef | PubMed | Bhatt K, Cherian S, Agarwal R, Jose S, Cherian KM. Perioperative management of sickle cell disease in paediatric cardiac surgery. Anaesth Intensive Care. 2007 Oct;35(5):792-5. | PubMed |
Bhatt K, Cherian S, Agarwal R, Jose S, Cherian KM. Perioperative management of sickle cell disease in paediatric cardiac surgery. Anaesth Intensive Care. 2007 Oct;35(5):792-5. | PubMed | Edwin F, Aniteye E, Tamatey M, Frimpong-Boateng K. eComment: Cardiopulmonary bypass without exchange transfusion in sickle cell disease--an update. Interact Cardiovasc Thorac Surg. 2010 Jan;10(1):68-9. | CrossRef | PubMed |
Edwin F, Aniteye E, Tamatey M, Frimpong-Boateng K. eComment: Cardiopulmonary bypass without exchange transfusion in sickle cell disease--an update. Interact Cardiovasc Thorac Surg. 2010 Jan;10(1):68-9. | CrossRef | PubMed | Maddali MM, Rajakumar MC, Vishnu PP, Valliattu J. Management of sickle cell disease during CABG surgery--a case report. Middle East J Anesthesiol. 2006 Oct;18(6):1139-45. | PubMed |
Maddali MM, Rajakumar MC, Vishnu PP, Valliattu J. Management of sickle cell disease during CABG surgery--a case report. Middle East J Anesthesiol. 2006 Oct;18(6):1139-45. | PubMed | Vichinsky EP, Haberkern CM, Neumayr L, Earles AN, Black D, Koshy M, et al. A comparison of conservative and aggressive transfusion regimens in the perioperative management of sickle cell disease. The Preoperative Transfusion in Sickle Cell Disease Study Group. N Engl J Med. 1995 Jul 27;333(4):206-13. | CrossRef | PubMed |
Vichinsky EP, Haberkern CM, Neumayr L, Earles AN, Black D, Koshy M, et al. A comparison of conservative and aggressive transfusion regimens in the perioperative management of sickle cell disease. The Preoperative Transfusion in Sickle Cell Disease Study Group. N Engl J Med. 1995 Jul 27;333(4):206-13. | CrossRef | PubMed | Al-Ebrahim KE. Cardiac surgery and sickle cell disease. Asian Cardiovasc Thorac Ann. 2008 Dec;16(6):479-82. | PubMed |
Al-Ebrahim KE. Cardiac surgery and sickle cell disease. Asian Cardiovasc Thorac Ann. 2008 Dec;16(6):479-82. | PubMed | Maddali MM, Rajakumar MC, Fahr J, Albahrani MJ, Amna MA. Cardiopulmonary bypass without preoperative exchange transfusion in sicklers. Asian Cardiovasc Thorac Ann. 2006 Feb;14(1):51-6. | PubMed |
Maddali MM, Rajakumar MC, Fahr J, Albahrani MJ, Amna MA. Cardiopulmonary bypass without preoperative exchange transfusion in sicklers. Asian Cardiovasc Thorac Ann. 2006 Feb;14(1):51-6. | PubMed | Compromiso renal en niños sometidos a oxigenación con membrana extracorpórea (ECMO)
Compromiso renal en niños sometidos a oxigenación con membrana extracorpórea (ECMO)