 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: COVID-19 disease, biomarkers, degree of severity
Introducción
COVID- 19, es una enfermedad que ha cobrado la vida de muchas personas. Sin embargo, las alteraciones en los perfiles de labora-torio en la ciudad de Tacna, no han sido establecidas de manera precisa en asociacion a su gravedad para apoyo en el diagnostico y tratamiento.
Objetivo
Determinar los biomarcadores que esten relacionados al grado de severidad de los pacientes COVID- 19 atendidos en el hospital de la seguridad social, en Tacna durante 2020.
Métodos
Estudio observacional, transversal y analitico. Conformado por 308 pacientes con COVID- 19 del hospital de la seguridad social de la ciudad de Tacna, Peru, durante el golpe de la “primera ola” (de julio a agosto de 2020). Se recolectaron resultados de marcadores inmunologicos, hematologicos, gases arteriales, hemostasia y bioquimicos. Los pacientes se categorizaron en leves, moderados y severos, basandonos en el criterio medico – clinico de la historia clinica. Las correlaciones y fuerza de correlacion fueron realizadas segun coeficiente Rho de Spearman. El rendimiento de los biomarcadores asociado a la gravedad, se realizo con curva Receiver Operating Characteristic.
Resultados
En marcadores hematologicos existe correlacion positiva con recuento de monocitos (coeficiente de correlacion: 0,841; area bajo la curva 97,0%; p < 0,05) y correlacion negativa con recuento de linfocitos (coeficiente de correlacion: -0,622; area bajo la curva 8.27%; p < 0,05). En marcadores bioquimicos, gases arteriales y hemostasia, no se hallaron correlaciones significativas. En marcadores in-munologicos, encontramos correlacion positiva con ferritina (coeficiente de correlacion: 0,805; area bajo la curva 94,0%; p < 0,05), y proteina C reactiva (coeficiente de correlacion: 0,587; area bajo la curva 87,4%; p < 0,05).
Conclusiones
Los biomarcadores que pueden considerarse como parametros asociados a la gravedad de COVID- 19, son el recuento sanguineo absoluto de monocitos y la concentracion serica de ferritina.
|
Ideas clave
|
Para la Organización Mundial de la Salud (OMS), el COVID- 19 es una enfermedad infecciosa causada por el virus de SARS- CoV- 2 que brotó por primera vez en Wuhan (China) a fines de 2019. Esta infección genera diversas complicaciones, entre ellas el síndrome respiratorio agudo severo (SARS) [1].
A nivel mundial, desde que se inició la pandemia hasta octubre de 2021, más de 249 millones de personas se han contagiado con este nuevo virus y 2,07% ha fallecido [2], Además, se ha observado que aquellas personas que presentan edades avanza-das y/o comorbilidad, tienen mayor predisposición de desencadenar un cuadro grave, caracterizado por neumonía grave o insuficiencia orgánica múltiple que es el causante de su fallecimiento [3]. Perú no es ajeno a esta realidad, ya que hasta el periodo señalado se han reportado más de 2 millones de casos confirmados de COVID- 19 y más de 200 mil muertes [2].
Las características clínicas de COVID- 19 han sido ampliamente descritas por diversos países a nivel mundial, definiendo clara-mente sus signos y síntomas. Sin embargo, la presencia de alte-raciones en los perfiles de laboratorio no han sido establecidas de manera precisa, ni con alteraciones definidas que puedan ayudar a prevenir complicaciones en los pacientes [4].
Diversas investigaciones han demostrado que los biomarcadores como la proteína C reactiva, la deshidrogenasa láctica, troponina T, ferritina, parámetros hematológicos y dímero D son útiles en la práctica clínica porque permiten categorizar mejor a los pacientes según su estado de severidad [5]. En las investigaciones realizadas por Sirvent J. et al. en España [6], Pujani M. et al. en la India [7] y Galicia C. et al. en México [8], han demostrado que estos biomarcadores se ven significativamente altera-dos por la insuficiencia orgánica múltiple que produce este virus en sus estadios más avanzados, debido a la hiperinflamación sostenida e hipoxia secundaria que sufren los diferentes órganos [9].
Al momento de la elaboración de este trabajo, en Tacna existen más de 30 mil casos confirmados de COVID- 19, cuyas complicaciones han resultado en el fallecimiento de casi dos mil personas [10]. Así nace una urgente necesidad de estandarizar los biomarcadores de laboratorio, que tenga en cuenta las características de la población tacneña y que permitan identificar la progresión de la enfermedad hacia los estadios más avanzados [11].
Por tal motivo, en nuestro estudio buscamos determinar los biomarcadores que estén relacionados con el grado de severidad de los pacientes COVID- 19 atendidos en el hospital de la seguridad social de Tacna. Asimismo, se orienta a establecer criterios que permitirán la estratificación del riesgo y encaminar las intervenciones oportunas dirigidas a pacientes con mayor probabilidad de desarrollar complicaciones graves.
El presente estudio observacional, transversal y analítico, se realizó en el hospital de la seguridad social en la ciudad de Tacna, Perú, del 1 de junio al 30 de agosto de 2020. Este trabajo contó con el consentimiento del Comité de Ética en Investigación (CEI) de la Universidad Privada de Tacna, con Código de Registro CEI- 001.
La investigación estuvo conformada por 308 pacientes con manifestación clínica de infección a las vías respiratorias bajas que dieron positivo a COVID- 19 mediante el test rápido de antígeno para la detección de SARS- CoV- 2, o con el ensayo de reacción en cadena de la polimerasa con transcripción inversa en tiempo real (prueba RT- PCR).
Los criterios de exclusión fueron pacientes menores de 18 años, pacientes con antecedentes de enfermedades, trastornos o condiciones clínicas (antecedentes de anemia, púrpura trombocitopénica, alergias, leucemia, entre otras) que afecten de forma basal el recuento o dosaje de los analitos testados como biomarcadores de gravedad de COVID- 19.
Se recopilaron datos del sistema de gestión de laboratorio, previo al cual se consideró la recogida de muestras de suero, plasma y sangre total de los pacientes al ingreso. La ferritina, troponina I y procalcitonina fueron testeados empleando el método de electroquimioluminiscencia en el equipo automatizado COBAS E411 de Roche Diagnostics. Los biomarcadores hematológicos (recuento absoluto de leucocitos, eosinófilos, basófilos, neutrófilos, linfocitos y plaquetas) se midieron con el equipo automatizado de cinco estirpes XS- 1000i de Sysmex- Roche Diagnostics. Los biomarcadores obtenidos de los gases arteriales (pH, presión parcial de oxígeno, presión parcial de dióxido de carbono, saturación arterial de oxígeno, porcentaje fraccional de oxígeno inspirado, concentración de bicarbonato-, sodio, potasio, cloro, calcio iónico, lactato) se midieron con el equipo automatizado ABL800 FLEX de Radiometer. Los biomarcadores de coagulación (tiempo de protrombina, fibrinógeno y dímero D) se midieron con el equipo automatizado Coatron A6 Plus de TECO Medical Instruments. Los biomarcadores bioquímicos (láctico deshidrogenasa, aspartato aminotransferasa, alanina- aminotransferasa, creatina fosfoquinasa total, creatina fosfoquinasa en miocardio, glucosa, urea y creatinina) se estimaron con el equipo automatizado BA400 de Byosistem, además de la proteína C reactiva, que es un marcador inmunológico. Los métodos analíticos se realizaron según las indicaciones del fabricante, considerando los controles de calidad interno y externo.
Los pacientes se categorizaron en leves, moderados y severos, basándonos en el criterio médico – clínico reportado en la historia clínica. Los pacientes con síntomas clínicos leves no exhibieron cambios en las imágenes pulmonares. El tipo moderado se caracterizó por uno de los siguientes síntomas: saturación de oxígeno en sangre en reposo menor o igual a 93%, frecuencia respiratoria superior o igual a 30 por minuto, relación presión parcial alveolar de oxígeno/porcentaje fraccional de oxígeno inspirado inferior a 300 milímetros de mercurio e infiltrados pulmonares superior a 50% en un periodo de 24 a 48 horas de iniciado los síntomas [12]. Los casos críticos fueron aquellos que presentaron insuficiencia respiratoria con ventilación mecánica, que requirió seguimiento en la unidad de cuidados intensivos).
Para el análisis estadístico se aplicó la prueba de Kolmogorov- Smirnov, para corroborar la normalidad de la muestra. Las correlaciones y fuerza de correlación entre variables fueron realizadas según el coeficiente Rho de Spearman. Los analitos de los biomarcadores hematológicos, bioquímicos, inmunológicos, gases arteriales y de hemostasia fueron expresados según las categorías leve, moderada y severa en media más/menos desviación estándar (DE). Las diferencias entre medias de los valores de los biomarcadores, fueron analizadas mediante la prueba de rangos de Wilcoxon para muestras independientes.
El rendimiento de los biomarcadores asociados a la gravedad de COVID- 19 se realizó con la curva ROC (acrónimo de Receiver Operating Characteristic, o característica operativa del receptor) donde hallamos el área bajo la curva ROC, llamada común-mente AUC (área bajo la curva). La realización de las pruebas estadísticas antes mencionadas fue valorada mediante el software SPSS Statistics Data versión 25, considerándose significativos valores de p < 0,05.
La información fue recogida entre los meses de julio y agosto del año 2020, cuando el “máximo” de la ola de la pandemia golpeaba a la ciudad de Tacna en Perú, razón por la cual la mayor proporción de la población es de estadio entre moderado y grave de COVID- 19.
El desabastecimiento de reactivos y la falta de un protocolo de exámenes de laboratorio estandarizado para COVID- 19, se muestra como limitante para contar una mayor población de estudio.
Se evaluó a 308 participantes con diagnóstico clínico de enfermedad COVID- 19. En ellos identificamos 36 analitos de laboratorio, los cuales se caracterizaron en las siguientes áreas: hematología, bioquímica, inmunología, hemostasia y gases arte-riales y electrolitos.
De la población total estudiada, el 69% fue de sexo masculino, el 36% mostró algún tipo de comorbilidad, asimismo, la edad media fue de 61,2 ± 13,7 años.
En la Tabla 1, se evidencia que de 308 pacientes con COVID- 19 elegibles, la media de la edad fue de 61,2 años (intervalo de confianza: 59,6 a 62,7 años), la población de sexo femenino representó el 31% (media de edad: 64,5 años), el sexo masculino el 69% (media de edad: 59,7 años). El 36% de la población en estudio manifestó alguna comorbilidad, siendo las más frecuentes diabetes (17%) e hipertensión arterial (8%).
Tabla 1. Correlación entre severidad de COVID-19 con biomarcadores de laboratorio clínico.
Al correlacionar el grado de severidad de COVID- 19 con los analitos de laboratorio observamos correlación positiva y negativa.
Con respecto a la correlación positiva se reportó que esta fue:
a) De grado alto con el recuento absoluto de monocitos y la concentración sérica de ferritina.
b) De grado moderado, con el recuento absoluto de leucocitos, neutrófilos, troponina I y proteína C reactiva.
c) De grado bajo con lactato deshidrogenasa, urea, procalcitonina y lactato.
d) De grado muy bajo con la concentración sanguínea de potasio, cloro, calcio iónico, dímero D, glucosa y creatinina.
Asimismo, en la correlación negativa observamos que esta fue de grado bueno con el recuento absoluto de linfocitos, de grado moderado con el recuento absoluto de eosinófilos y plaquetas y de grado bajo con la concentración sanguínea de presión parcial de oxígeno y saturación arterial de oxígeno.
El recuento absoluto de monocitos y la concentración sérica de ferritina mostraron mayor fuerza de correlación, la que se asocia al grado de severidad de COVID- 19.
Los grados de severidad clínica de COVID- 19 leve, moderado y grave fueron sometidos a prueba de normalidad, cuyos resultados se compararon mediante la prueba de Kruskal Walis.
En la Tabla 2, se observa diferencia con significancia estadística (p < 0,05), donde el recuento absoluto de leucocitos, monocitos, neutrófilos, la concentración sérica de deshidrogenasa láctica, alanina aminotransferasa, creatina quinasa isoenzima del miocardio, glucosa, urea, creatinina, los valores en sangre de porcentaje fraccional de oxígeno inspirado, sodio, potasio, lactato, la concentración sérica de ferritina, troponina I, procalcitonina y proteína C reactiva, y la concentración plasmática de dímero D; fue mayor en los pacientes con COVID- 19 grave con respecto a los leve y moderado. En tanto, el recuento absoluto de eosinófilos, linfocitos, plaquetas y los valores en sangre de presión parcial de oxígeno y saturación arterial de oxígeno fue menor en los pacientes con COVID- 19 grave con respecto a los leve y moderado.
En la Tabla 3 y Figura 1, se construyeron curvas ROC para evaluar la asociación del estado grave o severo en pacientes COVID- 19 al ingreso, con los biomarcadores de laboratorio clínico. Los resultados mostraron que el área bajo la curva de mayor rendimiento en los biomarcadores hematológicos fueron monocitos (área bajo la curva: 97%) y eosinófilos (área bajo la curva 84,3%). En los biomarcadores bioquímicos fueron láctico deshidrogenasa (área bajo la curva: 67,4%) y urea (área bajo la curva: 66,9%). En los biomarcadores de gases arteriales fue-ron saturación arterial de oxígeno (área bajo la curva: 66,3%) y presión parcial de oxígeno (área bajo la curva: 63,1%); mientras que en los biomarcadores inmunológicos fueron ferritina (área bajo la curva: 94%) y proteína C reactiva (área bajo la curva: 87,4%).
Los analitos de laboratorio que mostraron mejor rendimiento en asociación con el estado grave o severo en pacientes COVID- 19 fueron el recuento sanguíneo absoluto de monocitos, la concentración sérica de ferritina y la proteína C reactiva.
Este estudio evidenció dentro de los participantes elegibles un alto porcentaje de comorbilidad, presente en aproximadamente el 36% de los pacientes. Estos resultados se asemejan a los encontrados en un estudio realizado en Perú en el año 2020, donde los porcentajes de comorbilidad fueron cercanos al 40% [13]. Podemos apreciar también una correlación positiva del grado de severidad con el recuento absoluto de monocitos y la concentración de ferritina sérica. Estos resultados comparten similitud con los hallazgos de Lippi G. et al. y Zeng. et al. [4],[9] que colocan a los recuentos hematológicos y a la ferritina sérica como marcadores de progresión de severidad, debido a su correlación positiva. No obstante, debe tomarse en cuenta que estos estudios fueron realizados en otro contexto y que nuestro trabajo presentó ciertas limitaciones metodológicas como la ausencia de datos en la historia clínica, las que impactaron directamente en el tamaño de la muestra.
Por otro lado, se encontró que en los pacientes con presentación de COVID- 19 grave, existe una diferencia estadística significativa (p < 0,05) en parámetros como el recuento absoluto de leucocitos, monocitos, neutrófilos, la concentración sérica de lactato deshidrogenasa, alanina aminotransferasa, creatina qui-nasa isoenzima en miocardio, glucosa, urea, creatinina, ferritina, troponina I, procalcitonina, proteína C reactiva y la concentración plasmática de dímero D. Respecto al rendimiento de los biomarcadores, el recuento sanguíneo absoluto, la ferritina y la proteína C reactiva revelaron un mayor rendimiento asociado al estado grave en el manejo de los pacientes.
Tomando en cuenta los resultados obtenidos en nuestro estudio podemos apreciar que en el apartado de biomarcadores hematológicos, existe una correlación positiva del recuento total de leucocitos, monocitos y neutrófilos con el grado de severidad. Dichos resultados coinciden con el estudio realizado por Michael B. et al. [14] donde se evidencia correlación positiva tanto en el recuento de leucocitos como de neutrófilos. Por otro lado, el metanálisis realizado por Ghahramani S. et al. [15] nos muestra que existe una correlación negativa con respecto a el recuento de linfocitos, eosinófilos y plaquetas. Estos datos son coincidentes con los reportados en nuestro estudio.
Diversos estudios realizados en diferentes contextos y realidades, como Mardani R. et al. en Irán, Dong X. et al. en China, Bennouar S. et al. en Argelia y Aloisio E. et al. en Italia [16],[17],[18],[19], indican que existe una correlación significativa entre lactato deshidrogenasa y el grado de severidad de los pacientes diagnosticados con COVID- 19. Resultados que respaldan lo reportado en la presente investigación. Además, hemos encontrado una correlación significativa con la glucosa, creatinina y urea.
Con respecto a los biomarcadores de gases arteriales y electrolitos, luego del análisis estadístico se determinó que existe correlación positiva baja en las determinaciones de presión parcial de oxígeno, porcentaje fraccional de oxígeno inspirado, potasio, cloro, calcio iónico y lactato. También se estableció una correlación negativa en la determinación de saturación arterial de oxígeno.
Gutiérrez J. et al. [20] muestran que los exámenes de troponina I y procalcitonina (PCT), presentan correlación al grado de severidad de los pacientes con COVID- 19. Por otro lado, Huang I. et al. [21] indican en su estudio de biomarcadores inmunológicos que los exámenes que presentan correlación son PCR, PCT y ferritina. Dichos hallazgos concuerdan totalmente al compararlos con los obtenidos en el presente trabajo.
En el apartado de biomarcadores de coagulación se puede constatar que no se encontró correlación entre el grado de seguridad y los exámenes de tiempo de protrombina, razón normalizada internacional y fibrinógeno. A diferencia del examen de dímero D que evidenció una correlación positiva. Long H. et al. [22], en su investigación realizada en el Hospital Tianyou de la Universidad de Ciencia y Tecnología de Wuhan, a pesar de ser epidemiológicamente distinta, da cuenta de resultados similares con respecto al dímero D. Sin embargo, encuentra una correlación positiva entre la medición de fibrinógeno y el grado de severidad en los pacientes diagnosticados con COVID- 19.
Bajo nuestro contexto, sobre las diferencias en los biomarcadores de laboratorio según la estratificación de la gravedad de los pacientes con COVID- 19, hemos dado con resultados que son compartidos con otros estudios.
Gallo B. et al. [23], Tan L. et al. [24] y Henry B. et al. [25], reportan hallazgos de disminución del recuento de linfocitos en pacientes con diagnóstico de COVID- 19 grave. Los estudios de Lippi G. [26] y Tjendra Y. et al. [27] asocian en su estudio un conteo bajo de plaquetas al grado de severidad grave de COVID- 19. Por otro lado, Tuta E. et al. [28] y Dinevari M. [29] evidencian valores bajos de los niveles de hemoglobina y su presencia en casos graves de COVID- 19. Coincidiendo con los hallazgos de linfocitos y plaquetas, mas no con los niveles de hemoglobina. Esto puede deberse a la naturaleza de los estudios o al tipo de población.
Por otro lado, se encontró que la mayoría de los exámenes bio-químicos e inmunológicos de este estudio presentaron un aumento con respecto a la gravedad en la cual se presenta la enfermedad, a excepción de la aspartato aminotransferasa y la creatina fosfoquinasa total. Estos resultados se corresponden a los encontrados por Gutiérrez et al. [20] y Ocampo C. et al. [30] en sus trabajos sobre el comportamiento de los biomarcadores.
Respecto al rendimiento de los biomarcadores de laboratorio clínico en el pronóstico de gravedad, el presente estudio resaltó exámenes del apartado hematológico e inmunológico. Los pará-metros que presentaron un mejor rendimiento fueron el recuento de eosinófilos, monocitos, linfocitos, neutrófilos, plaquetas, proteína C reactiva y ferritina. Estos resultados comparten similitudes con investigaciones realizadas en otros con-textos como los efectuados por Fang L. et al. [31], Gutiérrez C. et al. [20] y Ocampo C. et al. [30].
Se debe recalcar que es de suma importancia el establecer perfiles de riesgo y diagnóstico que involucren la medición de bio-marcadores, ya sea para el manejo o el pronóstico de pacientes con COVID- 19.
Limitaciones
Por último, cabe mencionar que este estudio presenta ciertas limitantes. Entre ellas el contexto de pandemia en el cual se realizó la recopilación de los datos, limitando la información disponible. A ello se suma el hecho de que el manejo de estos pacientes variaba continuamente en relación al conocimiento científico de ese momento. Por otro lado, el tamaño muestral fue relativamente reducido por causas ajenas al estudio, lo cual hace discutible si los resultados obtenidos pueden reproducirse en otras regiones.
Con el llamado “máximo de ola”, la pandemia de COVID- 19 ha tenido momentos de alcance masivo. Ante ese tipo de escenarios críticos, es necesario garantizar el uso racional de los recursos médicos con el fin de alcanzar un tratamiento efectivo en pacientes en estado severo. Para ello se requiere el uso de herramientas diagnósticas de alerta oportuna para reducir la mortalidad en la población afectada. En el presente trabajo, investigamos la correlación y la fuerza de esta entre los biomarcadores de laboratorio y el grado de severidad en pacientes con enfermedad COVID- 19. Encontramos que el recuento absoluto de monocitos y la concentración sérica de ferritina, fueron los hallazgos característicos de mayor grado de correlación, así como mayor grado de asociación. Esto los diferencia como parámetros de laboratorio, lo que permite distinguir COVID- 19 severo de leve o moderado.
Metodológicamente el presente estudio muestra la posibilidad de integrar en una proporción matemática a ambos analitos (monocitos y ferritina) para ser evaluados como índice de inflamación y, posiblemente, como un predictor de estado de hiperinflamación por COVID- 19.
Considerando que la recolección de datos para el presente estudio se realizó en el “máximo” de la primera ola de la pandemia en la ciudad de Tacna, se recomienda efectuar más investigaciones con un mayor número de pacientes para confirmar nuestros hallazgos.
Implicancias
Autoría
MCRR: investigadora principal, realizó aportaciones importantes a la idea y diseño del estudio, llevó a cabo la planificación, documentación y elaboración del proyecto de investigación, hizo revisión literaria del trabajo en mención, ejecutó la interpretación de datos y análisis de resultados, elaboró el artículo presentado. EACC: co- investigador, realizó aportaciones importantes a la idea y diseño del estudio, obtuvo y organizó la data necesaria para la elaboración del trabajo de investigación, hizo revisión literaria del trabajo en mención, llevó a cabo la interpretación de datos, análisis y presentación de resultados, realizó las conclusiones finales. JJCC: co- invetigador, realizó aportaciones importantes a la idea y diseño del estudio, ayudó a obtención y organización de la data, ejecutó la interpretación de datos y análisis de resultados e hizo la revisión literaria necesaria con lo que elaboró la discusión del trabajo de investigación. DAMB: aprendiz de investigador, hizo la revisión literaria necesaria y apoyó la organización de los datos.
Agradecimientos
Los investigadores agradecemos y reconocemos el incondicional apoyo de la Dra. Giuliana Mónica Fuentes Aliaga, por facilitarnos el acceso a la información que nos permitió alcanzar los objetivos de la investigación.
Conflictos de intereses
Los autores declaran que no tienen intereses en competencia.
Financiamiento
Los autores declaran que el estudio actual fue financiado por la Universidad Privada de Tacna, en su IX CONVOCATORIA A CONCURSO DE FINANCIAMIENTO DE PROYECTOS DE INVESTIGACIÓN “UNIVERSIDAD PRIVADA DE TACNA”
Aspectos éticos
Los autores declaran que el estudio actual tuvo la aprobación y el consentimiento ético del Comité de Ética en Investigación de la Universidad Privada de Tacna, con Código de Registro CEI- 001.
Declaración de acceso a datos
Los conjuntos de datos generados y analizados durante el estudio actual no están disponibles públicamente debido a que son datos de historias clínicas de pacientes diagnosticados con COVID- 19 y se utilizaron bajo licencia del hospital de la seguridad social de Tacna para el estudio actual. Sin embargo, los datos están disponibles de los autores a solicitud razonable y con el permiso de la institución antes mencionada.
Origen y arbitraje
No solicitado. Con revisión por pares externos, por tres árbitros a doble ciego.
Idioma del envío
Español

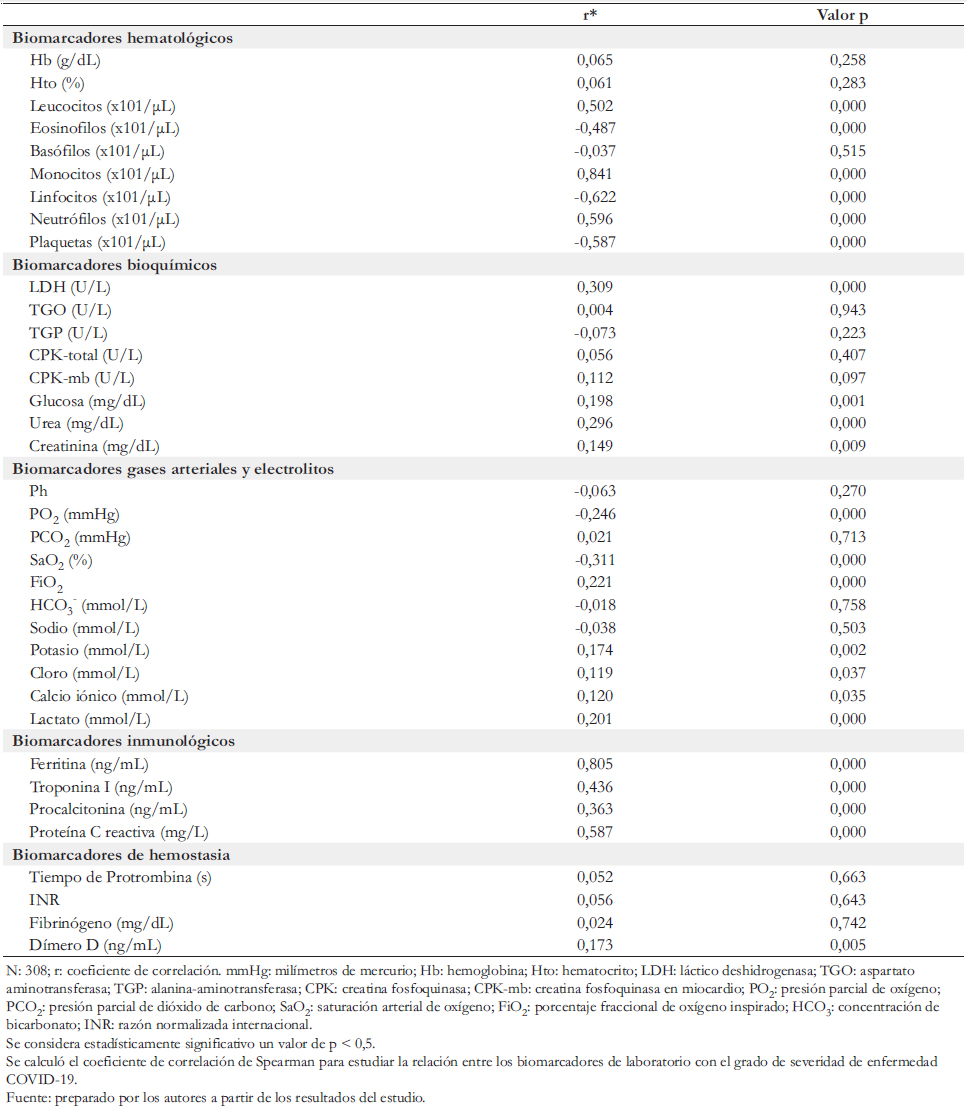 Tabla 1. Correlación entre severidad de COVID-19 con biomarcadores de laboratorio clínico.
Tabla 1. Correlación entre severidad de COVID-19 con biomarcadores de laboratorio clínico.

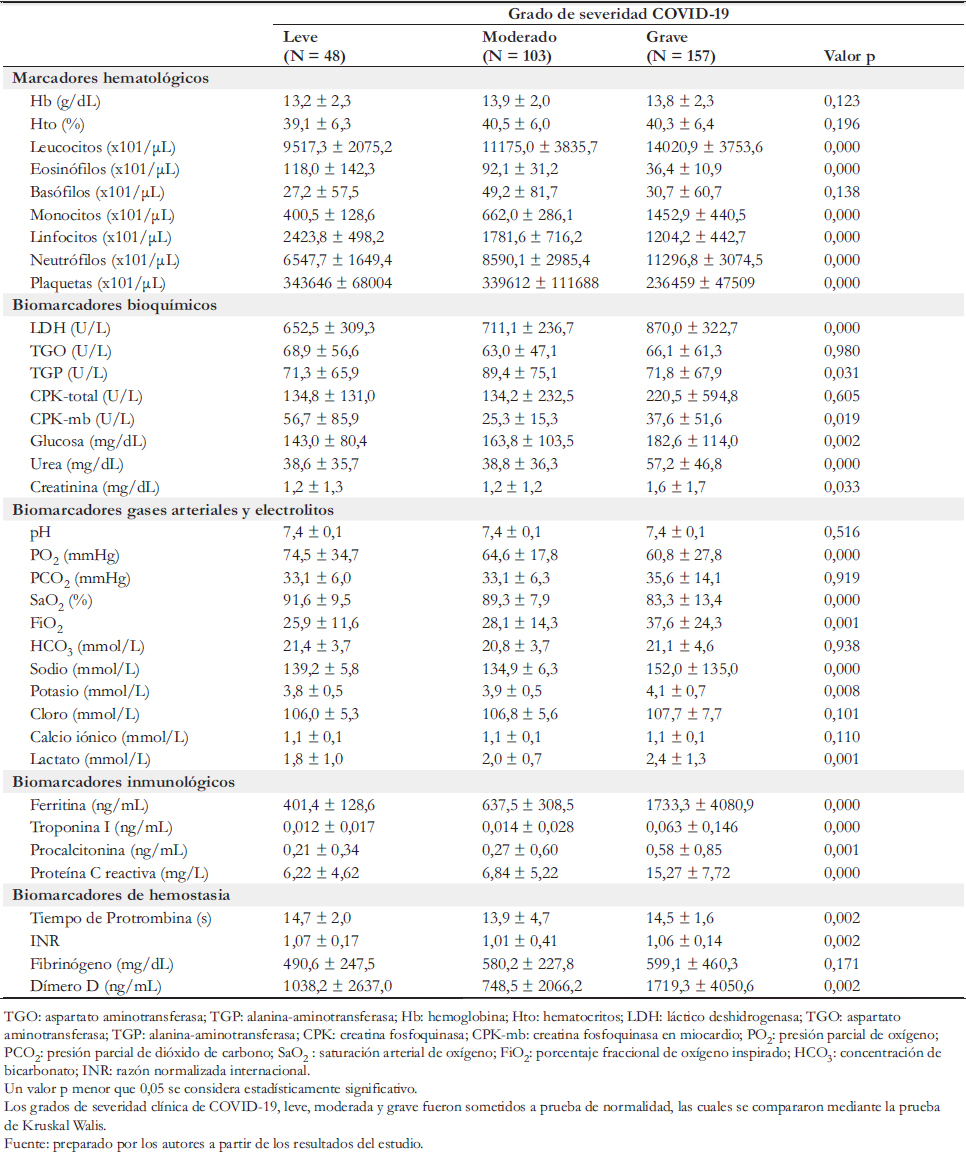 Tabla 2. Diferencia de los biomarcadores de laboratorio según la gravedad de la enfermedad de pacientes COVID-19.
Tabla 2. Diferencia de los biomarcadores de laboratorio según la gravedad de la enfermedad de pacientes COVID-19.

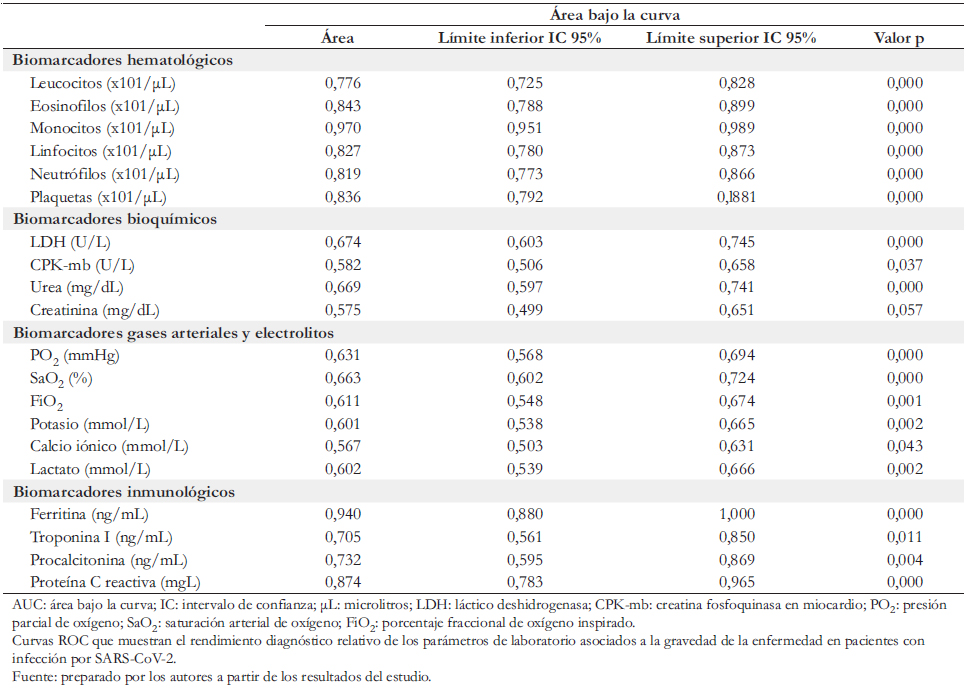 Tabla 3. Rendimiento de los biomarcadores de laboratorio clínico (AUC) de pronóstico de gravedad de COVID-19.
Tabla 3. Rendimiento de los biomarcadores de laboratorio clínico (AUC) de pronóstico de gravedad de COVID-19.

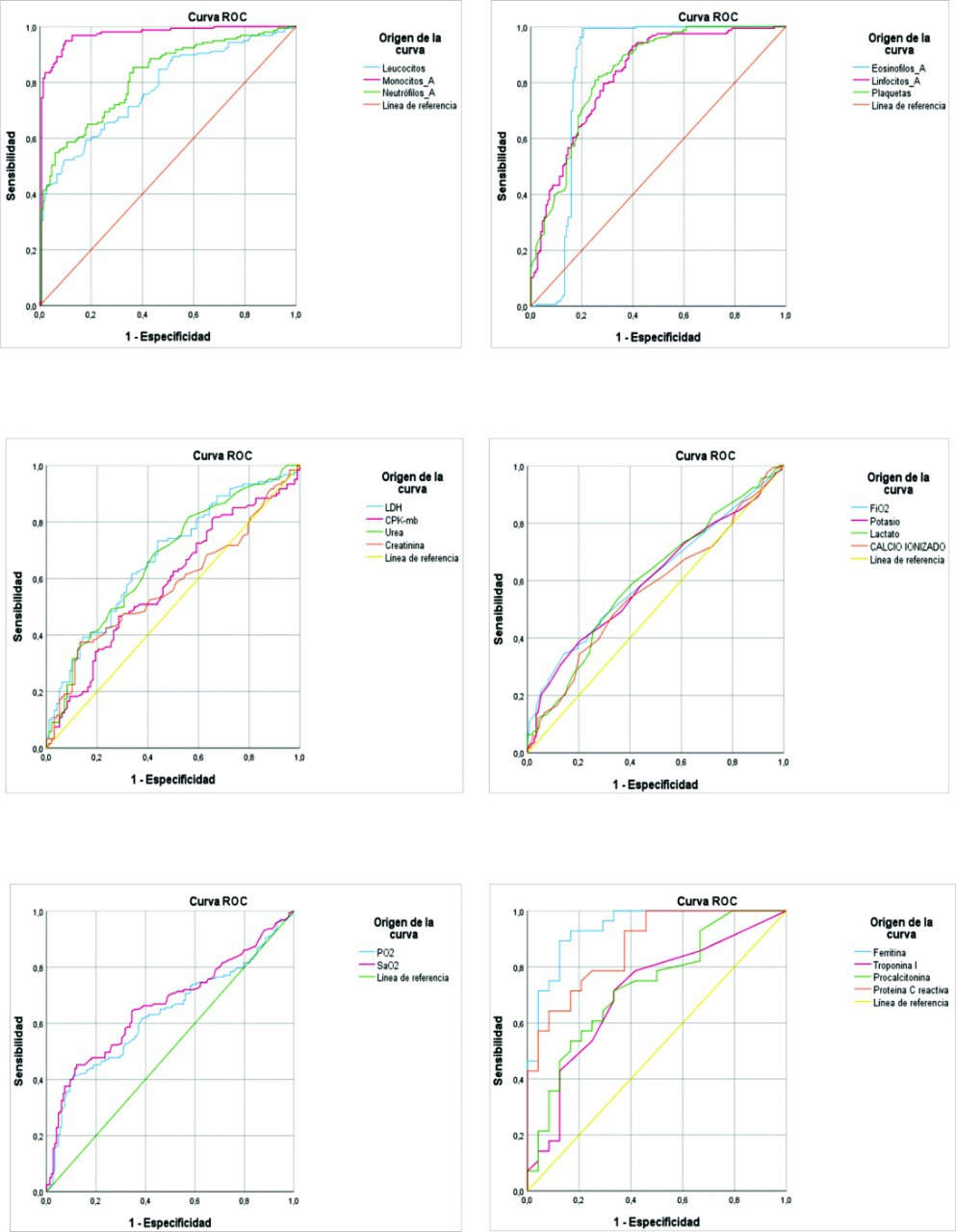 Figura 1. Análisis ROC utilizando biomarcadores hematológicos en el diagnóstico de casos graves de COVID-19.
Figura 1. Análisis ROC utilizando biomarcadores hematológicos en el diagnóstico de casos graves de COVID-19.

Introduction
COVID- 19 is a disease that has claimed the lives of many people. However, alterations in labo-ratory profiles in the city of Tacna have not been accurately established in association with its severity to support diagnosis and treatment.
Objective
To determine biomarkers related to the severity of COVID- 19 in patients treated at the social security hospital in Tacna during 2020.
Methods
We performed an observational, cross- sectional, and analytical study that included 308 patients with COVID- 19 from the social security hospital in Tacna, Peru, during the "first wave" of the pandemic (from July to August 2020). Immunological, hematological, arterial gas, hemostasis, and biochemical markers were collected. Patients were categorized into mild, moderate, and severe based on the clinical criteria found on clinical records. Correlation strength was per-formed according to Spearman’s Rho coefficient. The performance of the biomarkers associat-ed with severity was analyzed with the Receiver Operating Characteristic curve.
Results
Regarding hematological markers there was a positive correlation with monocyte count (correla-tion coefficient: 0.841; area under the curve 97.0%; p < 0.05) and a negative correlation with lymphocyte count (correlation coefficient: -0.622; area under the curve 82.7%; p < 0.05). Regarding biochemical markers, arterial gases and hemostasis, no significant correlations were found. In immunological markers, we found positive correlation with ferritin (correlation coef-ficient: 0.805; area under the curve 94.0%; p < 0.05), and C- reactive protein (correlation coeffi-cient: 0.587; area under the curve 87.4%; p < 0.05).
Conclusions
The biomarkers that can be considered as parameters associated with the severity of COVID- 19 are the absolute blood count of monocytes and serum ferritin concentration.
 Autores:
Mady Canelú Ramos Rojas[1,2], Edwin Antonio Cuaresma Cuadros[3], Jose Johao Cayo Castillo[4], Diego Alexander Monasterio Benique[5]
Autores:
Mady Canelú Ramos Rojas[1,2], Edwin Antonio Cuaresma Cuadros[3], Jose Johao Cayo Castillo[4], Diego Alexander Monasterio Benique[5]

Citación: Ramos Rojas MC, Cuaresma Cuadros EA, Cayo Castillo JJ, Monasterio Benique DA. Association of biomarkers and severity of COVID-19: A crosssectional study. Medwave 2022;22(6):e002548 doi: 10.5867/medwave.2022.06.002548
Fecha de envío: 22/12/2021
Fecha de aceptación: 3/6/2022
Fecha de publicación: 6/7/2022
Origen: No solicitado
Tipo de revisión: Con revisión por pares externos, por tres árbitros a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Assandri R, Buscarini E, Canetta C, Scartabellati A, Viganò G, Montanelli A. Laboratory Biomarkers Predicting COVID-19 Severity in the Emergency Room. Arch Med Res. 2020;51: 598–599. | CrossRef |
Assandri R, Buscarini E, Canetta C, Scartabellati A, Viganò G, Montanelli A. Laboratory Biomarkers Predicting COVID-19 Severity in the Emergency Room. Arch Med Res. 2020;51: 598–599. | CrossRef | Lippi G, Plebani M. Laboratory abnormalities in patients with COVID-2019 infection. Clin Chem Lab Med. 2020;58: 1131–1134.
| CrossRef |
Lippi G, Plebani M. Laboratory abnormalities in patients with COVID-2019 infection. Clin Chem Lab Med. 2020;58: 1131–1134.
| CrossRef | Kermali M, Khalsa RK, Pillai K, Ismail Z, Harky A. The role of biomarkers in diagnosis of COVID- 19 - A systematic review. Life Sci. 2020;254: 117788. | CrossRef |
Kermali M, Khalsa RK, Pillai K, Ismail Z, Harky A. The role of biomarkers in diagnosis of COVID- 19 - A systematic review. Life Sci. 2020;254: 117788. | CrossRef | Sirvent JM, Baro A, Morales M, Sebastian P, Saiz X. Biomarcadores predictivos de mortalidad en pacientes críticos con COVID- 19. Med Intensiva. 2022;46: 94–96. | CrossRef |
Sirvent JM, Baro A, Morales M, Sebastian P, Saiz X. Biomarcadores predictivos de mortalidad en pacientes críticos con COVID- 19. Med Intensiva. 2022;46: 94–96. | CrossRef | Pujani M, Raychaudhuri S, Verma N, Kaur H, Agarwal S, Singh M, et al. Association of Hematologic biomarkers and their combinations with disease severity and mortality in COVID- 19-an Indian perspective. Am J Blood Res. 2021;11: 180–190. | Link |
Pujani M, Raychaudhuri S, Verma N, Kaur H, Agarwal S, Singh M, et al. Association of Hematologic biomarkers and their combinations with disease severity and mortality in COVID- 19-an Indian perspective. Am J Blood Res. 2021;11: 180–190. | Link | Galicia García C, Vega Sánchez ÁE. Asociación de ferritina con deterioro ventilatorio y mortalidad debido a COVID- 19 en terapia intensiva. Medicina Crítica. 2021;35: 121–129. | CrossRef |
Galicia García C, Vega Sánchez ÁE. Asociación de ferritina con deterioro ventilatorio y mortalidad debido a COVID- 19 en terapia intensiva. Medicina Crítica. 2021;35: 121–129. | CrossRef | Zeng F, Huang Y, Guo Y, Yin M, Chen X, Xiao L, et al. Association of inflammatory markers with the severity of COVID- 19: A meta- analysis. Int J Infect Dis. 2020;96: 467–474. | CrossRef |
Zeng F, Huang Y, Guo Y, Yin M, Chen X, Xiao L, et al. Association of inflammatory markers with the severity of COVID- 19: A meta- analysis. Int J Infect Dis. 2020;96: 467–474. | CrossRef | Ponti G, Maccaferri M, Ruini C, Tomasi A, Ozben T. Biomarkers associated with COVID- 19 disease progression. Crit Rev Clin Lab Sci. 2020;57: 389–399. | CrossRef |
Ponti G, Maccaferri M, Ruini C, Tomasi A, Ozben T. Biomarkers associated with COVID- 19 disease progression. Crit Rev Clin Lab Sci. 2020;57: 389–399. | CrossRef | Organización Mundial de la Salud. Clinical care of severe acute respiratory infections – Tool kit. | Link |
Organización Mundial de la Salud. Clinical care of severe acute respiratory infections – Tool kit. | Link | Castro y Flores. Relación entre las comorbilidades y la morbilidad y la mortalidad en la COVID- 19. Anales de la Academia de Ciencias de Cuba. 2021;11: 2304–0106.
Castro y Flores. Relación entre las comorbilidades y la morbilidad y la mortalidad en la COVID- 19. Anales de la Academia de Ciencias de Cuba. 2021;11: 2304–0106.  Henry BM, de Oliveira MHS, Benoit S, Plebani M, Lippi G. Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID- 19): a meta- analysis. Clin Chem Lab Med. 2020;58: 1021–1028. | CrossRef |
Henry BM, de Oliveira MHS, Benoit S, Plebani M, Lippi G. Hematologic, biochemical and immune biomarker abnormalities associated with severe illness and mortality in coronavirus disease 2019 (COVID- 19): a meta- analysis. Clin Chem Lab Med. 2020;58: 1021–1028. | CrossRef | Ghahramani S, Tabrizi R, Lankarani KB, Kashani SMA, Rezaei S, Zeidi N, et al. Laboratory features of severe vs. non- severe COVID- 19 patients in Asian populations: a systematic review and meta- analysis. Eur J Med Res. 2020;25. | CrossRef |
Ghahramani S, Tabrizi R, Lankarani KB, Kashani SMA, Rezaei S, Zeidi N, et al. Laboratory features of severe vs. non- severe COVID- 19 patients in Asian populations: a systematic review and meta- analysis. Eur J Med Res. 2020;25. | CrossRef | Mardani R, Ahmadi Vasmehjani A, Zali F, Gholami A, Mousavi Nasab SD, Kaghazian H, et al. Arch Acad Emerg Med. 2020;8.
Mardani R, Ahmadi Vasmehjani A, Zali F, Gholami A, Mousavi Nasab SD, Kaghazian H, et al. Arch Acad Emerg Med. 2020;8.  Dong X, Sun L, Li Y. Prognostic value of lactate dehydrogenase for in- hospital mortality in severe and critically ill patients with COVID- 19. Int J Med Sci. 2020;17: 2225–2231. | CrossRef |
Dong X, Sun L, Li Y. Prognostic value of lactate dehydrogenase for in- hospital mortality in severe and critically ill patients with COVID- 19. Int J Med Sci. 2020;17: 2225–2231. | CrossRef | Bennouar S, Bachir Cherif A, Kessira A, Hamel H, Boudahdir A, Bouamra A, et al. Usefulness of biological markers in the early prediction of corona virus disease- 2019 severity. Scand J Clin Lab Invest. 2020;80: 611–618. | CrossRef |
Bennouar S, Bachir Cherif A, Kessira A, Hamel H, Boudahdir A, Bouamra A, et al. Usefulness of biological markers in the early prediction of corona virus disease- 2019 severity. Scand J Clin Lab Invest. 2020;80: 611–618. | CrossRef | Aloisio E, Chibireva M, Serafini L, Pasqualetti S, Falvella FS, Dolci A, et al. A Comprehensive Appraisal of Laboratory Biochemistry Tests as Major Predictors of COVID- 19 Severity. Arch Pathol Lab Med. 2020;144: 1457–1464. | CrossRef |
Aloisio E, Chibireva M, Serafini L, Pasqualetti S, Falvella FS, Dolci A, et al. A Comprehensive Appraisal of Laboratory Biochemistry Tests as Major Predictors of COVID- 19 Severity. Arch Pathol Lab Med. 2020;144: 1457–1464. | CrossRef | Gutiérrez Suárez JC, Almonacid Urrego CC, Hernández Rojas E del C, Mendieta Zerón H. Valor pronóstico de los marcadores bioquímicos en pacientes con COVID- 19. nova. 2020;18: 53–60. | CrossRef |
Gutiérrez Suárez JC, Almonacid Urrego CC, Hernández Rojas E del C, Mendieta Zerón H. Valor pronóstico de los marcadores bioquímicos en pacientes con COVID- 19. nova. 2020;18: 53–60. | CrossRef | Huang I, Pranata R, Lim MA, Oehadian A, Alisjahbana B. Proteína C reactiva, procalcitonina, Dímero D y ferritina en la enfermedad grave por coronavirus- 2019: un metanálisis. Ther Adv Respir Dis. 2020;14: 17. | CrossRef |
Huang I, Pranata R, Lim MA, Oehadian A, Alisjahbana B. Proteína C reactiva, procalcitonina, Dímero D y ferritina en la enfermedad grave por coronavirus- 2019: un metanálisis. Ther Adv Respir Dis. 2020;14: 17. | CrossRef | Long H, Nie L, Xiang X, Li H, Zhang X, Fu X, et al. D- Dimer and Prothrombin Time Are the Significant Indicators of Severe COVID- 19 and Poor Prognosis. Biomed Res Int. 2020;2020. | CrossRef |
Long H, Nie L, Xiang X, Li H, Zhang X, Fu X, et al. D- Dimer and Prothrombin Time Are the Significant Indicators of Severe COVID- 19 and Poor Prognosis. Biomed Res Int. 2020;2020. | CrossRef | Gallo Marin B, Aghagoli G, Lavine K, Yang L, Siff EJ, Chiang SS, et al. Predictors of COVID- 19 severity: A literature review. Rev Med Virol. 2021;31: 1–10. | CrossRef |
Gallo Marin B, Aghagoli G, Lavine K, Yang L, Siff EJ, Chiang SS, et al. Predictors of COVID- 19 severity: A literature review. Rev Med Virol. 2021;31: 1–10. | CrossRef | Tan L, Wang Q, Zhang D, Ding J, Huang Q, Tang Y- Q, et al. Lymphopenia predicts disease severity of COVID- 19: a descriptive and predictive study. Signal Transduct Target Ther. 2020;5: 33. | CrossRef |
Tan L, Wang Q, Zhang D, Ding J, Huang Q, Tang Y- Q, et al. Lymphopenia predicts disease severity of COVID- 19: a descriptive and predictive study. Signal Transduct Target Ther. 2020;5: 33. | CrossRef | Henry B, Cheruiyot I, Vikse J, Mutua V, Kipkorir V, Benoit J, et al. Lymphopenia and neutrophilia at admission predicts severity and mortality in patients with COVID- 19: a meta- analysis. Acta Biomed. 2020;91. | CrossRef |
Henry B, Cheruiyot I, Vikse J, Mutua V, Kipkorir V, Benoit J, et al. Lymphopenia and neutrophilia at admission predicts severity and mortality in patients with COVID- 19: a meta- analysis. Acta Biomed. 2020;91. | CrossRef | Lippi G, South AM, Henry BM. Electrolyte imbalances in patients with severe coronavirus disease 2019 (COVID- 19). Ann Clin Biochem. 2020;57: 262–265. | CrossRef |
Lippi G, South AM, Henry BM. Electrolyte imbalances in patients with severe coronavirus disease 2019 (COVID- 19). Ann Clin Biochem. 2020;57: 262–265. | CrossRef | Tjendra Y, Al Mana AF, Espejo AP, Akgun Y, Millan NC, Gomez-F ernandez C, et al. Predicting Disease Severity and Outcome in COVID- 19 Patients: A Review of Multiple Biomarkers. Arch Pathol Lab Med. 2020;144: 1465–1474. | CrossRef |
Tjendra Y, Al Mana AF, Espejo AP, Akgun Y, Millan NC, Gomez-F ernandez C, et al. Predicting Disease Severity and Outcome in COVID- 19 Patients: A Review of Multiple Biomarkers. Arch Pathol Lab Med. 2020;144: 1465–1474. | CrossRef | Tuta- Quintero E, Collazos E, Coronado- Sarmiento J, Pimentel J. Anemia como predictor de severidad en la COVID- 19: una revisión exploratoria. BMSA. 2021;61: 26–34. | CrossRef |
Tuta- Quintero E, Collazos E, Coronado- Sarmiento J, Pimentel J. Anemia como predictor de severidad en la COVID- 19: una revisión exploratoria. BMSA. 2021;61: 26–34. | CrossRef | Faghih Dinevari M, Somi MH, Sadeghi Majd E, Abbasalizad Farhangi M, Nikniaz Z. Anemia predicts poor outcomes of COVID- 19 in hospitalized patients: a prospective study in Iran. BMC Infect Dis. 2021;21. | CrossRef |
Faghih Dinevari M, Somi MH, Sadeghi Majd E, Abbasalizad Farhangi M, Nikniaz Z. Anemia predicts poor outcomes of COVID- 19 in hospitalized patients: a prospective study in Iran. BMC Infect Dis. 2021;21. | CrossRef | Ocampo- Salgado C, Palacio- Uribe J, Duque- Ramírez M, Orrego- Garay MJ. Valor pronóstico de biomarcadores cardíacos en la enfermedad por COVID- 19. Revista Colombiana de Cardiología. 2020;27: 137–141. | CrossRef |
Ocampo- Salgado C, Palacio- Uribe J, Duque- Ramírez M, Orrego- Garay MJ. Valor pronóstico de biomarcadores cardíacos en la enfermedad por COVID- 19. Revista Colombiana de Cardiología. 2020;27: 137–141. | CrossRef | Liu F, Li L, Xu M, Wu J, Luo D, Zhu Y, et al. Prognostic value of interleukin- 6, C- reactive protein, and procalcitonin in patients with COVID- 19. J Clin Virol. 2020;127: 104370. | CrossRef |
Liu F, Li L, Xu M, Wu J, Luo D, Zhu Y, et al. Prognostic value of interleukin- 6, C- reactive protein, and procalcitonin in patients with COVID- 19. J Clin Virol. 2020;127: 104370. | CrossRef |