Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión científica de la Sociedad Chilena de Nefrología.
En esta presentación se hablará sobre un tema innovador en nuestro medio y particularmente para los médicos de adultos, como es nuestra experiencia en el reemplazo renal de niños sometidos a oxigenación con membrana extracorpórea (ECMO).
ECMO es una técnica de circulación extracorpórea que se utiliza para mantener y asegurar la oxigenación en pacientes con insuficiencia respiratoria y/o cardiaca, en especial en pacientes hipoxémicos, con lo que se evita el daño iatrogénico asociado a barotrauma, altas fracciones inspiradas de oxígeno (FiO2) y altas dosis de inótropos (Fig. 1). La circulación extracorpórea se usó al principio en el bypass cardiopulmonar, que se desarrolló para cirugía cardiaca por malformaciones congénitas o bypass coronario; la ECMO derivó de ese procedimiento y su uso se ha extendido como soporte cardiopulmonar por períodos prolongados, de horas a días, en patologías que acarrean falla respiratoria y/o circulatoria reversible.
Los pacientes sometidos a ECMO son de extrema gravedad y complejidad y con frecuencia presentan insuficiencia renal aguda, causada por la enfermedad de base, por falla multiorgánica y/o por efectos directos del procedimiento; los casos más graves requieren apoyo con terapia de reemplazo renal continuo. Además, un porcentaje no despreciable de estos pacientes necesitan apoyo con ventilación mecánica. El riesgo de mortalidad de este tipo de pacientes es superior al 60 a 80%, por lo que antes esta técnica se utilizaba sólo como salvataje en pacientes con insuficiencias múltiples. En la actualidad, dado el porcentaje de complicaciones asociadas con este procedimiento, no se recomienda usarlo en pacientes cuyo pronóstico es mejor y existen indicaciones y contraindicaciones muy precisas, que se deben respetar.
Como esta técnica es muy compleja, también es en extremo costosa y pocos países disponen de ella; Chile es el único país de América Latina que cuenta con un equipo de ECMO, el que pertenece a la Asociación mundial ELSO (Extracorporeal Life Support Organization). Los centros mundiales son escasos y Chile aparece entre varios países europeos, norteamericanos y de Oceanía, en cuyo grupo el único país de menor desarrollo socioeconómico es Georgia. El equipo de ECMO que funciona en la Universidad Católica partió en el servicio de Neonatología y es multidisciplinario, de modo que exige que numerosos componentes trabajen en forma organizada; los pacientes que se han sometido a ECMO han nacido en el Hospital de la Universidad Católica o bien han sido derivados de otros centros, incluso de otras ciudades, de modo que entre estos componentes debe estar un equipo de traslado bien preparado. Las enfermeras son fundamentales en el cuidado de los pacientes y varias de ellas se han formado en el extranjero; los neonatólogos intensivistas hicieron un intenso curso práctico en ovejas. También es fundamental la colaboración de otros profesionales, como perfusionistas, cirujanos infantiles, cirujanos cardiacos, terapeutas respiratorios y la psicóloga, que apoya tanto al equipo como a la familia. Aunque la mayoría de los niños sometidos a este procedimiento son recién nacidos, algunos son niños mayores.
Alrededor de la década de 1950 se empezaron a realizar los primeros experimentos con animales, en los cuales se utilizaron pulmones de otros animales en circuitos paralelos. Recién en 1972 se trató con éxito al primer paciente, un joven que a raíz de un traumatismo tuvo una lesión pulmonar grave, recibió ECMO durante 75 horas y se recuperó por completo. Después de eso, la NIH (National Institutes of Health) propuso varios estudios controlados y aleatorios de tratamiento de adultos con síndrome de distrés respiratorio en los que se utilizó ECMO, pero los resultados no fueron tan alentadores, ya que, si bien se lograba mejorar la oxigenación de los pacientes, la sobrevida no mejoraba, por lo que la técnica empezó a caer en descrédito. Entonces se pensó que tal vez se debía acotar mejor la posible población beneficiaria. Como los pacientes neonatológicos tenían patologías más reversibles, en 1976 partió el programa de ECMO neonatal en la Universidad de California. En 1982 Bartlett publicó una serie de 45 recién nacidos tratados con ECMO por insuficiencia respiratoria grave, con una tasa de sobrevida bastante favorable, de 55%. En la Figura 2 aparece Esperanza, una niña con Hipertensión Pulmonar Persistente que fue la primera tratada con esta técnica por el Dr. Bartlett.
En la población neonatal, estudios aleatorios, controlados y prospectivos demuestran que la ECMO ofrece una mejoría, tanto en sobrevida como en morbilidad, en pacientes seleccionados, en comparación con otras terapias invasivas máximas. No se ha podido demostrar este efecto en niños mayores ni en adultos. Un ejemplo es un estudio controlado, aleatorio y prospectivo en el que se evaluaron neonatos con Hipertensión Pulmonar Persistente, separados en dos grupos: uno con ECMO y otro con terapia máxima convencional. Se evaluaron 185 recién nacidos mayores de 35 semanas, con más de 2 kg de peso, que presentaban falla respiratoria grave con índice de oxigenación de 40 o mayor, nacidos en distintos centros del Reino Unido, de los cuales algunos recibieron ventilación de alta frecuencia y óxido nítrico. A los cuatro años de seguimiento los niños que habían recibido ECMO tuvieron mejor evolución, ya que el porcentaje de muerte o discapacidad grave fue de 59% en el grupo con terapia convencional y de 37% en el de ECMO, con p menor de 0,004 (Bennett et al. UK Collaborative ECMO Trial Group: Follow-up to age 4 years. Lancet 2001; 357:1094-1096). A partir de entonces se ha usado cada vez menos como rescate y en la actualidad se considera como una terapia de primera línea cuando la situación lo amerita.
Las indicaciones principales de ECMO neonatal son patologías propias de este grupo etáreo, como la hipertensión pulmonar persistente, el síndrome aspirativo meconial y la hernia diafragmática congénita, situaciones en las que, si se sobrepasa la etapa aguda, existe una alta probabilidad de tener un niño sobreviviente absolutamente sano. La sepsis también se ha tratado en algunas ocasiones, pero los resultados son más discutibles.
Los criterios de selección para ingreso a ECMO son los siguientes:
Como contraindicaciones formales están las hemorragias, sobre todo la hemorragia intracraneana, pero en general todo cuadro hemorrágico grave controlado, porque el procedimiento implica anticoagulación. Tampoco se incorporan a este procedimiento pacientes con daño cerebral importante ni pacientes con síndromes malformativos graves o cromosomopatías.
Este recurso terapéutico es escaso en áreas geográficas de bajo nivel socio- económico; y el Equipo ECMO-UC es el único centro activo de Latinoamérica, perteneciente a la ELSO (Extracorporeal Life Support Organization). Un informe de la ELSO de julio de 2006 señala que en el mundo se han tratado, hasta la fecha, 32.900 pacientes, con una tasa de sobrevida general de 76%. Un porcentaje importante de estos pacientes son neonatos y ellos constituyen el grupo con mayor sobrevida (82%), la que disminuye a medida que aumenta la edad, porque aumentan las patologías irreversibles.
En ECMO hay dos fisiologías: veno-arterial y veno-venosa. La ECMO veno-arterial parte de un circuito con una cánula venosa que se introduce por la vena yugular interna derecha del paciente, hasta alcanzar la aurícula derecha; por esta vía sale la sangre del paciente hasta un reservorio, donde una bomba la impulsa hacia un oxigenador artificial, habitualmente de silicona, que está comunicado con un ventilador de gases con calefactor. La sangre retorna al paciente por la cánula arterial, que llega al arco aórtico en la parte más distal. En la medida que se necesite mayor apoyo de oxigenación, se aporta mayor flujo de oxígeno. Esta fisiología deja el corazón del paciente en reposo, porque la mayor parte del gasto cardiaco de la circulación del paciente se asegura con esta bomba. Algunos protocolos utilizan una menor parte de la volemia y realizan un bypass para que siga existiendo un pequeño débito cardiaco. El problema de esta técnica es que después de la decanulación se debe ligar la vena yugular interna y la carótida, y los niños pueden sufrir problemas secundarios a esta ligadura; otro problema de esta fisiología es que se produce un flujo no pulsátil, ya que la bomba de infusión genera un flujo continuo, lo que puede afectar la irrigación de algunos órganos.
Los distintos componentes de la ECMO se muestran en la Fig. 3 (Componentes de la ECMO. A: oxigenador; B: bomba; C: calentador; D: batería; E: detector de burbujas/flujímetro; F: monitor saturación de oxígeno venosa y hematocrito; G: mezclador de gases). La cánula venosa trae la sangre de la aurícula derecha; la sangre llega al oxigenador artificial; la bomba fija el flujo sanguíneo; el calentador; la fuente de energía o la batería que impulsa todo el sistema; un detector de burbujas o flujímetro, porque sin este aparato el riesgo de embolía es muy grande; un monitor de saturación venosa continua, que sirve para vigilar el procedimiento y el hematocrito; el mezclador de gases, que es una mezcla de oxígeno y de nitrógeno; y un circuito de retorno de la sangre oxigenada a la arteria carótida izquierda y a la aorta.
Figura 3. Componentes de la ECMO.
La fisiología veno-venosa es un poco distinta, ya que tanto la sangre drenada como la que retorna al organismo utilizan el sistema venoso. La sangre oxigenada se mezcla en la aurícula derecha y, por lo tanto, la eficacia de oxigenación es un poco menor que en el sistema veno-arterial, pero en este procedimiento el paciente conserva la función impulsora de la circulación por su propio corazón. Si bien es algo menos eficaz, tiene otras ventajas: por ejemplo, mantiene el flujo pulsátil; preserva la arteria carótida interna; y además tiene menor riesgo de embolía aérea, ya que la sangre retorna a la aurícula derecha. En una radiografía de un paciente con ECMO veno-arterial se observan ambas cánulas en la yugular interna y en el arco aórtico (Fig. 4).
Figura 4. ECMO veno-arterial: radiografía de tórax póstero-anterior.
En un esquema de ECMO veno-venoso se ve que mediante un dispositivo de doble lumen, la sangre entra y sale por la yugular y va a la aurícula derecha (Fig. 5).
Figura 5. Esquema de ECMO veno-venoso.
En un paciente con ECMO se deben tener ciertas consideraciones especiales: como todo procedimiento extracorpóreo invasivo, la ECMO necesita anticoagulación; además causa un importante consumo de plaquetas y hemólisis, de modo que los niños requieren una impresionante cantidad de transfusiones, tanto de plaquetas como de glóbulos rojos; el recién nacido que se somete a este procedimiento debe estar sedado y muchas veces paralizado, en especial durante la canulación y la decanulación; a pesar de que se conecta a un soporte respiratorio, el paciente persiste en ventilación mecánica, es decir, no se extuba, sino que se deja ventilación mecánica en parámetros mínimos para mantener una capacidad funcional y evitar atelectasias; es un paciente que está sometido a gran catabolismo, por lo que no se debe olvidar el apoyo nutricional; el uso de ultrafiltración continua de bajo grado para ir removiendo volumen es optativo.
En la tabla I se resumen las características de ambas fisiologías de ECMO. La modalidad veno-arterial se utiliza cada vez que se necesita soporte cardiaco, es decir, si un niño tiene una insuficiencia cardiaca por malformación, arritmia o intervención quirúrgica, necesitará que su corazón repose y se realizará una ECMO veno-arterial. Muchas veces es necesario hacer una ECMO veno-arterial, aunque sólo se necesite un reemplazo pulmonar: por ejemplo, en niños pequeños que tienen la vena yugular muy pequeña, por lo que no se les puede instalar una vía de doble lumen, deben ir a veno-arterial aunque no requieran forzosamente el apoyo cardiaco. En ECMO veno-arterial se canula la vena yugular interna, idealmente la arteria carótida y, cuando no hay otra opción, los vasos femorales. La modalidad veno-venosa sólo sirve para soporte pulmonar, no para soporte cardiaco; sólo se canulan venas, idealmente las yugulares o la femoral, con catéter de doble lumen. Como el veno-venoso es un poco menos eficaz, exige flujos sanguíneos más altos para mantener la misma oxigenación.
Tabla I. Características generales de las modalidades de ECMO.
En el informe de la ELSO de 2006 se describen las complicaciones de la ECMO en recién nacidos; entre las más frecuentes y graves están las neurológicas (11%-15%), como convulsiones y accidentes vasculares encefálicos; la hemólisis es bastante frecuente (alrededor de 11%), pero no es tan complicada; un porcentaje no despreciable de niños desarrolla hipertensión (7,6%-12,7%), cuya fisiopatología no está bien determinada; la complicación más frecuente es la coagulación del sistema (36,7%-53,1%). Las complicaciones renales también son relativamente frecuentes: 18% a 40% de los pacientes en ECMO veno-arterial y veno-venoso van a necesitar diálisis; si a esto se suman los pacientes que tuvieron alza de creatinina, pero no recibieron reemplazo, la incidencia de complicaciones renales es bastante alta.
La fisiopatología de la insuficiencia renal que se desarrolla en este procedimiento, como en todo paciente crítico, es multifactorial: por definición, son pacientes muy hipóxicos y muchos han tenido también hipotensión; el hecho de conectarlos a este sistema de circuito extracorpóreo produce vasodilatación; el mismo oxigenador de silicona produce liberación de mediadores inflamatorios, a tal punto que se habla de la tormenta de citoquinas que se origina en relación con el oxigenador; se ha planteado que el flujo no pulsátil del ECMO veno-arterial podría reducir el flujo plasmático renal, junto con la vasodilatación; finalmente, la depuración habitual de los medicamentos también se ve alterada, tanto por absorción en el oxigenador como por la cantidad de productos de transfusión, de modo que muchos fármacos potencialmente nefrotóxicos no van a ser depurados.
En un estudio retrospectivo se analizó a los pacientes sometidos a ECMO en el Departamento de Pediatría de la Universidad Católica, entre 2003 y 2005. Fueron 12 pacientes, con mediana de edad de 5,5 días y peso de 2,6 a 4 kg; la mayor parte de ellos tenían insuficiencia respiratoria, principalmente por hipertensión pulmonar persistente o por síndrome aspirativo meconial, neumonia, sepsis o hernia diafragmática congénita. Dos pacientes tuvieron ECMO con apoyo cardiaco por imposibilidad de weaning después de una cirugía de cardiopatía congénita. El promedio de duración de la terapia ECMO fue 8,8 días; 6 pacientes estuvieron con ECMO veno-arterial y 5 con veno-venoso; uno debió cambiarse de una modalidad a la otra. La sobrevida de estos 12 pacientes fue de 83%. 6 de los 12 pacientes necesitaron reemplazo renal; en 4 de ellos ésta se indicó por sobrecarga de volumen que no se pudo manejar con diuréticos. Estos niños requieren mucho aporte de volumen, transfusiones de plaquetas, plasma y glóbulos rojos; además, muchas veces se hipotensan por el circuito extracorpóreo y necesitan resucitación con volumen, por lo que se utilizan diuréticos de rutina para prevenir la retención de volumen. . 4 de 6 pacientes requirieron hemofiltración para sacar líquido y a 2 hubo que conectarlos por necesidad depurativa, es decir, por azotemia progresiva, con o sin oliguria. Ningún paciente necesitó reemplazo renal a causa de trastornos electrolíticos o ácido-base. De todos los pacientes sometidos a ECMO, la mitad necesitó antihipertensivos, lo que concuerda con las complicaciones descritas en la literatura.
En el aspecto técnico, se realizó hemo(dia)filtración continua, SCUF (Ultrafiltración lenta continua) y en algunos pacientes, sólo hemofiltración continua de bajo volumen; la indicación dependió de la condición clínica de cada paciente individual. En todos se utilizó un filtro Renaflo de 0,3 m2 de superficie. La rama arterial del filtro se conectaba al circuito después de la bomba de infusión y la rama venosa se conectaba al reservorio, como se muestra en la Fig. 6. Se puede poner el hemofiltro en paralelo a este circuito, antes o después del oxigenador; si se coloca antes de éste, permite una recirculación importante en esta parte del circuito, pero el problema es que en este sector el flujo sanguíneo es muy alto. En general, los flujos sanguíneos oscilan entre 80 y 100 ml/kg/min. El flujo normal para una hemofiltración en un paciente sin ECMO es menor, por lo que con frecuencia, para prevenir un exceso de ultrafiltración, se coloca el hemofiltro después del oxigenador, con o que el flujo es igual, pero las presiones disminuyen. El hemofiltro está conectado al circuito de diálisis y la sangre venosa que sale del filtro vuelve al reservorio; luego, del oxigenador pasa al hemofiltro. La bomba controla la ultrafiltración; como los flujos son muy altos, si no se coloca una resistencia los pacientes ultrafiltran en forma exagerada. Después de esta bomba, la sangre retorna al reservorio. En general se utilizan los flujos sanguíneos de la ECMO, no los fija el operador, sino que están dados por el sistema.
Figura 6. Reemplazo renal continuo.
En este grupo de pacientes se obtuvieron ultrafiltraciones de 20 ml/hora en promedio, y se utilizaron flujos de dializado de 2000 ml/hr/1,73 m2 en promedio en los niños que necesitaron diálisis. Los pacientes necesitaron reemplazo 3,3 días después de iniciado el procedimiento, el que duró alrededor de 8 días. Todos los niños recibieron diuréticos en dosis moderadas, porque, si bien su utilidad no se ha demostrado en estudios prospectivos y controlados, se utilizan para estimular la diuresis. En aquellos casos en que se producía ultrafiltración excesiva y se agregaba un factor prerrenal, se controlaba mejor la ultrafiltración o se suspendía el diurético. En todos los pacientes el reemplazo renal continuo tuvo éxito en cuanto a que se logró depurar a los pacientes y, sobre todo, se lograron balances hídricos negativos, que era el principal objetivo. Los seis pacientes lograron bajar de peso (Fig. 7).
Una vez que los pacientes se desconectaron de ECMO por mejoría de su cuadro general, también se desconectaron del reemplazo renal continuo. Sólo un paciente presentó una nueva alza del nitrógeno ureico plasmático después de un par de días sin ECMO, por lo que requirió diálisis peritoneal en ese momento; los demás recuperaron su función renal una vez que terminó la ECMO. En 2 de los 6 pacientes se terminó la ECMO porque se consideraron fuera del alcance terapéutico, es decir, eran niños tan graves que se decidió no seguir adelante.
Las principales complicaciones fueron banales, como coagulaciones del sistema; no hubo complicaciones derivadas del procedimiento de reemplazo en estos niños. Todos los pacientes se fueron de alta con función renal normal. Lo interesante va a ser el seguimiento a largo plazo, para determinar qué consecuencias pueden aparecer en el futuro. En nuestros pacientes, la incidencia de reemplazo renal fue de 50% de los niños sometidos a ECMO, lo que es levemente mayor que lo que informa la ELSO, que va entre 20% y 40%, pero en nuestro grupo había niños muy graves, que tal vez en otros lugares no serían sometidos a esta terapia. Por otro lado, la tasa de sobrevida fue bastante buena en los pacientes que necesitaron reemplazo renal, un poco superior a la que informa la ELSO.
Lo concreto es que no existen indicaciones absolutas ni parámetros claros para saber cuándo someter a estos niños a terapia de reemplazo renal. No hay guías al respecto, pero aparentemente no empeora la sobrevida, sino todo lo contrario, favorece el manejo de la parte respiratoria al mejorar el manejo del agua. Hasta julio de 2006, 18 pacientes se han sometido a ECMO, en 89% de los casos por causa respiratoria y en 11%, por causa cardiaca; de ellos, 67% han recibido ECMO veno-arterial, porque, si bien el respiratorio podría recibir veno-venoso, se ha visto que existen algunas condiciones de los vasos sanguíneos en las que muchas veces es necesario utilizar veno-arterial, aunque la falla sea exclusivamente respiratoria. De los 18 pacientes tratados, 87% han sobrevivido y si se consideran sólo los pacientes sometidos a ECMO respiratorio, la sobrevida aumenta a 92% (Fig. 8). La sobrevida general de los pacientes con insuficiencia respiratoria grave, incluyendo a los que se someten a óxido nítrico o ventilación de alta frecuencia, es de 97%, lo que es bastante bueno (Fig. 9).
Figura 8. Programa ECMO de la Universidad Católica: sobrevida y mortalidad en ECMO respiratorio.

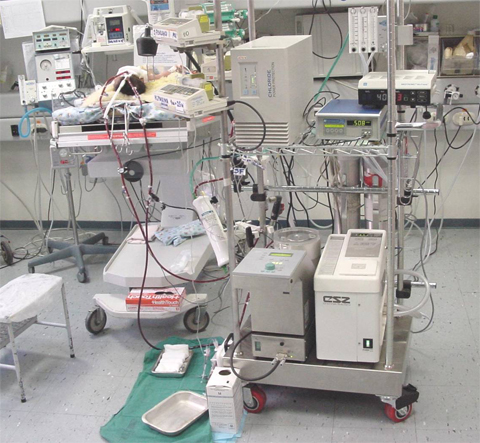 Figura 1. Recién nacido conectado a oxigenación con membrana extracorpórea (Unidad de Neonatología, Departamento de Pediatría de la Universidad Católica de Chile).
Figura 1. Recién nacido conectado a oxigenación con membrana extracorpórea (Unidad de Neonatología, Departamento de Pediatría de la Universidad Católica de Chile).

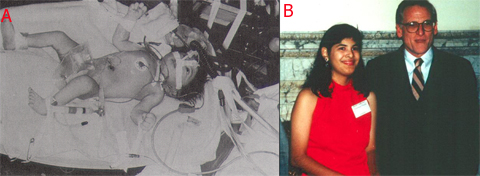 Figura 2. (A) Esperanza, primera paciente recién nacida tratada con ECMO en 1976. (B) Esperanza con el Dr. Robert H. Bartlett.
Figura 2. (A) Esperanza, primera paciente recién nacida tratada con ECMO en 1976. (B) Esperanza con el Dr. Robert H. Bartlett.

 Figura 3. Componentes de la ECMO.
Figura 3. Componentes de la ECMO.

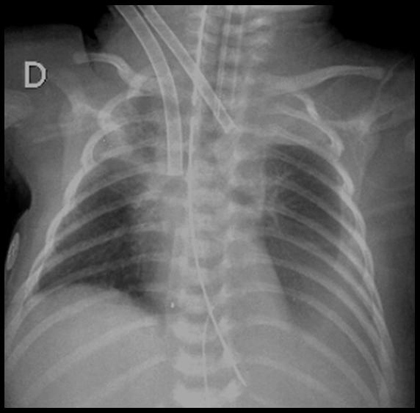 Figura 4. ECMO veno-arterial: radiografía de tórax póstero-anterior.
Figura 4. ECMO veno-arterial: radiografía de tórax póstero-anterior.

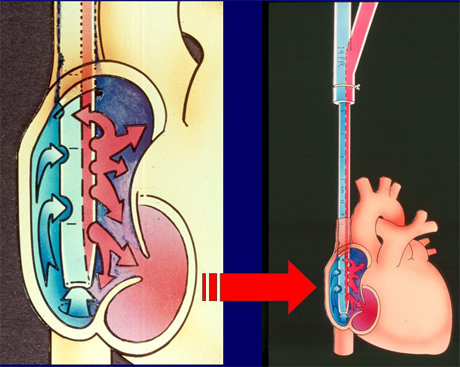 Figura 5. Esquema de ECMO veno-venoso.
Figura 5. Esquema de ECMO veno-venoso.

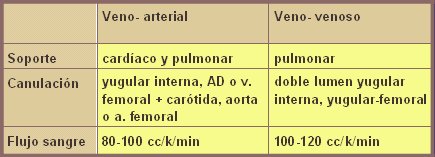 Tabla I. Características generales de las modalidades de ECMO.
Tabla I. Características generales de las modalidades de ECMO.

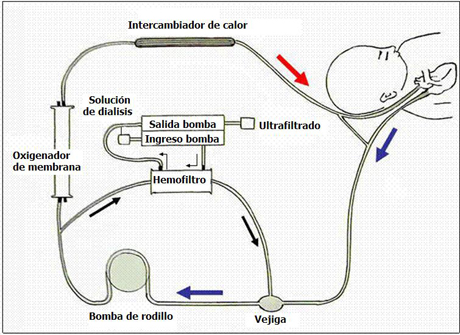 Figura 6. Reemplazo renal continuo.
Figura 6. Reemplazo renal continuo.

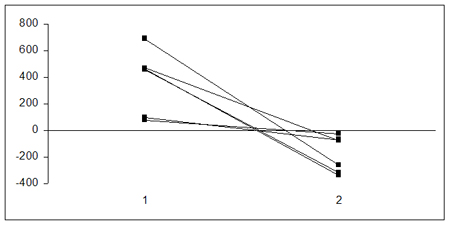 Figura 7. Cambios en el balance hídrico luego de empezar el reemplazo renal continuo: 1) Antes de reemplazo renal continuo 2) 24 horas después de iniciar reemplazo renal continuo.
Figura 7. Cambios en el balance hídrico luego de empezar el reemplazo renal continuo: 1) Antes de reemplazo renal continuo 2) 24 horas después de iniciar reemplazo renal continuo.

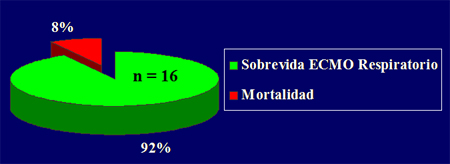 Figura 8. Programa ECMO de la Universidad Católica: sobrevida y mortalidad en ECMO respiratorio.
Figura 8. Programa ECMO de la Universidad Católica: sobrevida y mortalidad en ECMO respiratorio.

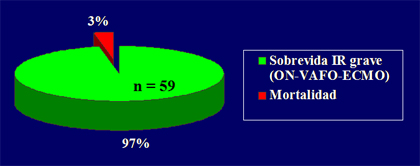 Figura 9. Programa ECMO de la Universidad Católica. Sobrevida y mortalidad en insuficiencia respiratoria grave.
Figura 9. Programa ECMO de la Universidad Católica. Sobrevida y mortalidad en insuficiencia respiratoria grave.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión científica de la Sociedad Chilena de Nefrología.
 Expositor:
Andrea Vogel Sánchez[1]
Expositor:
Andrea Vogel Sánchez[1]

Citación: Vogel A. Renal involvement in children undergoing extracorporeal membrane oxygenation (ECMO). Medwave 2007 Ene;7(1):e2300 doi: 10.5867/medwave.2007.01.2300
Fecha de publicación: 1/1/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión