 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
En pacientes con cáncer gástrico aparentemente localizado, la resección quirúrgica con intención curativa tiene pobres resultados a largo plazo, por lo que el uso de quimioterapia perioperatoria se ha planteado como alternativa. Utilizando la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en 19 bases de datos, identificamos cuatro revisiones sistemáticas que en conjunto incluyen dos estudios aleatorizados pertinentes. Los combinamos mediante un metanálisis y generamos tablas de resumen de resultados utilizando el método GRADE. Concluimos que la adición de quimioterapia perioperatoria a la resección quirúrgica del cáncer gástrico aumenta la sobrevida, probablemente en una magnitud importante, y podría no aumentar la morbimortalidad perioperatoria.
El cáncer gástrico es una de las principales causas de muerte por cáncer a nivel mundial. Chile se cuenta entre los países con tasas más altas. Aún en pacientes con enfermedad aparentemente localizada, que van a resección quirúrgica con intención curativa, los resultados a largo plazo son desalentadores. En este escenario, el uso de quimioterapia perioperatoria como tratamiento complementario a la cirugía, surge como una alternativa.
Utilizamos la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en 19 bases de datos, para identificar revisiones sistemáticas y sus estudios primarios incluidos. Con esta información generamos un resumen estructurado siguiendo un formato preestablecido, que incluye mensajes clave, un resumen del conjunto de evidencia (presentado como matriz de evidencia en Epistemonikos), tablas de resumen de resultados con el método GRADE, y otras consideraciones para la toma de decisión.
|
Mensajes clave
|
El cáncer gástrico representa la tercera causa de muerte por cáncer a nivel mundial, dando cuenta de 10% del total [1].
En Chile, constituye la primera causa de muerte por cáncer en hombres (21 por 100,000 habitantes)[2] y, a diferencia de lo que ocurre en países desarrollados, la mortalidad por esta causa no ha disminuido en las últimas décadas [3].
El tratamiento estándar para la enfermedad en estadio localizado es la cirugía con intención curativa. Sin embargo, en occidente, la sobrevida de pacientes resecados es de 28% a cinco años[4]. En Chile, en una gran serie de pacientes resecados, se reportó una sobrevida a cinco años de sólo 10% [5].
La adición de quimioterapia perioperatoria (tratamiento con quimioterapia antes y después de la resección quirúrgica), es una alternativa terapéutica que podría incrementar la sobrevida.
Acerca del conjunto de evidencia para esta pregunta
|
Cuál es la evidencia (véase matriz de evidencia en Epistemonikos más abajo) |
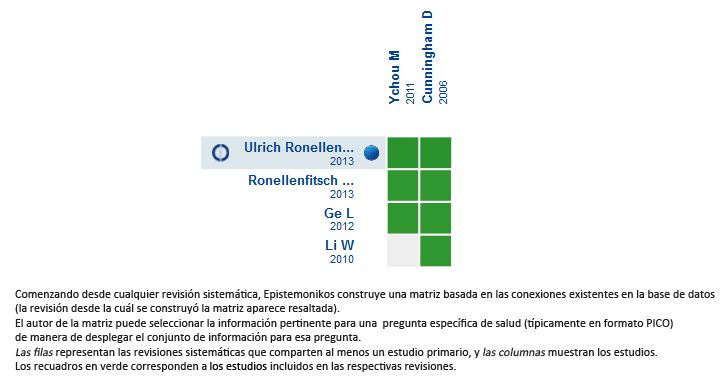
Encontramos cuatro revisiones sistemáticas[6],[7],[8],[9] , que evalúan una pregunta más amplia que la nuestra, pero que incluyen dos estudios aleatorizados que evalúan la pregunta específica: ACCORD [10] y MAGIC [11]. |
| Qué tipo de pacientes incluyeron los estudios |
Los estudios incluyeron pacientes con adenocarcinoma gástrico, del tercio inferior del esófago y de la unión gastroesofágica, susceptibles de ser resecados, etapa II o más de la UICC1, con Performance Status 0-1. |
| Qué tipo de intervenciones incluyeron los estudios |
Las intervenciones fueron: a. Estudio ACCORD: 2-3 ciclos preoperatorios de cisplatino (100 mg/m2 día 1) y 5-fluorouracilo (5FU) (800 mg/m/día por cinco días), cada 28 días.Cirugía 4-6 semanas después de la última quimioterapia. En postoperatorio, 3-4 ciclos de la misma quimioterapia.El procedimiento quirúrgico era elegido por el equipo de cirujanos. Cirugía recomendada: linfadenectomía D2. b. Estudio MAGIC: tres ciclos preoperatorios de epirrubicina (50 mg/m2 el día 1), cisplatino (60 mg/m2 el día 1) y 5-fluorouracilo (4200 mg/m2 dosis acumulada en días 1-21).Cirugía 3-6 semanas después del último ciclo de quimioterapia. En postoperatorio, comenzando 6-12 semanas tras cirugía, tres ciclos de quimioterapia del mismo esquema recibido en preoperatorio. |
| Qué tipo de desenlaces midieron |
Mortalidad, sobrevida libre de enfermedad, presencia de margen quirúrgico libre de tumor, etapa del tumor en la resección, seguridad de la quimioterapia, morbilidad perioperatoria, imposibilidad de administrar terapia postoperatoria. |
1Union for International Cancer Control.
La información de mortalidad, sobrevida libre de enfermedad, y morbilidad postoperatoria, está basada en dos estudios que incluyeron 727 pacientes.
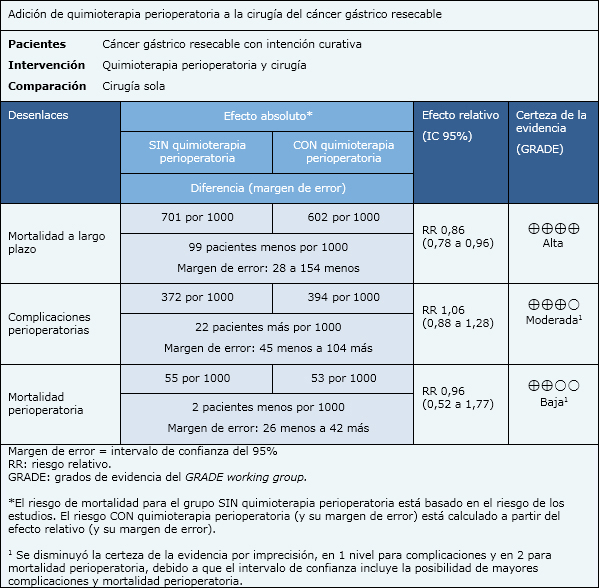
| A quién se aplica y a quién no se aplica esta evidencia |
|
| Sobre los desenlaces incluidos en este resumen |
|
| Qué piensan los pacientes |
|
| Consideraciones de recursos |
|
| Factibilidad e implementación |
|
| Diferencias entre este resumen y otras fuentes |
|
| ¿Puede que cambie esta información en el futuro? |
|
Mediante métodos automatizados y colaborativos recopilamos toda la evidencia relevante para la pregunta de interés y la presentamos en una matriz de evidencia.
Matriz de evidencia
Siga el enlace para acceder a la versión interactiva: Matriz de quimioterapia perioperatoria más cirugía vs solo cirugía en pacientes con adenocarcinoma gástroseofágico resecable

Si con posterioridad a la publicación de este resumen se publican nuevas revisiones sistemáticas sobre este tema, en la parte superior de la matriz se mostrará un aviso de “nueva evidencia”. Si bien el proyecto contempla la actualización periódica de estos resúmenes, los usuarios están invitados a comentar en Medwave o contactar a los autores mediante correo electrónico si creen que hay evidencia que motive una actualización más rápida.
Luego de crear una cuenta en Epistemonikos, al guardar las matrices recibirá notificaciones automáticas cada vez que exista nueva evidencia que potencialmente responda a esta pregunta.
El detalle de los métodos para elaborar este resumen están descritos aquí http://dx.doi.org/10.5867/medwave.2014.06.5997.
La Fundación Epistemonikos es una organización que busca acercar la información a quienes toman decisiones en salud, mediante el uso de tecnologías. Su principal desarrollo es la base de datos Epistemonikos (www.epistemonikos.org).
Los resúmenes de evidencia siguen un riguroso proceso de revisión por pares interno.
Los autores declaran no tener conflictos de intereses con la materia de este artículo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Surgical procedures with curative intention have poor long-term results in patients with resectable gastric cancer. Searching in Epistemonikos database, which is maintained by screening 19 databases, we identified four systematic reviews including two pertinent randomised studies overall. We combined the evidence using meta-analysis and generated a summary of findings table following the GRADE approach. We conclude that the addition of perioperative chemotherapy to surgical resection increases survival in gastric cancer, probably in an important magnitude, and may not increase perioperative morbidity and mortality.
 Autores:
José Peña[1,3,7], Marcelo Garrido[3,4], Gabriel Rada[1,2,5,6,7]
Autores:
José Peña[1,3,7], Marcelo Garrido[3,4], Gabriel Rada[1,2,5,6,7]

Citación: Peña J, Garrido M, Rada G. Is perioperative chemotherapy effective in patients with resectable gastric cancer?. Medwave 2014 Ago;14(7):e6008 doi: 10.5867/medwave.2014.07.6008
Fecha de publicación: 18/8/2014

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010 Dec 15;127(12):2893-917. | CrossRef | PubMed |
Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010 Dec 15;127(12):2893-917. | CrossRef | PubMed | World Health Organization, International Agency for Research of Cancer. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. globocan.iarc.fr [on line]. | Link |
World Health Organization, International Agency for Research of Cancer. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. globocan.iarc.fr [on line]. | Link | Gobierno de Chile, Ministerio de Salud, Departamento de estadísticas e información de salud. Series y gráficos de mortalidad 2014. deis.cl [on line] | Link |
Gobierno de Chile, Ministerio de Salud, Departamento de estadísticas e información de salud. Series y gráficos de mortalidad 2014. deis.cl [on line] | Link | Hundahl SA, Phillips JL, Menck HR. The National Cancer Data Base Report on poor survival of U.S. gastric carcinoma patients treated with gastrectomy: Fifth Edition American Joint Committee on Cancer staging, proximal disease, and the "different disease" hypothesis. Cancer. 2000 Feb 15;88(4):921-32. | PubMed |
Hundahl SA, Phillips JL, Menck HR. The National Cancer Data Base Report on poor survival of U.S. gastric carcinoma patients treated with gastrectomy: Fifth Edition American Joint Committee on Cancer staging, proximal disease, and the "different disease" hypothesis. Cancer. 2000 Feb 15;88(4):921-32. | PubMed | Heise K, Bertran E, Andia ME, Ferreccio C. Incidence and survival of stomach cancer in a high-risk population of Chile. World J Gastroenterol. 2009 Apr 21;15(15):1854-62. | CrossRef | PubMed |
Heise K, Bertran E, Andia ME, Ferreccio C. Incidence and survival of stomach cancer in a high-risk population of Chile. World J Gastroenterol. 2009 Apr 21;15(15):1854-62. | CrossRef | PubMed | Ronellenfitsch U, Schwarzbach M, Hofheinz R, Kienle P, Kieser M, Slanger TE, et al. Perioperative chemo(radio)therapy versus primary surgery for resectable adenocarcinoma of the stomach, gastroesophageal junction, and lower esophagus. Cochrane Database Syst Rev. 2013 May 31;5:CD008107. | CrossRef | PubMed |
Ronellenfitsch U, Schwarzbach M, Hofheinz R, Kienle P, Kieser M, Slanger TE, et al. Perioperative chemo(radio)therapy versus primary surgery for resectable adenocarcinoma of the stomach, gastroesophageal junction, and lower esophagus. Cochrane Database Syst Rev. 2013 May 31;5:CD008107. | CrossRef | PubMed | Li W, Qin J, Sun YH, Liu TS. Neoadjuvant chemotherapy for advanced gastric cancer: a meta-analysis. World J Gastroenterol. 2010 Nov 28;16(44):5621-8. | CrossRef | PubMed |
Li W, Qin J, Sun YH, Liu TS. Neoadjuvant chemotherapy for advanced gastric cancer: a meta-analysis. World J Gastroenterol. 2010 Nov 28;16(44):5621-8. | CrossRef | PubMed | Ge L, Wang HJ, Yin D, Lei C, Zhu JF, Cai XH, Zhang GQ. Effectiveness of 5-flurouracil-based neoadjuvant chemotherapy in locally-advanced gastric/gastroesophageal cancer: a meta-analysis. World J Gastroenterol. 2012 Dec 28;18(48):7384-93. | CrossRef | PubMed |
Ge L, Wang HJ, Yin D, Lei C, Zhu JF, Cai XH, Zhang GQ. Effectiveness of 5-flurouracil-based neoadjuvant chemotherapy in locally-advanced gastric/gastroesophageal cancer: a meta-analysis. World J Gastroenterol. 2012 Dec 28;18(48):7384-93. | CrossRef | PubMed | Ronellenfitsch U, Schwarzbach M, Hofheinz R, Kienle P, Kieser M, Slanger TE, et al. Preoperative chemo(radio)therapy versus primary surgery for gastroesophageal adenocarcinoma: systematic review with meta-analysis combining individual patient and aggregate data. Eur J Cancer. 2013 Oct;49(15):3149-58. | CrossRef | PubMed |
Ronellenfitsch U, Schwarzbach M, Hofheinz R, Kienle P, Kieser M, Slanger TE, et al. Preoperative chemo(radio)therapy versus primary surgery for gastroesophageal adenocarcinoma: systematic review with meta-analysis combining individual patient and aggregate data. Eur J Cancer. 2013 Oct;49(15):3149-58. | CrossRef | PubMed | Ychou M, Boige V, Pignon JP, Conroy T, Bouché O, Lebreton G, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol. 2011 May 1;29(13):1715-21. | CrossRef | PubMed |
Ychou M, Boige V, Pignon JP, Conroy T, Bouché O, Lebreton G, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol. 2011 May 1;29(13):1715-21. | CrossRef | PubMed | Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006 Jul 6;355(1):11-20. | CrossRef | PubMed |
Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006 Jul 6;355(1):11-20. | CrossRef | PubMed | Waddell T, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D, et al. Gastric cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Eur J Surg Oncol. 2014 May;40(5):584-91. | CrossRef | PubMed |
Waddell T, Verheij M, Allum W, Cunningham D, Cervantes A, Arnold D, et al. Gastric cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Eur J Surg Oncol. 2014 May;40(5):584-91. | CrossRef | PubMed | Knight G, Earle CC, Cosby R, Coburn N, Youssef Y, Malthaner R, et al. Neoadjuvant or adjuvant therapy for resectable gastric cancer: a systematic review and practice guideline for North America. Gastric Cancer. 2013 Jan;16(1):28-40. | CrossRef | PubMed |
Knight G, Earle CC, Cosby R, Coburn N, Youssef Y, Malthaner R, et al. Neoadjuvant or adjuvant therapy for resectable gastric cancer: a systematic review and practice guideline for North America. Gastric Cancer. 2013 Jan;16(1):28-40. | CrossRef | PubMed | Cassidy J, Saltz L, Twelves C, Van Cutsem E, Hoff P, Kang Y, et al. Efficacy of capecitabine versus 5-fluorouracil in colorectal and gastric cancers: a meta-analysis of individual data from 6171 patients. Ann Oncol. 2011 Dec;22(12):2604-9. | CrossRef | PubMed |
Cassidy J, Saltz L, Twelves C, Van Cutsem E, Hoff P, Kang Y, et al. Efficacy of capecitabine versus 5-fluorouracil in colorectal and gastric cancers: a meta-analysis of individual data from 6171 patients. Ann Oncol. 2011 Dec;22(12):2604-9. | CrossRef | PubMed | Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008 Jan 3;358(1):36-46. | CrossRef | PubMed |
Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl J Med. 2008 Jan 3;358(1):36-46. | CrossRef | PubMed | Gobierno de Chile, Ministerio De Salud. Guía clínica cáncer gástrico. Santiago: MINSAL, 2010. | Link |
Gobierno de Chile, Ministerio De Salud. Guía clínica cáncer gástrico. Santiago: MINSAL, 2010. | Link | Revisiones rápidas de la evidencia utilizando Epistemonikos: una aproximación rigurosa, amigable y actualizada a la evidencia en salud
Revisiones rápidas de la evidencia utilizando Epistemonikos: una aproximación rigurosa, amigable y actualizada a la evidencia en salud