 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
El artículo publicado por Taylor y cols., en junio de 2010 en el American Journal of Hypertension, puso en duda la eficacia que tendría la reducción de la ingesta de sal en la dieta como medida para la prevención y tratamiento de la hipertensión arterial y de otras patologías de causa cardiovascular. La publicación de este artículo ha generado una gran controversia, y las respuestas no se hicieron esperar tanto desde sociedades médicas como científicas. Éstas han criticado fuertemente los resultados de este metaanálisis, señalando serias falencias metodológicas. En el presente artículo presentamos críticamente la evidencia experimental que muestra la importancia del aporte dietario de sal y su papel como determinante de la presión arterial. Describimos muy brevemente el paradigma que explica el papel de la ingesta de sal en la presión arterial (hipótesis y modelo de Guyton) y mencionamos evidencia experimental que lo sustenta. Comentamos brevemente los estudios clásicos que indican que la ingesta de sal (NaCl) contribuye directamente al desarrollo de hipertensión arterial y daño de tejidos diana. Finalmente, exponemos brevemente los datos experimentales que motivan la controversia en cuanto al papel de la sal (NaCl) o el sodio como agentes prohipertensivos.
Desde la década de los años 60, la visión cardiocéntrica del control del sistema circulatorio y de la presión arterial fue cuestionada. En 1972 Guyton, Coleman y Granger2 publicaron la descripción de un modelo computacional de control circulatorio, que entre otros aspectos notables, estableció la relación entre el volumen del fluido extracelular (y por ende el volumen sanguíneo) y la presión arterial. El sodio y el cloruro son los principales iones del líquido extracelular, y por su efecto osmótico y la existencia de un control fino del balance de agua y la osmolaridad, el contenido total de sodio (pool de sodio) determina el volumen del LEC. La presión arterial depende de las propiedades y características del continente (función cardiovascular) y del contenido (volumen sanguíneo, volemia). El balance de sal y su manejo por el riñón son claves en la regulación de la volemia.
El análisis detallado sobre el comportamiento del modelo propuesto por Guyton, sumado a estudios experimentales, demostraron la tremenda importancia que tiene el volumen sanguíneo y la función renal en la regulación en el largo plazo de la presión arterial. Un cambio sostenido en el balance de sal, por ejemplo un aumento de la ingesta sin los aumentos correspondientes de la excreción de sal, aumentan el volumen sanguíneo y por ende la presión arterial. Según los estudios del propio Guyton, este efecto es normalmente prevenido por aumentos en la excreción renal de sodio, los que son directamente proporcionales a los aumentos de la ingesta. A este efecto lo denominó “natriuresis por presión”. En consecuencia, la presión arterial que se observa en un sujeto es aquella en la cual el balance de NaCl es cero (ingesta=excreción). La curva presión versus natriuresis presenta una alta pendiente o ganancia infinita, en las palabras de Guyton3, y además puede sufrir corrimientos hacia la izquierda (aumento de sensibilidad) o a la derecha (disminución de sensibilidad).
En la Figura 1, se muestra cómo el sujeto A (curva A) presenta una respuesta natriurética normal: aumenta la excreción renal de sodio en función de aumentos de la presión arterial. La línea horizontal muestra la natruresis normal. En el caso del sujeto A, para lograr una natriuresis normal (igual a 1), la Presión Arterial Media (PAM) es de 95 mmHg. Aumentos de la presión arterial aumentarán la natriuresis, lo que resulta homeostático ya que tiende a disminuir la PAM (por la mayor excreción renal de sodio y disminución de la volemia). En la versión clásica, la pendiente de la curva A es aún mayor a lo que muestra nuestro gráfico, lo que llevó a acuñar la frase “ganancia infinita” por Guyton. En el caso del sujeto B (curva B), la respuesta natriurética frente a aumentos de la PAM es menor (mayor “sensibilidad a la sal de la dieta”). Este sujeto logra natriuresis normales con PAM >100 mmHg, es decir que es hipertenso con respuesta natriurética anormal. Además, comparado con A, los aumentos de la PAM producen menores aumentos de la natriuresis.
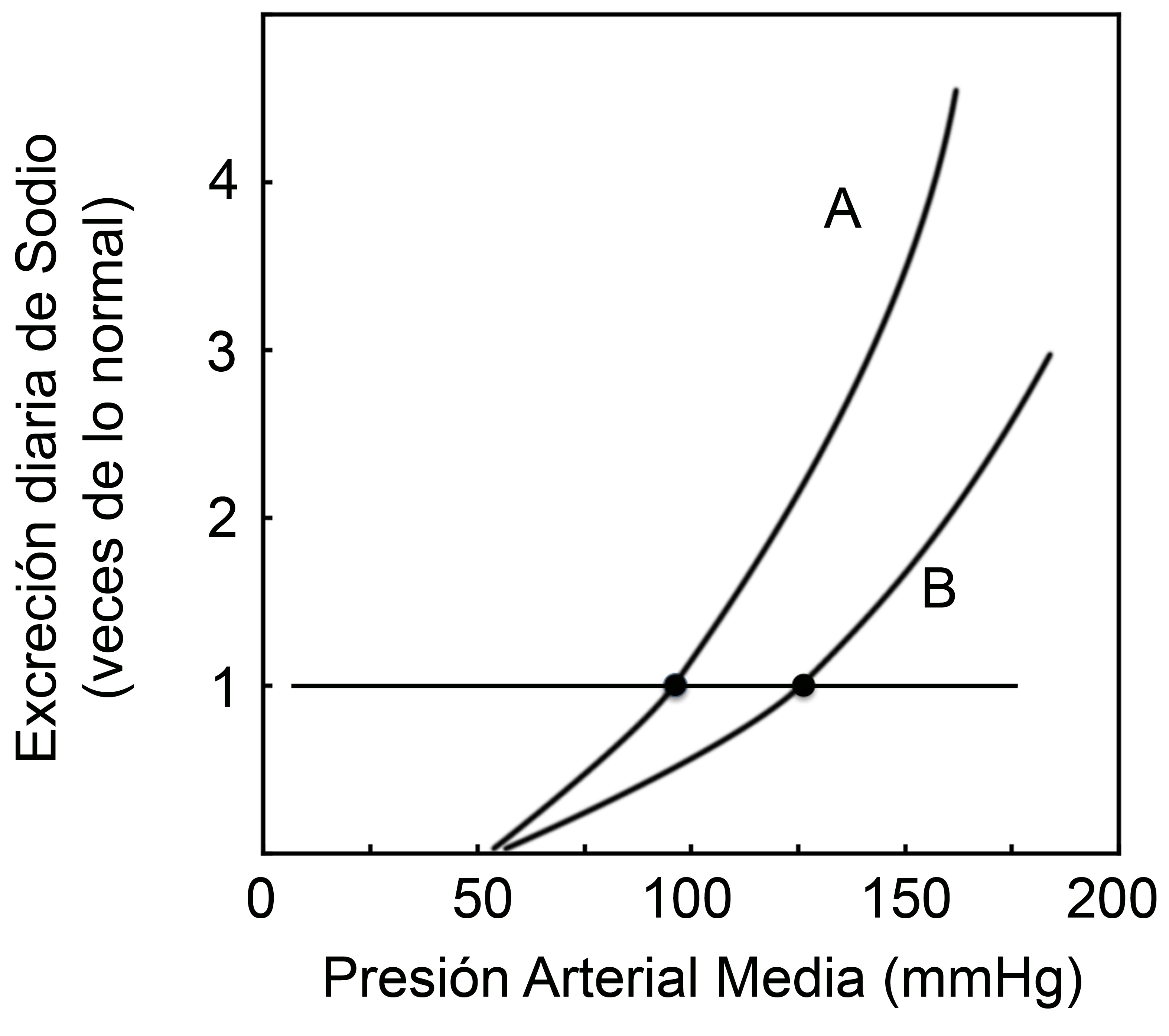
Figura 1. Curva Natriuresis-Presión de Guyton.
Durante los últimos 50 años, literalmente miles de publicaciones han demostrado el efecto de mecanismos neurohormonales que permiten el fenómeno de “natriuresis por presión” propuesto por Guyton y cols. (actividad simpática, hormonas natriuréticas y hormonas antinatriuréticas). En general, una mayoría abrumadora de estos experimentos apoyan el papel de la ingesta de sal en la presión arterial. Por ejemplo, aumentos del aporte de sal en la dieta produce efectos directamente proporcionales en la presión arterial de chimpancés4. Estudios en voluntarios sanos han mostrado que el cambio del aporte de sodio en la dieta, el cambio desde aportes bajos (70 milimoles de sodio/día) versus aportes normales-altos (185 milimoles/día), se asocian a aumentos de la presión arterial. Esta diferencia es particularmente evidente en aquellos sujetos en que se reduce en menor grado la reabsorción renal de sodio frente a la dieta con mayor aporte de sodio5.
El bloqueo farmacológico del sistema renina-angiotensina-aldosterona en animales de experimentación, que junto con suprimirlo impide los cambios adaptativos frente a cambios en la ingesta de sal, resulta en aumentos dramáticos de la presión arterial al aumentar la ingesta de sal6.
En el mismo sentido, la fijación de la actividad del RAAS mediante la infusión de AngII (el principal péptido del sistema), resulta en aumentos dramáticos de la presión arterial al aumentar la ingesta de sal6,7.
Una importante observación “en contra” de los efectos causales de la alta ingesta de sal como factor prohipertensivo, es que no todos los sujetos presentan el fenotipo de hipertensión salsensible8. Existe una serie de condiciones que se han asociado al fenotipo “sal-sensible” (bajo peso al nacer, enfermedad glomerular primaria, envejecimiento, obesidad, diabetes, entre otros), y estudios en modelos experimentales muestran que el daño renal hipertensivo lleva al desarrollo de fenotipo sal-sensible, así como también existen factores genéticos (cepas de animales) salsensibles8. El propio Guyton3 y el grupo de Dahl9 realizaron observaciones pioneras en los años 70, identificando que existen factores genéticos que determinan la magnitud de la respuesta hipertensiva frente a los aumentos del aporte de sal. Estudios más recientes han identificado una serie de genes que están asociados con la hipertensión arterial esencial o con formas de hipertensión arterial monogénicas10,11.
Es interesante destacar que la gran mayoría de estos genes codifican para proteínas transportadoras de sodio, o bien están directamente relacionadas al control de las proteínas que median la reabsorción de sodio a nivel renal. Estos estudios genéticos muestran que los cambios de expresión génica que se traducen en aumentos de actividad de los transportadores de sodio y aumento en la reabsorción renal de sal llevan al desarrollo de hipertensión arterial.
Un segundo punto “en contra” de los efectos prohipertensivos y deletéreos de la alta ingesta de sal, es la ausencia de un mecanismo molecular-celular que explique cómo es que la sal induce daño en los tejidos diana (corazón, riñón, cerebro) en forma independiente/aditiva a la hipertensión arterial. Los estudios experimentales han demostrado que un alto consumo de sal afecta la microcirculación, disminuyendo la relajación de vasos de resistencia en el músculo esquelético, aorta y arteria cerebral medias de ratas, efecto mediado por la caída en la producción y liberación de oxido nítrico endotelial12-16. También se ha reportado un aumento de la producción de radicales libres en la microcirculación con una alta ingesta de NaCl17,18. En el riñón, el consumo crónico de una dieta rica en sal provoca disfunción endotelial de la microcirculación renal, además de daño inflamatorio, daños que son independientes de los niveles de presión arterial19.
La dieta rica en sal acelera el remodelamiento (hipertrofia) del ventrículo izquierdo (VI) en ratas hipertensas20. En estos animales se observa que dietas con aportes crecientes en NaCl, (4% u 8%) producen hipertrofia directamente proporcional al aumento de la sal dietaria; sin embargo, los niveles de presión arterial en ambos grupos son similares20. También ha sido demostrado que la disminución del aporte de sal en la dieta es útil para la reducción del daño de tejidos blancos (cerebro, corazón, riñón) y de la incidencia de patologías cardiovasculares como el infarto agudo al miocardio (IAM), los accidentes vasculares encefálicos (AVE) y la insuficiencia renal crónica (IRC). Un alto consumo de sal al día está asociado con un aumento del 23% en el riesgo de sufrir un AVE y de un aumento del 17% en el riesgo de sufrir un IAM21.
El daño renal causado por la HTA, que puede desarrollar IRC, también está correlacionado con la ingesta de sal. Reducciones moderadas de consumo de sal en pacientes con HTA leve son suficientes para disminuir la presión arterial, además de lograr una reducción significativa (9 a 14%) de la excreción urinaria de albúmina22, factor de riesgo independiente de desarrollo y progresión de daño renal como de enfermedad cardiovascular en pacientes con IRC y/o HTA entre otras23,24. Sin embargo, es muy difícil disociar el efecto de la sal “per se”, de los efectos hemodinámicos asociados a la hipertensión en condiciones de alta ingesta de sal (estrés oxidativo, inflamación, daño endotelial, remodelación cardiovascular secundaria a factores tisulares), y por el momento no es claro si la sal ejerce acciones deletéreas independientes de la presión arterial.
A priori, los efectos prohipertensivos de una dieta rica en sal podrían deberse al aporte de sodio, al aporte de cloruro o a una combinación de ambos7. Por razones históricas, en la literatura médica en general se ha hecho sinónimo de ingesta rica en NaCl una dieta rica en sodio. Sin embargo, los estudios experimentales también indican que desde el punto de vista de la presión arterial, ingesta de sal (NaCl) no es equivalente a ingesta de sodio. Por ejemplo, en ratas unineferctomizadas sometidas a una dieta rica en sal y aldosterona, se desarrolla rápidamente (desde las 24 horas) hipertensión arterial severa. Sin embargo, al someter ratas uninefrectomizadas al tratamiento con aldosterona y una dieta rica en sodio en cantidades equimolares, aportado por bicarbonato de sodio (sin cloruro), los animales no desarrollan hipertensión arterial25.
Un resultado similar también ha sido demostrado en ratas que presentan desarrollo de hipertensión en respuesta a aumentos de los aportes de NaCl en la dieta (ratas de la cepa Dahl, fenotipo sensible a la sal, similar al de un grupo importante de pacientes hipertensos), tampoco se desarrolla hipertensión arterial si el aporte de sodio está dado por bicarbonato26.
Estos estudios y otros muestran que el cloruro tiene un papel importante en el desarrollo de hipertensión arterial frente a aumentos en la ingesta de sodio. Otra cepa de ratas que muestra fenotipo de hipertensión en respuesta al aumento de ingesta de sal en la dieta (cepa Dahl), también mostró hipertensión en respuesta a cloruro de potasio pero no de bicarbonato de sodio27. Por otra parte, otros grupos han observado que en ratas Dahl o en ratas sometidas a uninefrectomía y aldosterona, el aumento selectivo de sodio o cloruro en la dieta no produce cambios significativos de la presión arterial7,28. Todos estos datos indican que tanto el sodio como el cloruro deben ingerirse juntos para producir hipertensión arterial. Estudios en seres humanos muestran que las dietas ricas en NaCl, son prohipertensivas, pero las dietas ricas en citrato de sodio o bicarbonato de sodio no tienen efecto prohipertensivo29,30,31.
En resumen, existe abundante evidencia experimental del efecto deletéreo de los aumentos de la ingesta de sal en la dieta sobre la presión arterial y el daño en los tejidos blancos. También consideramos que existe evidencia epidemiológica y clínica que demuestra los importantes beneficios que tiene la reducción de la ingesta de sal y su impacto en el desarrollo de hipertensión como de otras enfermedades cardiovasculares y de las muertes asociadas a ellas21,32-34.
En base a estos antecedentes, la OMS recomienda la reducción de la sal de la dieta como una de las tres mayores acciones para detener la crisis global de enfermedades no transmisibles, dentro de las cuales se encuentran las enfermedades cardiovasculares35. De acuerdo al análisis de la información y resultados disponibles, nos parece que no hay razones suficientes como para ignorar el efecto deletéreo de las dietas ricas en sal sobre la presión arterial y el daño cardiovascular asociado.
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declaran haber recibido financiamiento para la realización del artículo/investigación de Fondecyt regular, Instituto Milenio y Fondap CEMC; declaran no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

The study by Taylor et al published in June 2010 in the American Journal of Hypertension questions the effectiveness of reducing salt intake in the diet in the prevention and treatment of high blood pressure and other cardiovascular conditions. The publication of this article has lead to great controversy and medical associations and learned societies responded promptly. The response criticized the results of the meta-analysis and pointed out its methodological shortcomings. In this review we critically appraise the experimental evidence that shows the importance of diet salt intake and its role as a determinant of blood pressure. We briefly describe the paradigm that explains the role of salt intake in contributing in the regulation of blood pressure (Guyton hypothesis and model) and we mention the experimental evidence that supports this. We briefly comment on the classical studies that indicate that salt intake (NaCl) contributes directly to the development of high blood pressure and target tissues. Finally, we briefly mention the experimental data that is related with the controversy on the role of salt (NaCl) or sodium as prohypertensive agents.
 Autores:
Ignacio Bravo A.[1], Luis Michea A.[2]
Autores:
Ignacio Bravo A.[1], Luis Michea A.[2]

Citación: Bravo I, Michea L. Analysis of experimental evidence that shows adverse effects of salt and its relation to hypertension. Medwave 2012 Feb;12(2):e5303 doi: 10.5867/medwave.2012.02.5303
Fecha de envío: 26/12/2011
Fecha de aceptación: 29/12/2011
Fecha de publicación: 1/2/2012
Origen: solicitado
Tipo de revisión: con revisión externa por 2 revisores

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Taylor RS, Ashton KE, Moxham T, Hooper L, Ebrahim S. Reduced dietary salt for the prevention of cardiovascular disease: a meta-analysis of randomized controlled trials (Cochrane Review). Am J Hypertens. 2011 Aug;24(8):843-53. | CrossRef | PubMed |
Taylor RS, Ashton KE, Moxham T, Hooper L, Ebrahim S. Reduced dietary salt for the prevention of cardiovascular disease: a meta-analysis of randomized controlled trials (Cochrane Review). Am J Hypertens. 2011 Aug;24(8):843-53. | CrossRef | PubMed | Guyton AC, Coleman TG, Granger HJ. Circulation: overall regulation Annu Rev Physiol. 1972;34:13-46. | CrossRef | PubMed |
Guyton AC, Coleman TG, Granger HJ. Circulation: overall regulation Annu Rev Physiol. 1972;34:13-46. | CrossRef | PubMed | Guyton AC. The surprising kidney-fluid mechanism for pressure control: its infinite gain! Hypertension. 1990 Dec;16(6):725-30. | PubMed |
Guyton AC. The surprising kidney-fluid mechanism for pressure control: its infinite gain! Hypertension. 1990 Dec;16(6):725-30. | PubMed | Denton D, Weisinger R, Mundy NI, Wickings EJ, Dixson A, Moisson P, et al. The effect of increased salt intake on blood pressure of chimpanzees. Nat Med. 1995 Oct;1(10):1009-16. | CrossRef | PubMed |
Denton D, Weisinger R, Mundy NI, Wickings EJ, Dixson A, Moisson P, et al. The effect of increased salt intake on blood pressure of chimpanzees. Nat Med. 1995 Oct;1(10):1009-16. | CrossRef | PubMed | Barba G, Cappuccio FP, Russo L, Stinga F, Iacone R, Strazzullo P. Renal function and blood pressure response to dietary salt restriction in normo- tensive men. Hypertension. 1996 May;27(5):1160-4.
| PubMed |
Barba G, Cappuccio FP, Russo L, Stinga F, Iacone R, Strazzullo P. Renal function and blood pressure response to dietary salt restriction in normo- tensive men. Hypertension. 1996 May;27(5):1160-4.
| PubMed | Hall JE, Guyton AC, Smith MJ Jr, Coleman TG. Blood pressure and renal function during chronic changes in sodium intake: role of angiotensin. Am J Physiol. 1980 Sep;239(3):F271-80. | PubMed |
Hall JE, Guyton AC, Smith MJ Jr, Coleman TG. Blood pressure and renal function during chronic changes in sodium intake: role of angiotensin. Am J Physiol. 1980 Sep;239(3):F271-80. | PubMed | Orlov SN, Mongin AA. Salt-sensing mechanisms in blood pressure regulation and hypertension. Am J Physiol Heart Circ Physiol. 2007 Oct;293(4):H2039-53. | CrossRef | PubMed |
Orlov SN, Mongin AA. Salt-sensing mechanisms in blood pressure regulation and hypertension. Am J Physiol Heart Circ Physiol. 2007 Oct;293(4):H2039-53. | CrossRef | PubMed | Ritz E. Salt and hypertension. Nephrology (Carlton). 2010 Jun;15 Suppl 2:49-52. | CrossRef | PubMed |
Ritz E. Salt and hypertension. Nephrology (Carlton). 2010 Jun;15 Suppl 2:49-52. | CrossRef | PubMed | Jaffe D, Sutherland LE, Barker DM, Dahl LK. Effects of chronic excess salt ingestion: morphologic findings in kidneys of rats with differing genetic susceptibilities to hypertension. Arch Pathol. 1970 Jul;90(1):1-16. | PubMed |
Jaffe D, Sutherland LE, Barker DM, Dahl LK. Effects of chronic excess salt ingestion: morphologic findings in kidneys of rats with differing genetic susceptibilities to hypertension. Arch Pathol. 1970 Jul;90(1):1-16. | PubMed | Lifton RP, Gharavi AG, Geller DS. Molecular mechanisms of human hypertension. Cell. 2001 Feb 23;104(4):545-56. | CrossRef | PubMed |
Lifton RP, Gharavi AG, Geller DS. Molecular mechanisms of human hypertension. Cell. 2001 Feb 23;104(4):545-56. | CrossRef | PubMed | Mullins LJ, Bailey MA, Mullins JJ. Hypertension, kidney, and transgenics: a fresh perspective. Physiol Rev. 2006 Apr;86(2):709-46. | CrossRef | PubMed |
Mullins LJ, Bailey MA, Mullins JJ. Hypertension, kidney, and transgenics: a fresh perspective. Physiol Rev. 2006 Apr;86(2):709-46. | CrossRef | PubMed | Frisbee JC, Lombard JH. Development and reversibility of altered skeletal muscle arteriolar structure and reactivity with high-salt diet and reduced renal mass hypertension. Microcirculation. 1999 Sep;6(3):215-25. | PubMed |
Frisbee JC, Lombard JH. Development and reversibility of altered skeletal muscle arteriolar structure and reactivity with high-salt diet and reduced renal mass hypertension. Microcirculation. 1999 Sep;6(3):215-25. | PubMed | Frisbee JC, Roman RJ, Krishna UM, Falck JR, Lombard JH. Altered mechanisms underlying hypoxic dilation of skeletal muscle resistance arteries of hypertensive versus normotensive Dahl rats. Microcirculation. 2001 Apr;8(2):115-27. | PubMed |
Frisbee JC, Roman RJ, Krishna UM, Falck JR, Lombard JH. Altered mechanisms underlying hypoxic dilation of skeletal muscle resistance arteries of hypertensive versus normotensive Dahl rats. Microcirculation. 2001 Apr;8(2):115-27. | PubMed | Frisbee JC, Sylvester FA, Lombard JH. High- salt diet impairs hypoxia-induced cAMP production and hyperpolarization in rat skeletal muscle arteries. Am J Physiol Heart Circ Physiol. 2001 Oct;281(4):H1808-15. | PubMed |
Frisbee JC, Sylvester FA, Lombard JH. High- salt diet impairs hypoxia-induced cAMP production and hyperpolarization in rat skeletal muscle arteries. Am J Physiol Heart Circ Physiol. 2001 Oct;281(4):H1808-15. | PubMed | Lombard JH, Sylvester FA, Phillips SA, Frisbee JC. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 2003 Apr;284(4):H1124-33. Epub 2002 Nov 27. | PubMed |
Lombard JH, Sylvester FA, Phillips SA, Frisbee JC. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 2003 Apr;284(4):H1124-33. Epub 2002 Nov 27. | PubMed | Zhu J, Mori T, Huang T, Lombard JH. Effect of high salt diet on NO release and superoxide production in rat aorta. Am J Physiol Heart Circ Physiol. 2004 Feb;286(2):H575-83. Epub 2003 Oct 2. | CrossRef | PubMed |
Zhu J, Mori T, Huang T, Lombard JH. Effect of high salt diet on NO release and superoxide production in rat aorta. Am J Physiol Heart Circ Physiol. 2004 Feb;286(2):H575-83. Epub 2003 Oct 2. | CrossRef | PubMed | Lenda DM, Boegehold MA. Effect of a high- salt diet on oxidant enzyme activity in skeletal muscle microcirculation. Am J Physiol Heart Circ Physiol. 2002 Feb;282(2):H395-402. | PubMed |
Lenda DM, Boegehold MA. Effect of a high- salt diet on oxidant enzyme activity in skeletal muscle microcirculation. Am J Physiol Heart Circ Physiol. 2002 Feb;282(2):H395-402. | PubMed | Lenda DM, Sauls BA, Boegehold MA. Reactive oxygen species may contribute to reduced endothelium-dependent dilation in rats fed high salt. Am J Physiol Heart Circ Physiol. 2000 Jul;279(1):H7-H14. | CrossRef | PubMed |
Lenda DM, Sauls BA, Boegehold MA. Reactive oxygen species may contribute to reduced endothelium-dependent dilation in rats fed high salt. Am J Physiol Heart Circ Physiol. 2000 Jul;279(1):H7-H14. | CrossRef | PubMed | Fiore MC, Jimenez PM, Cremonezzi D, Juncos LI, García NH. Statins reverse renal inflammation and endothelial dysfunction induced by chronic high salt intake Am J Physiol Renal Physiol. 2011 Aug;301(2):F263-70. | PubMed |
Fiore MC, Jimenez PM, Cremonezzi D, Juncos LI, García NH. Statins reverse renal inflammation and endothelial dysfunction induced by chronic high salt intake Am J Physiol Renal Physiol. 2011 Aug;301(2):F263-70. | PubMed | Gao F, Han ZQ, Zhou X, Shi R, Dong Y, Jiang TM, Li YM. High salt intake accelerated cardiac remodeling in spontaneously hypertensive rats: time window of left ventricular functional transition and its relation to salt-loading doses. Clin Exp Hypertens. 2011;33(7):492-9. | CrossRef | PubMed |
Gao F, Han ZQ, Zhou X, Shi R, Dong Y, Jiang TM, Li YM. High salt intake accelerated cardiac remodeling in spontaneously hypertensive rats: time window of left ventricular functional transition and its relation to salt-loading doses. Clin Exp Hypertens. 2011;33(7):492-9. | CrossRef | PubMed | Strazzullo P, D’Elia L, Kandala N-B, Cappuccio FP. Salt intake, stroke, and cardiovascular disease: meta-analysis of prospective studies. BMJ. 2009 Nov 24;339:b4567. | CrossRef | PubMed | PMC |
Strazzullo P, D’Elia L, Kandala N-B, Cappuccio FP. Salt intake, stroke, and cardiovascular disease: meta-analysis of prospective studies. BMJ. 2009 Nov 24;339:b4567. | CrossRef | PubMed | PMC | He FJ, Visagie E, Markandu ND, Anan V, Dalton RN, et al. Effect of modest salt reduction on blood pressure, urinary albumin and pulse wave velocity in white, black, and Asian mild hypertensives. Hypertension. 2009 Sep;54(3):482-8. | CrossRef | PubMed |
He FJ, Visagie E, Markandu ND, Anan V, Dalton RN, et al. Effect of modest salt reduction on blood pressure, urinary albumin and pulse wave velocity in white, black, and Asian mild hypertensives. Hypertension. 2009 Sep;54(3):482-8. | CrossRef | PubMed | Gerstein HC, Mann JF, Yi Q, Zinman B, Dinneen SF, Hoogwerf B, et al. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA. 2001 Jul 25;286(4):421-6. | CrossRef | PubMed |
Gerstein HC, Mann JF, Yi Q, Zinman B, Dinneen SF, Hoogwerf B, et al. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA. 2001 Jul 25;286(4):421-6. | CrossRef | PubMed | Arnlov J, Evans JC, Meigs JB, Wang TJ, Fox CS, Levy D, et al. Low-grade albuminuria and incidence of cardiovascular disease events in nonhypertensive and nondiabetic individuals: the Framingham Heart Study. Circulation. 2005 Aug 16;112(7):969-75. | CrossRef | PubMed |
Arnlov J, Evans JC, Meigs JB, Wang TJ, Fox CS, Levy D, et al. Low-grade albuminuria and incidence of cardiovascular disease events in nonhypertensive and nondiabetic individuals: the Framingham Heart Study. Circulation. 2005 Aug 16;112(7):969-75. | CrossRef | PubMed | Kurtz TW, Morris RC Jr. Dietary chloride as a determinant of ‘‘sodium-dependent’’ hypertension. Science. 1983 Dec 9;222(4628):1139-41. | CrossRef | PubMed |
Kurtz TW, Morris RC Jr. Dietary chloride as a determinant of ‘‘sodium-dependent’’ hypertension. Science. 1983 Dec 9;222(4628):1139-41. | CrossRef | PubMed | Whitescarver SA, Ott CE, Jackson BA, Guthrie GP Jr, Kotchen TA. Salt-sensitive hypertension: contribution of chloride. Science. 1984 Mar 30;223(4643):1430-2. | CrossRef | PubMed |
Whitescarver SA, Ott CE, Jackson BA, Guthrie GP Jr, Kotchen TA. Salt-sensitive hypertension: contribution of chloride. Science. 1984 Mar 30;223(4643):1430-2. | CrossRef | PubMed | Tanaka M, Schmidlin O, Yi SL, Bollen AW, Morris RC Jr. Genetically determined chloride-sensitive hypertension and stroke. Proc Natl Acad Sci U S A. 1997 Dec 23;94(26):14748-52. | CrossRef | PubMed | PMC |
Tanaka M, Schmidlin O, Yi SL, Bollen AW, Morris RC Jr. Genetically determined chloride-sensitive hypertension and stroke. Proc Natl Acad Sci U S A. 1997 Dec 23;94(26):14748-52. | CrossRef | PubMed | PMC | Luft FC, Steinberg H, Ganten U, Meyer D, Gless KH, Lang RE, et al. Effect of sodium chloride and sodium bicarbonate on blood pressure in stroke-prone spontaneously hypertensive rats. Clin Sci (Lond). 1988 Jun;74(6):577-85. | PubMed |
Luft FC, Steinberg H, Ganten U, Meyer D, Gless KH, Lang RE, et al. Effect of sodium chloride and sodium bicarbonate on blood pressure in stroke-prone spontaneously hypertensive rats. Clin Sci (Lond). 1988 Jun;74(6):577-85. | PubMed | Kurtz TW, Al-Bander HA, Morris RC Jr. ‘‘Salt-sensitive’’ essential hypertension in men. Is the sodium ion alone important? N Engl J Med. 1987 Oct 22;317(17):1043-8. | CrossRef | PubMed |
Kurtz TW, Al-Bander HA, Morris RC Jr. ‘‘Salt-sensitive’’ essential hypertension in men. Is the sodium ion alone important? N Engl J Med. 1987 Oct 22;317(17):1043-8. | CrossRef | PubMed | Boegehold MA, Kotchen TA. Relative contribution of dietary Na+ and Cl- to salt-sensitive hypertension. Hypertension. 1989 Dec;14(6):579-83. | PubMed |
Boegehold MA, Kotchen TA. Relative contribution of dietary Na+ and Cl- to salt-sensitive hypertension. Hypertension. 1989 Dec;14(6):579-83. | PubMed | Boegehold MA, Kotchen TA. Importance of dietary chloride for salt sensitivity of blood pressure. Hypertension. 1991 Jan;17(1 Suppl):I158-61. | PubMed |
Boegehold MA, Kotchen TA. Importance of dietary chloride for salt sensitivity of blood pressure. Hypertension. 1991 Jan;17(1 Suppl):I158-61. | PubMed | Law MR, Frost CD, Wald NJ. By how much does dietary salt reduction lower blood pressure? I--Analysis of observational data among populations. BMJ. 1991 Apr 6;302(6780):811-5. | CrossRef | PubMed | PMC |
Law MR, Frost CD, Wald NJ. By how much does dietary salt reduction lower blood pressure? I--Analysis of observational data among populations. BMJ. 1991 Apr 6;302(6780):811-5. | CrossRef | PubMed | PMC | He FJ, MacGregor GA. How far should salt intake be reduced? Hypertension. 2003 Dec;42(6):1093-9. | CrossRef | PubMed |
He FJ, MacGregor GA. How far should salt intake be reduced? Hypertension. 2003 Dec;42(6):1093-9. | CrossRef | PubMed | He FJ, MacGregor GA. Reducing population salt intake worldwide: from evidence to implementation. Prog Cardiovasc Dis. 2010 Mar-Apr;52(5):363-82. | CrossRef | PubMed |
He FJ, MacGregor GA. Reducing population salt intake worldwide: from evidence to implementation. Prog Cardiovasc Dis. 2010 Mar-Apr;52(5):363-82. | CrossRef | PubMed | Beaglehole R, Bonita R, Horton R, Adams C, Alleyne G, Asaria P, et al. Priority actions for the non-communicable disease crisis. Lancet. 2011 Apr 23;377(9775):1438-47. | CrossRef | PubMed |
Beaglehole R, Bonita R, Horton R, Adams C, Alleyne G, Asaria P, et al. Priority actions for the non-communicable disease crisis. Lancet. 2011 Apr 23;377(9775):1438-47. | CrossRef | PubMed | La sal de la tierra
La sal de la tierra