 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La hipertensión arterial esencial es considerada como la principal causa de muerte por la OMS. La cuarta parte de la población mayor de 15 años es hipertensa, lo que representa aproximadamente un billón de personas, que tendrán un importante aumento en el año 2025 cercano al 60%. Su prevalencia aumenta en proporción lineal con el aumento de edad. Desafortunadamente, los niveles de detección, tratamiento y control efectivo de la hipertensión arterial, son deficientes a nivel de Chile y mundial, por lo que es aún un problema de salud pública no resuelto y que por tanto necesita urgente atención. La reciente Encuesta Nacional Ministerial de Salud 2009-2010 de Chile reveló una prevalencia de hipertensión arterial nacional de un 26,9%, con un 65% de conocimiento de su existencia, 37,6% en tratamiento y sólo un 16,49% de control satisfactorio. Además, dicha encuesta revela marcadores de estilos de vida poco saludables, que permiten comprender la epidemia nacional de hipertensión arterial, a través de la existencia de múltiples factores de riesgo para ella. En esta revisión nos centramos especialmente en la importancia de la relación sodio-potasio en la regulación de la presión arterial. Llama la atención que todos los estudios destacan la importancia que tiene el sodio en la génesis de la hipertensión arterial por sus efectos presores, particularmente en sujetos sensibles, y poco o nada se manifieste de las variadas acciones benéficas que posee el potasio en la regulación de la presión arterial.
La hipertensión arterial esencial es considerada como la principal causa de muerte por la OMS. La cuarta parte de la población mayor de 15 años es hipertensa, lo que representa aproximadamente un billón de personas, que tendrán un importante aumento en el año 2025, cercano al 60%. Su prevalencia aumenta en proporción lineal con el aumento de edad. Es responsable del 62% de los accidentes vasculares cerebrales y del 48% de los infartos del miocardio. En tal sentido, una reducción de tan solo 2 mmHg de presión arterial, disminuye en aproximadamente un 7% el accidente vascular cerebral y en un 5% el infarto agudo del miocardio, por lo que si estas reducciones se proyectaran a la población general, se traducen en beneficios importantes.
Desafortunadamente, los niveles de detección, tratamiento y control efectivo de la hipertensión arterial, son deficientes a nivel de Chile y del mundo, por lo que es aún un problema de salud pública no resuelto y que necesita urgente atención.
Su aparición es la consecuencia de factores genéticos y principalmente de estilos de vida inadecuados, que inducen alteraciones neurohormonales de gran complejidad, responsables de inflamación y estrés oxidativo que producen lentos y progresivos cambios estructurales y funcionales llamados remodelación cardiovascular, caracterizada por disfunción endotelial, fenómenos de rarefacción capilar, hipertrofia arteriolar, progresiva rigidez de grandes arterias, fibrosis, apoptosis e hipertrofias miocárdicas.
La reciente Encuesta Nacional Ministerial de Salud 2009-2010 de Chile, que abarcó a más de 5000 personas mayores de 15 años, reveló una prevalencia de hipertensión arterial nacional de un 26,9%, con un 65% de conocimiento de su existencia, 37,6% en tratamiento y sólo un 16,49% de control satisfactorio, mostrando en los hombres niveles significativamente deficientes de 55,15% diagnosticados; 25,78% en tratamiento y sólo 8,71% con control satisfactorio. Además, dicha encuesta revela marcadores de estilos de vida poco saludables, que permiten comprender la pandemia nacional de hipertensión arterial, a través de la existencia de múltiples factores de riesgo para ella, como son: elevadísimos niveles de sobrepeso y obesidad, sedentarismo, tabaquismo, ingesta exagerada de alcohol, consumo excesivo de sal (9,8%), deficiente ingesta de frutas y verduras (sólo un 15% presenta una ingesta recomendada de 5 porciones diarias) y déficit en aporte diario de potasio (2,7 gramos), correspondiendo los valores recomendables de consumo de potasio de 4,7 gramos.
En esta revisión nos focalizamos especialmente en la importancia de la relación sodio-potasio en la regulación de la presión arterial, llamando extremadamente la atención que todos los estudios destacan la importancia que tiene el sodio en la génesis de la hipertensión arterial por sus efectos presores, particularmente en sujetos sensibles, y poco o nada se manifieste de las variadas acciones benéficas que posee el potasio en la regulación de la presión arterial.
El sodio, principal catión extracelular, ha sido siempre considerado esencial en la aparición y mantención de la hipertensión arterial. Numerosos estudios observacionales, intervencionales y experimentales en animales y humanos, lo han demostrado categóricamente1,2. Su contraparte, el potasio, principal catión intracelular, ha sido subestimado en la patogenia de la hipertensión arterial. Sin embargo, numerosas evidencias recientes indican que el déficit de potasio tiene un rol crítico en la hipertensión arterial y en sus trastornos estructurales3,4. Examinaremos la importancia de la interdependencia del sodio y el potasio en sus efectos estructurales y metabólicos. El análisis de las acciones aisladas de estos cationes no reflejan la trascendencia desus efectos recíprocos.
Como se mencionó, el potasio es el principal catión intracelular, donde alcanza concentraciones cercanas a 150 mEq/L, presentando una concentración en el plasma entre 3,5 a 5 mEq/L. Por lo tanto, la cantidad de K+ en el líquido extracelular es de entre 30 a 70 m Eql/L, representando un 2% del potasio corporal total (2.500 a 4.500 mEq). El cociente de la concentración de potasio entre el intra y extra celular es de 38:1, que se mantiene gracias al potencial de membrana en reposo y resulta esencial para la normalidad de la función neuromuscular. La bomba basolateral de ATPasa de Na+ y K+ transporta activamente al K+ al interior de la célula y al Na+ fuera de ella, en una proporción de 2:3, y la difusión pasiva del K+ hacia afuera es el factor cuantitativamente más importante para generar el potencial de membrana en reposo.
La actividad electrógena de la bomba de ATPasa de Na+ y K+ se puede estimular aumentando la concentración de Na+ intracelular y se puede inhibir cuando se induce intoxicación digitálica o en presencia de enfermedades crónicas, como la insuficiencia cardíaca o renal. Recordemos que la bomba ATPasa de Na+ y K+ tiene la capacidad de unirse a la uabaina endógena (UE), sustancia de efecto digitálico, y por lo tanto inhibidor de dicha bomba. Se ha observado que dicha sustancia se encuentra elevada en un 45% de los pacientes con hipertensión arterial. La relación de la UE con el balance de sodio es complejo, así en normotensos se suprime la elevación de UE generada por la elevada ingesta de sal, evitando el efecto presor. En hipertensos con elevada UE con ingesta normal de sodio, se observa que tienen hipertensión arterial por una inadecuada modulación de la síntesis de UE o falla en su depuración5. En los pacientes hipertensos con elevación de la UE se produce un aumento significativo del tono arteriolar.
En el régimen de alimentación occidental, la persona ingiere entre 40 y 120 mmol/día de K+, es decir, 1 mmol/kg/día aproximadamente, siendo absorbido el 90% por el tubo digestivo. En el comienzo, los mecanismos compensadores del riñón y la eliminación urinaria después, impiden que la concentración plasmática del K+ se duplique, como pasaría si este catión fuera ingerido con la dieta y permaneciera en el compartimiento extracelular. Es así como la mayor parte del potasio que se absorbe inmediatamente después de las comidas, luego de elevar su concentración en el plasma, penetra en las células; paso facilitado por la liberación de insulina y por los niveles basales de catecolaminas. Al final, el exceso de K+ se elimina por la orina. En la insuficiencia renal crónica, las pérdidas de K+ por las heces pueden aumentar desde 10 a 40% (del potasio ingerido).
El riñón es la principal vía para eliminar el exceso de K+ de los alimentos. La cantidad de K+ filtrado es de 720 mmol/día, 10 a 20 veces mayor que la cantidad de K+ del extracelular. El 90% del total filtrado se reabsorbe en el túbulo contorneado proximal y en el asa de Henle. Por lo tanto, la cantidad de K+ que llega a la nefronadistal se aproxima a la cantidad ingerida. En último término se produce secreción o resorción del K+ según exista exceso o disminución de K+, respectivamente. La célula principal es la encargada de la secreción de potasio en el último tramo del túbulo contorneado. Prácticamente toda la regulación de la eliminación del K+ por los riñones y del balance del potasio corporal total, se produce en la nefrona distal.
La secreción de potasio está regulada por dos estímulos fisiológicos: la aldosterona y la hipokalemia. La aldosterona es secretada por las células de la zona glomerulosa de la corteza suprarrenal cuando aumenta el nivel de la angiotensina II o cuando hay hiperkalemia. La concentración del potasio en el plasma afecta directamente la secreción de K+, independientemente de la acción de la aldosterona. Como la eliminación equivale al producto de la concentración multiplicada por el volumen, el aumento del flujo en la nefrona distal puede aumentar considerablemente la eliminación urinaria del K+. Por último, en la reducción severa de K+, se reduce la secreción de este catión, y su resorción es regulada en los conductos colectores.
Las funciones biológicas de este ión son múltiples; es cofactor de numerosas enzimas, participa en la secreción de insulina, en el metabolismo de los carbohidratos y en la síntesis de proteínas. Además, la razón K+ intracelular/K+ extracelular es el principal factor determinante en la excitabilidad muscular y neuronal, por tanto, si este balance es alterado, se pueden desarrollar diversas condiciones patológicas5. En poblaciones aisladas con predominio de alimentos naturales, ricos en frutas y verduras, la ingesta individual de potasio excede los 150 mEq por día, mientras que el aporte de sodio es de sólo 20 a 40 mEq diarios, siendo la relación potasio-sodio mayor de 3, con prevalencias muy bajas de hipertensión arterial, menores al 3%6. Por contraste, poblaciones industrializadas, con un alto consumo de alimentos predominantemente procesados, ingieren entre 30 y 70 mEq de potasio diario y entre 100-400 mEq de sodio por día, es decir, con una relación de potasio-sodio menor de 0,4, acompañándose de elevadas y crecientes tasas de hipertensión arterial7.
En estudios clínicos, una dieta baja en potasio (10 a 16 mEq por día) en personas con una dieta habitual de sodio de entre 120 y 200 mEq diarios, produce retención de sodio y elevación de la presión arterial, con un aumento promedio de 6 mmHg de presión arterial sistólica y 4 mmHg en la presión diastólica en personas normotensas, siendo levemente mayor en personas hipertensas8.
La sal sensibilidad, definida como un aumento de la presión arterial en respuesta a una mayor ingesta de cloruro de sodio, se presenta en 26% de normotensos y en 51% de hipertensos. La población normotensa sal sensible aparece como etapa precursora de hipertensión arterial. El mayor aporte de potasio ejerce un poderoso efecto inhibitorio dosis dependiente de la sensibilidad al sodio. Con una dieta que fue baja en potasio -30 mEq por día-, 79% de los normotensos afroamericanos y 36% de normotensos caucásicos tenían sal sensibilidad. La suplementación de 90 mEq de bicarbonato de potasio por día, redujo la sal sensibilidad en sólo un 20% de afroamericanos. Esta reducción se observó con un aporte de tan sólo 40 mmol de bicarbonato de potasio en caucásicos9. Por lo tanto, un aporte adecuado de potasio puede reducir significativamente la sal sensibilidad.
En el estudio INTERSALT, que incluyó a 10.079 personas de 32 países, se observó que la relación potasio-sodio urinaria tuvo una significativa e inversa relación con la presión arterial, siendo esta relación de mayor poder estadístico que la excreción aislada de sodio y potasio10.
La restricción de potasio causa un déficit del potasio celular que hace necesaria la incorporación de sodio para mantener su tonicidad y volumen. El aumento del sodio celular tiene efectos deletéreos inmediatos y a largo plazo. Se ha descrito en animales y personas hipertensas un exceso de sodio y un déficit de potasio11. El sodio intercambiable, medido por técnicas de dilución isotópica, está aumentado en hipertensos y se correlaciona positivamente con los niveles de presión arterial, siendo esta correlación mayor en personas de la tercera edad. Inversamente, el potasio intercambiable medido por iguales técnicas se correlacionan negativamente con la presión arterial en hipertensos esenciales12.
El potasio del músculo esquelético está disminuido en hipertensos no tratados, pero el potasio plasmático, generalmente un indicador de baja confiabilidad, está en rangos habitualmente normales13. Las presiones sistólica y diastólica se relacionan negativamente con el potasio muscular en normotensos e hipertensos14.
La reabsorción del sodio filtrado por los túbulos renales está aumentado en los hipertensos esenciales, teniendo un rol importante el intercambiador sodio-hidrógeno tipo 3, que se encuentra en el túbulo proximal y en la porción gruesa del asa ascendente de Henle, donde aproximadamente el 90% del sodio es reabsorbido. La actividad de este transportador está aumentado en ratas hipertensas15. Se ha observado que la depleción de potasio aumenta la actividad del sistema renina angiotensina y del sistema simpático, siendo a su vez estos sistemas estimulantes de este transportador16. La relación entre el sodio y el potasio en hipertensión, como el efecto de éste en la natriuresis, hipertensión sal sensible y la glucoregulación han sido de gran interés para la comunidad científica17.
En el contexto de la protección ejercida por el potasio, existen antecedentes interesantes, como los publicados por el grupo de McCabe el año 1994, donde demostraron que el aumento de potasio dentro de los rangos fisiológicos, puede disminuir la tasa de formación de radicales libres en células vasculares. Lo mismo ocurrió con macrófagos humanos, donde el aumento del potasio intracelular disminuyó la formación de aniones superóxidos18.
Si consideramos los efectos de la relación potasio-sodio en la pared arterial, se observa que la retención de sodio y el déficit de potasio inhiben la bomba sodio-potasio ATPasa de las células musculares lisas arteriales y arteriolares, aumentando la concentración de sodio y reduciendo la concentración de potasio intracelular. El aumento del sodio intracelular estimula el intercambiador de sodio calcio tipo 1 en la membrana celular, ingresando calcio a la célula.
Un déficit de potasio inhibe los canales de potasio en la membrana celular induciendo depolarización de la membrana. Esta depolarización promueve una mayor alza del calcio intracelular a través de los canales de calcio voltaje dependiente y de la liberación del calcio del retículo sarcoplasmático. Esta mayor presencia de calcio incrementa la contracción de la musculatura lisa19. El aumento de potasio por su cuenta produce el efecto inverso, es decir, a través de la hiperpolarización de la membrana crea las condiciones para reducir el sodio y el calcio intracelular, con vasodilatación dependiente del endotelio20.
La administración de solución salina hipertónica intraventricular aumenta la presión arterial, teniendo la administración de potasio efectos opuestos21. Si se hace una infusión intraventricular de aldosterona a dosis no presoras se reduce el potasio en el líquido cefalorraquídeo y aumenta la presión arterial. La administración de potasio o prorenona, un antagonista de los minerales o corticoides, a través de la misma vía previene la reducción de potasio en el líquido cefalorraquídeo y el efecto presor de la aldosterona22,23.
El efecto favorable de pequeñas dosis de espironolactona en insuficiencia cardíaca e hipertensión puede depender de su acción central, minimizando la reducción de potasio extracelular en el cerebro y, por lo tanto, modulando descargas simpáticas24.
Las acciones centrales de cambios en la concentración de sodio y potasio en el líquido cefalorraquídeo y un exceso de sodio y un déficit de potasio corporal son probablemente mediados por cambios en la actividad de la bomba de sodio neuronal y del sistema renina angiotensina del cerebro25. Estos cambios incrementan el tono simpático, lo cual potencia el efecto presor26.
La depleción de potasio inhibe la secreción de insulina y está asociada con intolerancia a la glucosa. La administración de potasio aumenta la secreción de insulina a través del cambio del potencial de membrana de las células beta del páncreas27. La insulina tiene un efecto vaso dilatador en el músculo esquelético mediado por la liberación de óxido nítrico28, este efecto se reduce en la hipertensión arterial29.
Diversos investigadores han podido aportar una serie de estudios en relación con los beneficios del ión potasio. Así, se ha determinado que este ión puede proteger a normotensos asiáticos del aumento de la dimetil arginina asimétrica, un competidor endógeno de la óxido nítrico sintasa y además un potente vasoconstrictor30,31. Una alta ingesta de potasio en la dieta reduce la presión arterial y aumenta la bio disponibilidad de óxido nítrico en normotensos asiáticos sensibles a la sal, no así a los no sensibles32.
Relacionado con la presión arterial, es importante destacar el fenómeno de natriuresis, donde el K+ posee un importante rol. Cambios en la ingesta de potasio provocan una notable alteración en el balance del sodio33,34,35,36. La retención de sodio, una característica de la depleción del potasio, aumenta la presión arterial por aumento del volumen del fluido extracelular, alterando la relación entre presión-natriuresis, aumento de la concentración del sodio intracelular y por estimulación de la liberación de inhibidores de la ATPasa Na+ y K+. Estudios han demostrado que el aumento de potasio en la dieta tiene un efecto en la mayor excreción de sodio37, lo que indica que el potasio -por mecanismos aún no determinados- incide en las moléculas que tienen relación con la regulación del sodio, como prostaglandinas, kininas y dopamina38,39.
Los riñones están diseñados para conservar sodio y excretar potasio, de acuerdo a las necesidades impuestas por la alimentación ancestral, rica en potasio y pobre en sodio en una relación mayor de 10. Por esta razón, podemos comprender su incapacidad para enfrentar la inversión total en la relación de estos cationes en la alimentación moderna.
La respuesta lógica, respaldada por toda la información existente, es propiciar “una vuelta al pasado” que permita reducir las respuestas neurohormonales inducidas por la alimentación actual, las que tienen un fuerte impacto a través del aumento. En apoyo al concepto de volver al pasado observemos la realidad actual de poblaciones tribales, que continúan viviendo en condiciones nutricionales y de actividad física similares a nuestros antepasados prehistóricos. Consume una dieta compuesta por alimentos no refinados, su contenido en grasas es reducido, con mayor contenido en fibras, calorías reducidas, significativo aumento en potasio y reducción en sal. El aporte diario de sodio es de 20-40 mEq/día y 150-290 mEq/día de potasio. En la dieta occidental la relación potasio-sodio es menor de 0,4, siendo en estas culturas primitivas mayor de 3 y cerca de 10.
Todas estas poblaciones presentan una prevalencia de hipertensión arterial menor de 1% y las enfermedades coronarias, insuficiencia cardíaca y accidentes vasculares cerebrales son infrecuentes. Son grupos con gran diversidad genética, pero tienen en común la mayor actividad física y el tipo de alimentación40.
Se utilizó la base de datos de la Encuesta Nacional de Salud 2009-2010, en una submuestra de 3.200 individuos seleccionados en forma aleatoria. El consumo de sal y potasio de 24 hrs fue calculado a partir de los datos obtenidos de sodio y potasio urinario. Se excluyeron para este análisis los sujetos en tratamiento con fármacos antihipertensivos. La muestra final incluyó 2.582 sujetos. Se evaluó con regresión lineal la relación entre potasio y sodio urinario, con las cifras de presión arterial. Los análisis se realizaron con STATA 11.2.
La proporción de mujeres fue 57%, 12,6% consumía 5 o más porciones de frutas o verduras y sólo un 1,5% presentó un consumo de sal menor de 5 gramos al día. El promedio de Na+ en orina fue de 124 mEq/L y para K+ 44,5 mEq/L. El índice sodio/potasio fue de 3,5. El 22% era hipertenso y 33,8% prehipertenso.
En los individuos de 50 años o más se observó que los niveles de sodio eran mayores en prehipertensos e hipertensos y que los niveles de potasio eran menores en los hipertensos que en los individuos con presión normal.
El potasio urinario mostró una relación inversa significativa con los niveles de presión arterial sistólica y diastólica en todo grupo etario y en ambos sexos.
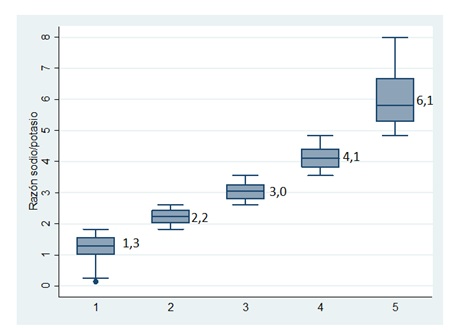
Figura 1. Relación sodio-potasio según quintiles de la población chilena.
En general las personas sanas, con función renal normal no presentan problemas con un aporte de potasio diario mayor a 4,7 gramos, siendo el exceso excretado con facilidad por la orina. Sin embargo, la presencia de insuficiencia renal con creatininas superiores a 1,8 mg/dL, diabetes de larga data, insuficiencia cardíaca o insuficiencia suprarrenal, presentan limitaciones en la excreción de potasio, lo que puede a su vez ser agravado por fármacos tales como: inhibidores de enzima convertidora, bloqueadores de receptores AT1 de angiotensina II, espironolactona, triamterene y amiloride. En estas condiciones el riesgo de hiperkalemia, hace necesaria una evaluación individual con apoyo de controles seriados de potasio plasmático.
Ambos autores han completado el formulario ICMJE traducido al español por Medwave (disponibles contactando al autor responsable) y declaran no haber recibido financiamiento para la realización del artículo; ambos declaran ser miembros de la Fundación Chilena de Hipertensión Arterial; y el Dr. Luis Zárate Méndez declara haber recibido financiamiento de Novartis Chile para la realización de consultorías, para el desarrollo de presentaciones o materiales educativos y para dictar conferencias en el ámbito biomédico en los últimos tres años; relaciones o actividades que podrían influir sobre el contenido del artículo publicado.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

The World Health Organization considers essential hypertension as a primary cause of death. Twenty-five percent of the population over 15 has high blood pressure (HBP), equivalent to a billion people. It has been predicted that this group will increase by 60%, lineal with age increase in the overall population. Unfortunately, detection, treatment and effective control of HBP, are deficient both in Chile and in the rest of the world, making it an unresolved health problem demanding urgent attention. The recently conducted Chilean National Health Survey (2009-2010) revealed a 26.9% prevalence of this condition in the population, sixty-five percent of individuals are aware of their condition, 37.6% are in treatment and only 16,49% are effectively controlled. Furthermore, the survey reveals unhealthy life-style markers, which explains the epidemic that besets the country as there are multiple risk factors at stake. This review focuses mainly on the importance of the sodium-potassium relationship in the regulation of high blood pressure. It must be pointed out that all of the studies underscore the importance of sodium in the genesis of hypertension because of its effects of blood pressure, especially in sensitive individuals, while little attention has been given to the manifold beneficial actions of potassium in the regulation of blood pressure.
 Autores:
Luis Hernán Zárate Méndez[1], Alex Valenzuela Montero[2]
Autores:
Luis Hernán Zárate Méndez[1], Alex Valenzuela Montero[2]

Citación: Zárate LH, Valenzuela A. Sodium-potassium balance in the regulation of high blood pressure. Medwave 2012 Feb;12(2):e5301 doi: 10.5867/medwave.2012.02.5301
Fecha de envío: 21/12/2011
Fecha de aceptación: 29/12/2011
Fecha de publicación: 1/2/2012
Origen: solicitado
Tipo de revisión: con revisión externa por 2 revisores

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: Mario Hernandez
Fecha/date: 2012-08-31 13:15:14
Comentario/comment:
Excelente artÃculo
Saludos
Mario Hernández
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Williams GH, Hollenberg NK. Non-modulating hypertension: a subset of sodium sensitive hypertension. Hypertension. 1991 Jan;17(1 Suppl):I81-5. | PubMed |
Williams GH, Hollenberg NK. Non-modulating hypertension: a subset of sodium sensitive hypertension. Hypertension. 1991 Jan;17(1 Suppl):I81-5. | PubMed | Iwamoto T, Kita S. Hypertension, Na+/Ca+2 exchanger, and Na+, K+ ATPasa Kidney Int. 2006 Jun;69(12):2148-54. | CrossRef | PubMed |
Iwamoto T, Kita S. Hypertension, Na+/Ca+2 exchanger, and Na+, K+ ATPasa Kidney Int. 2006 Jun;69(12):2148-54. | CrossRef | PubMed | Whelton PK. Potassium ann blood pressure. en: Hypertension primer. Dallas: American Heart Association/Council on High Blood Pressure Research,2003;280-2.
Whelton PK. Potassium ann blood pressure. en: Hypertension primer. Dallas: American Heart Association/Council on High Blood Pressure Research,2003;280-2.  Dietary reference intakes for water, potassium, sodium, chloride, and sulphate. Washington D.C.: National Academies Press, 2005.
Dietary reference intakes for water, potassium, sodium, chloride, and sulphate. Washington D.C.: National Academies Press, 2005.  Hamlyn J. Endogenous Ouabain : A link between sodium intake and hypertension. Curr Hypertens Rep. 2011 Feb;13(1):14-20. | CrossRef | PubMed |
Hamlyn J. Endogenous Ouabain : A link between sodium intake and hypertension. Curr Hypertens Rep. 2011 Feb;13(1):14-20. | CrossRef | PubMed | Elliot P. Salt and Blood pressure In: Izzo JL Jr, Black HR, eds. Hypertension primer. Dallas: American Heart Association/Council on High Blood Pressure Research, 2003; 277-279.
Elliot P. Salt and Blood pressure In: Izzo JL Jr, Black HR, eds. Hypertension primer. Dallas: American Heart Association/Council on High Blood Pressure Research, 2003; 277-279.  Dietary reference intakes for water, potassium, sodium, chloride, and sulphate. Washington DC: National Academies Press, 2005.
Dietary reference intakes for water, potassium, sodium, chloride, and sulphate. Washington DC: National Academies Press, 2005.  Krishna GG, Miller E, Kappor S. Increased clood pressure during potassium depletion in normotensive men. N Engl J Med. 1989 May 4;320(18):1177-82. | CrossRef | PubMed |
Krishna GG, Miller E, Kappor S. Increased clood pressure during potassium depletion in normotensive men. N Engl J Med. 1989 May 4;320(18):1177-82. | CrossRef | PubMed | Morris RC Jr, Sebastian A, Forman A, Tanaka M, Schmidlin O. Normotensive salt sensitivity: effectsof race and dietary potassium. Hypertension. 1999 Jan;33(1):18-23. | PubMed |
Morris RC Jr, Sebastian A, Forman A, Tanaka M, Schmidlin O. Normotensive salt sensitivity: effectsof race and dietary potassium. Hypertension. 1999 Jan;33(1):18-23. | PubMed | INTERSALT Cooperative Research Group. INTERSALT:an international study of electrolyte excretionand blood pressure: results for 24 hour urinary sodium and potassium excretion. BMJ. 1988 Jul 30;297(6644):319-28. | CrossRef | PubMed |
INTERSALT Cooperative Research Group. INTERSALT:an international study of electrolyte excretionand blood pressure: results for 24 hour urinary sodium and potassium excretion. BMJ. 1988 Jul 30;297(6644):319-28. | CrossRef | PubMed | Kaplan NM, Primary hypertension: pathogenesis. En: Kaplan's clinical Hypertension. Philadelphia: Lippicott Williams&Wilkins, 2006: 50-12.
Kaplan NM, Primary hypertension: pathogenesis. En: Kaplan's clinical Hypertension. Philadelphia: Lippicott Williams&Wilkins, 2006: 50-12.  Lever AF, Beretta-Piccoli C, Brown JJ, Davies DL, Fraser R, Robertson JI. Sodium and potassium inessential hypertension. Br Med J (Clin Res Ed). 1981 Aug 15;283(6289):463-8. | CrossRef | PubMed |
Lever AF, Beretta-Piccoli C, Brown JJ, Davies DL, Fraser R, Robertson JI. Sodium and potassium inessential hypertension. Br Med J (Clin Res Ed). 1981 Aug 15;283(6289):463-8. | CrossRef | PubMed | Ericsson R. Potassium in skeletal muscle in untreated primary hypertension and in chronic renalfailure, studied by X-Ray fluorescence technique. Acta Med Scand. 1984;215(3):225-30. | CrossRef | PubMed |
Ericsson R. Potassium in skeletal muscle in untreated primary hypertension and in chronic renalfailure, studied by X-Ray fluorescence technique. Acta Med Scand. 1984;215(3):225-30. | CrossRef | PubMed | Rubenowitz E, Landin K, Wihelmsen L. Skeletal muscle magnesium by gender and hypertensive status. Scand J Clin Lab Invest. 1998 Feb;58(1):47-54. | CrossRef | PubMed |
Rubenowitz E, Landin K, Wihelmsen L. Skeletal muscle magnesium by gender and hypertensive status. Scand J Clin Lab Invest. 1998 Feb;58(1):47-54. | CrossRef | PubMed | Meneton P, Jeunemaitre X, de Wardener HE, MacGregor GA. Links between dietary salt intake, renal,salt handling, blood pressure and cardiovascular disease. Physiol Rev. 2005 Apr;85(2):679-715. | CrossRef | PubMed |
Meneton P, Jeunemaitre X, de Wardener HE, MacGregor GA. Links between dietary salt intake, renal,salt handling, blood pressure and cardiovascular disease. Physiol Rev. 2005 Apr;85(2):679-715. | CrossRef | PubMed | Soleimani M, Bergman JA, Hosford MA, McKinney TD. Potassium depletion increases luminalNa+/H+ exchange and basolateral Na+:CO=:HCO3- cotrasnport in rat renal cortex. J Clin Invest. 1990 Oct;86(4):1076-83. | CrossRef | PubMed | PMC |
Soleimani M, Bergman JA, Hosford MA, McKinney TD. Potassium depletion increases luminalNa+/H+ exchange and basolateral Na+:CO=:HCO3- cotrasnport in rat renal cortex. J Clin Invest. 1990 Oct;86(4):1076-83. | CrossRef | PubMed | PMC | Delgado-Almeida A. Assessing cell K Physiology in hypertensive patients. Am J Hypertens. 2006 Apr;19(4):432-6. | CrossRef | PubMed |
Delgado-Almeida A. Assessing cell K Physiology in hypertensive patients. Am J Hypertens. 2006 Apr;19(4):432-6. | CrossRef | PubMed | McCabe RD, Bakarich MA, Srivastava K, Young DB. Potassium inhibits free radicals formation. Hypertension. 1994 Jul;24(1):77-82. | PubMed |
McCabe RD, Bakarich MA, Srivastava K, Young DB. Potassium inhibits free radicals formation. Hypertension. 1994 Jul;24(1):77-82. | PubMed | Iwamoto T. Vascular Na+/Ca+ exchange implications for the pathogenesis and terapy salt dependent hypertension. Am J Physiol Regul Integr Comp Physiol. 2006 Mar;290(3):R536-45. | PubMed |
Iwamoto T. Vascular Na+/Ca+ exchange implications for the pathogenesis and terapy salt dependent hypertension. Am J Physiol Regul Integr Comp Physiol. 2006 Mar;290(3):R536-45. | PubMed | Haddy FJ, Vanhoutte PM, Peletou M. Role of potassium in regulating blood flow and blood pressure. Am J Physiol Regul Integr Comp Physiol. 2006 Mar;290(3):R546-52. | PubMed |
Haddy FJ, Vanhoutte PM, Peletou M. Role of potassium in regulating blood flow and blood pressure. Am J Physiol Regul Integr Comp Physiol. 2006 Mar;290(3):R546-52. | PubMed | Meneton P, Jeunemaitre X, de Wardener HE, MacGregor GA. Links between dietary salt intake, renal,salt handling, blood pressure and cardiovascular disease. Physiol Rev. 2005 Apr;85(2):679-715. | CrossRef | PubMed |
Meneton P, Jeunemaitre X, de Wardener HE, MacGregor GA. Links between dietary salt intake, renal,salt handling, blood pressure and cardiovascular disease. Physiol Rev. 2005 Apr;85(2):679-715. | CrossRef | PubMed | Gómez-Sánchez EP. Intracerebroventricular infusion of aldosterone induces hypertension in rats. Endocrinology. 1986 Feb;118(2):819-23. | CrossRef | PubMed |
Gómez-Sánchez EP. Intracerebroventricular infusion of aldosterone induces hypertension in rats. Endocrinology. 1986 Feb;118(2):819-23. | CrossRef | PubMed | Atarashi K, Matsuoka H, Takagi M, Yamada K, Hirata Y, Hayakawa H, et al. Effects of intracerebroventricular infusion of aldosterona onblood pressure and sodium and potassium concentrations in cerebral spinal fluid in rats. Clin Exp Hypertens A. 1988;10 Suppl 1:317-22. | CrossRef | PubMed |
Atarashi K, Matsuoka H, Takagi M, Yamada K, Hirata Y, Hayakawa H, et al. Effects of intracerebroventricular infusion of aldosterona onblood pressure and sodium and potassium concentrations in cerebral spinal fluid in rats. Clin Exp Hypertens A. 1988;10 Suppl 1:317-22. | CrossRef | PubMed | Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patienswith severe heart failure. N Engl J Med. 1999 Sep 2;341(10):709-17. | CrossRef | PubMed |
Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A, et al. The effect of spironolactone on morbidity and mortality in patienswith severe heart failure. N Engl J Med. 1999 Sep 2;341(10):709-17. | CrossRef | PubMed | Lichtastein D, Rosen H. Endogenous digitalis-like Na+, K+ATPase inhibitors, and brain function. Neurochem Res. 2001 Sep;26(8-9):971-8. | CrossRef | PubMed |
Lichtastein D, Rosen H. Endogenous digitalis-like Na+, K+ATPase inhibitors, and brain function. Neurochem Res. 2001 Sep;26(8-9):971-8. | CrossRef | PubMed | Buckley JP. The central effects of the renin-angiotensin system. Clin Exp Hypertens A. 1988;10(1):1-16. | CrossRef | PubMed |
Buckley JP. The central effects of the renin-angiotensin system. Clin Exp Hypertens A. 1988;10(1):1-16. | CrossRef | PubMed | Rowe JW, Tobin JD, Rosa RM, et al. Effects of experimental potassium deficiency on glucose andinsulin metabolism. Metabolism. 1980 Jun;29(6):498-502. | CrossRef | PubMed |
Rowe JW, Tobin JD, Rosa RM, et al. Effects of experimental potassium deficiency on glucose andinsulin metabolism. Metabolism. 1980 Jun;29(6):498-502. | CrossRef | PubMed | Dluhy RG, Axelrod L, Williams GH. Serum immunoreactive insulin and growth hormone response to potassium infusion in normal man. J Appl Physiol. 1972 Jul;33(1):22-6. | PubMed |
Dluhy RG, Axelrod L, Williams GH. Serum immunoreactive insulin and growth hormone response to potassium infusion in normal man. J Appl Physiol. 1972 Jul;33(1):22-6. | PubMed | Feldman RD, Bierbrier GS. Insulin mediated vasodilation: impairment with increase blood pressure and body mass. Lancet. 1993 Sep 18;342(8873):707-9.
| CrossRef | PubMed |
Feldman RD, Bierbrier GS. Insulin mediated vasodilation: impairment with increase blood pressure and body mass. Lancet. 1993 Sep 18;342(8873):707-9.
| CrossRef | PubMed | MacAllister R, Vallance P. Nitric Oxide in essential and renal Hypertension. J Am Soc Nephrol 1994; J Am Soc Nephrol. 1994 Oct;5(4):1057-65. | PubMed |
MacAllister R, Vallance P. Nitric Oxide in essential and renal Hypertension. J Am Soc Nephrol 1994; J Am Soc Nephrol. 1994 Oct;5(4):1057-65. | PubMed | Surdacki A, Nowicki M, Sandmann J, Tsikas D, Boeger RH, Bode-Boeger SM, et al. Reduced urinary excretion of nitric oxide metabolites and increased plasma levelsof asymmetric dimethylargenine in men with essential hypertension. J Cardiovasc Pharmacol. 1999 Apr;33(4):652-8. | CrossRef | PubMed |
Surdacki A, Nowicki M, Sandmann J, Tsikas D, Boeger RH, Bode-Boeger SM, et al. Reduced urinary excretion of nitric oxide metabolites and increased plasma levelsof asymmetric dimethylargenine in men with essential hypertension. J Cardiovasc Pharmacol. 1999 Apr;33(4):652-8. | CrossRef | PubMed | Fang Y, Mu JJ, He LC, Wang SC, Liu ZQ. Salt loading on plasma Asymetrical Dimethylarginine and the protective role ofpotassium supplement in normotensive salt-sensitive Asians. Hypertension. 2006 Oct;48(4):724-9. | CrossRef | PubMed |
Fang Y, Mu JJ, He LC, Wang SC, Liu ZQ. Salt loading on plasma Asymetrical Dimethylarginine and the protective role ofpotassium supplement in normotensive salt-sensitive Asians. Hypertension. 2006 Oct;48(4):724-9. | CrossRef | PubMed | Lennon EJ, Lemann J. Jr. The effect of potassium deficient diet on the pattern recovery from metabolicacidosis. Clin Sci. 1968 Apr;34(2):365-78. | PubMed |
Lennon EJ, Lemann J. Jr. The effect of potassium deficient diet on the pattern recovery from metabolicacidosis. Clin Sci. 1968 Apr;34(2):365-78. | PubMed | Krishna GG. Effect of Potassium intake on blood pressure. J Am Soc Nephrol. 1990 Jul;1(1):43-52. | PubMed |
Krishna GG. Effect of Potassium intake on blood pressure. J Am Soc Nephrol. 1990 Jul;1(1):43-52. | PubMed | Krishna GG, Kapoor SC. Potassium supplementation ameliorates mineralocorticoidinducedsodium retention. J Am Soc Nephrol. 1990 Jul;1(1):43-52. | PubMed |
Krishna GG, Kapoor SC. Potassium supplementation ameliorates mineralocorticoidinducedsodium retention. J Am Soc Nephrol. 1990 Jul;1(1):43-52. | PubMed | Khaw KT, Barrett-Connor E.Dietary potassium and stroke-associated mortality: a 12 –yearprospective population study. N Engl J Med. 1987 Jan 29;316(5):235-40. | CrossRef | PubMed |
Khaw KT, Barrett-Connor E.Dietary potassium and stroke-associated mortality: a 12 –yearprospective population study. N Engl J Med. 1987 Jan 29;316(5):235-40. | CrossRef | PubMed | Gillman MW, Cupples LA, Gagnon D, Posner BM, Ellison RC, Castelli WP, et al. Protective effects of fruits and vegetables on development of stroke in men. JAMA. 1995 Apr 12;273(14):1113-7.
| CrossRef | PubMed |
Gillman MW, Cupples LA, Gagnon D, Posner BM, Ellison RC, Castelli WP, et al. Protective effects of fruits and vegetables on development of stroke in men. JAMA. 1995 Apr 12;273(14):1113-7.
| CrossRef | PubMed | Joshipura KJ, Ascherio A, Manson JE, Stampfer MJ, Rimm EB, Speizer FE, et al. Fruit and vegetable intake in relation to risk of ischemic stroke. JAMA. 1999 Oct 6;282(13):1233-9. | CrossRef |
Joshipura KJ, Ascherio A, Manson JE, Stampfer MJ, Rimm EB, Speizer FE, et al. Fruit and vegetable intake in relation to risk of ischemic stroke. JAMA. 1999 Oct 6;282(13):1233-9. | CrossRef | Feng HE, McGregor GA. Beficial effects of potassium. BMJ. 2001 Sep 1;323(7311):497-501. | CrossRef | PubMed | PMC |
Feng HE, McGregor GA. Beficial effects of potassium. BMJ. 2001 Sep 1;323(7311):497-501. | CrossRef | PubMed | PMC | Nazzal C, Alonso F , Zárate LH. Consumo de sodio y potasio en población chilena y su relación con los niveles de presión arterial. Congreso de cardiología, Chile, 2011.
Nazzal C, Alonso F , Zárate LH. Consumo de sodio y potasio en población chilena y su relación con los niveles de presión arterial. Congreso de cardiología, Chile, 2011.  U.S. Department of Agriculture, U.S. Department of Health and Human
Services. Dietary Guidelines for Americans, 2010. 7th Edition, Washington, DC: U.S. Government Printing Ofice, December 2010. | Link |
U.S. Department of Agriculture, U.S. Department of Health and Human
Services. Dietary Guidelines for Americans, 2010. 7th Edition, Washington, DC: U.S. Government Printing Ofice, December 2010. | Link | Young DB, Lin H, McCabe RD. Potassium’s cardiovascular protective mechanisms. Am J Physiol. 1995 Apr;268(4 Pt 2):R825-37. | PubMed |
Young DB, Lin H, McCabe RD. Potassium’s cardiovascular protective mechanisms. Am J Physiol. 1995 Apr;268(4 Pt 2):R825-37. | PubMed | Fang Y, Mu JJ, He LC, Wang SC, Liu ZQ. Salt loading on plasma Asymetrical Dimethylarginine and the protective role ofpotassium supplement in normotensive salt-sensitive Asians. Hypertension. 2006 Oct;48(4):724-9 | CrossRef | PubMed |
Fang Y, Mu JJ, He LC, Wang SC, Liu ZQ. Salt loading on plasma Asymetrical Dimethylarginine and the protective role ofpotassium supplement in normotensive salt-sensitive Asians. Hypertension. 2006 Oct;48(4):724-9 | CrossRef | PubMed | La sal de la tierra
La sal de la tierra