 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: atherosclerosis, statins, epigenetics, immunomodulation, cytokines
La aterosclerosis es una enfermedad de tipo inmunoinflamatoria, en la cual los mecanismos fisiopatológicos incluyen patrones de inflamación y cambios epignéticos que alteran la expresión genética de varios mediadores inflamatorios y no inflamatorios. La epigenética está ofreciendo explicaciones sobre cómo la dieta, los factores ambientales y el estilo de vida pueden influir en la aparición y progresión de la enfermedad, y cómo las alteraciones pueden ser transmitidas a las siguientes generaciones sin que haya modificaciones en las secuencias de ADN. Las estatinas, a través de los efectos pleiotrópicos, ofrecen una herramienta de gran ayuda en el control de la progresión de las placas y sus subsiguientes repercusiones.
La aterosclerosis es una enfermedad progresiva, de tipo inmunoinflamatoria, caracterizada por la acumulación de lípidos en la media de las arterias de gran y mediano calibre. Actualmente, se considera una enfermedad común en la cual depósitos grasos, placas de ateroma, aparecen en la capa interna de las arterias [1]. La formación de esas placas comienza con el depósito de pequeños cristales en la íntima y en su capa muscular subyacente, que crece con la proliferación de tejido fibroso y el tejido muscular liso que la rodea, dirigiéndose hacia el interior de las arterias con la consecuente reducción del flujo sanguíneo. La esclerosis de las arterias es causada por la reducción del tejido conectivo por fibroblastos y el depósito de calcio en la lesión [1]. Finalmente, una superficie irregular conlleva a la formación de coágulos y trombosis, lo cual resulta en una obstrucción súbita del flujo sanguíneo [2].
Dentro de los factores de riesgo se describen: hiperlipidemia, diabetes mellitus, hipertensión arterial y tabaquismo. Por lo tanto, la ateroesclerosis representa la causa de morbimortalidad cardiovascular más importante a nivel mundial. El entendimiento de los mecanismos fisiopatológicos ha permitido el desarrollo de estrategias terapéuticas que producen una reducción sustancial de las manifestaciones clínicas y complicaciones agudas de esta entidad [2].
Los inhibidores competitivos de la 3 hidroxi 3 metil glutaril CoA reductasa, mejor conocidos como estatinas, han demostrado con el paso de los años una capacidad para reducir la aparición y progresión de la ateroesclerosis. Ello las convierte en una alternativa de prevención y progresión de la ateroesclerosis [3]. Entre los estudios que demuestran su utilización, el Justification for the Use of statins in Prevention: an Intervention Trial Evaluating Rosuvastatin (JUPITER) mostró una reducción de 44% en la tasa de episodios vasculares mayores: infarto de miocardio, accidente cerebral vascular, revascularización, internación por angina inestable o muerte vascular. Con ello se justifica su utilización para disminuir factores de riesgo cardiovascular y de índole preventiva [4].
Los mecanismos mediante los cuales las estatinas ejercen este efecto a nivel vascular, va más allá del poder de la inhibición de la producción endógena de colesterol. Se han encontrado diversos efectos pleiotropicos que involucran componentes inmunológicos, inflamatorios y de función endotelial, que favorecen la reducción del riesgo cardiovascular de pacientes tratados [3].
La presente revisión pretende hacer una actualización de los conceptos fisiopatológicos de la ateroesclerosis, y en los efectos pleiotropicos de las estatinas en la enfermedad cardiovascular de origen ateroesclerótico.
Para esta revisión se utilizaron buscadores de artículos científicos en MEDLINE, Medscape y UpToDate. Se enfatizó en el concepto fisiopatológico actual, con el objeto de desarrollar referencias respecto de la epigenética y de los efectos de las estatinas, más allá del concepto actual que se tiene de ella.
Células hematopoyéticas y aterosclerosis
Se sabe desde hace varios años que los pacientes con hipercolesterolemia tienen recuentos elevados de células inflamatorias (neutrófilos y monocitos) en sangre periférica, los cuales están relacionados con alto riesgo de eventos coronarios agudos [1],[5]. También se ha observado que la hipercolesterolemia, específicamente niveles elevados de colesterol LDL oxidado (oxcLDL), induce la migración de monocitos a la placa ateromatosa. Esto favorece el crecimiento que conlleva a la inestabilidad de la misma y a las complicaciones derivadas. Esta situación se ha confirmado con estudios posteriores, donde se ha observado que la hipercolesterolemia provocada por la dieta promueve la migración de monocitos, identificados por los clústeres de diferenciación CD16 ─CD14+, a la lesión ateromatosa [6],[7]. Otros modelos animales de hipercolesterolemia han mostrado que el número de monocitos en sangre periférica se relaciona directamente con el tamaño de la lesión ateromatosa [8]. De igual manera, la hipercolesterolemia induce la liberación del factor de crecimiento de colonias granulocíticas, con la subsiguiente elevación de neutrófilos, lo cual tiene una relación directa con la aparición, progresión y severidad de la aterosclerosis [7],[9].
Se ha demostrado en modelos animales que la hipercolesterolemia induce a la proliferación de precursores de células inflamatorias, los cuales son liberados en la circulación general como resultado de la estimulación del receptor LDL [9]. Estos precursores celulares migran al bazo, el cual sirve como reservorio donde reciben estimulación por la interleucina 3 (IL-3) y factor estimulante de colonias granulocíticas y macrófagos (GM-CFS). Estos proliferan y se diferencian en monocitos, los que son reclutados en las lesiones ateromatosas. Estos hallazgos sugieren que el colesterol es capaz de movilizar las células progenitoras inflamatorias fuera de la medula ósea, lo que favorece la mielopoyesis extramedular y la progresión rápida de las lesiones vasculares [10] (Figura 1).
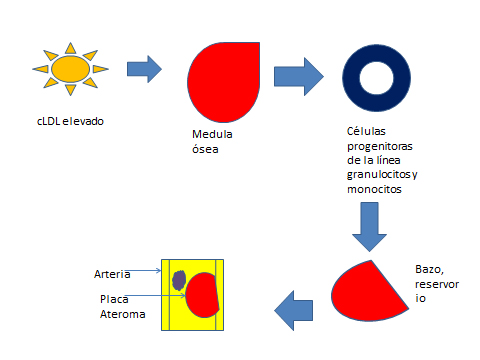
Figura 1. Efectos de los niveles elevados de colesterol sobre medula ósea, bazo y arterias.
Inflamación y aterosclerosis
La aterosclerosis se considera una enfermedad inflamatoria crónica de la pared arterial. Esta aseveración se basa en los hallazgos de abundante cantidad de células fagocíticas en el interior de las placas ateromatosas [11]. Además, se ha encontrado elevación de los niveles de biomarcadores inflamatorios en la sangre de los pacientes que padecen enfermedad cardiovascular y aterosclerosis [12]. Tradicionalmente los monocitos pueden ser divididos en dos sub poblaciones, conocidas como clásico o inflamatorio Ley-6C(high), y no clásico o residente Ley-6C(low). Existen diferencias sustanciales en el tipo y cantidad de receptores de quimiocinas en la membrana de cada población. Sin embargo, los estudios de mapeo de poblaciones de monocitos/macrófagos en modelos murinos muestran que los monocitos residentes necesariamente provienen de los linfocitos inflamatorios [12],[13].
La inflamación inmunomediada es un componente principal del proceso ateroesclerótico. El sistema de complemento, los receptores Toll-Like (TLRs) y las interacciones entre ellos, pueden ser de interés con respecto a la patogénesis y a blancos terapéuticos en ateroesclerosis. Estudios en animales indican que la inhibición de C3 a C5 reduce la ateroesclerosis. En tanto, estudios clínicos han demostrado que el complemento y los Toll-Like están sobre expresados en las enfermedades ateroescleróticas, aunque los estudios clínicos intervencionistas han fracasado en este aspecto [14],[15].
De igual forma, se observa un incremento en los niveles séricos de quimiocinas, las cuales son las responsables de la quimiotaxis de las células fagociticas al interior de las placas ateromotosas [12]. Resulta interesante ver cómo existe una redundancia funcional en el accionar de varias quimiocinas dada por la habilidad de algunas de ellas de interactuar con múltiples receptores a la vez, como también por la capacidad de los receptores de activarse con diferentes ligandos. En general, hay tres combinaciones de quimiocinas (ligando: receptor) que se relacionan con la migración de Ley-6C(high), que incluyen a las moléculas conocidas como CCL2:CCR2, CX3CL1:CX3CR1, y CCL5:CCR5. La deficiencia de estas tres quimiocinas, en modelos animales ha conllevado a la completa atenuación en modelos murinos de aterosclerosis. La migración de poblaciones de monocitos residentes ocurre menos frecuentemente y se relaciona con el eje CX3CL1:CX3CR1 [16],[17]. Sin embargo, las funciones de las quimiocinas no se limitan a la función quimiotáctica, sino que también tienen efectos metabólicos como los relacionados con la inhibición del trasporte reverso del colesterol mediado por la quimiocina CCL2. Ésta induce la represión de proteínas claves implicadas en el eflujo de colesterol de la célula [8]. Aquí aparece uno de los efectos pleiotrópicos de las estatinas, las cuales atenúan la expresión de las quimiocinas y sus receptores [18].
Epigenética y aterosclerosis
La epigenética (Figura 2) ofrece la explicación de cómo la dieta, los factores ambientales y el estilo de vida, pueden inducir a aberraciones en la expresión genética, alterando los patrones de metilación, acetilación de ADN e histonas a nivel nuclear. Los procesos relacionados a la expresión y represión de genes, se basan en el estado de metilación y acetilación del ADN y las histonas respectivamente. Un gen hipermetilado no puede ser transcrito. Las histonas acetiladas, permiten el paso de la heterocromatina (densa) a eucromatina (laxa o abierta) lo que permite la transcripción de genes. Los genes metilados están rodeados de histonas no acetiladas. Estos procesos pueden durar toda la vida del individuo e incluso transmitirse a las siguientes generaciones [19]. La importancia de la metilación como factor contribuyente en la patogénesis de la aterosclerosis fue demostrada en un estudio que vinculó la hipermetilación general del ADN en células inflamatorias de sangre periférica, con la predisposición e historia natural de la aterosclerosis. Sin embargo, este estudio no evaluó los cambios epigéneticos vinculados con las células endoteliales vasculares ni con las células musculares lisas vasculares [16]. Se observan estados de hipermetilación del genoma en pacientes que tienen niveles de proteína C reactiva elevados, lo que se relaciona con el estado inflamatorio crónico que acompaña a las enfermedades cardiovasculares [20].
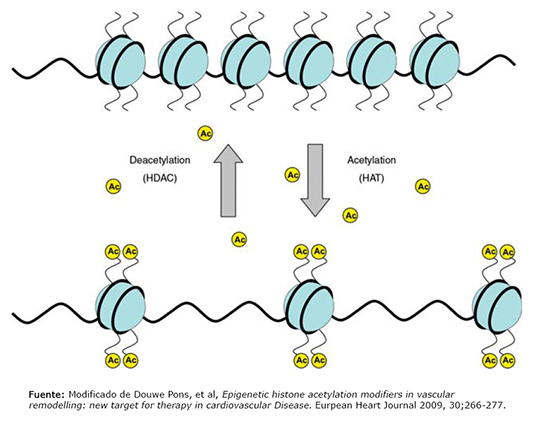
Figura 2. Procesos epigéneticos.
Además de la metilación del ADN dentro del espectro fisiopatológico, se ha descrito otro mecanismo inmerso en el origen y predisposición a la aterosclerosis. Se ha descrito a los ARN no codificantes como reguladores epigenéticos [21]. La transcripción del genoma en diferentes formas de ARN, incluyendo los ARN no codificantes, está bien establecida en la actualidad. Los ARN no codificantes se consideran marcas epigenéticas debido a que participan en el control de la expresión génica sin implicar cambios en la secuencia de nucleótidos o en el número de copias del ADN [22]. Los ARN no codificantes no producen cambios sobre la molécula de ADN, sino que se encargan de controlar la expresión génica de manera postranscripcional uniéndose a ARN mensajeros diana. De esta forma promueven, degradan o inhiben su traducción, evitando en todos los casos la expresión génica.
Los ARN no codificantes mejor estudiados y caracterizados son los micro ARN que se encargan de ajustar y dirigir finamente la traducción de hasta 60% de los genes codificantes de proteínas en humanos. En la actualidad hay descritos más de 1000 micro ARN en humanos. En los últimos años se ha ido describiendo el papel importante que estos juegan en las enfermedades cardiovasculares, no sólo como moléculas implicadas en la patogenia de los diferentes fenotipos cardiovasculares, sino que también como posibles biomarcadores de riesgo y progresión de enfermedades cardíacas como infarto agudo de miocardio, enfermedad cardiovascular o insuficiencia cardíaca [23] En este sentido, un resultado importante que explica la función crucial de los micro ARN en el desarrollo del sistema cardiovascular es el que describe que la eliminación en ratones de Dicer (la RNasa que procesa los pre-micro ARN) conlleva defectos en angiogénesis, formación de vasos y desarrollo cardíaco [24].
El estudio de los micro ARN ha permitido que se les relacionen con muchos de los procesos o mecanismos básicos, implicados en el desarrollo de arteriosclerosis. Así, se ha demostrado que los micro ARN funcionan como controladores clave de la expresión génica, y por lo tanto, de la funcionalidad de los diferentes tipos celulares implicados en la arteriosclerosis (células endoteliales, células musculares lisas vasculares, monocitos y macrófagos). Además, se han implicado en el control de procesos tales como la inflamación, el metabolismo cardíaco y lipoproteico, la biosíntesis y captación de colesterol, el remodelaje cardíaco, la disfunción endotelial, la angiogénesis o en la diferenciación, migración y proliferación celular.
Junto con regular dianas intracelulares, se ha descrito que los micro ARN están presentes en sangre a concentraciones fisiológicamente significativas. A pesar de que los estímulos que activan la secreción de los micro ARN a la circulación no están claros, los micro ARN circulantes pueden transportarse de forma estable y ser entregados a células destino gracias a su incorporación a cuerpos apoptóticos [22], exosomas, partículas de HDL y a la formación de complejos con argonauta [22]. Se necesitan más estudios para clarificar si los micro ARN endógenos circulantes pueden ser dirigidos a células diana para facilitar la comunicación entre diferentes órganos, y así regular la expresión génica a nivel sistémico. Sí está mucho más estudiado el papel de los micro ARN circulantes como biomarcadores específicos de enfermedad [22].
El reto en este tipo de estudios está en identificar de forma precisa y reproducible de micro ARN específicos, o de un conjunto de ellos, que puedan utilizarse como biomarcadores de riesgo o de progresión de enfermedad, y que permitan identificar a aquellos pacientes susceptibles de desarrollar la enfermedad.
Finalmente, está descrito que algunos micro ARN pueden aumentar la proliferación y la diferenciación de cardiomiocitos humanos provenientes de células madre embrionarias o de células progenitoras humanas [25]. Además, utilizando estos micro ARN específicos se puede aumentar la reprogramación de fibroblastos adultos, directamente en células con linaje cardiomiocítico [26]. También se ha descrito que una sobreexpresión del clúster micro ARN-17-92 en ratones aumenta la proliferación de células progenitoras cardíacas y facilita la regeneración cardíaca después de un infarto agudo de miocardio [25]. Así, es posible pensar que estos micro ARN puedan convertirse en dianas terapéuticas para la reparación del daño cardíaco y la regeneración del corazón.
Estatinas y aterosclerosis
Las estatinas tienen como principal mecanismo de acción la inhibición de la 3-OH-3-metilGlutaril CoA reductasa, enzima clave en el proceso de síntesis endógena de colesterol. En ellos destacan efectos pleiotrópicos de las estatinas, los cuales suceden a nivel inmunológico donde regulan la respuesta inflamatoria en diferentes niveles [27].
Las estatinas están relacionadas con la regulación de la expresión de las moléculas clase II del complejo mayor de histocompatibilidad, la cual está mediada por el Interferón gamma (INF γ) [2]. Este efecto de este grupo farmacológico es mediado por la inhibición de la expresión del transactivador pIV de la clase II del complejo mayor de histocompatibilidad, un promotor principal de la expresión del complejo mayor de histocompatibilidad clase II, necesitando concentraciones nanomolares y micromolares de las estatinas. De las estatinas, la que tiene el mayor efecto en la inhibición de dicho promotor es la atorvastatina [23]. Sin embargo, el efecto de inhibición sobre el complejo mayor de histocompatibilidad es específico de la clase II, ya que no se han observado efectos en la clase I del complejo mayor de histocompatibilidad [23].
Las estatinas también afectan las señales coestimuladoras de la activación de linfocitos T, de manera similar a lo que hacen con el complejo mayor de histocompatibilidad. Las estatinas regulan la expresión de moléculas coestimuladoras tales como CD40, CD80, y CD 86 en linfocitos, macrófagos, microglía y células endoteliales. A su vez, las estatinas también suprimen la maduración inducida por citoquinas de las células dendríticas, lo que resulta en la disminución de la expresión del receptor de quimiocina CC 7, CD 40, CD 83, CD 86 y HLA DR, y por consiguiente de la activación de linfocitos T [4],[28].
Con relación a las moléculas de adhesión leucocitaria, las estatinas pueden bloquear una proteína de superficie leucocitaria llamada LFA1, la cual se une a la I molécula de adhesión intercelular 1 (ICAM1), las que además de facilitar la diapédesis leucocitaria, también provee señales coestimuladoras para los linfocitos T [4].
La aterosclerosis representa la principal causa de morbimortalidad cardiovascular en la sociedad occidental. Los avances en el entendimiento de la fisiopatología han permitido no sólo mejorar el tratamiento y prevenir las complicaciones, sino desarrollar nuevos tratamientos dirigidos a blancos terapéuticos relacionados con el control de la inflamación y los cambios epigéneticos observados en la patología. Se avecinan nuevas herramientas terapéuticas para el control y estabilización de las placas ateromatosas. No obstante, las estatinas siguen siendo la principal arma para tal fin ya que con su mecanismo de acción sobre el nivel de colesterol plasmático, y por los efectos pleiotrópicos, ofrecen una utilidad muy amplia, con un perfil de seguridad y costo óptimos.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del artículo/investigación; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. El formulario puede ser solicitado contactando a la autora responsable.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Atherosclerosis is an immune-inflammatory disease, in which pathophysiological mechanisms include inflammation patterns and epigenetic changes that alter gene expression of several inflammatory and non-inflammatory mediators. Epigenetics is offering explanations on how diet, environmental factors and lifestyle can influence the onset and progression of the disease, and how these alterations can be transmitted to the following generations without any changes in DNA sequences. Statins, through their pleiotropic effects, provide a useful tool in controlling the progression of plaques and their subsequent impact.
 Autores:
Marcelo Storino Farina[1,2], Jairo Rojano Rada[1], Antony Molina Garrido[1], Xiomara Martínez[1], Alfredo Pulgar[1], Roxanna Paniagua[1], Jorge Garrido[1]
Autores:
Marcelo Storino Farina[1,2], Jairo Rojano Rada[1], Antony Molina Garrido[1], Xiomara Martínez[1], Alfredo Pulgar[1], Roxanna Paniagua[1], Jorge Garrido[1]

Citación: Storino Farina M, Rojano Rada J, Molina Garrido A, Martínez X, Pulgar A, Paniagua R, et al. Statins and atherosclerosis: the role of epigenetics. Medwave 2015 Nov;15(10):e6324 doi: 10.5867/medwave.2015.10.6324
Fecha de envío: 27/7/2015
Fecha de aceptación: 8/11/2015
Fecha de publicación: 26/11/2015
Origen: no solicitado
Tipo de revisión: con revisión por cinco pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Lang JK, Cimato TR. Cholesterol and hematopoietic stem cells: inflammatory mediators of atherosclerosis. Stem Cells Transl Med. 2014 May;3(5):549-52. | CrossRef | PubMed |
Lang JK, Cimato TR. Cholesterol and hematopoietic stem cells: inflammatory mediators of atherosclerosis. Stem Cells Transl Med. 2014 May;3(5):549-52. | CrossRef | PubMed | Guardiola M, Vallvé JC, Zaina S, Ribalta J. [Epigenetics in atherosclerosis]. Clin Investig Arterioscler. 2015 Jun 15. pii: S0214-9168(15)00054-6. | CrossRef | PubMed |
Guardiola M, Vallvé JC, Zaina S, Ribalta J. [Epigenetics in atherosclerosis]. Clin Investig Arterioscler. 2015 Jun 15. pii: S0214-9168(15)00054-6. | CrossRef | PubMed | Chow SC. Immunomodulation by statins: mechanisms and potential impact on autoimmune diseases. Arch Immunol Ther Exp (Warsz). 2009 Jul-Aug;57(4):243-51. | CrossRef | PubMed |
Chow SC. Immunomodulation by statins: mechanisms and potential impact on autoimmune diseases. Arch Immunol Ther Exp (Warsz). 2009 Jul-Aug;57(4):243-51. | CrossRef | PubMed | Ridker PM, Danielson E, Fonseca FA, Genest J, Gotto AM Jr, Kastelein JJ, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008 Nov 20;359(21):2195-207. | CrossRef | PubMed |
Ridker PM, Danielson E, Fonseca FA, Genest J, Gotto AM Jr, Kastelein JJ, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008 Nov 20;359(21):2195-207. | CrossRef | PubMed | Swirski FK, Nahrendorf M. Leukocyte behavior in atherosclerosis, myocardial infarction, and heart failure. Science. 2013 Jan 11;339(6116):161-6. | CrossRef | PubMed |
Swirski FK, Nahrendorf M. Leukocyte behavior in atherosclerosis, myocardial infarction, and heart failure. Science. 2013 Jan 11;339(6116):161-6. | CrossRef | PubMed | Swirski FK, Libby P, Aikawa E, Alcaide P, Luscinskas FW, Weissleder R, et al. Ly-6Chi monocytes dominate hypercholesterolemia-associated monocytosis and give rise to macrophages in atheromata. J Clin Invest. 2007 Jan;117(1):195-205. | PubMed |
Swirski FK, Libby P, Aikawa E, Alcaide P, Luscinskas FW, Weissleder R, et al. Ly-6Chi monocytes dominate hypercholesterolemia-associated monocytosis and give rise to macrophages in atheromata. J Clin Invest. 2007 Jan;117(1):195-205. | PubMed | Berg KE, Ljungcrantz I, Andersson L, Bryngelsson C, Hedblad B, Fredrikson GN, et al. Elevated CD14++CD16- monocytes predict cardiovascular events. Circ Cardiovasc Genet. 2012 Feb 1;5(1):122-31. | CrossRef | PubMed |
Berg KE, Ljungcrantz I, Andersson L, Bryngelsson C, Hedblad B, Fredrikson GN, et al. Elevated CD14++CD16- monocytes predict cardiovascular events. Circ Cardiovasc Genet. 2012 Feb 1;5(1):122-31. | CrossRef | PubMed | Combadière C, Potteaux S, Rodero M, Simon T, Pezard A, Esposito B, et al. Combined inhibition of CCL2, CX3CR1, and CCR5 abrogates Ly6C(hi) and Ly6C (lo) monocytosis and almost abolishes atherosclerosis in hypercholesterolemic mice. Circulation. 2008 Apr 1;117(13):1649-57. | CrossRef | PubMed |
Combadière C, Potteaux S, Rodero M, Simon T, Pezard A, Esposito B, et al. Combined inhibition of CCL2, CX3CR1, and CCR5 abrogates Ly6C(hi) and Ly6C (lo) monocytosis and almost abolishes atherosclerosis in hypercholesterolemic mice. Circulation. 2008 Apr 1;117(13):1649-57. | CrossRef | PubMed | Drechsler M, Megens RT, van Zandvoort M, Weber C, Soehnlein O. Hyperlipidemia-triggered neutrophilia promotes early atherosclerosis. Circulation. 2010 Nov 2;122(18):1837-45. | CrossRef | PubMed |
Drechsler M, Megens RT, van Zandvoort M, Weber C, Soehnlein O. Hyperlipidemia-triggered neutrophilia promotes early atherosclerosis. Circulation. 2010 Nov 2;122(18):1837-45. | CrossRef | PubMed | Gomes AL, Carvalho T, Serpa J, Torre C, Dias S. Hypercholesterolemia promotes bone marrow cell mobilization by perturbing the SDF-1:CXCR4 axis. Blood. 2010 May 13;115(19):3886-94. | CrossRef | PubMed |
Gomes AL, Carvalho T, Serpa J, Torre C, Dias S. Hypercholesterolemia promotes bone marrow cell mobilization by perturbing the SDF-1:CXCR4 axis. Blood. 2010 May 13;115(19):3886-94. | CrossRef | PubMed | Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005 Apr 21;352(16):1685-95. | PubMed |
Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005 Apr 21;352(16):1685-95. | PubMed | Zernecke A, Weber C. Chemokines in atherosclerosis: proceedings resumed. Arterioscler Thromb Vasc Biol. 2014 Apr;34(4):742-50. | CrossRef | PubMed |
Zernecke A, Weber C. Chemokines in atherosclerosis: proceedings resumed. Arterioscler Thromb Vasc Biol. 2014 Apr;34(4):742-50. | CrossRef | PubMed | Yona S, Kim KW, Wolf Y, Mildner A, Varol D, Breker M, et al. Fate mapping reveals origins and dynamics of monocytes and tissue macrophages under homeostasis. Immunity. 2013 Jan 24;38(1):79-91. | CrossRef | PubMed |
Yona S, Kim KW, Wolf Y, Mildner A, Varol D, Breker M, et al. Fate mapping reveals origins and dynamics of monocytes and tissue macrophages under homeostasis. Immunity. 2013 Jan 24;38(1):79-91. | CrossRef | PubMed | Rafieian-Kopaei M, Setorki M, Doudi M, Baradaran A, Nasri H. Atherosclerosis: process, indicators, risk factors and new hopes. Int J Prev Med. 2014 Aug;5(8):927-46. | PubMed |
Rafieian-Kopaei M, Setorki M, Doudi M, Baradaran A, Nasri H. Atherosclerosis: process, indicators, risk factors and new hopes. Int J Prev Med. 2014 Aug;5(8):927-46. | PubMed | Hovland A, Jonasson L, Garred P, Yndestad A, Aukrust P, Lappegård KT, et al. The complement system and toll-like receptors as integrated players in the pathophysiology of atherosclerosis. Atherosclerosis. 2015 Aug;241(2):480-94. | CrossRef | PubMed |
Hovland A, Jonasson L, Garred P, Yndestad A, Aukrust P, Lappegård KT, et al. The complement system and toll-like receptors as integrated players in the pathophysiology of atherosclerosis. Atherosclerosis. 2015 Aug;241(2):480-94. | CrossRef | PubMed | Moore KJ, Sheedy FJ, Fisher EA. Macrophages in atherosclerosis: a dynamic balance. Nat Rev Immunol. 2013 Oct;13(10):709-21. | CrossRef | PubMed |
Moore KJ, Sheedy FJ, Fisher EA. Macrophages in atherosclerosis: a dynamic balance. Nat Rev Immunol. 2013 Oct;13(10):709-21. | CrossRef | PubMed | Ley K, Laudanna C, Cybulsky MI, Nourshargh S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat Rev Immunol. 2007 Sep;7(9):678-89. | PubMed |
Ley K, Laudanna C, Cybulsky MI, Nourshargh S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat Rev Immunol. 2007 Sep;7(9):678-89. | PubMed | Nie P, Li D, Hu L, Jin S, Yu Y, Cai Z, et al. Atorvastatin improves plaque stability in ApoE-knockout mice by regulating chemokines and chemokine receptors. PLoS One. 2014 May 9;9(5):e97009. | CrossRef | PubMed |
Nie P, Li D, Hu L, Jin S, Yu Y, Cai Z, et al. Atorvastatin improves plaque stability in ApoE-knockout mice by regulating chemokines and chemokine receptors. PLoS One. 2014 May 9;9(5):e97009. | CrossRef | PubMed | Wierda RJ, Geutskens SB, Jukema JW, Quax PH, van den Elsen PJ. Epigenetics in atherosclerosis and inflammation. J Cell Mol Med. 2010 Jun;14(6A):1225-40. | CrossRef | PubMed |
Wierda RJ, Geutskens SB, Jukema JW, Quax PH, van den Elsen PJ. Epigenetics in atherosclerosis and inflammation. J Cell Mol Med. 2010 Jun;14(6A):1225-40. | CrossRef | PubMed | Stenvinkel P, Karimi M, Johansson S, Axelsson J, Suliman M, Lindholm B, et al. Impact of inflammation on epigenetic DNA methylation - a novel risk
factor for cardiovascular disease? J Intern Med. 2007 May;261(5):488-99. | PubMed |
Stenvinkel P, Karimi M, Johansson S, Axelsson J, Suliman M, Lindholm B, et al. Impact of inflammation on epigenetic DNA methylation - a novel risk
factor for cardiovascular disease? J Intern Med. 2007 May;261(5):488-99. | PubMed | Friedman RC, Farh KK, Burge CB, Bartel DP. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 2009 Jan;19(1):92-105. | CrossRef | PubMed |
Friedman RC, Farh KK, Burge CB, Bartel DP. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 2009 Jan;19(1):92-105. | CrossRef | PubMed | van Rooij E, Olson EN. MicroRNAs: powerful new regulators of heart disease and provocative therapeutic targets. J Clin Invest. 2007 Sep;117(9):2369-76.
| PubMed |
van Rooij E, Olson EN. MicroRNAs: powerful new regulators of heart disease and provocative therapeutic targets. J Clin Invest. 2007 Sep;117(9):2369-76.
| PubMed | Friedman RC, Farh KK, Burge CB, Bartel DP. Most mammalia mRNAs are conserved targets of microRNAs. Genome Res. 2009;19:92-105.
Friedman RC, Farh KK, Burge CB, Bartel DP. Most mammalia mRNAs are conserved targets of microRNAs. Genome Res. 2009;19:92-105.  Chen J, Huang ZP, Seok HY, Ding J, Kataoka M, Zhang Z, et al. mir-17-92 cluster is required for and sufficient to induce cardiomyocyte proliferation in postnatal and adult hearts. Circ Res. 2013 Jun 7;112(12):1557-66.
| CrossRef | PubMed |
Chen J, Huang ZP, Seok HY, Ding J, Kataoka M, Zhang Z, et al. mir-17-92 cluster is required for and sufficient to induce cardiomyocyte proliferation in postnatal and adult hearts. Circ Res. 2013 Jun 7;112(12):1557-66.
| CrossRef | PubMed | Jayawardena TM, Egemnazarov B, Finch EA, Zhang L, Payne JA, Pandya K, et al. MicroRNA-mediated in vitro and in vivo direct reprogramming of cardiac fibroblasts to cardiomyocytes. Circ Res. 2012 May 25;110(11):1465-73.
| CrossRef | PubMed |
Jayawardena TM, Egemnazarov B, Finch EA, Zhang L, Payne JA, Pandya K, et al. MicroRNA-mediated in vitro and in vivo direct reprogramming of cardiac fibroblasts to cardiomyocytes. Circ Res. 2012 May 25;110(11):1465-73.
| CrossRef | PubMed | Sek C. Chow. Immunomodulation by Statins: mechanisms and potential impact on autoimmune disease, Arch. Immunol. Ther. Exp., 2009, 57, 243–251.
Sek C. Chow. Immunomodulation by Statins: mechanisms and potential impact on autoimmune disease, Arch. Immunol. Ther. Exp., 2009, 57, 243–251.  Kwak B, Mulhaupt F, Myit S, Mach F. Statins as a newly recognized type of immunomodulator. Nat Med. 2000 Dec;6(12):1399-402.
| PubMed |
Kwak B, Mulhaupt F, Myit S, Mach F. Statins as a newly recognized type of immunomodulator. Nat Med. 2000 Dec;6(12):1399-402.
| PubMed | Weitz-Schmidt G, Welzenbach K, Brinkmann V, Kamata T, Kallen J, Bruns C, et al. Statins selectively inhibit leukocyte function antigen-1 by binding to a novel regulatory integrin site. Nat Med. 2001 Jun;7(6):687-92. | PubMed |
Weitz-Schmidt G, Welzenbach K, Brinkmann V, Kamata T, Kallen J, Bruns C, et al. Statins selectively inhibit leukocyte function antigen-1 by binding to a novel regulatory integrin site. Nat Med. 2001 Jun;7(6):687-92. | PubMed |