 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: fungal keratitis, natamycin, voriconazole, Epistemonikos, GRADE.
INTRODUCCIÓN
La queratitis infecciosa de origen fúngico afecta principalmente a personas de países tropicales y subtropicales, y constituye una importante causa de ceguera prevenible. Los antifúngicos tópicos, en particular la natamicina y el voriconazol, se consideran efectivos, pero no está claro cuál de ellos constituye la mejor alternativa de tratamiento.
MÉTODOS
Realizamos una búsqueda en Epistemonikos, la mayor base de datos de revisiones sistemáticas en salud, la cual es mantenida mediante el cribado de múltiples fuentes de información, incluyendo MEDLINE, EMBASE, Cochrane, entre otras. Extrajimos los datos desde las revisiones identificadas, analizamos los datos de los estudios primarios, realizamos un metanálisis y preparamos una tabla de resumen de los resultados utilizando el método GRADE.
RESULTADOS Y CONCLUSIONES
Identificamos tres revisiones sistemáticas que en conjunto incluyeron tres estudios primarios, todos correspondientes a ensayos aleatorizados. Concluimos que natamicina probablemente se asocia a mejor agudeza visual tras la infección, y que previene la perforación corneal y/o la necesidad de realizar queratoplastia terapéutica en comparación a voriconazol en queratitis fúngica.
La queratitis fúngica corresponde a una infección micótica de la córnea, principalmente del epitelio y del estroma. Los agentes etiológicos más frecuentes corresponden, en primer lugar, a hongos filamentosos de los géneros Fusarium, Aspergillus y Curvularia, en orden descendente de frecuencia y, en segundo lugar, a levaduras. En países tropicales y subtropicales constituye una importante causa de ceguera prevenible, en contraposición a lo que ocurre en países desarrollados, donde afecta escasamente a la población. El principal factor de riesgo corresponde al trauma ocular asociado a contaminación con material vegetal, pero también se ha visto asociada al uso de corticoides, antibióticos, inmunosupresores, quimioterápicos y uso de prótesis oculares.
Existen múltiples agentes antifúngicos tópicos para el tratamiento, tales como, polienos (natamicina, anfotericina B), imidazoles (ketoconazol, econazol) y triazoles (fluconazol, posaconazol). El tratamiento de elección ha sido por décadas la natamicina de uso tópico, único antifúngico aprobado por la Food and Drugs Administration (FDA), pero la reciente aparición de voriconazol tópico, un triazol de segunda generación de amplio espectro, ha planteado nuevas interrogantes, surgiendo, así, la necesidad de evaluar cuál de los dos antifúngicos tópicos se presenta como la mejor alternativa terapéutica.
Realizamos una búsqueda en Epistemonikos, la mayor base de datos de revisiones sistemáticas en salud, la cual es mantenida mediante búsquedas en múltiples fuentes de información, incluyendo MEDLINE, EMBASE, Cochrane, entre otras. Extrajimos los datos desde las revisiones identificadas y analizamos los datos de los estudios primarios. Con esta información, generamos un resumen estructurado denominado FRISBEE (Friendly Summaries of Body of Evidence using Epistemonikos), siguiendo un formato preestablecido, que incluye mensajes clave, un resumen del conjunto de evidencia (presentado como matriz de evidencia en Epistemonikos), metanálisis del total de los estudios cuando sea posible, una tabla de resumen de resultados con el método GRADE y una sección de otras consideraciones para la toma de decisión.
|
Mensajes clave
|
|
Cuál es la evidencia |
Encontramos tres revisiones sistemáticas [1], [2], [3] que incluyeron tres estudios primarios reportados en siete referencias [4], [5], [6], [7], [8], [9],[10], todos correspondientes a ensayos controlados aleatorizados. |
|
Qué tipo de pacientes incluyeron los estudios* |
Todos los ensayos incluyeron pacientes hombres y mujeres mayores de 16 años con una edad promedio de 46,7 años, con evidencia microbiológica de queratitis fúngica; visualización directa de hifas en raspado corneal mediante frotis con tinción de KOH al 10% o tinción de Gram [5], frotis con tinción de KOH al 10%, tinción de Giemsa o de Gram [4] y frotis de úlcera corneal positivo para hongos en pacientes con agudeza visual de 20/40 (0,3 unidades logMAR) a 20/400 (1,3 unidades logMAR) [8]. Todos los ensayos excluyeron a pacientes que tuvieran coinfección corneal concomitante (viral, bacteriana o protozoaria), signos de perforación corneal inminente o historia de perforación corneal [4], [5], [8]. Dos ensayos [4], [8] excluyeron a pacientes con agudeza visual peor que 20/200 (1,0 unidades logMAR) en el ojo no afectado y con úlceras bilaterales. Dos ensayos excluyeron a pacientes sin percepción de luz en el ojo afectado [4], [5], y un ensayo además excluyó a pacientes embarazadas[4]. |
|
Qué tipo de intervenciones incluyeron los estudios* |
Todos los ensayos utilizaron como intervención natamicina tópica 5%: dos ensayos administraron 1 gota cada hora durante 1 semana y luego 1 gota cada 2 horas durante 2 semanas (mientras el paciente estaba despierto) [4], [8] y un ensayo 1 gota cada hora durante 2 semanas [5]. Como comparación se utilizó voriconazol tópico 1%: en dos ensayos se administró 1 gota cada hora durante 1 semana y luego cada 2 horas durante 2 semanas (mientras el paciente estaba despierto) [4], [8] y un ensayo administró 1 gota cada hora durante 2 semanas [5]. |
|
Qué tipo de desenlaces midieron |
Los ensayos evaluaron múltiples desenlaces, los cuales fueron agrupados en las revisiones sistemáticas de la siguiente forma:
El seguimiento promedio de los ensayos fue de 11,3 semanas con un intervalo que fluctuó entre 10 y 12 semanas. |
* La información sobre los estudios primarios es extraída desde las revisiones sistemáticas identificadas, no directamente desde los estudios, a menos que se especifique lo contrario.
Cuál es la evidencia
La información sobre los efectos de natamicina tópica 5% versus voriconazol tópico 1% está basada en tres ensayos aleatorizados que incluyeron 473 pacientes [5], [6], [8].
Un ensayo reportó el desenlace cura clínica (30 pacientes) [5], tres ensayos reportaron cambio en la agudeza visual (logMAR), y perforación corneal y/o necesidad de realizar queratoplastia terapéutica (434 pacientes) [5], [6], [8].
El resumen de los resultados es el siguiente:
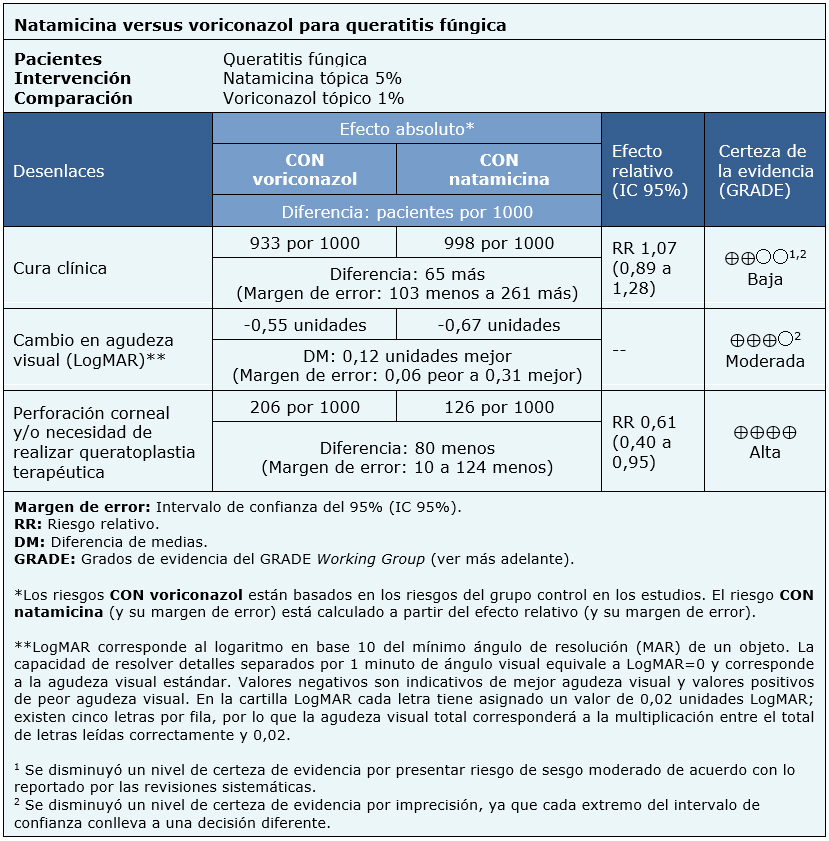
| Siga el enlace para acceder a la versión interactiva de esta tabla (Interactive Summary of Findings - iSoF) |
|
A quién se aplica y a quién no se aplica esta evidencia |
|
| Sobre los desenlaces incluidos en este resumen |
|
| Balance riesgo/beneficio y certeza de la evidencia |
|
| Consideraciones de recursos |
|
| Qué piensan los pacientes y sus tratantes |
|
| Diferencias entre este resumen y otras fuentes |
|
| ¿Puede que cambie esta información en el futuro? |
|
Mediante métodos automatizados y colaborativos recopilamos toda la evidencia relevante para la pregunta de interés y la presentamos en una matriz de evidencia.
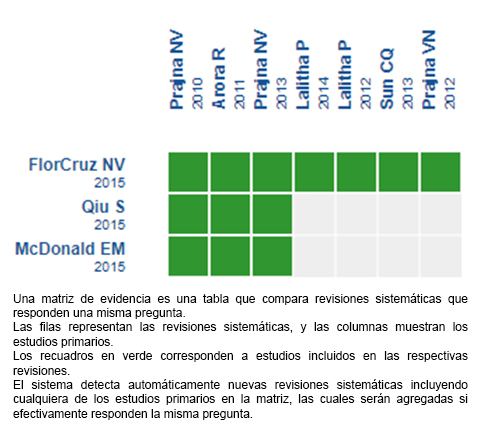
Siga el enlace para acceder a la versión interactiva: Natamicina versus voriconazol para queratitis fúngica.
Si con posterioridad a la publicación de este resumen se publican nuevas revisiones sistemáticas sobre este tema, en la parte superior de la matriz se mostrará un aviso de “nueva evidencia”. Si bien el proyecto contempla la actualización periódica de estos resúmenes, los usuarios están invitados a comentar en la página web de Medwave o contactar a los autores mediante correo electrónico si creen que hay evidencia que motive una actualización más precoz.
Luego de crear una cuenta en Epistemonikos, al guardar las matrices recibirá notificaciones automáticas cada vez que exista nueva evidencia que potencialmente responda a esta pregunta.
Este artículo es parte del proyecto síntesis de evidencia de Epistemonikos. Se elabora con una metodología preestablecida, siguiendo rigurosos estándares metodológicos y proceso de revisión por pares interno. Cada uno de estos artículos corresponde a un resumen, denominado FRISBEE (Friendly Summary of Body of Evidence using Epistemonikos), cuyo principal objetivo es sintetizar el conjunto de evidencia de una pregunta específica, en un formato amigable a los profesionales clínicos. Sus principales recursos se basan en la matriz de evidencia de Epistemonikos y análisis de resultados usando metodología GRADE. Mayores detalles de los métodos para elaborar este FRISBEE están descritos aquí (http://dx.doi.org/10.5867/medwave.2014.06.5997)
La Fundación Epistemonikos es una organización que busca acercar la información a quienes toman decisiones en salud, mediante el uso de tecnologías. Su principal desarrollo es la base de datos Epistemonikos (www.epistemonikos.org).
Declaración de conflictos de intereses
Los autores declaran no tener conflictos de intereses con la materia de este artículo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
Infectious keratitis of fungal origin mainly affects people in tropical and subtropical countries, and is an important cause of preventable blindness. Topical antifungals, particularly natamycin and voriconazole, are considered effective, but it is not clear which one is the best treatment alternative.
METHODS
We searched in Epistemonikos, the largest database of systematic reviews in health, which is maintained by screening multiple information sources, including MEDLINE, EMBASE, Cochrane, among others. We extracted data from the systematic reviews, reanalyzed data of primary studies, conducted a meta-analysis and generated a summary of findings table using the GRADE approach.
RESULTS AND CONCLUSIONS
We identified three systematic reviews including three studies overall,all of which were randomized trials. We concluded natamycin probably is associated with better visual acuity after infection, and it prevents corneal perforation and/or need to perform therapeutic keratoplasty compared to voriconazole in fungal keratitis.
 Autores:
José Retamal[1,2], Gonzalo Ordenes-Cavieres[1,2], Arturo Grau-Diez[2,3]
Autores:
José Retamal[1,2], Gonzalo Ordenes-Cavieres[1,2], Arturo Grau-Diez[2,3]

Citación: Retamal J, Ordenes-Cavieres G, Grau-Diez A. Natamycin versus voriconazole for fungal keratitis. Medwave 2018;18(8):e7387 doi: 10.5867/medwave.2018.08.7387
Fecha de envío: 26/11/2018
Fecha de aceptación: 11/12/2018
Fecha de publicación: 18/12/2018
Origen: Este artículo es producto del Epistemonikos Evidence Synthesis Project de la Fundación Epistemonikos, en colaboración con Medwave para su publicación.
Tipo de revisión: Con revisión por pares sin ciego por parte del equipo metodológico del Epistemonikos Evidence Synthesis Project.

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 FlorCruz NV, Evans JR. Medical interventions for fungal keratitis. Cochrane Database Syst Rev. 2015 Apr 9;(4):CD004241. | CrossRef | PubMed |
FlorCruz NV, Evans JR. Medical interventions for fungal keratitis. Cochrane Database Syst Rev. 2015 Apr 9;(4):CD004241. | CrossRef | PubMed | Qiu S, Zhao GQ, Lin J, Wang X, Hu LT, Du ZD, Wang Q, Zhu CC. Natamycin in the treatment of fungal keratitis: a systematic review and Meta-analysis. Int J Ophthalmol. 2015 Jun 18;8(3):597-602. | CrossRef | PubMed | PMC |
Qiu S, Zhao GQ, Lin J, Wang X, Hu LT, Du ZD, Wang Q, Zhu CC. Natamycin in the treatment of fungal keratitis: a systematic review and Meta-analysis. Int J Ophthalmol. 2015 Jun 18;8(3):597-602. | CrossRef | PubMed | PMC | McDonald EM, Ram FS, Patel DV, McGhee CN. Effectiveness of Topical Antifungal Drugs in the Management of Fungal Keratitis: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Asia Pac J Ophthalmol (Phila). 2014 Jan-Feb;3(1):41-7. | CrossRef | PubMed |
McDonald EM, Ram FS, Patel DV, McGhee CN. Effectiveness of Topical Antifungal Drugs in the Management of Fungal Keratitis: A Systematic Review and Meta-analysis of Randomized Controlled Trials. Asia Pac J Ophthalmol (Phila). 2014 Jan-Feb;3(1):41-7. | CrossRef | PubMed | Prajna NV, Mascarenhas J, Krishnan T, Reddy PR, Prajna L, Srinivasan M, Vaitilingam CM, Hong KC, Lee SM, McLeod SD, Zegans ME, Porco TC, Lietman TM, Acharya NR. Comparison of natamycin and voriconazole for the treatment of fungal keratitis. Arch Ophthalmol. 2010 Jun;128(6):672-8. | CrossRef | PubMed | PMC |
Prajna NV, Mascarenhas J, Krishnan T, Reddy PR, Prajna L, Srinivasan M, Vaitilingam CM, Hong KC, Lee SM, McLeod SD, Zegans ME, Porco TC, Lietman TM, Acharya NR. Comparison of natamycin and voriconazole for the treatment of fungal keratitis. Arch Ophthalmol. 2010 Jun;128(6):672-8. | CrossRef | PubMed | PMC | Arora R, Gupta D, Goyal J, Kaur R. Voriconazole versus natamycin as primary treatment in fungal corneal ulcers. Clin Exp Ophthalmol. 2011 Jul;39(5):434-40. | CrossRef | PubMed |
Arora R, Gupta D, Goyal J, Kaur R. Voriconazole versus natamycin as primary treatment in fungal corneal ulcers. Clin Exp Ophthalmol. 2011 Jul;39(5):434-40. | CrossRef | PubMed | Prajna VN, Lalitha PS, Mascarenhas J, Krishnan T, Srinivasan M, Vaitilingam CM, Oldenburg CE, Sy A, Keenan JD, Porco TC, Acharya NR, Lietman TM. Natamycin and voriconazole in Fusarium and Aspergillus keratitis: subgroup analysis of a randomised controlled trial. Br J Ophthalmol. 2012 Nov;96(11):1440-1. | CrossRef | PubMed | PMC |
Prajna VN, Lalitha PS, Mascarenhas J, Krishnan T, Srinivasan M, Vaitilingam CM, Oldenburg CE, Sy A, Keenan JD, Porco TC, Acharya NR, Lietman TM. Natamycin and voriconazole in Fusarium and Aspergillus keratitis: subgroup analysis of a randomised controlled trial. Br J Ophthalmol. 2012 Nov;96(11):1440-1. | CrossRef | PubMed | PMC | Lalitha P, Prajna NV, Oldenburg CE, Srinivasan M, Krishnan T, Mascarenhas J, Vaitilingam CM, McLeod SD, Zegans ME, Porco TC, Acharya NR, Lietman TM. Organism, minimum inhibitory concentration, and outcome in a fungal corneal ulcer clinical trial. Cornea. 2012 Jun;31(6):662-7. | CrossRef | PubMed | PMC |
Lalitha P, Prajna NV, Oldenburg CE, Srinivasan M, Krishnan T, Mascarenhas J, Vaitilingam CM, McLeod SD, Zegans ME, Porco TC, Acharya NR, Lietman TM. Organism, minimum inhibitory concentration, and outcome in a fungal corneal ulcer clinical trial. Cornea. 2012 Jun;31(6):662-7. | CrossRef | PubMed | PMC | Prajna NV, Krishnan T, Mascarenhas J, Rajaraman R, Prajna L, Srinivasan M, Raghavan A, Oldenburg CE, Ray KJ, Zegans ME, McLeod SD, Porco TC, Acharya NR, Lietman TM; Mycotic Ulcer Treatment Trial Group. The mycotic ulcer treatment trial: a randomized trial comparing natamycin vs voriconazole. JAMA Ophthalmol. 2013 Apr;131(4):422-9. | PubMed | PMC |
Prajna NV, Krishnan T, Mascarenhas J, Rajaraman R, Prajna L, Srinivasan M, Raghavan A, Oldenburg CE, Ray KJ, Zegans ME, McLeod SD, Porco TC, Acharya NR, Lietman TM; Mycotic Ulcer Treatment Trial Group. The mycotic ulcer treatment trial: a randomized trial comparing natamycin vs voriconazole. JAMA Ophthalmol. 2013 Apr;131(4):422-9. | PubMed | PMC | Sun CQ, Prajna NV, Krishnan T, Mascarenhas J, Rajaraman R, Srinivasan M, Raghavan A, O'Brien KS, Ray KJ, McLeod SD, Porco TC, Acharya NR, Lietman TM. Expert prior elicitation and Bayesian analysis of the Mycotic Ulcer Treatment Trial I. Invest Ophthalmol Vis Sci. 2013 Jun 14;54(6):4167-73. | CrossRef | PubMed | PMC |
Sun CQ, Prajna NV, Krishnan T, Mascarenhas J, Rajaraman R, Srinivasan M, Raghavan A, O'Brien KS, Ray KJ, McLeod SD, Porco TC, Acharya NR, Lietman TM. Expert prior elicitation and Bayesian analysis of the Mycotic Ulcer Treatment Trial I. Invest Ophthalmol Vis Sci. 2013 Jun 14;54(6):4167-73. | CrossRef | PubMed | PMC | Lalitha P, Sun CQ, Prajna NV, Karpagam R, Geetha M, O'Brien KS, Cevallos V, McLeod SD, Acharya NR, Lietman TM; Mycotic Ulcer Treatment Trial Group. In vitro susceptibility of filamentous fungal isolates from a corneal ulcer clinical trial. Am J Ophthalmol. 2014 Feb;157(2):318-26. | CrossRef | PubMed | PMC |
Lalitha P, Sun CQ, Prajna NV, Karpagam R, Geetha M, O'Brien KS, Cevallos V, McLeod SD, Acharya NR, Lietman TM; Mycotic Ulcer Treatment Trial Group. In vitro susceptibility of filamentous fungal isolates from a corneal ulcer clinical trial. Am J Ophthalmol. 2014 Feb;157(2):318-26. | CrossRef | PubMed | PMC | Joseph J., Sharma S. (2016) Antifungal Therapy in Eye Infections: New Drugs, New Trends. In: Basak A., Chakraborty R., Mandal S. (eds) Recent Trends in Antifungal Agents and Antifungal Therapy. Springer, New Delhi. | CrossRef |
Joseph J., Sharma S. (2016) Antifungal Therapy in Eye Infections: New Drugs, New Trends. In: Basak A., Chakraborty R., Mandal S. (eds) Recent Trends in Antifungal Agents and Antifungal Therapy. Springer, New Delhi. | CrossRef | Heralgi MM, Badami A, Vokuda H, Venkatachalam K. An Update On Voriconazole In Ophthalmology. Delhi J Ophthalmol 2016;27;9-15.
Heralgi MM, Badami A, Vokuda H, Venkatachalam K. An Update On Voriconazole In Ophthalmology. Delhi J Ophthalmol 2016;27;9-15.  Sharma S, Das S, Virdi A, Fernandes M, Sahu SK, Kumar Koday N, Ali MH, Garg P, Motukupally SR. Re-appraisal of topical 1% voriconazole and 5% natamycin in the treatment of fungal keratitis in a randomised trial. Br J Ophthalmol. 2015 Sep;99(9):1190-5. | CrossRef | PubMed |
Sharma S, Das S, Virdi A, Fernandes M, Sahu SK, Kumar Koday N, Ali MH, Garg P, Motukupally SR. Re-appraisal of topical 1% voriconazole and 5% natamycin in the treatment of fungal keratitis in a randomised trial. Br J Ophthalmol. 2015 Sep;99(9):1190-5. | CrossRef | PubMed | World Health Organization, Regional Office for South-East Asia. (2004). Guidelines for the management of corneal ulcer at primary, secondary and tertiary care health facilities in the South-East Asia region. WHO Regional Office for South-East Asia. | Link |
World Health Organization, Regional Office for South-East Asia. (2004). Guidelines for the management of corneal ulcer at primary, secondary and tertiary care health facilities in the South-East Asia region. WHO Regional Office for South-East Asia. | Link | National Health Service (NHS). Joint Ophthalmology and Microbiology Microbial Keratitis Guidelines. 2016 Sept. | Link |
National Health Service (NHS). Joint Ophthalmology and Microbiology Microbial Keratitis Guidelines. 2016 Sept. | Link |