 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
El dolor es uno de los síntomas más frecuentes y relevantes en pacientes oncológicos. La estrategia analgésica escalonada de la Organización Mundial de la Salud postula el uso de opioides fuertes asociado a coadyuvantes como el paracetamol o los antiinflamatorios no esteroidales en el peldaño III. Sin embargo, existe la duda si agregar paracetamol a un esquema analgésico basado en opioides fuertes presenta algún beneficio en pacientes oncológicos con dolor moderado a severo. Utilizando la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en múltiples fuentes de información, identificamos dos revisiones sistemáticas que en conjunto incluyen cinco estudios aleatorizados. Extrajimos los datos relevantes y resumimos los resultados utilizando el método GRADE. Concluimos que agregar paracetamol a los opioides fuertes podría hacer poca o nula diferencia en el control del dolor en pacientes oncológicos.
Durante las últimas décadas la incidencia del cáncer ha aumentado en todo el mundo. El dolor constituye una de sus complicaciones más frecuentes, especialmente en etapas avanzadas [1],[2]. Para enfrentar este problema la Organización Mundial de la Salud (OMS) presentó en 1986 su estrategia escalonada de analgésicos [3],[4], la cual ha sido muy efectiva en el control del dolor de pacientes con cáncer [5],[6]. La Escala Analgésica de la OMS plantea que frente a dolor moderado o severo (peldaños II y III) se deben usar opioides asociado a coadyuvantes, como el paracetamol o los antiinflamatorios no esteroidales, entre otras opciones.
Este esquema se justifica en base a un posible efecto aditivo o sinérgico, dado que presentan mecanismos de acción diferentes: Los opioides se unen a receptores opiodes y replican los efectos de los opiáceos endógenos, inhibiendo la liberación presináptica y la respuesta postsináptica de neurotransmisores excitatorios de neuronas nociceptivas en distintos niveles del sistema nervioso central y periférico; el paracetamol produce analgesia a través de la inhibición de la síntesis de prostaglandinas a nivel central y periférico, donde las prostaglandinas sensibilizan las terminaciones nociceptivas a otros mediadores. A estas consideraciones se suman la amplia disponibilidad, el relativo bajo costo y el adecuado perfil de seguridad del paracetamol, además de su utilidad demostrada para el manejo del dolor de diversas etiologías, lo que lo hace un medicamento fácil de usar con bajos riesgos.
Sin embargo, en pacientes recibiendo opioides de elevada potencia analgésica (por ej. morfina o metadona) existe la duda si agregar paracetamol presenta algún beneficio para los pacientes, como por ejemplo, mejor analgesia, reducción en los requerimientos de opioides o disminución en los efectos adversos.
Utilizamos la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en múltiples fuentes de información, para identificar revisiones sistemáticas y sus estudios primarios incluidos. Con esta información generamos un resumen estructurado, siguiendo un formato preestablecido, que incluye mensajes clave, un resumen del conjunto de evidencia (presentado como matriz de evidencia en Epistemonikos), tablas de resumen de resultados con el método GRADE, y tabla de otras consideraciones para la toma de decisión.
|
Mensajes clave
|
|
Cuál es la evidencia. |
Encontramos dos revisiones sistemáticas [7],[8] que incluyen cinco estudios controlados aleatorizados con duración entre uno y 14 días [9],[10],[11],[12],[13]. |
|
Qué tipo de pacientes incluyeron los estudios |
Todos los estudios incluyeron pacientes mayores de 18 años, de ambos sexos, con dolor relacionado a patología oncológica. Los estudios incluyeron pacientes con diversa intensidad de dolor: dolor severo [9], leve-moderado [10], leve [11] y todas las intensidades [12]; un estudio no lo especificó [13]. Todos incluyeron pacientes con dosis estable de opioide, sin cambios en los fármacos al menos 48 horas previo al ingreso al estudio. Tres estudios aceptaron pacientes usuarios de coadyuvantes [10],[12],[13]. El origen del dolor fue diverso: visceral, somático, neuropático. Tres estudios incluyeron pacientes con cánceres sólido y hematológico [9],[10],[13], un estudio incluyó solo pacientes con cáncer sólido [11] y en uno no fue especificado [12]. Dos estudios describieron la presencia de metástasis en el 97% y 100% de los pacientes incluidos respectivamente [10],[12]. Tres estudios fueron realizados de forma ambulatoria [10],[11],[12], uno con pacientes hospitalizados [9] y otro incluyó pacientes en ambos escenarios [13]. Todos los estudios excluyeron a pacientes con alteración en pruebas hepáticas, contraindicaciones al uso de paracetamol o que hubiesen recibido radioterapia dentro de las 48 horas previas al ingreso al estudio. Tres estudios excluyeron a pacientes con dolor neuropático [9],[10],[13]. Además, dos estudios excluyeron a pacientes usuarios de coadyuvantes [9],[11]. |
|
Qué tipo de intervenciones incluyeron los estudios |
Todos los estudios compararon el uso de un opioide fuerte asociado con paracetamol contra el mismo opioide asociado a placebo. Respecto al opioide estudiado: dos estudios usaron morfina [9],[11], un estudio usó morfina e hidromorfina [10], un estudio usó metadona [12] y un estudio describió el uso de opioides fuertes con dosis equivalente de morfina oral mayor a 200 mg [13]. La dosis de paracetamol fue variable: 3 g/día vía oral [12], 4 g/día vía oral [11],[13], 5 g/día vía oral [10] y 4 g/día endovenoso [9]. |
|
Qué tipo de desenlaces midieron |
Se midió la intensidad del dolor a través de escalas verbales de 11 puntos (0 sin dolor a 10 dolor máximo) y también de escalas visuales análogas o de expresión facial. Además, se reportó la reducción de la cantidad de opioides consumida, escalas de bienestar global, la preferencia de los pacientes y la presencia de efectos adversos (principalmente somnolencia, constipación, náuseas y vómitos) |
La información sobre los efectos de agregar paracetamol a los opioides fuertes en pacientes con dolor oncológico está basada en todos los ensayos aleatorizados incluidos en este resumen, los cuales incluyen 171 pacientes. Todos los estudios midieron la reducción del puntaje en escalas de dolor y la presencia de efectos adversos, sin embargo, no fue posible realizar un metanálisis de estos resultados. El resumen de los resultados es el siguiente:
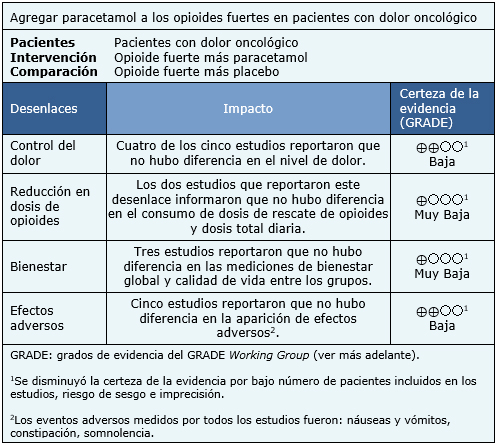

|
A quién se aplica y a quién no se aplica esta evidencia |
|
| Sobre los desenlaces incluidos en este resumen |
|
| Balance riesgo/beneficio y certeza de la evidencia |
|
| Consideraciones de recursos |
|
| Qué piensan los pacientes y sus tratantes |
|
| Diferencias entre este resumen y otras fuentes |
|
| ¿Puede que cambie esta información en el futuro? |
|
Mediante métodos automatizados y colaborativos recopilamos toda la evidencia relevante para la pregunta de interés y la presentamos en una matriz de evidencia.
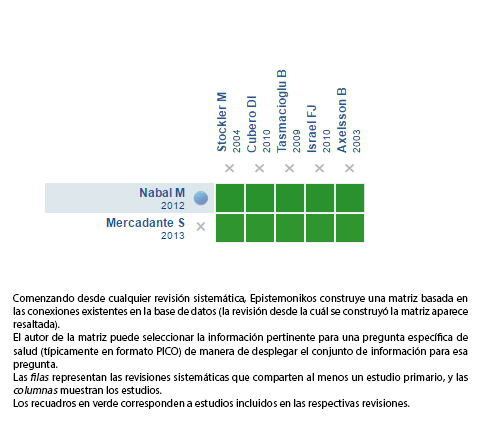
Siga el enlace para acceder a la versión interactiva: Adición de paracetamol al tratamiento con opioides fuertes en pacientes con dolor oncológico
Si con posterioridad a la publicación de este resumen se publican nuevas revisiones sistemáticas sobre este tema, en la parte superior de la matriz se mostrará un aviso de “nueva evidencia”. Si bien el proyecto contempla la actualización periódica de estos resúmenes, los usuarios están invitados a comentar en Medwave o contactar a los autores mediante correo electrónico si creen que hay evidencia que motive una actualización más rápida.
Luego de crear una cuenta en Epistemonikos, al guardar las matrices recibirá notificaciones automáticas cada vez que exista nueva evidencia que potencialmente responda a esta pregunta. El detalle de los métodos para elaborar este resumen están descritos aquí: http://dx.doi.org/10.5867/medwave.2014.06.5997.
La Fundación Epistemonikos es una organización que busca acercar la información a quienes toman decisiones en salud, mediante el uso de tecnologías. Su principal desarrollo es la base de datos Epistemonikos (www.epistemonikos.org).
Los resúmenes de evidencia siguen un riguroso proceso de revisión por pares interno.
Declaración de conflictos de intereses
Los autores declaran no tener conflictos de intereses con la materia de este artículo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Pain is one of the most frequent and relevant symptoms in cancer patients. The World Health Organization's analgesic ladder proposes the use of strong opioids associated with adjuvants such as acetaminophen or nonsteroidal anti-inflammatory drugs in step III. However, it is unclear whether adding acetaminophen to an analgesic regimen based on strong opioids has any benefit in cancer patients with moderate to severe pain. To answer this question we searched in Epistemonikos database, which is maintained by screening multiple information sources. We identified two systematic reviews including five randomized trials overall. We extracted data and generated a summary of findings table using the GRADE approach. We concluded that adding acetaminophen to strong opioids might make little or no difference in improving pain management in cancer patients.
 Autores:
Oscar Corsi[1,2], Pedro E. Pérez-Cruz[1,2,3]
Autores:
Oscar Corsi[1,2], Pedro E. Pérez-Cruz[1,2,3]

Citación: Corsi O, Pérez-Cruz PE. Is it useful to add acetaminophen to high-potency opioids in cancer-related pain?. Medwave2017;17(Suppl2):e6944 doi: 10.5867/medwave.2017.6944
Fecha de envío: 13/4/2017
Fecha de aceptación: 20/4/2017
Fecha de publicación: 4/5/2017

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 van den Beuken-van Everdingen MH, de Rijke JM, Kessels AG, Schouten HC, van Kleef M, Patijn J. High prevalence of pain in patients with cancer in a large population-based study in The Netherlands. Pain. 2007 Dec 5;132(3):312-20 | PubMed |
van den Beuken-van Everdingen MH, de Rijke JM, Kessels AG, Schouten HC, van Kleef M, Patijn J. High prevalence of pain in patients with cancer in a large population-based study in The Netherlands. Pain. 2007 Dec 5;132(3):312-20 | PubMed | Teunissen SC, Wesker W, Kruitwagen C, de Haes HC, Voest EE, de Graeff A. Symptom prevalence in patients with incurable cancer: a systematic review. J Pain Symptom Manage. 2007 Jul;34(1):94- | PubMed |
Teunissen SC, Wesker W, Kruitwagen C, de Haes HC, Voest EE, de Graeff A. Symptom prevalence in patients with incurable cancer: a systematic review. J Pain Symptom Manage. 2007 Jul;34(1):94- | PubMed | World Health Organization. Cancer Pain Relief. Geneva, Switzerland: World Health Organization; 1986.
World Health Organization. Cancer Pain Relief. Geneva, Switzerland: World Health Organization; 1986.  Jadad AR, Browman GP. The WHO analgesic ladder for cancer pain management. Stepping up the quality of its evaluation. JAMA. 1995 Dec 20;274(23):1870-3 | PubMed |
Jadad AR, Browman GP. The WHO analgesic ladder for cancer pain management. Stepping up the quality of its evaluation. JAMA. 1995 Dec 20;274(23):1870-3 | PubMed | Grond S, Zech D, Schug SA, Lynch J, Lehmann KA. Validation of World Health Organization guidelines for cancer pain relief during the last days and hours of life. J Pain Symptom Manage. 1991 Oct;6(7):411-22 | PubMed |
Grond S, Zech D, Schug SA, Lynch J, Lehmann KA. Validation of World Health Organization guidelines for cancer pain relief during the last days and hours of life. J Pain Symptom Manage. 1991 Oct;6(7):411-22 | PubMed | Nabal M, Librada S, Redondo MJ, Pigni A, Brunelli C, Caraceni A. The role of paracetamol and nonsteroidal anti-inflammatory drugs in addition to WHO Step III opioids in the control of pain in advanced cancer. A systematic review of the literature. Palliat Med. 2012 Jun;26(4):305-12 | CrossRef | PubMed |
Nabal M, Librada S, Redondo MJ, Pigni A, Brunelli C, Caraceni A. The role of paracetamol and nonsteroidal anti-inflammatory drugs in addition to WHO Step III opioids in the control of pain in advanced cancer. A systematic review of the literature. Palliat Med. 2012 Jun;26(4):305-12 | CrossRef | PubMed | Mercadante S, Giarratano A. The long and winding road of non steroidal antinflammatory drugs and paracetamol in cancer pain management: a critical review. Crit Rev Oncol Hematol. 2013 Aug;87(2):140-5 | CrossRef | PubMed |
Mercadante S, Giarratano A. The long and winding road of non steroidal antinflammatory drugs and paracetamol in cancer pain management: a critical review. Crit Rev Oncol Hematol. 2013 Aug;87(2):140-5 | CrossRef | PubMed | Tasmacioglu B, Aydinli I, Keskinbora K, Pekel AF, Salihoglu T, Sonsuz A. Effect of intravenous administration of paracetamol on morphine consumption in cancer pain control. Support Care Cancer. 2009 Dec;17(12):1475-81 | CrossRef | PubMed |
Tasmacioglu B, Aydinli I, Keskinbora K, Pekel AF, Salihoglu T, Sonsuz A. Effect of intravenous administration of paracetamol on morphine consumption in cancer pain control. Support Care Cancer. 2009 Dec;17(12):1475-81 | CrossRef | PubMed | Stockler M, Vardy J, Pillai A, Warr D. Acetaminophen (paracetamol) improves pain and well-being in people with advanced cancer already receiving a strong opioid regimen: a randomized, double-blind, placebo-controlled cross-over trial. J Clin Oncol. 2004 Aug 15;22(16):3389-94 | PubMed |
Stockler M, Vardy J, Pillai A, Warr D. Acetaminophen (paracetamol) improves pain and well-being in people with advanced cancer already receiving a strong opioid regimen: a randomized, double-blind, placebo-controlled cross-over trial. J Clin Oncol. 2004 Aug 15;22(16):3389-94 | PubMed | Axelsson B, Borup S. Is there an additive analgesic effect of paracetamol at step 3? A double-blind randomized controlled study. Palliat Med. 2003 Dec;17(8):724-5 | PubMed |
Axelsson B, Borup S. Is there an additive analgesic effect of paracetamol at step 3? A double-blind randomized controlled study. Palliat Med. 2003 Dec;17(8):724-5 | PubMed | Cubero DI, del Giglio A. Early switching from morphine to methadone is not improved by acetaminophen in the analgesia of oncologic patients: a prospective, randomized, double-blind, placebo-controlled study. Support Care Cancer. 2010 Feb;18(2):235-42 | CrossRef | PubMed |
Cubero DI, del Giglio A. Early switching from morphine to methadone is not improved by acetaminophen in the analgesia of oncologic patients: a prospective, randomized, double-blind, placebo-controlled study. Support Care Cancer. 2010 Feb;18(2):235-42 | CrossRef | PubMed | Israel FJ, Parker G, Charles M, Reymond L. Lack of benefit from paracetamol (acetaminophen) for palliative cancer patients requiring high-dose strong opioids: a randomized, double-blind, placebo-controlled, crossover trial. J Pain Symptom Manage. 2010 Mar;39(3):548-54. | CrossRef | PubMed |
Israel FJ, Parker G, Charles M, Reymond L. Lack of benefit from paracetamol (acetaminophen) for palliative cancer patients requiring high-dose strong opioids: a randomized, double-blind, placebo-controlled, crossover trial. J Pain Symptom Manage. 2010 Mar;39(3):548-54. | CrossRef | PubMed | Farrar JT, Young JP Jr, LaMoreaux L, Werth JL, Poole RM. Clinical importance of changes in chronic pain intensity measured on an 11-point numerical pain rating scale. Pain. 2001 Nov;94(2):149-58. | PubMed |
Farrar JT, Young JP Jr, LaMoreaux L, Werth JL, Poole RM. Clinical importance of changes in chronic pain intensity measured on an 11-point numerical pain rating scale. Pain. 2001 Nov;94(2):149-58. | PubMed | National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines): Adult Cancer Pain 2016 [cited July 21, 2016]. | Link |
National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines): Adult Cancer Pain 2016 [cited July 21, 2016]. | Link | Ripamonti CI, Santini D, Maranzano E, Berti M, Roila F; ESMO Guidelines Working Group..Management of cancer pain: ESMO Clinical Practice Guidelines. Ann Oncol. 2012 Oct;23 Suppl 7:vii139-54 | PubMed |
Ripamonti CI, Santini D, Maranzano E, Berti M, Roila F; ESMO Guidelines Working Group..Management of cancer pain: ESMO Clinical Practice Guidelines. Ann Oncol. 2012 Oct;23 Suppl 7:vii139-54 | PubMed | Yamaguchi T, Shima Y, Morita T, Hosoya M, Matoba M; Japanese Society of Palliative Medicine. Clinical guideline for pharmacological management of cancer pain: the Japanese Society of Palliative Medicine recommendations. Jpn J Clin Oncol. 2013 Sep;43(9):896-909 | CrossRef | PubMed |
Yamaguchi T, Shima Y, Morita T, Hosoya M, Matoba M; Japanese Society of Palliative Medicine. Clinical guideline for pharmacological management of cancer pain: the Japanese Society of Palliative Medicine recommendations. Jpn J Clin Oncol. 2013 Sep;43(9):896-909 | CrossRef | PubMed | Caraceni A, Hanks G, Kaasa S, Bennett MI, Brunelli C, Cherny N, et al; European Palliative Care Research Collaborative (EPCRC); European Association for Palliative Care (EAPC). Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol. 2012 Feb;13(2):e58-68 | CrossRef | PubMed |
Caraceni A, Hanks G, Kaasa S, Bennett MI, Brunelli C, Cherny N, et al; European Palliative Care Research Collaborative (EPCRC); European Association for Palliative Care (EAPC). Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol. 2012 Feb;13(2):e58-68 | CrossRef | PubMed |