 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La fibrosis pulmonar idiopática es una enfermedad respiratoria crónica y progresiva, que en etapas finales conlleva una alta mortalidad. Se han planteado múltiples opciones terapéuticas, entre ellas la N-acetilcisteína, pero su rol no está claramente establecido. Utilizando la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en 30 bases de datos, identificamos ocho revisiones sistemáticas que en conjunto incluyen 16 estudios aleatorizados. Realizamos un metanálisis y tablas de resumen de los resultados utilizando el método GRADE. Concluimos que N-acetilcisteína probablemente aumenta el riesgo de hospitalización y exacerbaciones. Si bien no está claro si esto conlleva un aumento de mortalidad porque la certeza de la evidencia es muy baja, en general existe consenso en que no debiera utilizarse, a no ser que sea en el contexto de un nuevo estudio clínico.
En el último tiempo ha surgido gran cantidad de evidencia en torno a la efectividad de distintas terapias para la fibrosis pulmonar idiopática, sobre todo considerando que ninguna intervención más que el trasplante pulmonar aumenta claramente la sobrevida [1].
La N-acetilcisteína, por su carácter reductor, ejerce una actividad citoprotectora en el aparato respiratorio humano, actuando frente a la acción perjudicial del estrés oxidativo generado por radicales libres de diversa etiología. En base a su estructura derivada de la cisteína, la N-acetilcisteína tiene un rol precursor en la síntesis de la molécula antioxidante glutatión y normaliza sus niveles cuando se ven reducidos por una acción oxidante continua sobre el aparato respiratorio. Es así como en los pacientes con fibrosis pulmonar idiopática la acción de este fármaco podría estar mediada por el mecanismo de acción previamente descrito [2].
Además, N-acetilcisteína está disponible ampliamente, y según la guía ATS/ERS 2011, usada sola o en combinación (con prednisolona y azatriopina) podría ser una elección razonable en una minoría de pacientes con esta enfermedad [1]. Sin embargo, una actualización de la misma guía el año 2015 propone prohibir su uso debido a un aumento del riesgo de hospitalización y muerte [3].
Utilizamos la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en 30 bases de datos, para identificar revisiones sistemáticas y sus estudios primarios incluidos. Con esta información generamos un resumen estructurado, siguiendo un formato preestablecido, que incluye mensajes clave, un resumen del conjunto de evidencia (presentado como matriz de evidencia en Epistemonikos), metanálisis del total de los estudios, tablas de resumen de resultados con el método GRADE, y tablas de otras consideraciones para la toma de decisión.
|
Mensajes clave
|
|
Cuál es la evidencia. |
Encontramos ocho revisiones sistemáticas publicadas en nueve referencias [4],[5],[6],[7],[8],[9],[10],[11],[12] que incluyen 16 estudios controlados aleatorizados publicados en 18 referencias [13],[14],[15],[16],[17],[18],[19],[20], [21],[22],[23],[24],[25],[26],[27],[28],[29],[30]. |
|
Qué tipo de pacientes incluyeron los estudios |
Todos los estudios incluyeron pacientes mayores de 18 años. En trece estudios el diagnóstico se realizó solo en base a las normas ATS/ERS/JRS/ALAT [13],[15],[20],[21],[22], [23],[24],[25],[26],[27],[28],[29],[30], en un estudio se incluyeron además pacientes con diagnóstico por imágenes o biopsia [16], en otro estudio se requirió además marcadores de injuria pulmonar [14] y en otro estudio el diagnóstico se realizó solo en base a imágenes y biopsia [18]. En tres estudios se incluyeron pacientes según test de función pulmonar o gases en sangre arterial [14],[16], [18], y un estudio especificó un score de disnea como criterio de inclusión [18]. |
|
Qué tipo de intervenciones incluyeron los estudios |
Dos estudios utilizaron N-acetilcisteína como monoterapia oral [15],[17], un estudio la utilizó como monoterapia inhalatoria [14], diez estudios la utilizaron en combinación con prednisona 0,4 a 0,5 mg/kg/día [13],[20],[21],[23], [24],[25],[26],[27],[30], un estudio la utilizó asociada con interferón [22], un estudio refiere asociar N-acetilcisteína a antiinflamatorios pero no especifica cuales [29], un estudio la utilizó asociada con prednisolona y azatriopina [18], y un estudio utilizó N-acetilcisteína asociada con prednisolona y azatriopina, el cual fue interrumpido precozmente por alta tasa de mortalidad [16]. Todos los estudios compararon contra placebo o tratamiento estándar (placebo, prednisolona y azatriopina), excepto un estudio que comparó con bromhexina [15]. |
|
Qué tipo de desenlaces midieron |
Las distintas revisiones sistemáticas identificadas agruparon los desenlaces de la siguiente forma:
|
La información sobre los efectos de N-acetilcisteína está basada en cuatro estudios aleatorizados [14],[15],[16],[18] que incluyen 694 pacientes. El resto de los estudios no presentaba datos sobre los desenlaces de interés, o no fue posible utilizarlos en un metanálisis. Cuatro estudios [14],[15],[16],[18] midieron el desenlace mortalidad, y sólo un estudio [16] midió el desenlace hospitalizaciones y exacerbaciones agudas. El resumen de los resultados es el siguiente:
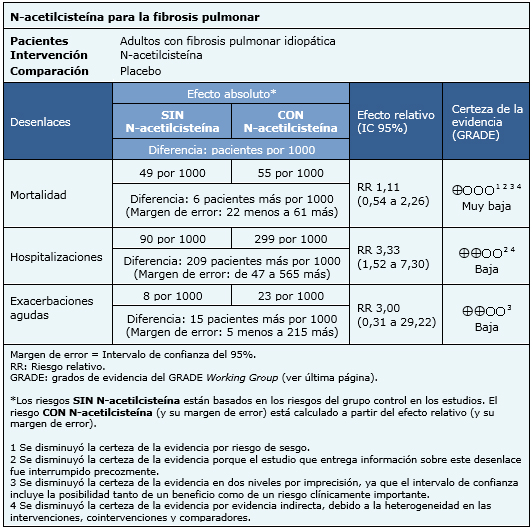

|
A quién se aplica y a quién no se aplica esta evidencia |
|
| Sobre los desenlaces incluidos en este resumen |
|
| Balance riesgo/beneficio y certeza de la evidencia |
|
| Qué piensan los pacientes y sus tratantes |
|
| Consideraciones de recursos |
|
| Diferencias entre este resumen y otras fuentes |
|
| ¿Puede que cambie esta información en el futuro? |
|
Mediante métodos automatizados y colaborativos recopilamos toda la evidencia relevante para la pregunta de interés y la presentamos en una matriz de evidencia.
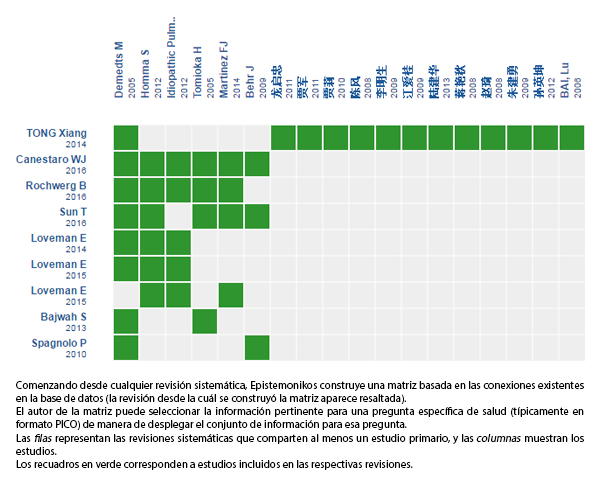
Siga el enlace para acceder a la versión interactiva: N-acetilcisteína para la fibrosis pulmonar idiopática
Si con posterioridad a la publicación de este resumen se publican nuevas revisiones sistemáticas sobre este tema, en la parte superior de la matriz se mostrará un aviso de “nueva evidencia”. Si bien el proyecto contempla la actualización periódica de estos resúmenes, los usuarios están invitados a comentar en Medwave o contactar a los autores mediante correo electrónico si creen que hay evidencia que motive una actualización más rápida.
Luego de crear una cuenta en Epistemonikos, al guardar las matrices recibirá notificaciones automáticas cada vez que exista nueva evidencia que potencialmente responda a esta pregunta. El detalle de los métodos para elaborar este resumen están descritos aquí: http://dx.doi.org/10.5867/medwave.2014.06.5997.
La Fundación Epistemonikos es una organización que busca acercar la información a quienes toman decisiones en salud, mediante el uso de tecnologías. Su principal desarrollo es la base de datos Epistemonikos (www.epistemonikos.org).
Los resúmenes de evidencia siguen un riguroso proceso de revisión por pares interno.
Declaración de conflictos de intereses
Los autores declaran no tener conflictos de intereses con la materia de este artículo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Idiopathic pulmonary fibrosis is a progressive chronic respiratory disease that in final stages carries high mortality. Several treatment options have been proposed, including N-acetylcysteine, but its role is not clearly established. Searching in Epistemonikos database, which is maintained by screening 30 databases, we identified eight systematic reviews including 16 trials addressing the question of this article. We combined the evidence using meta-analysis and generated a summary of findings following the GRADE approach. We concluded N-acetylcysteine might increase the risk of hospitalizations and exacerbations. While it is unclear whether this leads to increased mortality because the certainty of the evidence is very low, in general there is consensus that it should not be used except in the context of a new clinical trial.
 Autores:
Alejandro Jeldres Pulgar[1,2], Gonzalo Labarca[2,3,4]
Autores:
Alejandro Jeldres Pulgar[1,2], Gonzalo Labarca[2,3,4]

Citación: Jeldres Pulgar A, Labarca G. Is N-acetylcysteine effective in the treatment of pulmonary fibrosis?. Medwave 2016;16(Suppl 3):e6555 doi: 10.5867/medwave.2016.6555
Fecha de publicación: 29/9/2016

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011 Mar 15;183(6):788-824.
| CrossRef | PubMed |
Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011 Mar 15;183(6):788-824.
| CrossRef | PubMed | National Institute for Health and Care Excellence. Diagnosis and Management of Suspected Idiopathic Pulmonary Fibrosis. Clinical guideline CG163. London: NICE; 2013.
National Institute for Health and Care Excellence. Diagnosis and Management of Suspected Idiopathic Pulmonary Fibrosis. Clinical guideline CG163. London: NICE; 2013.  Raghu G, Rochwerg B, Zhang Y, Garcia CA, Azuma A, Behr J, et al. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline. Am J Respir Crit Care Med. 2015 Jul 15;192(2):e3-19. | CrossRef | PubMed |
Raghu G, Rochwerg B, Zhang Y, Garcia CA, Azuma A, Behr J, et al. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline. Am J Respir Crit Care Med. 2015 Jul 15;192(2):e3-19. | CrossRef | PubMed | Rochwerg B, Neupane B, Zhang Y, Garcia CC, Raghu G, Richeldi L, et alH. Treatment of idiopathic pulmonary fibrosis: a network meta-analysis. BMC Med. 2016 Feb 3;14:18. | CrossRef | PubMed |
Rochwerg B, Neupane B, Zhang Y, Garcia CC, Raghu G, Richeldi L, et alH. Treatment of idiopathic pulmonary fibrosis: a network meta-analysis. BMC Med. 2016 Feb 3;14:18. | CrossRef | PubMed | Loveman E, Copley VR, Colquitt JL, Scott DA, Clegg AJ, Jones J, et al. The effectiveness and cost-effectiveness of treatments for idiopathic pulmonary fibrosis: systematic review, network meta-analysis and health economic evaluation. BMC Pharmacol Toxicol. 2014 Nov 19;15:63. | CrossRef | PubMed |
Loveman E, Copley VR, Colquitt JL, Scott DA, Clegg AJ, Jones J, et al. The effectiveness and cost-effectiveness of treatments for idiopathic pulmonary fibrosis: systematic review, network meta-analysis and health economic evaluation. BMC Pharmacol Toxicol. 2014 Nov 19;15:63. | CrossRef | PubMed | Loveman E, Copley VR, Colquitt J, Scott DA, Clegg A, Jones J, et al. The clinical effectiveness and cost-effectiveness of treatments for idiopathic pulmonary fibrosis: a systematic review and economic evaluation. Health Technol Assess. 2015 Mar;19(20):i-xxiv, 1-336. | CrossRef | PubMed |
Loveman E, Copley VR, Colquitt J, Scott DA, Clegg A, Jones J, et al. The clinical effectiveness and cost-effectiveness of treatments for idiopathic pulmonary fibrosis: a systematic review and economic evaluation. Health Technol Assess. 2015 Mar;19(20):i-xxiv, 1-336. | CrossRef | PubMed | Bajwah S, Ross JR, Peacock JL, Higginson IJ, Wells AU, Patel AS, et al. Interventions to improve symptoms and quality of life of patients with fibrotic interstitial lung disease: a systematic review of the literature. Thorax. 2013 Sep;68(9):867-79. | CrossRef | PubMed |
Bajwah S, Ross JR, Peacock JL, Higginson IJ, Wells AU, Patel AS, et al. Interventions to improve symptoms and quality of life of patients with fibrotic interstitial lung disease: a systematic review of the literature. Thorax. 2013 Sep;68(9):867-79. | CrossRef | PubMed | Fu XW, Tong X, Liu ST, Fan H. Efficacy of N-acetylcysteine for patients with idiopathic pulmonary fibrosis: a meta-analysis. Chinese Journal of Evidence-Based Medicine 2014; 14(4): 449-455. | CrossRef |
Fu XW, Tong X, Liu ST, Fan H. Efficacy of N-acetylcysteine for patients with idiopathic pulmonary fibrosis: a meta-analysis. Chinese Journal of Evidence-Based Medicine 2014; 14(4): 449-455. | CrossRef | Spagnolo P, Del Giovane C, Luppi F, Cerri S, Balduzzi S, Walters EH, et al. Non-steroid agents for idiopathic pulmonary fibrosis. Cochrane Database Syst Rev. 2010 Sep 8;(9):CD003134. | CrossRef | PubMed |
Spagnolo P, Del Giovane C, Luppi F, Cerri S, Balduzzi S, Walters EH, et al. Non-steroid agents for idiopathic pulmonary fibrosis. Cochrane Database Syst Rev. 2010 Sep 8;(9):CD003134. | CrossRef | PubMed | Loveman E, Copley VR, Scott DA, Colquitt JL, Clegg AJ, O'Reilly KM. Comparing new treatments for idiopathic pulmonary fibrosis--a network meta-analysis. BMC Pulm Med. 2015 Apr 18;15:37.
| CrossRef | PubMed |
Loveman E, Copley VR, Scott DA, Colquitt JL, Clegg AJ, O'Reilly KM. Comparing new treatments for idiopathic pulmonary fibrosis--a network meta-analysis. BMC Pulm Med. 2015 Apr 18;15:37.
| CrossRef | PubMed | Canestaro WJ, Forrester SH, Raghu G, Ho L, Devine BE. Drug Treatment of Idiopathic Pulmonary Fibrosis: Systematic Review and Network Meta-Analysis. Chest. 2016 Mar;149(3):756-66.
| CrossRef | PubMed |
Canestaro WJ, Forrester SH, Raghu G, Ho L, Devine BE. Drug Treatment of Idiopathic Pulmonary Fibrosis: Systematic Review and Network Meta-Analysis. Chest. 2016 Mar;149(3):756-66.
| CrossRef | PubMed | Sun T, Liu J, Zhao de W. Efficacy of N-Acetylcysteine in Idiopathic Pulmonary Fibrosis: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016 May;95(19):e3629. | CrossRef | PubMed |
Sun T, Liu J, Zhao de W. Efficacy of N-Acetylcysteine in Idiopathic Pulmonary Fibrosis: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016 May;95(19):e3629. | CrossRef | PubMed | Chen Feng, Li Songkun, Liuzhang Bo. Shi Fu Lu large doses (N- acetylcysteine) efficacy in the treatment of idiopathic pulmonary fibrosis Analysis. Chinese Journal of Medical Device). 2008;21(7):33-34. | CrossRef |
Chen Feng, Li Songkun, Liuzhang Bo. Shi Fu Lu large doses (N- acetylcysteine) efficacy in the treatment of idiopathic pulmonary fibrosis Analysis. Chinese Journal of Medical Device). 2008;21(7):33-34. | CrossRef | Homma S, Azuma A, Taniguchi H, Ogura T, Mochiduki Y, Sugiyama Y, et al. Efficacy of inhaled N-acetylcysteine monotherapy in patients with early stage idiopathic pulmonary fibrosis. Respirology. 2012 Apr;17(3):467-77. | CrossRef | PubMed |
Homma S, Azuma A, Taniguchi H, Ogura T, Mochiduki Y, Sugiyama Y, et al. Efficacy of inhaled N-acetylcysteine monotherapy in patients with early stage idiopathic pulmonary fibrosis. Respirology. 2012 Apr;17(3):467-77. | CrossRef | PubMed | Tomioka H, Kuwata Y, Imanaka K, Hashimoto K, Ohnishi H, Tada K, et al. A pilot study of aerosolized N-acetylcysteine for idiopathic pulmonary fibrosis. Respirology. 2005 Sep;10(4):449-55. | PubMed |
Tomioka H, Kuwata Y, Imanaka K, Hashimoto K, Ohnishi H, Tada K, et al. A pilot study of aerosolized N-acetylcysteine for idiopathic pulmonary fibrosis. Respirology. 2005 Sep;10(4):449-55. | PubMed | Idiopathic Pulmonary Fibrosis Clinical Research Network, Raghu G, Anstrom KJ, King TE, Lasky JA, Martinez FJ. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med. 2012 May 24;366(21):1968-77. | CrossRef | PubMed |
Idiopathic Pulmonary Fibrosis Clinical Research Network, Raghu G, Anstrom KJ, King TE, Lasky JA, Martinez FJ. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med. 2012 May 24;366(21):1968-77. | CrossRef | PubMed | Idiopathic Pulmonary Fibrosis Clinical Research Network, Martinez FJ, de Andrade JA, Anstrom KJ, King TE Jr, Raghu G. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2014 May 29;370(22):2093-101. | CrossRef | PubMed |
Idiopathic Pulmonary Fibrosis Clinical Research Network, Martinez FJ, de Andrade JA, Anstrom KJ, King TE Jr, Raghu G. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2014 May 29;370(22):2093-101. | CrossRef | PubMed | Behr J, Demedts M, Buhl R, Costabel U, Dekhuijzen RP, Jansen HM, et al. Lung function in idiopathic pulmonary fibrosis--extended analyses of the IFIGENIA trial. Respir Res. 2009 Oct 27;10:101. | CrossRef | PubMed |
Behr J, Demedts M, Buhl R, Costabel U, Dekhuijzen RP, Jansen HM, et al. Lung function in idiopathic pulmonary fibrosis--extended analyses of the IFIGENIA trial. Respir Res. 2009 Oct 27;10:101. | CrossRef | PubMed | Demedts M, Behr J, Buhl R, Costabel U, Dekhuijzen R, et al. High-dose acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2005 Nov 24;353(21):2229-42. | PubMed |
Demedts M, Behr J, Buhl R, Costabel U, Dekhuijzen R, et al. High-dose acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2005 Nov 24;353(21):2229-42. | PubMed | Jia Jun, Chen Bo-Jiang, Pu Qing, Wang Bo. Effects of cyclophosphamide and high-dose N-acetylcysteine in the treatment of idiopathic pulmonary fibrosis. Journal of Clinical Pulmonary Medicine. 2011;16(6). | CrossRef |
Jia Jun, Chen Bo-Jiang, Pu Qing, Wang Bo. Effects of cyclophosphamide and high-dose N-acetylcysteine in the treatment of idiopathic pulmonary fibrosis. Journal of Clinical Pulmonary Medicine. 2011;16(6). | CrossRef | Jia Li, Meng Hongxia. Idiopathic pulmonary fibrosis Clinical Shi Fu Lu combined with prednisone therapy. Medical Information. 2010;5(7):1890-1891. | CrossRef |
Jia Li, Meng Hongxia. Idiopathic pulmonary fibrosis Clinical Shi Fu Lu combined with prednisone therapy. Medical Information. 2010;5(7):1890-1891. | CrossRef | Long Qizhong, Du Juan, Zhang Xianming, Ma Wen, Gui Kun. Curative Effect of Combination of Interferon-γ, N-acetylcysteine and Low Dose Prednisone on Idiopathic Pulmonary Interstitial Fibrosis. Journal of Guiyang Medical College. 2011;36(5):465-469. | CrossRef |
Long Qizhong, Du Juan, Zhang Xianming, Ma Wen, Gui Kun. Curative Effect of Combination of Interferon-γ, N-acetylcysteine and Low Dose Prednisone on Idiopathic Pulmonary Interstitial Fibrosis. Journal of Guiyang Medical College. 2011;36(5):465-469. | CrossRef | Li Mingsheng, Luming Usted, Zheng Xiaolu, Li Jifu, Shi Liya, Chen Yongde. Effects of N-acetylcysteine TGF-β1 and IL-13 on idiopathic pulmonary fibrosis. Chinese Medicine and Pharmacology. 2009;4(9):691-693. | CrossRef |
Li Mingsheng, Luming Usted, Zheng Xiaolu, Li Jifu, Shi Liya, Chen Yongde. Effects of N-acetylcysteine TGF-β1 and IL-13 on idiopathic pulmonary fibrosis. Chinese Medicine and Pharmacology. 2009;4(9):691-693. | CrossRef | Jiang Ai-Gui, Lu Hui-Yu, Duan De-Jun. N- acetylcysteine efficacy associated with idiopathic pulmonary fibrosis was observed with methylprednisolone therapy. Journal of Clinical Medicine in Practice. 2009;(8):69-70. | Link |
Jiang Ai-Gui, Lu Hui-Yu, Duan De-Jun. N- acetylcysteine efficacy associated with idiopathic pulmonary fibrosis was observed with methylprednisolone therapy. Journal of Clinical Medicine in Practice. 2009;(8):69-70. | Link | Lu Jianhua, Gao Jingzhen. Idiopathic pulmonary fibrosis nitric oxide levels in the United acetylcysteine glucocorticoid treatment. Chinese Journal of Laboratory Diagnosis. 2013;17(9):1692-1693. | CrossRef |
Lu Jianhua, Gao Jingzhen. Idiopathic pulmonary fibrosis nitric oxide levels in the United acetylcysteine glucocorticoid treatment. Chinese Journal of Laboratory Diagnosis. 2013;17(9):1692-1693. | CrossRef | Jiang Yanqiu, Jiang Hong. Clinical analysis of 20 cases of N- acetylcysteine treatment of idiopathic pulmonary fibrosis. Chinese Community Doctor. 2008;10(15):43-44. | Link |
Jiang Yanqiu, Jiang Hong. Clinical analysis of 20 cases of N- acetylcysteine treatment of idiopathic pulmonary fibrosis. Chinese Community Doctor. 2008;10(15):43-44. | Link | Zhao Qi, Lu Fuzhen, Mao Ziyuan. The N-acetyl Cysteine Treatment Idiopathic Pulmomary Fibrosis Curative Effect Observation. Heilongjiang Medical Journal. 2008;32(1):30-31. | CrossRef |
Zhao Qi, Lu Fuzhen, Mao Ziyuan. The N-acetyl Cysteine Treatment Idiopathic Pulmomary Fibrosis Curative Effect Observation. Heilongjiang Medical Journal. 2008;32(1):30-31. | CrossRef | Zhu Jianyong, Zeng Yuqin, Yuan Liangjun, Chen Gong, Wang Yonglan, Hu Ke. Study on the Treatment of Idiopathic Pulmonary Fibrosis with Prednisone, N-acetylcysteine Combined Captopril. Journal of Yunyang Medical College. 2009;28(6):582-584. | Link |
Zhu Jianyong, Zeng Yuqin, Yuan Liangjun, Chen Gong, Wang Yonglan, Hu Ke. Study on the Treatment of Idiopathic Pulmonary Fibrosis with Prednisone, N-acetylcysteine Combined Captopril. Journal of Yunyang Medical College. 2009;28(6):582-584. | Link | Sun Yingkun, Zhao Qi, Shao Yuxia. Clinical analysis of treatment of idiopathic pulmonary fibrosis with N-acetylcysteine. Journal of Harbin Medical University. 2012;46(5):465-467.
Sun Yingkun, Zhao Qi, Shao Yuxia. Clinical analysis of treatment of idiopathic pulmonary fibrosis with N-acetylcysteine. Journal of Harbin Medical University. 2012;46(5):465-467.  Bai, Lu, Wu, Xiao-Mei. Effect of High Dose Fluimucil on the Pulmonary Function of Patients with Idiopathic Pulmonary Fibrosis. Chinese Journal of Rehabilitation Theory and Practice. 2006;12(7):618-619. | Link |
Bai, Lu, Wu, Xiao-Mei. Effect of High Dose Fluimucil on the Pulmonary Function of Patients with Idiopathic Pulmonary Fibrosis. Chinese Journal of Rehabilitation Theory and Practice. 2006;12(7):618-619. | Link | Bradley B, Branley HM, Egan JJ, Greaves MS, Hansell DM, Harrison NK, et al. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax. 2008 Sep;63 Suppl 5:v1-58. | CrossRef | PubMed |
Bradley B, Branley HM, Egan JJ, Greaves MS, Hansell DM, Harrison NK, et al. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax. 2008 Sep;63 Suppl 5:v1-58. | CrossRef | PubMed | National Institute for Health and Clinical Excellence ) Idiopathic pulmonary fibrosis in adults: diagnosis and management. NICE guideline (CG163). 2013 [on line] | Link |
National Institute for Health and Clinical Excellence ) Idiopathic pulmonary fibrosis in adults: diagnosis and management. NICE guideline (CG163). 2013 [on line] | Link |