 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La infección por VIH es una epidemia a nivel mundial. El uso de terapia antirretroviral ha cambiado el pronóstico de estos pacientes, sin embargo existe controversia sobre el mejor momento para iniciarla, especialmente en pacientes con recuentos de CD4 mayores o iguales a 350 células/mm3. Utilizando la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en 30 bases de datos, identificamos dos revisiones sistemáticas que en conjunto incluyen cuatro estudios aleatorizados. Realizamos un metanálisis y tablas de resumen de los resultados utilizando el método GRADE. Concluimos que el uso temprano de terapia antirretroviral probablemente disminuye la mortalidad, el riesgo de enfermedades oportunistas y de tuberculosis, aunque aumenta el riesgo de efectos adversos importantes.
El virus de la inmunodeficiencia humana (VIH) es una epidemia a nivel mundial. El inicio de terapia antirretroviral cambió el pronóstico de esta enfermedad, reduciendo la morbimortalidad de manera clara y consistente. Existe suficiente consenso en que el tratamiento antirretroviral debe iniciarse de manera inmediata en pacientes en etapas B y C, con recuentos de CD4 menores o iguales a 350 y en casos especiales como embarazadas, pacientes con coinfecciones como virus hepatitis B o C, o tuberculosis, o en mayores de 50 años. Sin embargo, no está claro cuál es el efecto del inicio temprano en pacientes con recuentos de CD4 mayores a 350.
Utilizamos la base de datos Epistemonikos, la cual es mantenida mediante búsquedas en 30 bases de datos, para identificar revisiones sistemáticas y sus estudios primarios incluidos. Con esta información generamos un resumen estructurado, siguiendo un formato preestablecido, que incluye mensajes clave, un resumen del conjunto de evidencia (presentado como matriz de evidencia en Epistemonikos), metanálisis del total de los estudios, tablas de resumen de resultados con el método GRADE, y tabla de otras consideraciones para la toma de decisión.
|
Mensajes clave
|
|
Cuál es la evidencia. |
Encontramos dos revisiones sistemáticas [1],[2], que consideran 23 estudios primarios reportados en 25 referencias [3],[4],[5],[6],[7],[8],[9],[10],[11],[12],[13], [14],[15],[16],[17],[18],[19],[20],[21],[22],[23],[24], [25],[26],[27], incluyendo cuatro estudios controlados aleatorizados reportados en seis referencias [6],[11],[12], [13],[16],[20]. Esta tabla y el resumen en general se basan en los últimos. |
|
Qué tipo de pacientes incluyeron los estudios |
Dos estudios se realizaron en múltiples países [6],[11], uno de ellos en Haití [13] y uno en Estados Unidos [16]. Todos los pacientes eran mayores de 18 años, salvo en un estudio que incluyó pacientes mayores a 13 años [11]. Todos los estudios incluyeron pacientes VIH(+) naive a tratamiento, con voluntad de ser tratados. Un estudio incluyó pacientes con CD4 mayor o igual a 350 [11], uno con CD4 entre 200 y 350 [13], uno con CD4 entre 350 y 500 [6] y otro con CD4 mayor o igual a 350 [16]. La media de CD4 de los estudios fue de 337. Todos los estudios excluyeron pacientes embarazadas, en periodo de lactancia, en etapa SIDA o con uso previo de terapia antiretroviral. Dos estudios incluyeron dentro de sus criterios de inclusión, tener parámetros de laboratorio básico aceptables [6],[16]. |
|
Qué tipo de intervenciones incluyeron los estudios |
Las intervenciones fueron las siguientes:
|
|
Qué tipo de desenlaces midieron |
Los desenlaces medidos en los estudios primarios fueron:
|
La información sobre los efectos del inicio precoz de terapia antirretroviral en pacientes VIH(+) con recuentos CD4 mayor o igual a 350 está basada en cuatro estudios aleatorizados [6],[11],[13],[16], que incluyen 4686 pacientes. Dos estudios [6],[11] midieron el desenlace enfermedades oportunistas, tres estudios [6],[11],[13] el desenlace tuberculosis, tres estudios [6],[11],[13] el desenlace mortalidad y dos estudios [6],[13] midieron el desenlace efectos adversos grado 3 y 4.
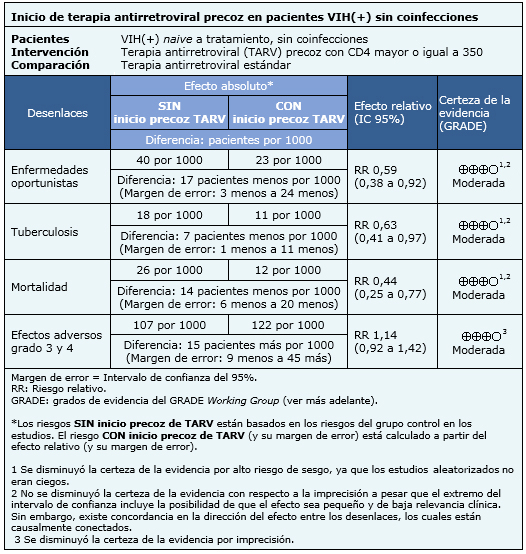

|
A quién se aplica y a quién no se aplica esta evidencia |
|
| Sobre los desenlaces incluidos en este resumen |
|
| Balance riesgo/beneficio y certeza de la evidencia |
|
| Consideraciones de recursos |
|
|
Diferencias entre este resumen y otras fuentes |
|
| ¿Puede que cambie esta información en el futuro? |
|
Mediante métodos automatizados y colaborativos recopilamos toda la evidencia relevante para la pregunta de interés y la presentamos en una matriz de evidencia.

Siga el enlace para acceder a la versión interactiva Inicio precoz de terapia antirretroviral en adultos VIH (+) sin coinfecciones
Si con posterioridad a la publicación de este resumen se publican nuevas revisiones sistemáticas sobre este tema, en la parte superior de la matriz se mostrará un aviso de “nueva evidencia”. Si bien el proyecto contempla la actualización periódica de estos resúmenes, los usuarios están invitados a comentar en Medwave o contactar a los autores mediante correo electrónico si creen que hay evidencia que motive una actualización más rápida.
Luego de crear una cuenta en Epistemonikos, al guardar las matrices recibirá notificaciones automáticas cada vez que exista nueva evidencia que potencialmente responda a esta pregunta. El detalle de los métodos para elaborar este resumen están descritos aquí: http://dx.doi.org/10.5867/medwave.2014.06.5997.
La Fundación Epistemonikos es una organización que busca acercar la información a quienes toman decisiones en salud, mediante el uso de tecnologías. Su principal desarrollo es la base de datos Epistemonikos (www.epistemonikos.org).
Los resúmenes de evidencia siguen un riguroso proceso de revisión por pares interno.
Declaración de conflictos de intereses
Los autores declaran no tener conflictos de intereses con la materia de este artículo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

HIV infection is a worldwide epidemic. Antiretroviral therapy has dramatically changed the outcome of the disease but there is still controversy about the best time to initiate it, especially in patients with CD4 counts over 350 cells/µL. Searching in Epistemonikos database, which is maintained by screening 30 databases, we identified two systematic reviews including four pertinent randomized controlled trials overall. We concluded early initiation of antiretroviral therapy probably reduces mortality, risk of opportunistic infections and tuberculosis, but increases the risk of important adverse effects.
 Autores:
Verónica Chauriye[1,2], Ximena Monsalve[1,2,3]
Autores:
Verónica Chauriye[1,2], Ximena Monsalve[1,2,3]

Citación: Chauriye V, Monsalve X. Is early antiretroviral therapy initiation useful in HIV(+) adults without co-infections?. Medwave 2015;15(Suppl 3):e6326 doi: 10.5867/medwave.2015.6326
Fecha de publicación: 2/12/2015

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Siegfried N, Uthman OA, Rutherford GW. Optimal time for initiation of antiretroviral therapy in asymptomatic, HIV-infected, treatment-naive adults. Cochrane Database Syst Rev. 2010 Mar 17;(3):CD008272. | CrossRef | PubMed |
Siegfried N, Uthman OA, Rutherford GW. Optimal time for initiation of antiretroviral therapy in asymptomatic, HIV-infected, treatment-naive adults. Cochrane Database Syst Rev. 2010 Mar 17;(3):CD008272. | CrossRef | PubMed | Anglemyer A, Rutherford GW, Easterbrook PJ, Horvath T, Vitória M, Jan M, et al. Early initiation of antiretroviral therapy in HIV-infected adults and adolescents: a systematic review. AIDS. 2014 Mar;28 Suppl 2:S105-18. | CrossRef | PubMed |
Anglemyer A, Rutherford GW, Easterbrook PJ, Horvath T, Vitória M, Jan M, et al. Early initiation of antiretroviral therapy in HIV-infected adults and adolescents: a systematic review. AIDS. 2014 Mar;28 Suppl 2:S105-18. | CrossRef | PubMed | Ahdieh-Grant L, Yamashita TE, Phair JP, Detels R, Wolinsky SM, Margolick JB, et al. When to initiate highly active antiretroviral therapy: a cohort approach. Am J Epidemiol. 2003 Apr 15;157(8):738-46. | PubMed |
Ahdieh-Grant L, Yamashita TE, Phair JP, Detels R, Wolinsky SM, Margolick JB, et al. When to initiate highly active antiretroviral therapy: a cohort approach. Am J Epidemiol. 2003 Apr 15;157(8):738-46. | PubMed | Babiker A, Darbyshire J, Pezzotti P, Porter K, Prins M, Sabin C, et al. Short-term CD4 cell response after highly active antiretroviral therapy initiated at different times from seroconversion in 1,500 seroconverters. J Acquir Immune Defic Syndr. 2003 Mar 1;32(3):303-10. | PubMed |
Babiker A, Darbyshire J, Pezzotti P, Porter K, Prins M, Sabin C, et al. Short-term CD4 cell response after highly active antiretroviral therapy initiated at different times from seroconversion in 1,500 seroconverters. J Acquir Immune Defic Syndr. 2003 Mar 1;32(3):303-10. | PubMed | Chêne G, Sterne JA, May M, Costagliola D, Ledergerber B, Phillips AN, et al. Prognostic importance of initial response in HIV-1 infected patients starting potent antiretroviral therapy: analysis of prospective studies. Lancet. 2003 Aug 30;362(9385):679-86. | PubMed |
Chêne G, Sterne JA, May M, Costagliola D, Ledergerber B, Phillips AN, et al. Prognostic importance of initial response in HIV-1 infected patients starting potent antiretroviral therapy: analysis of prospective studies. Lancet. 2003 Aug 30;362(9385):679-86. | PubMed | Cohen MS, Chen YQ, McCauley M, Gamble T, Hosseinipour MC, Kumarasamy N, et al. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med. 2011 Aug 11;365(6):493-505. | CrossRef | PubMed |
Cohen MS, Chen YQ, McCauley M, Gamble T, Hosseinipour MC, Kumarasamy N, et al. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med. 2011 Aug 11;365(6):493-505. | CrossRef | PubMed | HIV-CAUSAL Collaboration, Cain LE, Logan R, Robins JM, Sterne JA, et al. When to initiate combined antiretroviral therapy to reduce mortality and AIDS-defining illness in HIV-infected persons in developed countries: an observational study. Ann Intern Med. 2011 Apr 19;154(8):509-15. | CrossRef | PubMed |
HIV-CAUSAL Collaboration, Cain LE, Logan R, Robins JM, Sterne JA, et al. When to initiate combined antiretroviral therapy to reduce mortality and AIDS-defining illness in HIV-infected persons in developed countries: an observational study. Ann Intern Med. 2011 Apr 19;154(8):509-15. | CrossRef | PubMed | HIV-CAUSAL Collaboration, Ray M, Logan R, Sterne JA, Hernández-Díaz S, Robins JM, et al. The effect of combined antiretroviral therapy on the overall mortality of HIV-infected individuals. AIDS. 2010 Jan 2;24(1):123-37. | CrossRef | PubMed |
HIV-CAUSAL Collaboration, Ray M, Logan R, Sterne JA, Hernández-Díaz S, Robins JM, et al. The effect of combined antiretroviral therapy on the overall mortality of HIV-infected individuals. AIDS. 2010 Jan 2;24(1):123-37. | CrossRef | PubMed | Cozzi Lepri A, Phillips AN, d'Arminio Monforte A, Castelli F, Antinori A, de Luca A, et al. When to start highly active antiretroviral therapy in chronically HIV-infected patients: evidence from the ICONA study. AIDS. 2001 May 25;15(8):983-90. | PubMed |
Cozzi Lepri A, Phillips AN, d'Arminio Monforte A, Castelli F, Antinori A, de Luca A, et al. When to start highly active antiretroviral therapy in chronically HIV-infected patients: evidence from the ICONA study. AIDS. 2001 May 25;15(8):983-90. | PubMed | Egger M, May M, Chêne G, Phillips AN, Ledergerber B, Dabis F, et al. Prognosis of HIV-1-infected patients starting highly active antiretroviral therapy: a collaborative analysis of prospective studies. Lancet. 2002 Jul 13;36(9327):119-29. | PubMed |
Egger M, May M, Chêne G, Phillips AN, Ledergerber B, Dabis F, et al. Prognosis of HIV-1-infected patients starting highly active antiretroviral therapy: a collaborative analysis of prospective studies. Lancet. 2002 Jul 13;36(9327):119-29. | PubMed | Strategies for Management of Antiretroviral Therapy (SMART) Study Group, El-Sadr WM, Lundgren J, Neaton JD, Gordin F, Abrams D, et al. CD4+ count-guided interruption of antiretroviral treatment. N Engl J Med. 2006 Nov 30;355(22):2283-96. | PubMed |
Strategies for Management of Antiretroviral Therapy (SMART) Study Group, El-Sadr WM, Lundgren J, Neaton JD, Gordin F, Abrams D, et al. CD4+ count-guided interruption of antiretroviral treatment. N Engl J Med. 2006 Nov 30;355(22):2283-96. | PubMed | Strategies for Management of Antiretroviral Therapy (SMART) Study Group, Emery S, Neuhaus JA, Phillips AN, Babiker A, Cohen CJ, Get al. Major clinical outcomes in antiretroviral therapy (ART)-naive participants and in those not receiving ART at baseline in the SMART study. J Infect Dis. 2008 Apr 15;197(8):1133-44.
| CrossRef | PubMed |
Strategies for Management of Antiretroviral Therapy (SMART) Study Group, Emery S, Neuhaus JA, Phillips AN, Babiker A, Cohen CJ, Get al. Major clinical outcomes in antiretroviral therapy (ART)-naive participants and in those not receiving ART at baseline in the SMART study. J Infect Dis. 2008 Apr 15;197(8):1133-44.
| CrossRef | PubMed | Fitzgerald D. A randomized clinical trial of early versus strandard antiretroviral therapy for HIV-infected patients with a CD4 T cell count of 200 - 350 cells/ml (CIPRA HT 001). International AIDS Society Conference, Cape Town; 2009.
Fitzgerald D. A randomized clinical trial of early versus strandard antiretroviral therapy for HIV-infected patients with a CD4 T cell count of 200 - 350 cells/ml (CIPRA HT 001). International AIDS Society Conference, Cape Town; 2009.  Gallant JE, Hulbert E, Harley C. Health outcomes associated with the timing of antiretroviral therapy initiation. 6th IAS Conference on HIV Pathogenesis and Treatment Rome, Italy; 2011: Abstract no. CDB320.
Gallant JE, Hulbert E, Harley C. Health outcomes associated with the timing of antiretroviral therapy initiation. 6th IAS Conference on HIV Pathogenesis and Treatment Rome, Italy; 2011: Abstract no. CDB320.  García F, de Lazzari E, Plana M, Castro P, Mestre G, Nomdedeu M, et al. Long-term CD4+ T-cell response to highly active antiretroviral therapy according to baseline CD4+ T-cell count. J Acquir Immune Defic Syndr. 2004 Jun 1;36(2):702-13. | PubMed |
García F, de Lazzari E, Plana M, Castro P, Mestre G, Nomdedeu M, et al. Long-term CD4+ T-cell response to highly active antiretroviral therapy according to baseline CD4+ T-cell count. J Acquir Immune Defic Syndr. 2004 Jun 1;36(2):702-13. | PubMed | Grant P, Tierney C, Katzenstein D. Association of baseline viral load, CD4 count, and Week 4 virologic response (VR) with virologic failure (VF) in ACTG study A5202. 18th Conference on Retroviruses and Opportunistic Infections, Boston, Massachusetts; 2011: Abstract 535.
Grant P, Tierney C, Katzenstein D. Association of baseline viral load, CD4 count, and Week 4 virologic response (VR) with virologic failure (VF) in ACTG study A5202. 18th Conference on Retroviruses and Opportunistic Infections, Boston, Massachusetts; 2011: Abstract 535.  Gras L, Kesselring AM, Griffin JT, van Sighem AI, Fraser C, Ghani AC, et al. CD4 cell counts of 800 cells/mm3 or greater after 7 years of highly active antiretroviral therapy are feasible in most patients starting with 350 cells/mm3 or greater. J Acquir Immune Defic Syndr. 2007 Jun 1;45(2):183-92. | PubMed |
Gras L, Kesselring AM, Griffin JT, van Sighem AI, Fraser C, Ghani AC, et al. CD4 cell counts of 800 cells/mm3 or greater after 7 years of highly active antiretroviral therapy are feasible in most patients starting with 350 cells/mm3 or greater. J Acquir Immune Defic Syndr. 2007 Jun 1;45(2):183-92. | PubMed | Kitahata MM, Gange SJ, Abraham AG, Merriman B, Saag MS, Justice AC, et al. Effect of early versus deferred antiretroviral therapy for HIV on survival. N Engl J Med. 2009 Apr 30;360(18):1815-26. | CrossRef | PubMed |
Kitahata MM, Gange SJ, Abraham AG, Merriman B, Saag MS, Justice AC, et al. Effect of early versus deferred antiretroviral therapy for HIV on survival. N Engl J Med. 2009 Apr 30;360(18):1815-26. | CrossRef | PubMed | Krishnan S, Schouten JT, Jacobson DL, Benson CA, Collier AC, Koletar SL, et al. Incidence of non-AIDS-defining cancer in antiretroviral treatment-naïve subjects after antiretroviral treatment initiation: an ACTG longitudinal linked randomized trials analysis. Oncology. 2011;80(1-2):42-9. | CrossRef | PubMed |
Krishnan S, Schouten JT, Jacobson DL, Benson CA, Collier AC, Koletar SL, et al. Incidence of non-AIDS-defining cancer in antiretroviral treatment-naïve subjects after antiretroviral treatment initiation: an ACTG longitudinal linked randomized trials analysis. Oncology. 2011;80(1-2):42-9. | CrossRef | PubMed | Strategies for Management of Antiretroviral Therapy (SMART) Study Group, Lundgren JD, Babiker A, El-Sadr W, Emery S, Grund B, et al. Inferior clinical outcome of the CD4+ cell count-guided antiretroviral treatment interruption strategy in the SMART study: role of CD4+ Cell counts and HIV RNA levels during follow-up. J Infect Dis. 2008 Apr 15;197(8):1145-55. | CrossRef | PubMed |
Strategies for Management of Antiretroviral Therapy (SMART) Study Group, Lundgren JD, Babiker A, El-Sadr W, Emery S, Grund B, et al. Inferior clinical outcome of the CD4+ cell count-guided antiretroviral treatment interruption strategy in the SMART study: role of CD4+ Cell counts and HIV RNA levels during follow-up. J Infect Dis. 2008 Apr 15;197(8):1145-55. | CrossRef | PubMed | Merito M, Pezzotti P; ICONA Study Group. Comparing costs and effectiveness of different starting points for highly active antiretroviral therapy in HIV-positive patients. Evidence from the ICONA cohort. Eur J Health Econ. 2006 Mar;7(1):30-6. | PubMed |
Merito M, Pezzotti P; ICONA Study Group. Comparing costs and effectiveness of different starting points for highly active antiretroviral therapy in HIV-positive patients. Evidence from the ICONA cohort. Eur J Health Econ. 2006 Mar;7(1):30-6. | PubMed | Moore DM, Harris R, Lima V, Hogg B, May M, Yip B, et al. Effect of baseline CD4 cell counts on the clinical significance of short-term immunologic response to antiretroviral therapy in individuals with virologic suppression. J Acquir Immune Defic Syndr. 2009 Nov 1;52(3):357-63. | CrossRef | PubMed |
Moore DM, Harris R, Lima V, Hogg B, May M, Yip B, et al. Effect of baseline CD4 cell counts on the clinical significance of short-term immunologic response to antiretroviral therapy in individuals with virologic suppression. J Acquir Immune Defic Syndr. 2009 Nov 1;52(3):357-63. | CrossRef | PubMed | Opravil M, Ledergerber B, Furrer H, Hirschel B, Imhof A, Gallant S, et al. Clinical efficacy of early initiation of HAART in patients with asymptomatic HIV infection and CD4 cell count > 350 x 10(6) /l. AIDS. 2002 Jul 5;16(10):1371-81. | PubMed |
Opravil M, Ledergerber B, Furrer H, Hirschel B, Imhof A, Gallant S, et al. Clinical efficacy of early initiation of HAART in patients with asymptomatic HIV infection and CD4 cell count > 350 x 10(6) /l. AIDS. 2002 Jul 5;16(10):1371-81. | PubMed | Palella FJ Jr, Deloria-Knoll M, Chmiel JS, Moorman AC, Wood KC, Greenberg AE, et al. Survival benefit of initiating
antiretroviral therapy in HIV-infected persons in different CD4+ cell strata. Ann Intern Med. 2003 Apr 15;138(8):620-6.
| PubMed |
Palella FJ Jr, Deloria-Knoll M, Chmiel JS, Moorman AC, Wood KC, Greenberg AE, et al. Survival benefit of initiating
antiretroviral therapy in HIV-infected persons in different CD4+ cell strata. Ann Intern Med. 2003 Apr 15;138(8):620-6.
| PubMed | Phillips AN, Staszewski S, Weber R, Kirk O, Francioli P, Miller V, et al. HIV viral load response to antiretroviral therapy according to the baseline CD4 cell count and viral load. JAMA. 2001 Nov 28;286(20):2560-7. | PubMed |
Phillips AN, Staszewski S, Weber R, Kirk O, Francioli P, Miller V, et al. HIV viral load response to antiretroviral therapy according to the baseline CD4 cell count and viral load. JAMA. 2001 Nov 28;286(20):2560-7. | PubMed | Plettenberg A, Brockmeyer NH, Haastert B, Michalik C, Dupke S, Schewe K, et al. Impact of earlier HAART initiation on the immune status and clinical course of treated patients on the basis of cohort data of the German Competence Network for HIV/AIDS. Infection. 2011 Feb;39(1):3-12. | CrossRef | PubMed |
Plettenberg A, Brockmeyer NH, Haastert B, Michalik C, Dupke S, Schewe K, et al. Impact of earlier HAART initiation on the immune status and clinical course of treated patients on the basis of cohort data of the German Competence Network for HIV/AIDS. Infection. 2011 Feb;39(1):3-12. | CrossRef | PubMed | Writing Committee for the CASCADE Collaboration. Timing of HAART initiation and clinical outcomes in human immunodeficiency virus type 1 seroconverters. Arch Intern Med. 2011 Sep 26;171(17):1560-9. | CrossRef | PubMed |
Writing Committee for the CASCADE Collaboration. Timing of HAART initiation and clinical outcomes in human immunodeficiency virus type 1 seroconverters. Arch Intern Med. 2011 Sep 26;171(17):1560-9. | CrossRef | PubMed | When To Start Consortium, Sterne JA, May M, Costagliola D, de Wolf F, Phillips AN, et al. Timing of initiation of antiretroviral therapy in AIDS-free HIV-1-infected patients: a collaborative analysis of 18 HIV cohort studies. Lancet. 2009 Apr 18;373(9672):1352-63. | CrossRef | PubMed |
When To Start Consortium, Sterne JA, May M, Costagliola D, de Wolf F, Phillips AN, et al. Timing of initiation of antiretroviral therapy in AIDS-free HIV-1-infected patients: a collaborative analysis of 18 HIV cohort studies. Lancet. 2009 Apr 18;373(9672):1352-63. | CrossRef | PubMed | Adolescents PoAGfAa. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Bethesda (MD): Department of Health and Human Services (DHHS); 2014. | Link |
Adolescents PoAGfAa. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Bethesda (MD): Department of Health and Human Services (DHHS); 2014. | Link |