 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
En 2013 escribimos acerca del perjuicio, desperdicio y engaño generado a partir de las conductas de la industria farmacéutica, al ocultar los datos brutos y los Clinical Study Reports (CSR) de los ojos de las autoridades cuando solicitan la patente de comercialización. Describimos el caso de Tamiflu (Roche), medicamento que ha sido ampliamente usado en nuestra población y profusamente indicado por prescriptores. También ha sido comprado por autoridades sanitarias, acarreando un gran costo a los países de la región. En esta editorial haremos una cronología sobre cómo se fue instalando la idea de usar inhibidores de la neuroaminidasa para la profilaxis y después (...)
En 2013 escribimos acerca del perjuicio, desperdicio y engaño generado a partir de las conductas de la industria farmacéutica, al ocultar los datos brutos y los Clinical Study Reports (CSR) de los ojos de las autoridades cuando solicitan la patente de comercialización [1].Describimos el caso de Tamiflu (Roche), medicamento que ha sido ampliamente usado en nuestra población y profusamente indicado por prescriptores. También ha sido comprado por autoridades sanitarias, acarreando un gran costo a los países de la región.
En esta editorial haremos una cronología sobre cómo se fue instalando la idea de usar inhibidores de la neuroaminidasa para la profilaxis y tratamiento de la influenza, desde las primeras recomendaciones entusiastas hasta llegar a la revisión sistemática publicada el mes pasado en BMJ. Revisión que fue realizada sobre los datos brutos de los pacientes, tal como fueron entregados por Roche y la European Medicines Agency (EMA), a los investigadores encabezados por Tom Jefferson. Esta revisión sistemática cierra el tema al concluir que oseltamivir no sirve para la profilaxis y el tratamiento de la influenza [2]. También abordaremos las implicancias que esto tiene respecto de la naturaleza de la base de evidencia, sobre la cual se toman decisiones que afectan a los pacientes y cómo se abren nuevos desafíos en cuanto a la forma en que se conducen las revisiones sistemáticas.
La cronología es elocuente al dejar en evidencia cómo se puede implantar un curso terapéutico en el ámbito de la atención en salud que, si bien no estaba fundado en evidencia científica sólida, se convirtió en un verdadero mantra de la práctica clínica. Después de más de diez años de gasto y riesgo inútiles, la recomendación de usar inhibidores de la neuroaminidasa como profilaxis (ciclos de seis a ocho semanas) y como tratamiento de la influenza estacional sintomática (tratamientos de una semana), ha quedado definitivamente desacreditada. Esta historia ha de servir para motivarnos a afinar nuestra capacidad de análisis crítico y de sano escepticismo, que siempre deben estar disponibles para mejorar el cuidado de nuestros pacientes, principal norte del accionar médico. Los estados de resultados de las grandes corporaciones farmacéuticas no deben ni guiar ni influenciar nuestra conducta terapéutica.
Tamiflu fue desarrollado durante la década de los noventa y fue autorizado por la Food and Drug Administration (FDA) en 1999. Pero no fue sino hasta 2009 cuando se masificó su uso a raíz de la pandemia H1N1. Se llegó a tal nivel de convencimiento colectivo acerca de su supuesta efectividad para reducir los días de afectación por gripe, así como las complicaciones respiratorias y los días de estadía hospitalaria, que se consideró casi una negligencia el no indicar Tamiflu y no tomar Tamiflu como profilaxis.
Aquí presentamos una pincelada de esta historia, partiendo donde lo dejó el tristemente célebre estudio de Kaiser [3]: un análisis agrupado de diez ensayos clínicos, sólo dos de los cuales habían sido publicados, todos financiados por Roche. Este estudio constituyó la base de evidencia, distorsionada como ya sabemos, de todo lo que se describe a continuación.
En 2003 se publicó una revisión sistemática sobre el uso de oseltamivir y zanamivir [4]. Este estudio concluía que el tratamiento disminuía la duración de los síntomas entre 0,4 y un día en la población con intención de tratar, y se asociaba a una reducción relativa en la probabilidad de complicación con indicación de antibióticos de 29% a 43% si se administraba antes de las primeras 48 horas del inicio del cuadro. No se encontró evidencia de efectividad en complicaciones mayores que requirieran hospitalización. En el desenlace primario “prevención” para oseltamivir, la revisión incluyó nueve ensayos clínicos aleatorizados y para el desenlace “tratamiento”, cuatro. La revisión no analizó la existencia de sesgo de publicación (cuando se publican más los estudios con resultados favorables que los no favorables), ni las fuentes de financiamiento de los ensayos incluidos. Entre los autores figura un profesor de infectología con fuertes lazos con la industria farmacéutica, especialmente con GlaxoSmithKline (fabricante de Relenza, zanamivir) y Roche (fabricante de Tamiflu).
En los años siguientes, un consenso sueco y otro alemán recomendaron los inhibidores de la neuroaminidasa como primera línea de tratamiento en la influenza [5],[6]. De ahí en adelante fueron apareciendo artículos de revisión narrativa que hacían mención a las recomendaciones del National Institute for Health and Care Excellence (NICE) y a la efectividad del uso de estos medicamentos como profilaxis y tratamiento [7]. Sin embargo, los análisis económicos eran contradictorios [8],[9]. A pesar de no existir evidencia publicada alguna hasta ese momento sobre efectividad de oseltamivir y zanamivir en personas de edad avanzada o niños, la recomendación de su uso fue incorporada en diferentes directrices clínicas y documentos de consenso en Europa y Estados Unidos [10],[11]. En el contexto de la gripe aviar H5N1 se llegó al punto de decir que los inhibidores de la neuroaminidasa serían “altamente efectivos” [12] y la discusión giraba en torno a dosificaciones y combinaciones [13] sin cuestionar efectividad y seguridad, lo que se daba por descontado.
El 11 de junio de 2009 la Organización Mundial de la Salud decretó alerta seis para la gripe por influenzavirus A subtipo H1N1. Ese mismo año aparece una revisión sistemática y evaluación económica sobre oseltamivir y zanamivir del NICE [14], en donde se afirma que el primero es efectivo en prevenir influenza sintomática con confirmación de laboratorio, particularmente en personas de edad avanzada y de mayor riesgo (RR 0,08; IC 95%: 0,01-0,63); seis estudios fueron incluidos para fundamentar esta conclusión. En cuanto a profilaxis postexposición en hogares, también se decía que eran efectivos (RR 0,19; IC 95%: 0,08-0,45). El estudio concluyó que había “evidencia limitada” para establecer la efectividad de la intervención en prevenir complicaciones, hospitalización y en acortar la duración del cuadro. No pudo concluir nada respecto de costo-efectividad de la intervención por escasez de evidencia de buena calidad.
No obstante, ese fue el año en que las grandes guías clínicas le dijeron al mundo que había que incluir oseltamivir dentro del listado de medicamentos esenciales. Esto llevó a muchos gobiernos a gastar sumas siderales en la compra de Tamiflu, fármaco que llegó a desabastecerse producto de la verdadera histeria colectiva que se desató después de la declaración de pandemia por influenza A.
Sobre la base de una metodología de consenso por expertos altamente cuestionada, la Organización Mundial de la Salud emitió su directriz para el manejo farmacológico de la influenza pandémica H1N1 en que -según criterios GRADE (Grading of Recommendations Assessment, Development and Evaluation) - para el tratamiento de pacientes con sospecha o confirmación de infección por influenza pandémica (H1N1) con presentación clínica severa o progresiva, se recomendaba tratar estos pacientes con oseltamivir [15]. Calificaron esta recomendación como fuerte (strong), con evidencia de baja calidad. En virtud de este tipo de recomendación, la conducta clínica debe ser iniciación del tratamiento tan pronto sea posible. La directriz indicó que la recomendación debía ser aplicada a todos los grupos de pacientes, incluyendo mujeres embarazadas, niños pequeños menores de cinco años de edad y recién nacidos.
Después de esta afirmación tan categórica proveniente de la más alta autoridad sanitaria mundial, resultaría improbable discrepar. Siguieron las publicaciones más o menos en la misma línea [16],[17],[18],[19] y guías clínicas como la de Centers for Disease Control (CDC) y otros [20],[21], que continuaban con el mismo mantra, grados más, grados menos.
En este contexto, ¿quién osaría contradecir lo que literalmente todo el mundo estaba diciendo? Pues, el Grupo de Infecciones Respiratorias Agudas de Cochrane (Cochrane’s Acute Respiratory Infections Group). En 2006 aparece la primera revisión sistemática que concluye “debido a su baja efectividad, no se deberían usar los inhibidores de la neuroaminidasa para el manejo de la influenza estacional, y en epidemia o pandemia, se deberían asociar a otras medidas de salud pública” [22]. En 2009 los mismos autores concluyen que “los inhibidores de la neuroaminidasa presentan una efectividad modesta frente a los síntomas de influenza…” [16] y fue este estudio el que desencadenó un proceso que duró cinco años hasta llegar a fecha presente, en que ese mismo grupo de investigadores lideró una verdadera cruzada para conseguir los datos brutos de los pacientes de los estudios Roche, tanto los publicados como los no publicados.
¿Y qué dicen las recomendaciones actuales o más recientes?
Se sigue insistiendo en que el tratamiento antiviral rápidamente instituido reduce morbilidad y mortalidad [23]. Del mismo modo, los estudios observacionales sugieren que oseltamivir podría reducir la mortalidad, la hospitalización y la duración de los síntomas comparado con ningún otro tratamiento [24]. El Ministerio de Salud de Chile, hasta hace pocos días, también decía que en influenza “se pueden usar antivirales”, pero la página en que estaba publicada esta recomendación se encuentra retirada al momento de escribir esta editorial.
Y así llegamos a abril de 2014, cuando aparece la última revisión Cochrane sobre oseltamivir, pero esta vez sobre datos brutos [2]. El objetivo del estudio fue evaluar los potenciales beneficios o perjuicios de oseltamivir sobre la base de una revisión exhaustiva de todos los CSR de los ensayos clínicos aleatorizados y de los comentarios de las entidades regulatorias. El diseño es una revisión sistemática de información regulatoria. Los desenlaces estudiados fueron los siguientes: tiempo de alivio de síntomas; desenlaces relacionados con influenza; complicaciones; ingresos hospitalarios; y eventos adversos en la población con intención de tratar. Las fuentes de datos correspondieron a información entregada por Roche (después de una larga disputa pública, enteramente difundida por el BMJ) y por la EMA, con lo que los investigadores lograron los datos de 83 ensayos clínicos y más de 150.000 fojas. Los resultados se presentan en las Tablas I y II.
La conclusión es que oseltamivir reduce la proporción de influenza sintomática en profilaxis, pero con la contrapartida del mayor riesgo de síndromes psiquiátricos, entre otros. En el tratamiento de la influenza sintomática (5 a 7 días), oseltamivir produce una modesta reducción del tiempo para alivio de los síntomas, pero también acompañado de efectos secundarios como náuseas, vómitos, y síndromes renales y psiquiátricos.
¿Por qué antes se decía una cosa y ahora otra? ¿Qué es lo que falló en el camino?
En primer lugar, la existencia de sesgo de publicación. En 2003 aparece el estudio Kaiser, que hace referencia a diez estudios, dos publicados y el resto no publicados. ¿Por qué no están publicados todos los ensayos clínicos que llevó a cabo el fabricante? La respuesta es simple: porque no quiere, porque no le conviene. Los datos pertenecen a las empresas que desarrollan los productos farmacéuticos y los ensayos son conducidos por ellos mismos. Es perfectamente legal y nadie los puede obligar a divulgar sus datos a terceras partes, aunque esto está ad portas de cambiar en Europa gracias a la promulgación de legislación que hará exigible la publicación de todos los resultados de los estudios hechos. El resultado de ello es que la literatura publicada no refleja lo que realmente se ha investigado, con la consecuencia de que se ha llegado a decir que hay un 30% de sobreestimación de beneficio en los estudios financiados por la industria y 80% de reacciones adversas que no son reportadas en la literatura.
En segundo lugar, la falla multisistémica de las autoridades regulatorias norteamericanas y europeas. Los reguladores han llegado a diferentes opiniones acerca de la eficacia y seguridad de drogas como Tamiflu, puesto que la documentación presentada a las autoridades sistemáticamente exagera la eficacia y minimiza los riesgos. Por de pronto, los reguladores ni siquiera exigen que uno de los dos estudios “pivotales” exigidos para la obtención de patente de comercialización sea independiente. Dos importantes agencias como la FDA y la EMA, cuyas decisiones son copiadas sin discusión por decenas de otras agencias nacionales de medicamentos como las de nuestros propios países, no se comunican entre sí y, para peor, a veces hasta discrepan abiertamente. No se le puede pedir a la industria farmacéutica que actúe en el mejor interés del público ya que son empresas con arreglo al lucro, pero sí debemos exigirlo de parte de las agencias estatales y públicas.
En tercer lugar, cambió lo que se entiende como evidencia. La exclamación “el Rey está desnudo” resultó en un profundo autocuestionamiento por parte del grupo liderado por Jefferson sobre la metodología aplicada a las revisiones sistemáticas Cochrane sobre los inhibidores de la neuroaminidasa en influenza. ¿Es posible fundar conclusiones con repercusiones en decisiones de salud pública sobre pocos estudios, financiados y conducidos por los mismos fabricantes? ¿Qué hay debajo de esta punta del témpano que representan los estudios publicados? Así comenzó una batalla sin tregua de este grupo de investigadores que al cabo de cinco años ha redundado en esta revisión sistemática que ha sido la más abierta y transparente jamás realizada. Por primera vez se tiene acceso a los datos brutos de pacientes individuales, contenidos en los CSR. Se incluyeron veinte ensayos no publicados y 9.623 participantes. Esta es la primera vez que la Colaboración Cochrane, en alianza con el BMJ, hace una revisión sobre datos brutos y no sobre artículos publicados.
Es de esperar que esta historia haga reflexionar a los gobiernos y legisladores del mundo sobre estas profundas fallas en la evaluación de seguridad y eficacia de las drogas, cuya comercialización se autoriza. Es necesario reflexionar también sobre la ausencia de ensayos independientes sobre los medicamentos llamados innovadores. El caso de Tamiflu, en que se sobreestimó su efectividad y omitieron los reportes sobre sus daños, no es un caso aislado. Si quienes hacen las revisiones sistemáticas deberán ahora revisar la metodología y la unidad de análisis que emplean, junto con reconsiderar lo que entendemos por base de evidencia, también quienes tienen injerencia en los arreglos institucionales y regulatorios que nos rigen deberán comenzar a revisar las políticas públicas que sobre esta materia hemos tenido. Ha llegado la hora de las reformas.
Declaración de conflictos de intereses
VCB declara no tener conflictos de intereses con la materia del presente editorial. Declara que en los últimos cinco años la Revista recibió ingresos por concepto de publicidad de algunas empresas farmacéuticas.
Puede seguir a Vivienne Bachelet en Twitter: @V_Bachelet

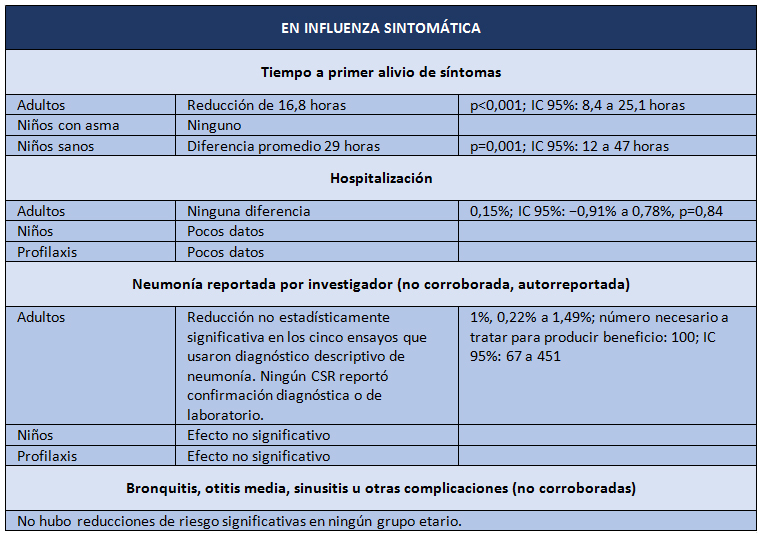 Tabla I. Resultados de los ensayos de intervención con oseltamivir en influenza sintomática. Adaptado de Tom Jefferson, et al [2].
Tabla I. Resultados de los ensayos de intervención con oseltamivir en influenza sintomática. Adaptado de Tom Jefferson, et al [2].

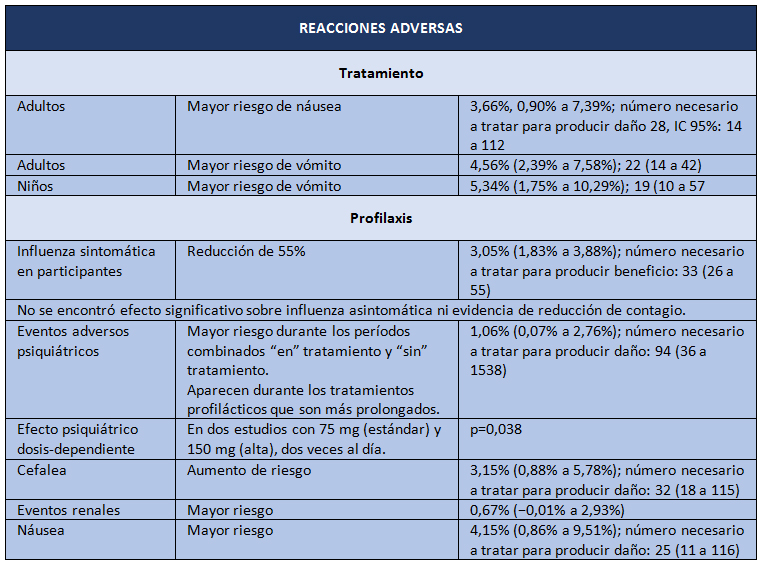 Tabla II. Reacciones adversas en ensayos de intervención con oseltamivir. Adaptado de Tom Jefferson, et al [2].
Tabla II. Reacciones adversas en ensayos de intervención con oseltamivir. Adaptado de Tom Jefferson, et al [2].
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

In 2013, we wrote about the harm, waste and deception stemming from conducts adopted by the pharmaceutical industry, by concealing raw data and Clinical Study Reports (CSRs) from the regulator’s view when requesting the marketing patent. We described the case of Tamiflu (Roche), a drug that has been widely used in our population and profusely prescribed by physicians. Health authorities, entailing a great cost for the countries in the region, have also purchased it. In this editorial, we will show how the idea of using antivirals for prophylaxis and treatment of influenza took hold, starting from the first enthusiastic recommendations up to the systematic review published last month in the BMJ.
 Autora:
Vivienne C. Bachelet[1]
Autora:
Vivienne C. Bachelet[1]

Citación: Bachelet VC. The Tamiflu saga continues: will our conduct change after the publication of the latest systematic review on benefits and harms of oseltamivir?. Medwave 2014;14(4)e:5953 doi: 10.5867/medwave.2014.04.5953
Fecha de publicación: 20/5/2014

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: roberto balassa
Fecha/date: 2014-06-08 22:18:39
Comentario/comment:
Leà su artÃculo con extremo interes pero también leà el artÃculo adjunto que contradice sus afirmaciones en algunos aspectos.
Le agradecerÃa su respuesta y sus comentarios, los cuales definen la conducta clinica a seguir
Atentamente,
Doctor Roberto Balassa
Pediatra
Pediatrics
Today
News
Reference
Education
Dr. R Balassa
Society for Healthcare Epidemiology of America (SHEA) > Expert Commentaries
Oseltamivir and Influenza -- The Rush to Judgment
Stephen Y. Liang, MD
DisclosuresMay 23, 2014
1 comment
Print
Email
Editors < Recommendations
When to Give Antiviral Drugs for the Flu
Influenza: Fact or Fallacy?
Is It Influenza?
Topic Alert
Receive an email from Medscape whenever new articles on this topic are available.
Personal Alert Add Influenza to My Topic Alert
Drug & Reference Information
H1N1 Influenza (Swine Flu)
Influenza
Pediatric Influenza
Oseltamivir for Influenza in Adults and Children: Systematic Review of Clinical Study Reports and Summary of Regulatory Comments
Jefferson T, Jones M, Doshi P, Spencer EA, Onakpoya I, Heneghan CJ
BMJ. 2014;348:g2545
Study Summary
A recent systematic review by Jefferson and colleagues, conducted for the Cochrane Library and published in the British Medical Journal, takes aim at oseltamivir, one of the most widely stockpiled antiviral agents in our arsenal against seasonal and pandemic influenza. With unprecedented access to full clinical study reports generated from randomized, placebo-controlled trials sponsored by the drug < s manufacturer, Roche, the investigators found that treatment with oseltamivir hastened resolution of symptoms by 16.8 hours in adults but had no effect on rates of hospital admission or diagnostically confirmed pneumonia. Likewise, in children, oseltamivir reduced the time to alleviation of symptoms by 29 hours but had no effect on rates of hospital admission or risk for pneumonia.
Side effects, including nausea and vomiting, were seen more frequently in those who were treated with the drug. When it came to prophylaxis, oseltamivir reduced symptomatic influenza by 55% in participants but had no impact on asymptomatic influenza or interrupting the transmission of disease. Risks for headache as well as psychiatric and renal adverse events were found to be higher in those receiving oseltamivir prophylaxis. In total, 5 deaths were reported in the treatment and prophylaxis trials, all of which were attributed to causes other than influenza. The study authors concluded that although oseltamivir shortened the duration of symptoms, there was no evidence to support the claim that it reduced hospital admissions or serious complications associated with influenza.
Viewpoint
Much of the popular press has taken the message of this systematic review to imply that oseltamivir is no better than acetaminophen when it comes to treating or preventing influenza. The investigators have used their findings to call into question "the stockpiling of oseltamivir, its inclusion on the World Health Organization list of essential drugs, and its use in clinical practice as an anti-influenza drug."
Although many of the benefits of oseltamivir in the otherwise healthy adults and children recruited for the randomized controlled trials underpinning this review may indeed have been overestimated, studies of hospitalized patients paint a somewhat different picture. Treatment with oseltamivir in patients with either seasonal or pandemic 2009 H1N1 influenza has demonstrated significant reductions in serious complications leading to intensive care unit admissions and death, optimally when treatment is started within 48 hours of symptom onset. Treatment as far out as 4-5 days after illness onset has been beneficial for some patients.
To this effect, the US Centers for Disease Control and Prevention continues to recommend[1] the early use of neuraminidase inhibitors such as oseltamivir in the treatment of suspected and confirmed influenza in patients who are hospitalized; those with severe, complicated, or progressive illness; and those at high risk for complications including pneumonia and respiratory failure.
The systematic review published by Jefferson and colleagues is a remarkable accomplishment not only in terms of its groundbreaking methodology but the championing of a higher level of transparency in the conduct and reporting of data from clinical trials, particularly those sponsored by the pharmaceutical industry. However, caution must be taken in generalizing their results to all influenza patients, particularly those who are severely ill and hospitalized, especially during pandemics. Although oseltamivir < s true role in treating influenza in these patients under such circumstances has yet to be clarified through a randomized controlled trial, to say that this agent has little or no role is likely premature.
References
1 comment
Comment
Post as:
Commenting is moderated. See our Terms of Use.
Latest in Infectious Diseases
Mosquito-Borne Chikungunya Virus Spreads in the Americas
Many Lyme Tests Unnecessary, Experts Say
Saudi MERS Data Review Shows Big Jump in Number of Deaths
Uptick in Worldwide Polio Cases in 2013 Continues Into 2014
Ultraviolet Disinfection Cuts Hospital-Acquired Infections
© 2014 WebMD, LLC
Cite this article: Stephen Y. Liang. Oseltamivir and Influenza -- The Rush to Judgment. Medscape. May 23, 2014.
advertisement
Most Popular Articles
According to PEDIATRICIANS
Hypoxia in Preemies: How Long Should Caffeine Be Used?
The Pediatrician < s Pay: A Slow Climb Toward Equity
Impact of Poor Sleep Equal to Binge Drinking, Marijuana Use
Early Repetitive Behaviors Reliably Predict Autism
Guidelines Could Lead to Missed Urine Reflux in Kids
View More
More from your Pediatrics MedPulse newsletter...
FeaturesThe Inevitable Loss
First Confirmed Cases of MERS-CoV Infection in the US
Oseltamivir and Influenza -- The Rush to Judgment
Surgical Innovations in Pediatric Ophthalmology
Infant Assessment and Reduction of Postnatal Collapse Risk
Top StoriesAssessing Recovery From Concussion
Hypoxia in Preemies: How Long Should Caffeine Be Used?
Doctors Are Talking: EHRs Destroy the Patient Encounter
An Infant in Acute Respiratory Distress: Case Challenge
Surgery for Children With Crohn < s Disease
Patient Contact: Shake Hands, Hug, Fist Bump, or Just Smile?
About Medscape
Privacy Policy
Terms of Use
WebMD
MedicineNet
eMedicineHealth
RxList
WebMD Corporate
Help
All material on this website is protected by copyright, Copyright © 1994-2014 by WebMD LLC. This website also contains material copyrighted by 3rd parties.
Nombre/name: Vivienne Bachelet
Fecha/date: 2014-06-09 11:14:24
Comentario/comment:
Muchas gracias por su comentario.
Me parece entender que pide que comente sobre el resumen del estudio, pero no me queda claro dónde se publicó este resumen. ¿Fue en el BMJ? Intenté acceder a un comentario en Medscape pero me pide contraseña, por lo que no me quedó clara su referencia.
En todo caso, cuando yo afirmo que no sirve Tamiflu es porque hay que sopesar los daños con los beneficios, tal como indico en el editorial. La revisión sistemática de Jefferson et al concluye que el beneficio es acortamiento de menos de 1 dÃa (en condiciones controladas, e indicado al inicio del cuadro), en influenza sintomática. Entonces, hay que poner sobre la balanza la mayor tasa de efectos secundarios que no se habÃan reportado anteriormente y que ahora aparecen reportados. Además, es necesario considerar el costo del medicamento. Estas últimas consideraciones aplican sobre todo en uso profiláctico de los antivirales.
Entonces, ¿vale la pena indicar Tamiflu si el beneficio no es el que se habÃa señalado cuando se recomendó a los gobiernos tener stock de oseltamivir e indicar como profilaxis? Lo que se habÃa dicho entonces es que Tamiflu reducÃa la frecuencia de hospitalizaciones y complicaciones secundarias, pero ahora, con esta última revisión sistemática realizada sobre los datos brutos de los ensayos clÃnicos, eso no se ha visto corroborado.
En el siguiente link figura quizás la opinión que usted considera contradictoria con mi editorial: http://www.medscape.com/viewarticle/821653. Pero es muy importante revisar las fechas de publicación. El comentario de Angela Campbell en el sitio de Medscape (que debemos recordar no es una revista biomédica revisada por pares) aparece el 17 de marzo, por lo que se basa en la información previamente existente sobre antivirales en influenza que, como sabemos, adolecÃa de fuerte sesgo de publicación. La revisión sistemática de Jefferson se publicó en el BMJ el 10 de abril de 2014. En Medwave consideramos de suma importancia esta revisión sistemática por lo que publicamos el editorial.
Nuevamente, gracias por expresar su opinión en la Revista.
Nombre/name: RAUL ERNESTO VARGAS
Fecha/date: 2014-11-09 18:11:10
Comentario/comment:
Excelente artÃculo Dra.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Bachelet V. A tale of harm, waste and deception: how big pharma has undermined public faith in trial data disclosure and what we can do about it. Medwave. 2013;13(4):e5671. | CrossRef |
Bachelet V. A tale of harm, waste and deception: how big pharma has undermined public faith in trial data disclosure and what we can do about it. Medwave. 2013;13(4):e5671. | CrossRef | Jefferson T, Jones M, Doshi P, Spencer EA, Onakpoya I, Heneghan CJ. Oseltamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments. BMJ. 2014;348:g2545. | CrossRef | PubMed |
Jefferson T, Jones M, Doshi P, Spencer EA, Onakpoya I, Heneghan CJ. Oseltamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments. BMJ. 2014;348:g2545. | CrossRef | PubMed | Kaiser L, Wat C, Mills T, Mahoney P, Ward P, Hayden F. Impact of oseltamivir treatment on influenza-related lower respiratory tract complications and hospitalizations. Arch Intern Med. 2003;163(14):1667-72. | CrossRef | PubMed |
Kaiser L, Wat C, Mills T, Mahoney P, Ward P, Hayden F. Impact of oseltamivir treatment on influenza-related lower respiratory tract complications and hospitalizations. Arch Intern Med. 2003;163(14):1667-72. | CrossRef | PubMed | Cooper NJ1, Sutton AJ, Abrams KR, Wailoo A, Turner D, Nicholson KG. Effectiveness of neuraminidase inhibitors in treatment and prevention of influenza A and B: systematic review and meta-analyses of randomised controlled trials. BMJ. 2003;326(7401):1235. | CrossRef | PubMed |
Cooper NJ1, Sutton AJ, Abrams KR, Wailoo A, Turner D, Nicholson KG. Effectiveness of neuraminidase inhibitors in treatment and prevention of influenza A and B: systematic review and meta-analyses of randomised controlled trials. BMJ. 2003;326(7401):1235. | CrossRef | PubMed | Uhnoo I, Linde A, Pauksens K, Lindberg A, Eriksson M, Norrby R. Treatment and prevention of influenza: Swedish recommendations. Scand J Infect Dis. 2003;35(1):3–11. | PubMed |
Uhnoo I, Linde A, Pauksens K, Lindberg A, Eriksson M, Norrby R. Treatment and prevention of influenza: Swedish recommendations. Scand J Infect Dis. 2003;35(1):3–11. | PubMed | Wutzler P, Kossow K-D, Lode H, Ruf BR, Scholz H, Vogel GE. Antiviral treatment and prophylaxis of influenza in primary care: German recommendations. J Clin Virol. 2004;31(2):84–91. | CrossRef | PubMed |
Wutzler P, Kossow K-D, Lode H, Ruf BR, Scholz H, Vogel GE. Antiviral treatment and prophylaxis of influenza in primary care: German recommendations. J Clin Virol. 2004;31(2):84–91. | CrossRef | PubMed | Kirkbride HA, Watson J. Review of the use of neuraminidase inhibitors for prophylaxis of influenza. Commun Dis Public Health. 2003;6(2):123–7. | PubMed |
Kirkbride HA, Watson J. Review of the use of neuraminidase inhibitors for prophylaxis of influenza. Commun Dis Public Health. 2003;6(2):123–7. | PubMed | Schmidt AC. Antiviral therapy for influenza : a clinical and economic comparative review. Drugs. 2004;64(18):2031–46. | CrossRef | PubMed |
Schmidt AC. Antiviral therapy for influenza : a clinical and economic comparative review. Drugs. 2004;64(18):2031–46. | CrossRef | PubMed | Reisinger K, Greene G, Aultman R, Sander B, Gyldmark M. Effect of influenza treatment with oseltamivir on health outcome and costs in otherwise healthy children. Clin Drug Investig. 2004;24(7):395–407. | CrossRef | PubMed |
Reisinger K, Greene G, Aultman R, Sander B, Gyldmark M. Effect of influenza treatment with oseltamivir on health outcome and costs in otherwise healthy children. Clin Drug Investig. 2004;24(7):395–407. | CrossRef | PubMed | Cools HJM, van Essen GA. Practice guideline “Influenza prevention in nursing homes and care homes”, issued by the Dutch Society of Nursing Home Specialists; division of tasks between nursing home specialist, general practitioner and company doctor. Ned Tijdschr Geneeskd. 2005;149(3):119–24; discussion 116–8. | PubMed |
Cools HJM, van Essen GA. Practice guideline “Influenza prevention in nursing homes and care homes”, issued by the Dutch Society of Nursing Home Specialists; division of tasks between nursing home specialist, general practitioner and company doctor. Ned Tijdschr Geneeskd. 2005;149(3):119–24; discussion 116–8. | PubMed | Lynch JP, Walsh EE. Influenza: evolving strategies in treatment and prevention. Semin Respir Crit Care Med. 2007;28(2):144–58. | CrossRef | PubMed |
Lynch JP, Walsh EE. Influenza: evolving strategies in treatment and prevention. Semin Respir Crit Care Med. 2007;28(2):144–58. | CrossRef | PubMed | Moscona A. Medical management of influenza infection. Annu Rev Med. 2008;59:397–413. | CrossRef | PubMed |
Moscona A. Medical management of influenza infection. Annu Rev Med. 2008;59:397–413. | CrossRef | PubMed | White NJ, Webster RG, Govorkova EA, Uyeki TM. What is the optimal therapy for patients with H5N1 influenza? PLoS Med. 2009;6(6):e1000091. | CrossRef | PubMed |
White NJ, Webster RG, Govorkova EA, Uyeki TM. What is the optimal therapy for patients with H5N1 influenza? PLoS Med. 2009;6(6):e1000091. | CrossRef | PubMed | Tappenden P, Jackson R, Cooper K, Rees A, Simpson E, Read R, et al. Amantadine, oseltamivir and zanamivir for the prophylaxis of influenza (including a review of existing guidance no. 67): a systematic review and economic evaluation. Health Technol Assess. 2009;13(11):iii, ix–xii, 1–246. | CrossRef | PubMed |
Tappenden P, Jackson R, Cooper K, Rees A, Simpson E, Read R, et al. Amantadine, oseltamivir and zanamivir for the prophylaxis of influenza (including a review of existing guidance no. 67): a systematic review and economic evaluation. Health Technol Assess. 2009;13(11):iii, ix–xii, 1–246. | CrossRef | PubMed | WHO guidelines for pharmacological management of pandemic (H1N1) 2009 influenza and other influenza viruses. Geneva: World Health Organization (WHO), 2009:83. [on line] | Link |
WHO guidelines for pharmacological management of pandemic (H1N1) 2009 influenza and other influenza viruses. Geneva: World Health Organization (WHO), 2009:83. [on line] | Link | Jefferson T, Jones M, Doshi P, Del Mar C. Neuraminidase inhibitors for preventing and treating influenza in healthy adults: systematic review and meta-analysis. BMJ. 2009;339:b5106. | CrossRef | PubMed |
Jefferson T, Jones M, Doshi P, Del Mar C. Neuraminidase inhibitors for preventing and treating influenza in healthy adults: systematic review and meta-analysis. BMJ. 2009;339:b5106. | CrossRef | PubMed | Smith JR, Ariano RE, Toovey S. The use of antiviral agents for the management of severe influenza. Crit Care Med. 2010;38(4 Suppl):e43–51. | CrossRef | PubMed |
Smith JR, Ariano RE, Toovey S. The use of antiviral agents for the management of severe influenza. Crit Care Med. 2010;38(4 Suppl):e43–51. | CrossRef | PubMed | Reddy D. Responding to pandemic (H1N1) 2009 influenza: the role of oseltamivir.J Antimicrob Chemother. 2010;65(Suppl 2):ii35–ii40. | CrossRef | PubMed |
Reddy D. Responding to pandemic (H1N1) 2009 influenza: the role of oseltamivir.J Antimicrob Chemother. 2010;65(Suppl 2):ii35–ii40. | CrossRef | PubMed | Smith JR, Rayner CR, Donner B, Wollenhaupt M, Klumpp K, Dutkowski R. Oseltamivir in seasonal, pandemic, and avian influenza: a comprehensive review of 10-years clinical experience. Adv Ther. 2011;28(11):927–59. | CrossRef | PubMed |
Smith JR, Rayner CR, Donner B, Wollenhaupt M, Klumpp K, Dutkowski R. Oseltamivir in seasonal, pandemic, and avian influenza: a comprehensive review of 10-years clinical experience. Adv Ther. 2011;28(11):927–59. | CrossRef | PubMed | Fiore AE, Fry A, Shay D, Gubareva L, Bresee JS, Uyeki TM. Antiviral agents for the treatment and chemoprophylaxis of influenza --- recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2011;60(1):1–24. | PubMed | Link |
Fiore AE, Fry A, Shay D, Gubareva L, Bresee JS, Uyeki TM. Antiviral agents for the treatment and chemoprophylaxis of influenza --- recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2011;60(1):1–24. | PubMed | Link | Rodríguez A, Alvarez-Rocha L, Sirvent JM, Zaragoza R, Nieto M, Arenzana A, et al. Recommendations of the Infectious Diseases Work Group (GTEI) of the Spanish Society of Intensive and Critical Care Medicine and Coronary Units (SEMICYUC) and the Infections in Critically Ill Patients Study Group (GEIPC) of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC) for the diagnosis and treatment of influenza A/H1N1 in seriously ill adults admitted to the Intensive Care Unit. Med Intensiva. 2012;36(2):103–37. | CrossRef | PubMed |
Rodríguez A, Alvarez-Rocha L, Sirvent JM, Zaragoza R, Nieto M, Arenzana A, et al. Recommendations of the Infectious Diseases Work Group (GTEI) of the Spanish Society of Intensive and Critical Care Medicine and Coronary Units (SEMICYUC) and the Infections in Critically Ill Patients Study Group (GEIPC) of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC) for the diagnosis and treatment of influenza A/H1N1 in seriously ill adults admitted to the Intensive Care Unit. Med Intensiva. 2012;36(2):103–37. | CrossRef | PubMed | Jefferson TO, Demicheli V, Di Pietrantonj C, Jones M, Rivetti D. Neuraminidase inhibitors for preventing and treating influenza in healthy adults. Cochrane database Syst Rev. 2006;(3):CD001265. | CrossRef | PubMed |
Jefferson TO, Demicheli V, Di Pietrantonj C, Jones M, Rivetti D. Neuraminidase inhibitors for preventing and treating influenza in healthy adults. Cochrane database Syst Rev. 2006;(3):CD001265. | CrossRef | PubMed | Committee on infectious diseases. Recommendations for prevention and control of influenza in children, 2013-2014. Pediatrics. 2013;132(4):e1089–104. | CrossRef | PubMed |
Committee on infectious diseases. Recommendations for prevention and control of influenza in children, 2013-2014. Pediatrics. 2013;132(4):e1089–104. | CrossRef | PubMed | Santesso N, Hsu J, Mustafa R, Brozek J, Chen YL, Hopkins JP, et al. Antivirals for influenza: a summary of a systematic review and meta-analysis of observational studies. Influenza Other Respi Viruses. 2013;7 Suppl 2:76–81. | CrossRef | PubMed |
Santesso N, Hsu J, Mustafa R, Brozek J, Chen YL, Hopkins JP, et al. Antivirals for influenza: a summary of a systematic review and meta-analysis of observational studies. Influenza Other Respi Viruses. 2013;7 Suppl 2:76–81. | CrossRef | PubMed | Una historia de perjuicio, desperdicio y engaño: cómo la gran industria farmacéutica ha socavado la fe pública en los datos de sus ensayos clínicos y qué podemos hacer al respecto
Una historia de perjuicio, desperdicio y engaño: cómo la gran industria farmacéutica ha socavado la fe pública en los datos de sus ensayos clínicos y qué podemos hacer al respecto