 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: acute myeloid leukemia, azacitidine, palliative care
INTRODUCCIÓN
La leucemia mieloide aguda tiene una alta mortalidad sin tratamiento. El trasplante hematopoyético es la única estrategia curativa hasta ahora. Los pacientes que tienen contraindicaciones para el trasplante, pueden ser tratados con fármacos hipometilantes que han mostrado mejorar la sobrevida libre de enfermedad y sobrevida global.
OBJETIVOS
Describir las características clínicas de los pacientes con síndrome mielodisplásico avanzado y leucemia mieloide aguda, las respuestas logradas y efectos adversos del tratamiento con el fármaco hipometilante.
MÉTODOS
Este reporte muestra nuestra experiencia en 38 pacientes con leucemia mieloide aguda tratados con azacitidina o con tratamiento paliativo.
RESULTADOS
La azacitidina permitió alargar la sobrevida en 80% de los pacientes con alta incidencia de efectos adversos y afectación de la calidad de vida. La mayoría de los pacientes tratados con intención paliativa, fallecieron en el primer mes post diagnóstico.
CONCLUSIONES
La azacitidina permite prolongar la sobrevida, pero con efectos adversos considerables.
La leucemia mieloide aguda es una de las neoplasias hematológicas más frecuentes en los adultos, especialmente en la tercera edad [1],[2]. En los pacientes jóvenes con buen estado de desempeño (performance status), la terapia óptima es la restauración de la hematopoyesis por medio de quimioterapia intensa, seguida del trasplante alogénico de células hematopoyéticas. Mientras que en los pacientes con pobre desempeño o de edad avanzada, no candidatos a trasplante o a quimioterapia intensiva, las terapias de menor toxicidad como los medicamentos hipometilantes suelen ser una alternativa válida. Esto porque terapias más intensas en este grupo de pacientes, se asocian a mayor morbilidad y mortalidad relacionada con el tratamiento [3],[4].
La azacitidina es un medicamento análogo de la citidina, que es utilizado en el tratamiento de los pacientes con mielodisplasia y leucemia aguda por su acción hipometilante de oncogenes. Este fármaco es una alternativa para pacientes con leucemia mieloide aguda, quienes no son candidatos a terapias más intensas, donde estudios han demostrado efectividad en prolongar la sobrevida global y mejorar calidad de vida, comparado con la terapia estándar y soporte transfusional exclusivo [5],[6]. En nuestro medio no hay información disponible con respecto al uso de medicamentos hipometilantes en el tratamiento de la leucemia mieloide aguda, en pacientes no candidatos a trasplante de células hematopoyéticas alogénico.
En este estudio mostramos la experiencia de nuestro centro universitario en pacientes con leucemia mieloide aguda, no candidatos a tratamiento de alta intensidad, tratados con azacitidina o con tratamiento de soporte. Nuestro objetivo es describir de forma retrospectiva las características clínicas de los pacientes con síndrome mielodisplásico avanzado y leucemia mieloide aguda, las respuestas logradas y efectos adversos del tratamiento con el fármaco hipometilante.
Diseño del estudio
Entre los años 2010 y 2014 se trataron 79 pacientes con leucemia mieloide aguda en nuestra institución. Se realizó un análisis retrospectivo y descriptivo de todos aquellos pacientes que no fueron candidatos a trasplante.
Pacientes
De los 79 pacientes con leucemia mieloide aguda, 38 no fueron candidatos a quimioterapia estándar con citarabina a dosis altas y trasplante. De estos, 22 fueron tratados con azacitidina y en 16 se realizó tratamiento paliativo con soporte transfusional y cuidados de fin de vida. El tratamiento paliativo consistió en uso de transfusiones de glóbulos rojos o plaquetas según necesidad y uso de medicamentos para alivio del dolor, basado en opiáceos y sus derivados. La elección de cuál estrategia de tratamiento se determinó teniendo en cuenta la decisión del paciente por consentimiento informado, las comorbilidades existentes que impedían uso de medicamentos hipometilantes y la posibilidad económica de acceso al tratamiento. Se realizó una comparación retrospectiva entre estos dos grupos. Todos los pacientes o sus acudientes firmaron un documento de consentimiento informado de tratamiento.
Diagnóstico
El diagnóstico de leucemia mieloide aguda se sospechó en aquellos pacientes que tenían hemograma alterado con cambios displásicos o células inmaduras. Se confirmó con citología y citometría de flujo de sangre medular. El diagnóstico de leucemia mieloide aguda en citología de médula ósea, se realizó con la presencia de células inmaduras mieloides, de acuerdo a los criterios de la Organización Mundial de la Salud [1], confirmado con la presencia de más de 20% de blastos en médula ósea. El diagnóstico con citometría de flujo multiparamétrica, se realizó con un amplio panel de anticuerpos contra cúmulos (clusters) de diferenciación (CD) de estirpe mieloide: CD13, CD14, CD15, CD16, CD33, CD34, CD36, CD38, CD45, CD56, CD117, CD11b, CD10 y MPO. Además, en los pacientes que se sometieron a tratamiento con azacitidina se realizó un estudio con cariotipo.
Tratamiento
Hubo dos modalidades de tratamiento con la azacitidina subcutánea o intravenosa:
Los pacientes que fueron tratados con azacitidina y aquellos con intención paliativa, recibieron transfusiones para mantener recuentos plaquetarios mayores a 20 000/ µl, hemoglobina mayor a 8 g/dl y tratamiento sintomático dirigido a cada dolencia.
Todos los pacientes recibieron tratamiento antimicrobiano profiláctico con 400 mg de fluconazol oral, 500 mg de levofloxacino oral cada día y trimetroprim/sulfametoxazol 160/800 mg los días lunes, miércoles y viernes. Aquellos que tuvieron episodios de neutropenia febril, recibieron tratamiento hospitalario de acuerdo a lo definido por las guías de tratamiento de nuestro hospital. En aquellos pacientes que tuvieron síntomas de difícil manejo en domicilio, se realizó tratamiento hospitalario y cuidados de fin de la vida.
Acorde a la política institucional de nuestro hospital y de nuestra facultad, todos los pacientes recibieron explicaciones claras sobre la enfermedad y las opciones terapéuticas. Se realizó firma por parte del paciente o representante legal y el médico tratante del consentimiento informado diseñado para estos efectos. El estudio fue aprobado por el comité de ética de la Facultad de Medicina de la Pontificia Universidad Católica de Chile.
Criterios de respuesta
La respuesta al tratamiento se realizó con citometría de flujo y citología en sangre de médula ósea. La respuesta completa fue delimitada por la presencia de menos de 5% de células leucémicas. La remisión parcial se precisó como la persistencia de células leucémicas mayor a 5%, pero no superando el valor del diagnóstico. La enfermedad progresiva fue especificada por el aumento de células leucémicas. La remisión hematológica se definió en los pacientes con persistencia de blastos medulares, pero con mejoría de las alteraciones al hemograma. El tiempo medio de respuesta se delimitó como el lapso de tiempo entre el inicio del tratamiento con azacitidina y el momento de disminución de las células leucémicas en sangre periférica o médula ósea. El tiempo de duración de la respuesta fue determinado como el período de tiempo entre el inicio del tratamiento y la recaída o progresión de la enfermedad [3],[4].
Análisis estadístico
Este es un estudio retrospectivo y descriptivo. Se recolectó información de los registros clínicos con respecto a edad al momento del diagnóstico, género, hemograma, LDH, citología medular, citometría de flujo, cariotipo, tipo de tratamiento indicado (azacitidina versus soporte), toxicidad, infecciones y agente bacteriano (viral o fúngico si lo hubo), tiempo de sobrevida y fecha de muerte. Se realizó análisis por medio del programa Graphpad v.6.2. En cuanto a la estadística descriptiva, los datos demográficos se muestran por medio de mediana y rango, mientras que los análisis de sobrevida se realizaron con el método de Kaplan Meier. La diferencia estadísticamente significativa se estableció con valores de p<0,05.
Características de los pacientes
Las características de los pacientes se resumen en la Tabla 1. En suma, en su mayoría fueron del género masculino, con edad promedio de 65 años para los pacientes tratados con azacitidina y 72 años para los pacientes tratados con soporte. En 63% de los pacientes se encontró alguna alteración genética de alto riesgo en el cariotipo.
Tabla 1. Características de los pacientes.
Respuesta
Como se describe en la Tabla 2, no se logró remisión completa en ningún paciente de los tratados con azacitidina. Se obtuvo remisión parcial en 60% de los pacientes y remisión hematológica en 20%. En el 20% restante, la enfermedad fue progresiva. El tiempo medio de inicio de la respuesta al tratamiento fue de dos meses (rango 0,5 a 4 meses) y el tiempo de duración de la respuesta fue de siete meses (rango de 2 a 24 meses).
Tabla 2. Respuesta al tratamiento con azacitidina.
Toxicidad
La toxicidad asociada al tratamiento con azacitidina se describe en la Tabla 3. En resumen, todos los enfermos tuvieron episodios de pancitopenia y en nueve enfermos (40%) se presentaron episodios de neutropenia febril, en su mayoría por hongos, con requerimiento de tratamiento anti fúngico prolongado. En los pacientes tratados con intención paliativa se observó dependencia transfusional en 16 (100%), infecciones graves en 15 (96%) y sangrados terminales en sistema nervioso central en 4 (25%).
Tabla 3. Toxicidad asociada al tratamiento con azacitidina.
Sobrevida
La sobrevida global estimada en los pacientes que lograron remisión parcial a dos años de seguimiento fue de 30% y en los que tuvieron enfermedad progresiva o refractaria fue de 5%. La mediana de sobrevida fue de siete meses (rango de 2 a 24 meses) en los pacientes tratados con azacitidina y de un mes (rango de 1 a 3 meses) en los pacientes que tuvieron tratamiento paliativo (p<0,001). El 95% de los pacientes con tratamiento de intención paliativa fallecieron en el primer mes post diagnóstico.
Los pacientes con leucemia mieloide aguda, no candidatos a tratamiento estándar y de edad avanzada con comorbilidades mayores, son un reto en la hematología pues es claro que sin mediar tratamiento alguno hay una rápida progresión hacia la muerte. Los agentes hipometilantes han mostrado hace ya varios años que favorecen una mejor sobrevida en este tipo de pacientes. Los primeros reportes mostraron que la azacitidina permitió prolongar la sobrevida entre 6 y 12 meses a pacientes no candidatos a tratamiento, y logró tasas de respuesta global cercanas al 50% [7],[8]. Más recientemente, el grupo europeo multicéntrico de tratamiento de leucemia mieloide aguda confirmó que la azacitidina permite prolongar la sobrevida global en 9,6 meses y que el 40% de los pacientes estuvieron vivos luego de un año de tratamiento con una media de 4 ciclos de tratamiento (rango 1-29) [9].
Nuestros datos muestran que el tratamiento con azacitidina permite prolongar la sobrevida de los pacientes en un periodo similar a lo reportado previamente [9],[10],[11],[12]. Las limitaciones de nuestro estudio están dadas por la naturaleza retrospectiva del análisis y el tamaño muestral reducido. Además, es preciso señalar que nuestros pacientes tratados con azacitidina recibieron en promedio menos ciclos de tratamiento, si se compara con reportes previos. Esto puede explicarse por la alta toxicidad y por la dificultad de acceso al fármaco.
Por otra parte, los pacientes que no recibieron tratamiento con intención curativa tuvieron una elevada mortalidad precoz con una muy mala calidad de vida. Esto se debió principalmente a infecciones graves y dependencia transfusional, lo cual reafirma que la azacitidina es una buena opción de tratamiento al mejorar la sobrevida. El siguiente proceso ha de dirigirse a establecer las dosis adecuadas y esquemas apropiados para nuestra población, que permitan a los enfermos afectados de leucemia mieloide aguda y síndrome mielodisplásico poder prolongar la sobrevida con el uso de hipometilantes, pero con un menor impacto en la calidad de vida.
Los enfermos con leucemia mieloide aguda no candidatos a trasplante, tienen un pronóstico ominoso, con una elevada mortalidad precoz. Nuestro análisis retrospectivo mostró que la azacitidina permite prolongar de forma significativa la sobrevida a expensas de alta toxicidad.
Aspectos éticos
La Revista tiene constancia de que el comité ético científico de la Facultad de Medicina de la Pontificia Universidad Católica de Chile tuvo conocimiento sobre este estudio y su posible publicación en una revista de difusión nacional.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.
Declaración de conflictos de intereses
Los autores han completado el formulario de conflictos de intereses del ICMJE y declaran no tener conflictos de intereses asociados a la materia del estudio. Los formularios pueden ser solicitados al autor responsable o a la dirección editorial de la Revista.

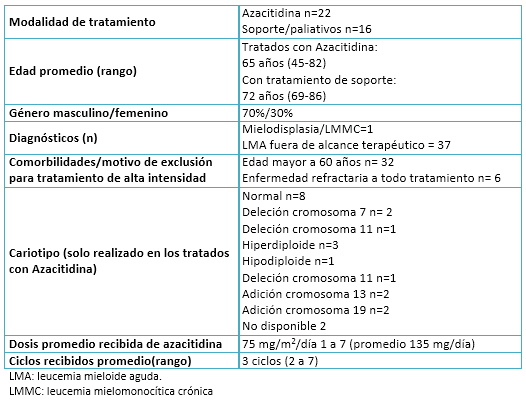 Tabla 1. Características de los pacientes.
Tabla 1. Características de los pacientes.

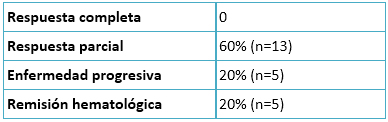 Tabla 2. Respuesta al tratamiento con azacitidina.
Tabla 2. Respuesta al tratamiento con azacitidina.

 Tabla 3. Toxicidad asociada al tratamiento con azacitidina.
Tabla 3. Toxicidad asociada al tratamiento con azacitidina.

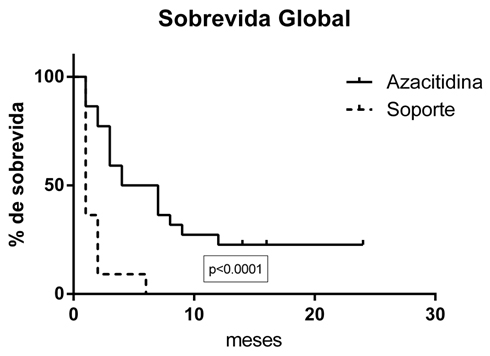 Figura 1. Sobrevida global.
Figura 1. Sobrevida global.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
Acute myeloid leukemia has a high mortality if untreated. Hematopoietic stem cell transplantation is the only curative treatment so far. Patients who are not eligible to receive a transplant can be treated with hypomethylating agents that have shown to improve disease-free and overall survival.
OBJECTIVE
Retrospective description of the clinical characteristics of patients suffering from advanced myelodysplastic syndrome and acute myeloid leukemia that were treated with a hypomethylating agent as well as its adverse effects and response to treatment.
METHODS
This report shows our experience in 38 patients with acute myeloid leukemia treated with azacitidine or palliative treatment.
RESULTS
Azacitidine was able to prolong survival in 80% of patients with a high incidence of adverse effects and negative impact on quality of life. Most of the patients treated with palliative intent died in the first month after diagnosis.
CONCLUSIONS
Azacitidine can prolong survival but with significant adverse effects. Untreated patients had a high early mortality.
 Autores:
Mauricio Sarmiento Maldonado[1], Mauricio Ocqueteau Tachini[1], Javier Pilcante[1], Pablo Ramírez Villanueva[1]
Autores:
Mauricio Sarmiento Maldonado[1], Mauricio Ocqueteau Tachini[1], Javier Pilcante[1], Pablo Ramírez Villanueva[1]

Citación: Sarmiento Maldonado M, Ocqueteau Tachini M, Pilcante J, Ramírez Villanueva P. Response and survival in acute myeloid leukemia patients not candidates to transplantation treated with azacitidine versus palliative treatment: a retrospective study. Medwave 2015 Ago;15(7):e6207 doi: 10.5867/medwave.2015.07.6207
Fecha de envío: 9/6/2015
Fecha de aceptación: 30/7/2015
Fecha de publicación: 10/8/2015
Origen: no solicitado
Tipo de revisión: con revisión estadística y con revisión por dos pares revisores externos

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Vardiman JW, Thiele J, Arber DA, Brunning RD, Borowitz MJ, Porwit A, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009 Jul 30;114(5):937-51. | CrossRef | PubMed |
Vardiman JW, Thiele J, Arber DA, Brunning RD, Borowitz MJ, Porwit A, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009 Jul 30;114(5):937-51. | CrossRef | PubMed | Greenberg PL, Tuechler H, Schanz J, Sanz G, Garcia-Manero G, Solé F, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012 Sep 20;120(12):2454-65.
| PubMed |
Greenberg PL, Tuechler H, Schanz J, Sanz G, Garcia-Manero G, Solé F, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012 Sep 20;120(12):2454-65.
| PubMed | Malcovati L, Hellström-Lindberg E, Bowen D, Adès L, Cermak J, Del Cañizo C, et al. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendations from the European LeukemiaNet. Blood. 2013 Oct 24;122(17):2943-64. | CrossRef | PubMed |
Malcovati L, Hellström-Lindberg E, Bowen D, Adès L, Cermak J, Del Cañizo C, et al. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendations from the European LeukemiaNet. Blood. 2013 Oct 24;122(17):2943-64. | CrossRef | PubMed | Smith BD, Beach CL, Mahmoud D, Weber L, Henk HJ. Survival and hospitalization among patients with acute myeloid leukemia treated with azacitidine or decitabine in a large managed care population: a real-world, retrospective, claims-based, comparative analysis. Exp Hematol Oncol. 2014 Mar 25;3(1):10. | CrossRef | PubMed |
Smith BD, Beach CL, Mahmoud D, Weber L, Henk HJ. Survival and hospitalization among patients with acute myeloid leukemia treated with azacitidine or decitabine in a large managed care population: a real-world, retrospective, claims-based, comparative analysis. Exp Hematol Oncol. 2014 Mar 25;3(1):10. | CrossRef | PubMed | Fenaux P, Mufti GJ, Hellström-Lindberg E, Santini V, Gattermann N, Germing U, et al. Azacitidine prolongs overall survival compared with conventional care regimens in elderly patients with low bone marrow blast count acute myeloid leukemia. J Clin Oncol. 2010 Feb 1;28(4):562-9. | CrossRef | PubMed |
Fenaux P, Mufti GJ, Hellström-Lindberg E, Santini V, Gattermann N, Germing U, et al. Azacitidine prolongs overall survival compared with conventional care regimens in elderly patients with low bone marrow blast count acute myeloid leukemia. J Clin Oncol. 2010 Feb 1;28(4):562-9. | CrossRef | PubMed | Thépot S, Itzykson R, Seegers V, Recher C, Raffoux E, Quesnel B, et al. Azacitidine in untreated acute myeloid leukemia: a report on 149 patients. Am J Hematol. 2014 Apr;89(4):410-6. | CrossRef | PubMed |
Thépot S, Itzykson R, Seegers V, Recher C, Raffoux E, Quesnel B, et al. Azacitidine in untreated acute myeloid leukemia: a report on 149 patients. Am J Hematol. 2014 Apr;89(4):410-6. | CrossRef | PubMed | Wheatley K, Brookes CL, Howman AJ, Goldstone AH, Milligan DW, Prentice AG, et al. Prognostic factor analysis of the survival of elderly patients with AML in the MRC AML11 and LRF AML14 trials. Br J Haematol. 2009 Jun;145(5):598-605. | CrossRef | PubMed |
Wheatley K, Brookes CL, Howman AJ, Goldstone AH, Milligan DW, Prentice AG, et al. Prognostic factor analysis of the survival of elderly patients with AML in the MRC AML11 and LRF AML14 trials. Br J Haematol. 2009 Jun;145(5):598-605. | CrossRef | PubMed | Al-Ali HK, Jaekel N, Junghanss C, Maschmeyer G, Krahl R, Cross M, et al. Azacitidine in patients with acute myeloid leukemia medically unfit for or resistant to chemotherapy: a multicenter phase I/II study. Leuk Lymphoma. 2012 Jan;53(1):110-7. | CrossRef | PubMed |
Al-Ali HK, Jaekel N, Junghanss C, Maschmeyer G, Krahl R, Cross M, et al. Azacitidine in patients with acute myeloid leukemia medically unfit for or resistant to chemotherapy: a multicenter phase I/II study. Leuk Lymphoma. 2012 Jan;53(1):110-7. | CrossRef | PubMed | Ramos F, Thépot S, Pleyer L, Maurillo L, Itzykson R, Bargay J, et al. Azacitidine frontline therapy for unfit acute myeloid leukemia patients: clinical use and outcome prediction. Leuk Res. 2015 Mar;39(3):296-306. | CrossRef | PubMed |
Ramos F, Thépot S, Pleyer L, Maurillo L, Itzykson R, Bargay J, et al. Azacitidine frontline therapy for unfit acute myeloid leukemia patients: clinical use and outcome prediction. Leuk Res. 2015 Mar;39(3):296-306. | CrossRef | PubMed | Huls G. Azacitidine in AML: a treatment option? Blood. 2015 Jul 16;126(3):283-4. | CrossRef | PubMed |
Huls G. Azacitidine in AML: a treatment option? Blood. 2015 Jul 16;126(3):283-4. | CrossRef | PubMed | Dombret H, Seymour JF, Butrym A, Wierzbowska A, Selleslag D, Jang JH, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood. 2015 Jul 16;126(3):291-9. | CrossRef | PubMed |
Dombret H, Seymour JF, Butrym A, Wierzbowska A, Selleslag D, Jang JH, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood. 2015 Jul 16;126(3):291-9. | CrossRef | PubMed | Cabrero M, Jabbour E, Ravandi F, Bohannan Z, Pierce S, Kantarjian HM, et al. Discontinuation of hypomethylating agent therapy in patients with myelodysplastic syndromes or acute myelogenous leukemia in complete remission or partial response: retrospective analysis of survival after long-term follow-up. Leuk Res. 2015 May;39(5):520-4. | CrossRef | PubMed |
Cabrero M, Jabbour E, Ravandi F, Bohannan Z, Pierce S, Kantarjian HM, et al. Discontinuation of hypomethylating agent therapy in patients with myelodysplastic syndromes or acute myelogenous leukemia in complete remission or partial response: retrospective analysis of survival after long-term follow-up. Leuk Res. 2015 May;39(5):520-4. | CrossRef | PubMed |