 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: cost-benefit analysis, multiple myeloma, lenalidomide, bortezomib
CONTEXTO
El mieloma múltiple es una neoplasia de las células plasmáticas de la medula ósea. Las terapias disponibles no son curativas y la mayoría de los pacientes se vuelve refractario al tratamiento. Agentes como lenalidomida y bortezomib han demostrado su eficacia en el tratamien-to en segunda línea de estos pacientes.
OBJETIVO
Evaluar el costo-efectividad de la combinación lenalidomida/dexametasona frente a bortezomib/dexametasona en pacientes con mieloma múltiple, no candidatos a trasplante, previamente tratados con bortezomib, desde la perspectiva del sistema nacional de salud chileno.
METODOLOGÍA
Se empleó un modelo de Markov que simula la evolución de una cohorte de pacientes a través de cuatro estados de salud (preprogresión en tratamiento, preprogresión sin tratamiento, progresión o muerte) en un horizonte temporal de 25 años. Los datos de eficacia, uso de recursos y frecuencia de efectos adversos fueron extraídos de los ensayos sobre mieloma múltiple MM-009 y MM-010 y de un estudio retrospectivo de retratamiento con bortezomib. Todos los parámetros fueron validados por expertos. Se aplicó una tasa de descuento en costos y beneficios de 3%. La robustez de los resultados fue evaluada mediante un análisis de sensibilidad univariante y probabilístico.
RESULTADOS
El tratamiento con lenalidomida/dexametasona proporciona 1,41 años de vida y 0,83 años de vida ajustados por calidad incrementales respecto a bortezomib/dexametasona, con un costo incremental de 11 864 597,86 pesos chilenos (19 589,86 dólares). La ratio de cos-to-efectividad y costo-utilidad incremental se cifró en 8 410 266,92 pesos chilenos (13 886,35 dólares) por año de vida ganado y 14 271 896,16 pesos chilenos (23 564,59 dólares) por año de vida ajustado por calidad respectivamente.
CONCLUSIÓN
La lenalidomida/dexametasona representa una alternativa potencialmente costo-efectiva, desde la perspectiva del sistema nacional de salud chileno, para el tratamiento en segunda línea de pacientes con mieloma múltiple no candidatos a trasplante.
El mieloma múltiple es una neoplasia maligna que se caracteriza por la proliferación clonal de células plasmáticas originadas de células B de la médula ósea [1]. Generalmente va precedido de una fase pre-maligna asintomática denominada gammapatía monoclonal de significación indeterminada, que puede evolucionar directamente a mieloma múltiple sintomático o progresar a un estadio intermedio, el mieloma quiescente. En este último caso, se estima que el 10% progresará a mieloma múltiple sintomático durante los primeros cinco años [2]. La evolución de la enfermedad va asociada a un deterioro significativo de la calidad de vida, debido principalmente a las complicaciones asociadas. Entre ellas, las más relevantes incluyen anemia, trombocitopenia, leucopenia, fractura ósea, hipercalcemia e insuficiencia renal [1],[3].
Pese a los avances en el tratamiento del mieloma múltiple, sigue observándose una elevada tasa de mortalidad en estos pacientes, registrándose más de 260 000 fallecimientos al año por esta causa a nivel global [4]. En Chile, se estima una incidencia de 2,3 casos por 100 000 habitantes por año y una prevalencia a cinco años del 1% [4].
En ausencia de una terapia definitiva [5], la introducción de agentes como la talidomida, lenalidomida y bortezomib ha permitido aumentar sensiblemente la sobrevida de los pacientes con mieloma múltiple. La selección del tratamiento adecuado depende del riesgo del paciente y de si este es elegible para el trasplante autólogo de células madre [6],[7].
En pacientes no candidatos a trasplante, se recomienda un esquema de tres o dos medicamentos, dependiendo de su estado general, basado en bortezomib, lenalidomida o talidomida [6],[7],[8]. En caso de recaída o progresión, las principales guías de práctica clínica recomiendan repetir el mismo tratamiento o considerar el cambio a otra terapia (lenalidomida/dexametasona o bortezomib/doxorubicina pegilada) [6],[7],[8].
En este contexto, el objetivo de este trabajo es estimar la razón de costo-efectividad incremental del tratamiento en segunda línea con lenalidomida en combinación con dexametasona, frente al retratamiento con bortezomib combinado con dexametasona en pacientes con mieloma múltiple y tratamiento previo con bortezomib, desde la perspectiva del ámbito sanitario público chileno.
Para llevar a cabo el objetivo propuesto, se adaptó al ámbito sanitario chileno un modelo que se presentó originariamente en el National Institute for Health Care and Excellence (NICE) en su adaptación al Reino Unido y que estima los beneficios clínicos y costos de lenalidomida en combinación con dexametasona frente a bortezomib combinado con dexametasona en el tratamiento de pacientes con mieloma múltiple no candidatos a trasplante, previamente tratados con bortezomib [9].
Los parámetros empleados en el modelo fueron validados por dos hematólogos expertos en el tratamiento del mieloma múltiple en Chile (CP y CG). Para la elaboración del presente trabajo se han utilizado las directrices del Consolidated Health Economic Evaluation Reporting Standards (CHEERS) [10].
Estructura del modelo
El diseño es un modelo de Markov que simula la evolución de una cohorte hipotética de pacientes desde la asignación del tratamiento hasta finalizar el horizonte temporal (25 años). De acuerdo a las recomendaciones de la Sociedad Internacional de Farmacoeconomía e Investigación de Resultados (ISPOR, por su sigla en inglés International Society For Pharmacoeconomics and Outcomes Research), la elección de este tipo de diseño resulta adecuada si se considera la extensión del horizonte temporal y a la naturaleza de la enfermedad, que implica que los pacientes puedan encontrase en distintas fases de la enfermedad o estados de salud [11]. Asimismo, los modelos de Markov son apropiados cuando el análisis requiere la simulación de varias líneas de tratamiento consecutivas [12].
Desde su entrada en el modelo, los pacientes transitan a través de cuatro posibles estados de salud (Figura 1). Inicialmente todos los pacientes se encuentran en el estado preprogresión en tratamiento, que corresponde a pacientes estables que están recibiendo tratamiento (lenalidomida en combinación con dexametasona o bortezomib junto con dexametasona). A partir de ese estado los pacientes pueden permanecer en su estado o transitar a uno de los siguientes estados:
Las probabilidades de transición a los estados de salud de preprogresión sin tratamiento, progresión y muerte se han obtenido a partir de las curvas de sobrevida libre de progresión, tiempo hasta el fallo y sobrevida global respectivamente, de los estudios sobre mieloma múltiple MM-009 y MM-010, en los que se evaluó la eficacia de lenalidomida en combinación con dexametasona frente a placebo en conjunto con dexametasona en pacientes previamente tratados, y del estudio retrospectivo de retratamiento con bortezomib [13],[14],[15].
Figura 1. Estados de salud contemplados en el modelo.
Tratamientos comparados
El presente análisis compara los resultados asociados al tratamiento en segunda línea de lenalidomida en combinación con dexametasona frente al retratamiento con bortezomib junto con dexametasona. El modelo asume que todos los pacientes han recibido una primera línea de tratamiento con bortezomib. Tras su entrada en el modelo, los pacientes son asignados a recibir lenalidomida en combinación con dexametasona o retratamiento con bortezomib en conjunto con dexametasona hasta fallo (el tratamiento en segunda línea con bortezomib en combinación con dexametasona es limitado a un máximo de ocho ciclos según indicado en la ficha técnica) [16]. En tercera línea, los pacientes tratados con bortezomib en combinación con dexametasona pasan a recibir lenalidomida en combinación con dexametasona, mientras que los pacientes tratados con lenalidomida combinado con dexametasona reciben Best Supportive Care, un conjunto de tratamientos formado por quimioterápicos (ciclofosfamida, melfalán, cisplatino, doxorrubicina, etoposido) y eventualmente lenalidomida (Tabla 1) [17],[18]. En cuarta línea de tratamiento ambos brazos reciben el Best supportive Care.
Tabla 1. Composición del Best supportive Care empleada en el modelo.
Población
El tratamiento de primera línea en pacientes con mieloma múltiple no candidatos a trasplante consiste en esquemas de tres o dos medicamentos basados en bortezomib, lenalidomida o talidomida. En caso de recaída, se recomienda repetir el mismo tratamiento o considerar el cambio a otra terapia (lenalidomida/dexametasona o bortezomib/doxorubicina pegilada) [6],[7],[8]. Sobre esta base, la población considerada en el presente análisis corresponde a pacientes con mieloma múltiple no candidatos a trasplante previamente tratados con bortezomib. Las características sociodemográficas y clínicas de la población fueron obtenidas de los ensayos clínicos sobre mieloma múltiple MM-009 y MM-010 [13],[14]. No obstante, con el objetivo de ajustar las curvas de sobrevida y el cálculo del área de superficie corporal a la población chilena, la proporción de hombres/mujeres con mieloma múltiple, el peso y la altura medios fueron extraídos de la literatura (Tabla 2) [19],[20].
Tabla 2. Parámetros empleados en el modelo.
Horizonte temporal y perspectiva del estudio
Se definieron ciclos de 28 días, en concordancia con la duración de los ciclos de los tratamientos principales, según lo indicado en ficha técnica. Esta elección está en línea con las recomendaciones de la Sociedad Internacional de Farmacoeconomía e Investigación de Resultados, que indican que “la duración de los ciclos del modelo debe ser lo suficientemente corta como para representar la frecuencia de los eventos clínicos y de las intervenciones” [11]. En total, el modelo se compone de 326 ciclos que corresponden a un horizonte temporal de 25 años, lo suficientemente largo como para capturar los costos y efectos clínicos relevantes.
El sistema de salud chileno consta de dos sectores: el público, constituido principalmente por el Fondo Nacional de Salud; y el privado, conformado principalmente por los seguros de salud llamados instituciones de salud previsional [24]. En el presente análisis, se adoptó la perspectiva del sistema nacional de salud público chileno.
Tasa de descuento
Se aplicó una tasa de descuento en costos y beneficios del 3% [22].
Eficacia
El modelo de Markov empleado en el presente estudio utiliza las probabilidades de transición entre los distintos estados de salud para estimar los años de vida ganados a lo largo del horizonte temporal. Estas probabilidades se obtienen de las curvas de sobrevida global y sobrevida libre de progresión de los tratamientos. Se llevó a cabo una revisión sistemática de la literatura con el objetivo de identificar la evidencia disponible relativa a la eficacia de los tratamientos evaluados [25]. Las curvas de lenalidomida en combinación con dexametasona han sido modelizadas a partir de los resultados agregados de los estudios sobre mieloma múltiple MM-009 y MM-010 y parametrizados mediante distribuciones Gompertz (sobrevida global) y Γ (sobrevida libre de progresión) [13],[14],[15]. Dada la falta de una comparación directa entre bortezomib en combinación con dexametasona y lenalidomida junto con dexametasona, las curvas de sobrevida global y sobrevida libre de progresión de bortezomib combinado con dexametasona se han reconstruido a partir del hazard ratio de la comparación indirecta entre los ensayos sobre mieloma múltiple MM-009 y MM-010 y el estudio retrospectivo de retratamiento con bortezomib [13],[14],[15]. Los hazard ratio se han obtenido como la razón entre la mediana de sobrevida de ambos tratamientos, tras ajustar la eficacia de lenalidomida en combinación con dexametasona a las características de la población del estudio comparador (Tabla 2).
El presente modelo estima también los años de vida ajustados por calidad como la suma de los años de vida transcurridos en cada estado de salud, ponderados por la utilidad asociada. Los datos de utilidad, así como los de disutilidad asociada a los eventos adversos fueron extraídos de la literatura [22],[26],[27],[28],[29],[30].
Costos
Los costos totales fueron estimados como la suma de costos farmacológicos (Tabla 3), costos asociados al uso de recursos (Tabla 4) y manejo de eventos adversos (Tabla 5) [16],[17],[18],[31],[32],[33],[34],[35]. Los costos asociados al uso de recursos incluyen costos asociados a pruebas de seguimiento y monitorización, administración, consultas y cuidados paliativos (Tabla 6).
Tabla 3. Costos farmacológicos.
Tabla 4. Frecuencia y costos asociados al uso de recursos.
Tabla 5. Frecuencia y costo asociado al manejo de los eventos adversos (grado 3-4).
Tabla 6. Costos y beneficios asociados al tratamiento con Len/Dex y Bor/Dex.
Todos los costos fueron estimados en pesos chilenos y actualizados a 2018. Los valores de cambio, y conversión fueron tomados desde el Banco Central de Chile en el día 28 de marzo de 2018 [37]. Los costos farmacológicos fueron obtenidos de la base de datos del portal Mercado Público de Chile Compra [31]. Para cada uno de los medicamentos considerados se obtuvieron los costos de distintas licitaciones y se calculó un promedio por miligramo. Las dosis y frecuencia de administración fueron obtenidas de las fichas técnicas y ajustadas según recomendaciones de los expertos. Los costos de uso de recurso fueron extraídos de los aranceles del Fondo Nacional de Salud (2018) [32],[33]. La frecuencia de uso de recursos fue obtenida de los estudios sobre mieloma múltiple MM-009 y MM-010 y validada por expertos [13],[14].
Variables de resultado
A partir de los años de vida ganados, los años de vida ganados ajustados por calidad y los costos totales acumulados por el paciente, se han estimado la razón de costo-efectividad incremental y costo-utilidad incremental como el cociente entre el costo incremental de lenalidomida en combinación con dexametasona frente a bortezomib junto con dexametasona, y la diferencia en años de vida o años de vida ajustados por calidad ganados..
Análisis de sensibilidad
Se realizó un análisis de sensibilidad univariante y un análisis de sensibilidad probabilístico para evaluar la robustez de los resultados bajo la incertidumbre o variabilidad de los parámetros del modelo. El análisis de sensibilidad univariante muestra los resultados obtenidos al modificar, de manera individual, cada uno de los parámetros entre un valor mínimo y máximo establecidos. Estos valores se han obtenido a partir del intervalo de confianza al 95% o introduciendo una variación del ± 20% sobre el valor del caso base. Para la tasa de descuento, el análisis de sensibilidad univariante contempla una variación entre 0% y 6% según recomendaciones de la guía de evaluaciones económicas del Ministerio de Salud de Chile [22]. El análisis de sensibilidad probabilístico se ha implementado mediante una simulación de Montecarlo de 1000 iteraciones, mediante la cual se asignan valores aleatorios a cada uno de los parámetros del modelo según su propia distribución de probabilidad (Tabla 2).
En la Tabla 6 se muestran los beneficios y los costos asociados a las dos cohortes de tratamiento. A lo largo del horizonte temporal, los pacientes asignados al tratamiento con lenalidomida en combinación con dexametasona acumulan 4,69 años de vida (3,09 años de vida ajustados por calidad) frente a 3,28 años de vida (2,26 años de vida ajustados por calidad) del tratamiento con bortezomib en combinación con dexametasona. El costo del tratamiento con lenalidomida combinado con dexametasona se cifra en 68 818 192,92 pesos chilenos (113 627,00 dólares) frente a 56 953 595,06 pesos chilenos (94 037,14 dólares) del comparador. En la Tabla 6 se desglosan los costos acumulados por los dos brazos de tratamiento a lo largo de la simulación. Los resultados muestran que lenalidomida en combinación con dexametasona sería más eficaz y más costoso respecto a bortezomib en combinación con dexametasona, aportando 1,41 años de vida (0,83 años de vida ajustados por calidad) incrementales y asociándose a un costo incremental de 11 864 597,86 pesos chilenos (19 589,86 dólares) (Tabla 6).
La Organización Mundial de la Salud [38] sugiere considerar como muy costo-efectivas las intervenciones cuya razón de costo-efectividad incremental sea inferior a un Producto Interno Bruto (PIB) per cápita y como “no costo efectivas” aquellas intervenciones que superen los tres PIB per cápita (en este caso 9 136 835,90 pesos chilenos equivalentes a 15 086 dólares - 27 410 507,70 pesos chilenos equivalentes a 45 258 dólares) por año de vida ganado ajustado por calidad [39]. Sobre esta base, el tratamiento con lenalidomida en combinación con dexametasona podría considerarse como potencialmente costo-efectivo frente al retratamiento con bortezomib asociándose a una razón de costo-efectividad incremental inferior a un PIB per cápita (8 410 266,92 pesos chilenos equivalentes a 13 886,35 dólares por año de vida ganado) y de costo-utilidad incremental inferior a tres veces el PIB (14 271 896,16 pesos chilenos equivalentes a 23 564,59 dólares por año de vida ajustado por calidad adicional).
El análisis de sensibilidad univariante muestra que las variables con mayor impacto en los resultados del análisis son el tiempo hasta el fallo y la sobrevida global en pacientes que hayan recibido dos o más terapias previas. En concreto, un incremento o un decremento del 20% en el tiempo hasta el fallo, haría oscilar el costo-utilidad incremental (valor basal) entre 4 579 321 pesos chilenos (7 561,00 dólares) y 22 799 751 pesos chilenos (37 645,09 dólares), respectivamente. Por otra parte, una variación de ± 20% en la sobrevida global se traduciría en una oscilación del costo-utilidad incremental comprendida entre 9 982 787 pesos chilenos (16 482,77 dólares) y 23 990 535 pesos chilenos (39 611,22 dólares) (Figura 2).
Los resultados del análisis de sensibilidad probabilístico muestran que en el 98,4% de las simulaciones, el tratamiento con lenalidomida en combinación con dexametasona sería potencialmente costo-efectivo frente a bortezomib junto con dexametasona, asociándose a un costo-utilidad incremental inferior al umbral de 27 410 507,70 pesos chilenos (45 258 dólares) (Figura 3).
Figura 2. Análisis de sensibilidad univariante (razón de costo-utilidad incremental).
El análisis de los costos y beneficios asociados a las alternativas actualmente disponibles para el tratamiento del mieloma múltiple es esencial para asegurar una asignación eficiente de los recursos. El presente estudio muestra que en el ámbito sanitario chileno, la lenalidomida en combinación con dexametasona sería una alternativa potencialmente costo-efectiva en el tratamiento en segunda línea de pacientes con mieloma múltiple no candidatos a trasplante, aportando un incremento significativo de la sobrevida sin superar el umbral de tres veces el PIB per cápita por año de vida ganado ajustado por calidad [38].
Los resultados hallados concuerdan con los reportados por otros estudios que han evaluado el costo-efectividad de la lenalidomida en combinación con dexametasona en el mismo grupo de pacientes, en otros entornos [40],[41]. En un estudio realizado en Noruega, el tratamiento con lenalidomida en combinación con dexametasona resultó costo-efectivo frente a bortezomib, asociándose a un mayor número de años de vida (4,06 versus 3,11) y a años de vida ajustados por calidad (2,95 versus 2,19) y a un costo incremental de 188 245 coronas noruegas (valor monetario a 2011), estimándose una razón de costo-efectividad de 198 714 coronas noruegas (valor monetario a 2011) por año de vida y un costo-utilidad incremental de 247 078 coronas noruegas (valor monetario a 2011) por año de vida ajustados por calidad [40].
De modo similar, en un estudio llevado a cabo en el ámbito sanitario griego, se estimó un incremento de 0,99 años de vida y 0,79 años de vida ajustados por calidad a favor de lenalidomida en combinación con dexametasona y un costo incremental de 28 741 euros, calculándose una razón de costo-efectividad incremental y de coste utilidad incremental de 29 415 euros por año de vida y de 38 268 euros por año de vida ajustado por calidad respectivamente [41]. Sobre la base de estos resultados, los autores concluyeron que el tratamiento con lenalidomida en combinación con dexametasona sería coste-efectivo frente a bortezomib, teniendo en cuenta una disposición a pagar tres veces el Producto Interno Bruto per cápita en Grecia (60 000 euros -según valor monetario a 2013- por año de vida ajustado por calidad).
Cabe destacar que contrariamente al presente estudio, los datos relativos a la eficacia de bortezomib empleados en los análisis económicos noruego y griego fueron extraídos del ensayo clínico APEX en el que se comparó la eficacia de bortezomib y dexametasona en altas dosis en pacientes con mieloma múltiple previamente tratados [42]. No obstante, en el estudio APEX, el tratamiento previo con bortezomib constituía un criterio de exclusión del ensayo, por lo que en el presente análisis no se consideró oportuno emplear esa fuente ya que la población incluida en ese estudio difiere sustancialmente de la población de interés (pacientes previamente tratados con bortezomib).
Por otra parte, en un estudio llevado a cabo en el entorno sueco, se concluyó que el tratamiento con bortezomib sería dominante frente a lenalidomida en combinación con dexametasona, asociándose a un mayor número de años de vida ajustados por calidad (2,95 versus 2,91 meses) y generando un ahorro de 546 126 coronas suecas (según el valor monetario de 2010) [43]. La divergencia entre estos resultados y los del presente trabajo se debe probablemente a diferencias metodológicas entre los mencionados estudios [43]. En concreto, el análisis sueco contempla solo tres posibles estados de salud (preprogresión, progresión y muerte) y utiliza un método paramétrico de modelización de la sobrevida (partitioned survival model) en el que la proporción de pacientes en cada estado es calculada en base a ecuaciones paramétricas [43].
En el presente análisis, por el contrario, se eligió emplear un modelo de transición de estados, como es el modelo de Markov. Esta elección se debe a la extensión del horizonte temporal y naturaleza de la enfermedad, que implica que los pacientes puedan experimentar fases de estabilidad (preprogresión con o sin tratamiento) y fases de progresión (progresión). Esta elección está en línea con las recomendaciones elaboradas por la Sociedad Internacional de Farmacoeconomía e Investigación de Resultados, en su Task Force, en el cual se indica que “si la conceptualización del problema de salud implica representar la enfermedad o el proceso de tratamiento como una serie de estados de salud, los modelos de transición de estado son apropiados” [11]. Asimismo, se indica que los modelos de transición son particularmente útiles en el caso de horizontes temporales amplios, como es el caso en el presente análisis11. Finalmente, un reciente estudio sugiere que, en comparación con otros tipos de diseños, los modelos de Markov resultan más adecuados cuando el análisis requiere la simulación de varias líneas de tratamiento consecutivas [12].
Este estudio no está exento de limitaciones. Debido a la ausencia de ensayos clínicos controlados que evalúen la eficacia del retratamiento con bortezomib en pacientes con mieloma múltiple previamente tratados, los datos relativos a la eficacia de bortezomib en combinación con dexametasona han sido extraídos de un estudio retrospectivo de retratamiento con bortezomib, realizado en pacientes con mieloma múltiple de Alemania y Suiza [15]. El tamaño muestral (n = 42) y el diseño del estudio pueden introducir cierta incertidumbre en el análisis realizado. No obstante, el estudio aporta datos relativos a la efectividad de bortezomib en la práctica clínica habitual, lo que confiere una mayor validez externa al análisis y generalización de los resultados. Asimismo, la concordancia de los resultados de este estudio con los realizados en el entorno noruego y griego indica que la elección del estudio retrospectivo de retratamiento con bortezomib, para la estimación de la eficacia de bortezomib no comporta una subestimación de los beneficios clínicos asociados a este tratamiento. Otra posible limitación de este análisis se relaciona con las características de la población incluida en los ensayos sobre mieloma múltiple MM-009 y MM-010, de los que se han extraído los datos de eficacia relativos al tratamiento con lenalidomida en combinación con dexametasona [13],[14]. En los estudios mencionados, una menor proporción de pacientes había recibido una única terapia previa antes de recibir el tratamiento con lenalidomida en combinación con dexametasona, por lo que la población incluida en los ensayos podría diferir de la población de interés. Sin embargo, el NICE Evidence Review Group, tras la revisión del presente estudio en su adaptación al Reino Unido, determinó que a pesar de estas diferencias, los resultados de los estudios sobre mieloma múltiple MM-009 y MM-010 podían ser extrapolados a la población de interés sin comprometer la generalización de los resultados [9].
En conjunto, pese a la posible incertidumbre asociada a los datos de eficacia a partir de los cuales se ha realizado la comparación entre los tratamientos evaluados, los análisis de sensibilidad indican que los resultados obtenidos son robustos. En concreto, el análisis de sensibilidad univariante muestra como en la mayoría de las variables evaluadas, la variación introducida en los valores del caso base, no afecta al costo-efectividad de lenalidomida en combinación con dexametasona frente a bortezomib. Asimismo, de acuerdo a los resultados del análisis de sensibilidad probabilístico, que evalúa el impacto de la variación simultánea de todos los parámetros del modelo en los resultados del análisis, el tratamiento con lenalidomida en combinación con dexametasona presenta un 98,4% de probabilidades de ser costo-efectivo frente a bortezomib, teniendo en cuenta una disposición a pagar de 27 410 507,70 pesos chilenos (45 258 dólares).
Este estudio sugiere que lenalidomida en combinación con dexametasona representa una alternativa potencialmente eficiente en el tratamiento en segunda línea de pacientes con mieloma múltiple no candidatos a trasplante desde la perspectiva del sistema público nacional de salud chileno, al proporcionar una mayor sobrevida y al suponer un costo por año de vida ganado inferior a un PIB per cápita y un costo por año de vida ganado ajustado por calidad inferior a tres veces el PIB per cápita chileno.
Roles de autoría
MA: Recopilación de datos, Metodología, Validación, Visualización, Redacción de borrador original, Redacción-revisión y edición. IG: Recopilación de datos, Metodología, Validación, Redacción de borrador original, Redacción-revisión y edición. LL: Metodología, Administración de proyectos, Supervisión, Validación, Redacción-revisión y edición. SA: Metodología, Administración de proyectos, Supervisión, Validación, Redacción-revisión y edición.
Agradecimientos
Se agradecen a la Dra. Camila Peña y Dra. Carolina Guerra por su participación en el proyecto, validando y aportando nuevos datos clínicos y económicos, que han permitido la adaptación del presente trabajo al ámbito sanitario público chileno.
Financiamiento
El presente trabajo de investigación fue financiado por la empresa Tecnofarma S.A. La empresa no tuvo influencia en el diseño del estudio, análisis o interpretación de los datos. Asimismo, no hubo influencia en la preparación, revisión o aprobación del manuscrito.
Declaración de conflicto de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran haber recibido financiamiento de parte de Tecnofarma S.A para la realización del estudio de evaluación económica. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.

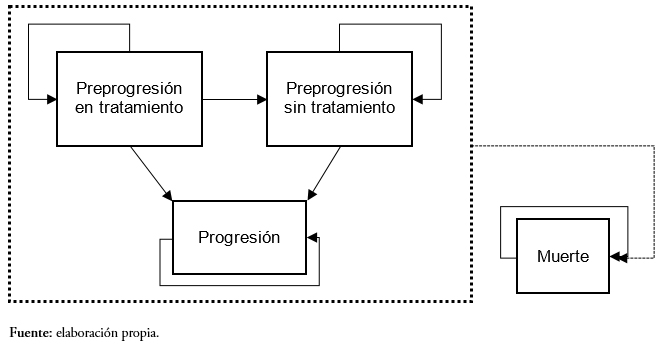 Figura 1. Estados de salud contemplados en el modelo.
Figura 1. Estados de salud contemplados en el modelo.

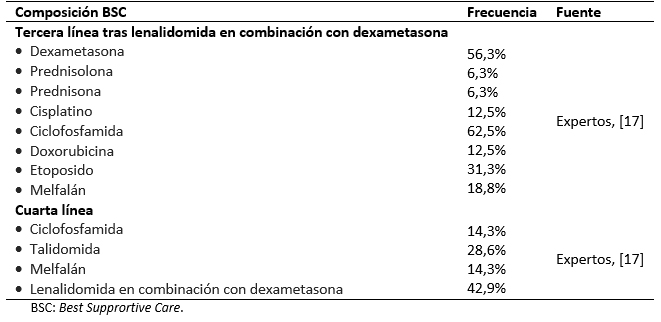 Tabla 1. Composición del Best supportive Care empleada en el modelo.
Tabla 1. Composición del Best supportive Care empleada en el modelo.

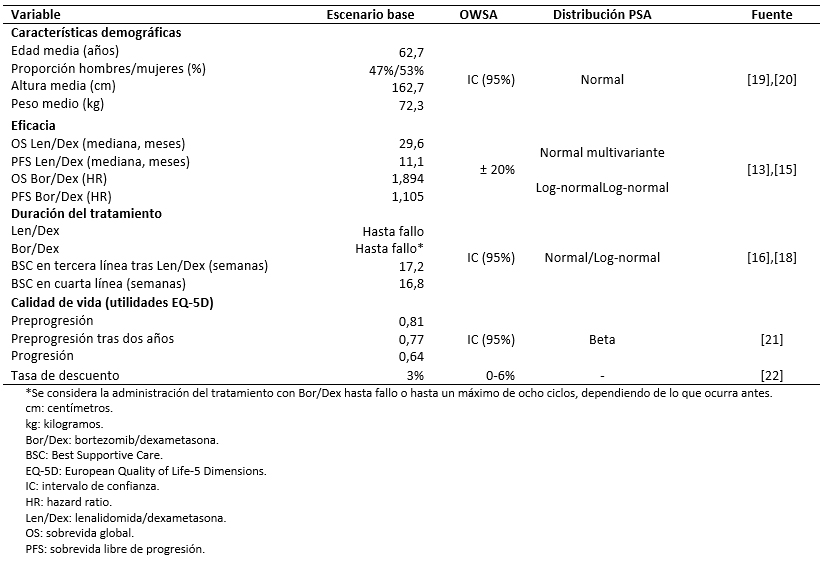 Tabla 2. Parámetros empleados en el modelo.
Tabla 2. Parámetros empleados en el modelo.

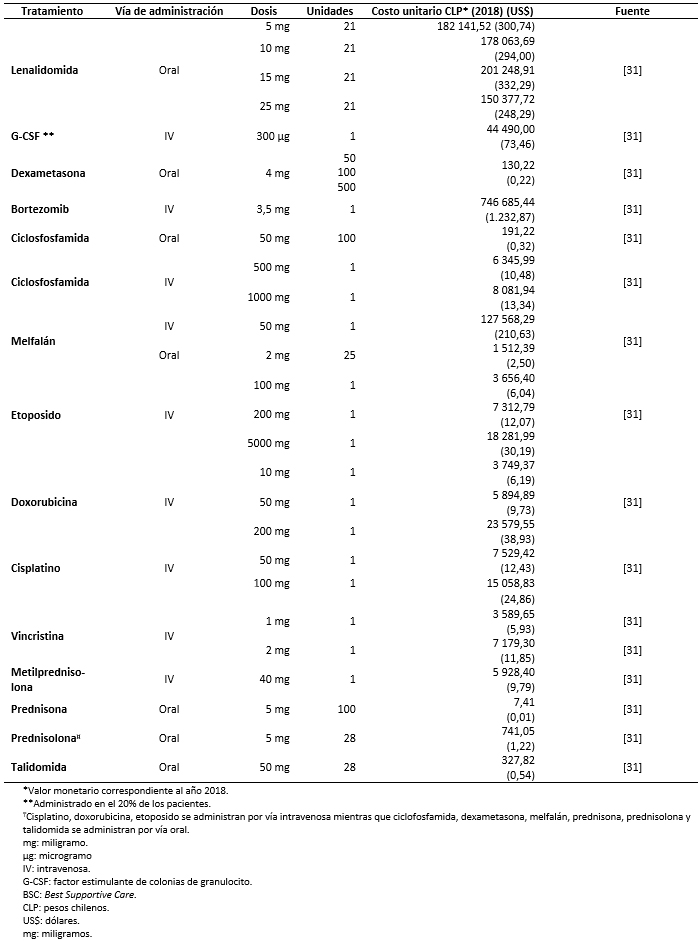 Tabla 3. Costos farmacológicos.
Tabla 3. Costos farmacológicos.

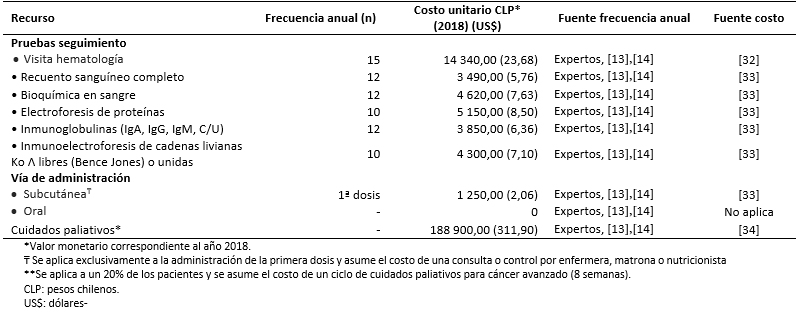 Tabla 4. Frecuencia y costos asociados al uso de recursos.
Tabla 4. Frecuencia y costos asociados al uso de recursos.

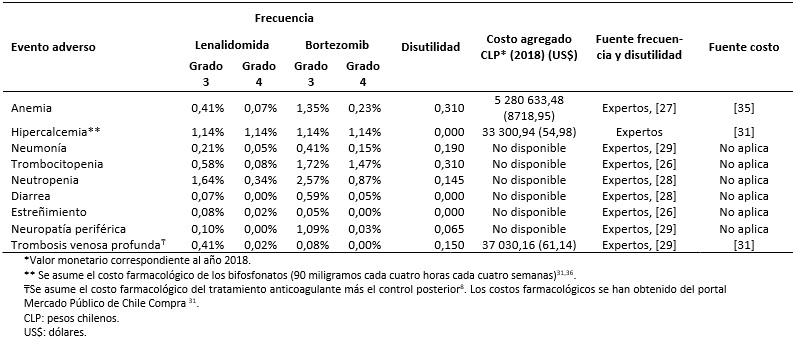 Tabla 5. Frecuencia y costo asociado al manejo de los eventos adversos (grado 3-4).
Tabla 5. Frecuencia y costo asociado al manejo de los eventos adversos (grado 3-4).

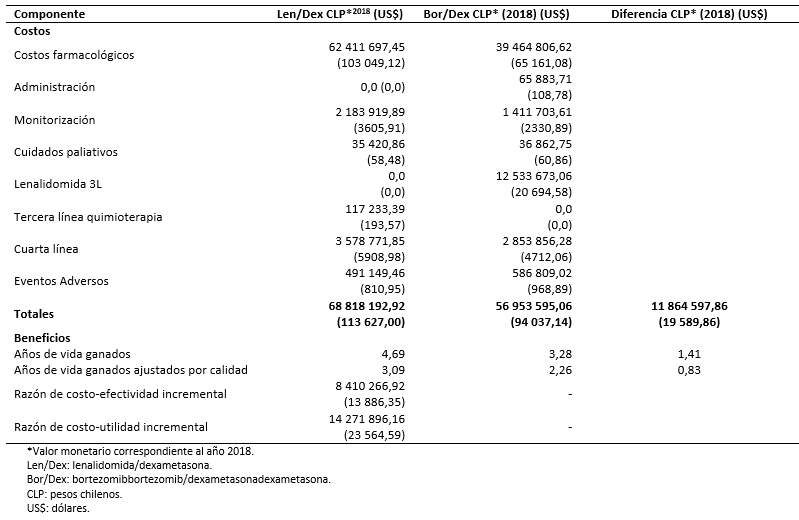 Tabla 6. Costos y beneficios asociados al tratamiento con Len/Dex y Bor/Dex.
Tabla 6. Costos y beneficios asociados al tratamiento con Len/Dex y Bor/Dex.

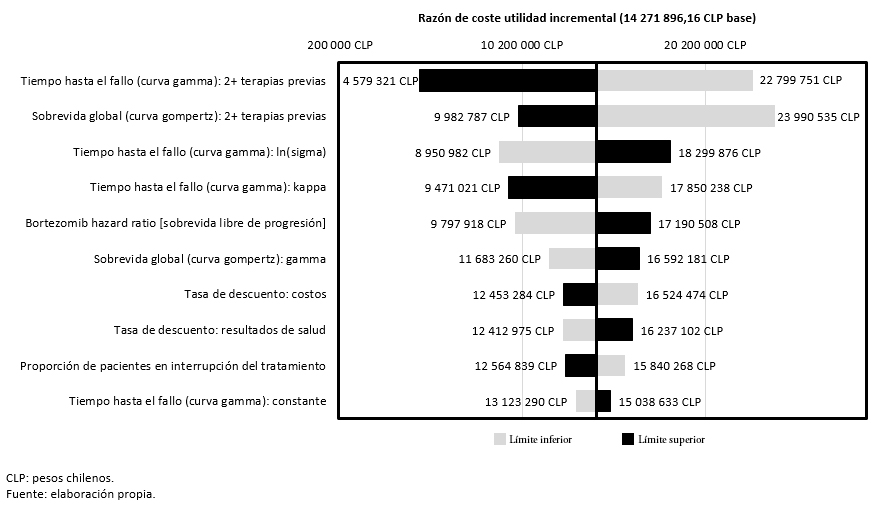 Figura 2. Análisis de sensibilidad univariante (razón de costo-utilidad incremental).
Figura 2. Análisis de sensibilidad univariante (razón de costo-utilidad incremental).

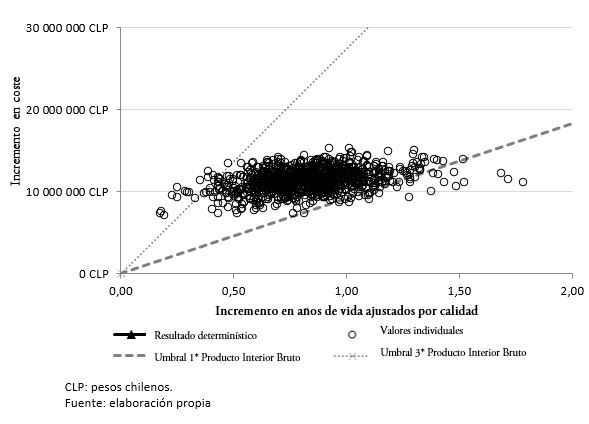 Figura 3. Resultados del análisis de sensibilidad probabilístico: plano costo-efectividad incremental.
Figura 3. Resultados del análisis de sensibilidad probabilístico: plano costo-efectividad incremental.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

BACKGROUND
Multiple myeloma is a hematologic malignancy affecting bone marrow derived plasma cells. Current therapies are not able to eradicate the disease and most patients become refractory to the treatment. Lenalidomide and bortezomib have proved effective in the second-line treatment of these patients.
OBJECTIVE
To evaluate the cost-effectiveness of lenalidomide in combination with dexamethasone compared to bortezomib in combination with dexamethasone in patients with multiple myeloma previously treated with bortezomib, from the perspective of the Chilean National Health Service.
METHODOLOGY
A four-state Markov model (preprogression on treatment; preprogression off treatment, progression and death) was used to simulate the evolution of a cohort of multiple myeloma patients over a 25-year time horizon. Efficacy data, resource use and frequency of adverse events were extracted from MM009/010 studies and a retrospective analysis of retreatment with bortezomib. All inputs were validated by experts. A 3% annual discount rate was used for costs and health outcomes. The robustness of the results was evaluated through univariate and probabilistic sensitivity analyses.
RESULTS
Lenalidomide in combination with dexamethasone treatment provided 1.41 incremental life years and 0.83 incremental quality-adjusted life years in comparison with bortezomib in combination with dexamethasone, with an incremental cost of 11 864 597.86 CLP (19 589.86 US$). The incremental cost-effectiveness and cost-utility ratio were estimated at 8 410 266.92 CLP (13 886,35 US$) / incremental life year and 14 271 896.16 CLP (23 564,59 US$)/incremental quality-adjusted life years, respectively.
CONCLUSIONS
Lenalidomide in combination with dexamethasone represents a potentially cost-effective alternative for the second-line treatment of patients with multiple myeloma who are not eligible for transplantation, from the perspective of the Chilean National Health Service.
 Autores:
Susana Aceituno[1], Irmina Gozalbo[1], Marilena Appierto[1], Luis Lizán[1,2]
Autores:
Susana Aceituno[1], Irmina Gozalbo[1], Marilena Appierto[1], Luis Lizán[1,2]

Citación: Aceituno S, Gozalbo I, Appierto M, Lizán L. Cost-effectiveness of lenalidomide in combination with dexamethasone compared to bortezomib in combination with dexamethasone for the second-line treatment of multiple myeloma in Chile. Medwave 2018 May-Jun;18(3):e7220 doi: 10.5867/medwave.2018.03.7220
Fecha de envío: 7/11/2017
Fecha de aceptación: 13/5/2018
Fecha de publicación: 29/6/2018
Origen: no solicitado
Tipo de revisión: con revisión por tres pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia. 2009 Jan;23(1):3-9.
| CrossRef | PubMed |
Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia. 2009 Jan;23(1):3-9.
| CrossRef | PubMed | Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos MV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48. | CrossRef | PubMed |
Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos MV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014 Nov;15(12):e538-48. | CrossRef | PubMed | GLOBOCAN 2012. Estimated cancer Incidence, Mortality, Prevalence and Disability-adjusted life years (DALYs) Worldwide in 2012. [on line] | Link |
GLOBOCAN 2012. Estimated cancer Incidence, Mortality, Prevalence and Disability-adjusted life years (DALYs) Worldwide in 2012. [on line] | Link | Sonneveld P, De Wit E, Moreau P. How have evolutions in strategies for the treatment of relapsed/refractory multiple myeloma translated into improved outcomes for patients? Crit Rev Oncol Hematol. 2017 Apr;112:153-170. | CrossRef | PubMed |
Sonneveld P, De Wit E, Moreau P. How have evolutions in strategies for the treatment of relapsed/refractory multiple myeloma translated into improved outcomes for patients? Crit Rev Oncol Hematol. 2017 Apr;112:153-170. | CrossRef | PubMed | Moreau P, San Miguel J, Sonneveld P, Mateos MV, Zamagni E, Avet-Loiseau H, et al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017 Jul 1;28(suppl_4):iv52-iv61. | CrossRef | PubMed |
Moreau P, San Miguel J, Sonneveld P, Mateos MV, Zamagni E, Avet-Loiseau H, et al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017 Jul 1;28(suppl_4):iv52-iv61. | CrossRef | PubMed | Anderson KC, Alsina M, Atanackovic D, Biermann JS, Chandler JC, Costello C, Djulbegovic B, et al. NCCN Guidelines Insights: Multiple Myeloma, Version 3.2016. J Natl Compr Canc Netw. 2016 Apr;14(4):389-400. | PubMed |
Anderson KC, Alsina M, Atanackovic D, Biermann JS, Chandler JC, Costello C, Djulbegovic B, et al. NCCN Guidelines Insights: Multiple Myeloma, Version 3.2016. J Natl Compr Canc Netw. 2016 Apr;14(4):389-400. | PubMed | Sociedad Chilena de Hematología SOCHIHEM 2014. Guías prácticas clínicas para diagnóstico y tratamiento de mieloma múltiple. 2014. hematologia.org [On line] | Link |
Sociedad Chilena de Hematología SOCHIHEM 2014. Guías prácticas clínicas para diagnóstico y tratamiento de mieloma múltiple. 2014. hematologia.org [On line] | Link | National Institute for Health and Care Excellence (NICE). Lenalidomide for treating multiple myeloma after 1 prior treatment with bortezomib (part-review of TA171): appraisal consultation document. nice.org.uk [on line]. | Link |
National Institute for Health and Care Excellence (NICE). Lenalidomide for treating multiple myeloma after 1 prior treatment with bortezomib (part-review of TA171): appraisal consultation document. nice.org.uk [on line]. | Link | Husereau D, Drummond M, Petrou S, Carswell C, Moher D, Greenberg D, et al. Consolidated Health Economic Evaluation Reporting Standards (CHEERS) statement. Eur J Health Econ. 2013 Jun;14(3):367-72. | CrossRef | PubMed |
Husereau D, Drummond M, Petrou S, Carswell C, Moher D, Greenberg D, et al. Consolidated Health Economic Evaluation Reporting Standards (CHEERS) statement. Eur J Health Econ. 2013 Jun;14(3):367-72. | CrossRef | PubMed | Roberts M, Russell LB, Paltiel AD, Chambers M, McEwan P, Krahn M; ISPOR-SMDM Modeling Good Research Practices Task Force. Conceptualizing a model: a report of the ISPOR-SMDM Modeling Good Research Practices Task Force-2. Med Decis Making. 2012 Sep-Oct;32(5):678-89. | PubMed |
Roberts M, Russell LB, Paltiel AD, Chambers M, McEwan P, Krahn M; ISPOR-SMDM Modeling Good Research Practices Task Force. Conceptualizing a model: a report of the ISPOR-SMDM Modeling Good Research Practices Task Force-2. Med Decis Making. 2012 Sep-Oct;32(5):678-89. | PubMed | Minacori R, Bonastre J, Lueza B, Marguet S, Levy P. How to Model Survival In Cost-Effectiveness Analysis? Differences Between Markov and Partitioned Survival Analysis Models. Value Health. 2015 Nov;18(7):A704. | CrossRef | PubMed |
Minacori R, Bonastre J, Lueza B, Marguet S, Levy P. How to Model Survival In Cost-Effectiveness Analysis? Differences Between Markov and Partitioned Survival Analysis Models. Value Health. 2015 Nov;18(7):A704. | CrossRef | PubMed | Weber DM, Chen C, Niesvizky R, Wang M, Belch A, Stadtmauer EA, Siegel D, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med. 2007 Nov 22;357(21):2133-42. | PubMed |
Weber DM, Chen C, Niesvizky R, Wang M, Belch A, Stadtmauer EA, Siegel D, et al. Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America. N Engl J Med. 2007 Nov 22;357(21):2133-42. | PubMed | Dimopoulos M, Spencer A, Attal M, Prince HM, Harousseau JL, Dmoszynska A, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med. 2007 Nov 22;357(21):2123-32. | PubMed |
Dimopoulos M, Spencer A, Attal M, Prince HM, Harousseau JL, Dmoszynska A, et al. Lenalidomide plus dexamethasone for relapsed or refractory multiple myeloma. N Engl J Med. 2007 Nov 22;357(21):2123-32. | PubMed | Taverna C, Voegeli J, Trojan A, Olie RA, von Rohr A. Effective response with bortezomib retreatment in relapsed multiple myeloma--a multicentre retrospective survey in Switzerland. Swiss Med Wkly. 2012 Apr 27;142:w13562. | CrossRef | PubMed |
Taverna C, Voegeli J, Trojan A, Olie RA, von Rohr A. Effective response with bortezomib retreatment in relapsed multiple myeloma--a multicentre retrospective survey in Switzerland. Swiss Med Wkly. 2012 Apr 27;142:w13562. | CrossRef | PubMed | Myeloma Pathways 2007-9 data. Haematological Malignancy Research Network, York UK.
Myeloma Pathways 2007-9 data. Haematological Malignancy Research Network, York UK.  Ministerio de Salud (MINSAL) Gobierno de Chile. Encuesta Nacional de Salud ENS Chile 2009-2010. [on line] | Link |
Ministerio de Salud (MINSAL) Gobierno de Chile. Encuesta Nacional de Salud ENS Chile 2009-2010. [on line] | Link | Conté LG, Figueroa MG, Lois VV, Cabrera C ME, León RA, García LH, Rojas R H. [Clinical features and survival of Chilean patients with multiple myeloma]. Rev Med Chil. 2007 Sep;135(9):1111-7. | PubMed |
Conté LG, Figueroa MG, Lois VV, Cabrera C ME, León RA, García LH, Rojas R H. [Clinical features and survival of Chilean patients with multiple myeloma]. Rev Med Chil. 2007 Sep;135(9):1111-7. | PubMed | van Agthoven M, Segeren CM, Buijt I, Uyl-de Groot CA, van der Holt B, Lokhorst HM, et al. A cost-utility analysis comparing intensive chemotherapy alone to intensive chemotherapy followed by myeloablative chemotherapy with autologous stem-cell rescue in newly diagnosed patients with stage II/III multiple myeloma; a prospective randomised phase III study. Eur J Cancer. 2004 May;40(8):1159-69. | PubMed |
van Agthoven M, Segeren CM, Buijt I, Uyl-de Groot CA, van der Holt B, Lokhorst HM, et al. A cost-utility analysis comparing intensive chemotherapy alone to intensive chemotherapy followed by myeloablative chemotherapy with autologous stem-cell rescue in newly diagnosed patients with stage II/III multiple myeloma; a prospective randomised phase III study. Eur J Cancer. 2004 May;40(8):1159-69. | PubMed | Ministerio de Salud, Gobierno de Chile. Guía Metodológica para la Evaluación Económica de intervenciones en Salud en Chile. Santiago, Chile: Minsal;2013:16-36. | Link |
Ministerio de Salud, Gobierno de Chile. Guía Metodológica para la Evaluación Económica de intervenciones en Salud en Chile. Santiago, Chile: Minsal;2013:16-36. | Link | Roberts M1, Russell LB, Paltiel AD, Chambers M, McEwan P, Krahn M. Conceptualizing a model: a report of the ISPOR-SMDM Modeling Good Research Practices Task Force--2. Value Health. 2012 Sep-Oct;15(6):804-11. | CrossRef | PubMed |
Roberts M1, Russell LB, Paltiel AD, Chambers M, McEwan P, Krahn M. Conceptualizing a model: a report of the ISPOR-SMDM Modeling Good Research Practices Task Force--2. Value Health. 2012 Sep-Oct;15(6):804-11. | CrossRef | PubMed | Becerril-Montekio V, de Dios Reyes J, Manuel A. Sistema de salud de Chile. Salud Publica Mex. 2011;53(SUPPL.2):s132-42. | Link |
Becerril-Montekio V, de Dios Reyes J, Manuel A. Sistema de salud de Chile. Salud Publica Mex. 2011;53(SUPPL.2):s132-42. | Link | National Institute for health and Care Excellence (NICE). Single Technology Appraisal (STA) of lenalidomide for the treatment of multiple myeloma in people who have received at least one prior therapy with bortezomib (partial review of TA171). Celgene submission of evidence. nice.org.uk [on line]. | Link |
National Institute for health and Care Excellence (NICE). Single Technology Appraisal (STA) of lenalidomide for the treatment of multiple myeloma in people who have received at least one prior therapy with bortezomib (partial review of TA171). Celgene submission of evidence. nice.org.uk [on line]. | Link | Coffey JT, Brandle M, Zhou H, Marriott D, Burke R, Tabaei BP, et al. Valuing health-related quality of life in diabetes. Diabetes Care. 2002 Dec;25(12):2238-43. | PubMed |
Coffey JT, Brandle M, Zhou H, Marriott D, Burke R, Tabaei BP, et al. Valuing health-related quality of life in diabetes. Diabetes Care. 2002 Dec;25(12):2238-43. | PubMed | Ossa DF, Briggs A, McIntosh E, Cowell W, Littlewood T, Sculpher M. Recombinant erythropoietin for chemotherapy-related anaemia: economic value and health-related quality-of-life assessment using direct utility elicitation and discrete choice experiment methods. Pharmacoeconomics. 2007;25(3):223-37. | PubMed |
Ossa DF, Briggs A, McIntosh E, Cowell W, Littlewood T, Sculpher M. Recombinant erythropoietin for chemotherapy-related anaemia: economic value and health-related quality-of-life assessment using direct utility elicitation and discrete choice experiment methods. Pharmacoeconomics. 2007;25(3):223-37. | PubMed | Lloyd A, Nafees B, Narewska J, Dewilde S, Watkins J. Health state utilities for metastatic breast cancer. Br J Cancer. 2006 Sep 18;95(6):683-90. | PubMed |
Lloyd A, Nafees B, Narewska J, Dewilde S, Watkins J. Health state utilities for metastatic breast cancer. Br J Cancer. 2006 Sep 18;95(6):683-90. | PubMed | Cykert S, Joines JD, Kissling G, Hansen CJ. Racial differences in patients' perceptions of debilitated health states. J Gen Intern Med. 1999 Apr;14(4):217-22. | PubMed |
Cykert S, Joines JD, Kissling G, Hansen CJ. Racial differences in patients' perceptions of debilitated health states. J Gen Intern Med. 1999 Apr;14(4):217-22. | PubMed | Mathias SD, Prebil LA, Putterman CG, Chmiel JJ, Throm RC, Comerota AJ. A Health-Related Quality of Life Measure in Patients with Deep Vein Thrombosis: A Validation Study. Ther Innov Regul Sci 1999 Oct 1;33(4):1173–87. | CrossRef |
Mathias SD, Prebil LA, Putterman CG, Chmiel JJ, Throm RC, Comerota AJ. A Health-Related Quality of Life Measure in Patients with Deep Vein Thrombosis: A Validation Study. Ther Innov Regul Sci 1999 Oct 1;33(4):1173–87. | CrossRef | FONASA. Alivio del Dolor y Cuidados Paliativos por Cáncer Avanzado. Disponible en: Alivio del Dolor y Cuidados Paliativos por Cáncer Avanzado. [on line]
FONASA. Alivio del Dolor y Cuidados Paliativos por Cáncer Avanzado. Disponible en: Alivio del Dolor y Cuidados Paliativos por Cáncer Avanzado. [on line]  Vargas CL, Espinoza MA, Giglio A, Soza A. Cost Effectiveness of Daclatasvir/Asunaprevir Versus Peginterferon/Ribavirin and Protease Inhibitors for the Treatment of Hepatitis c Genotype 1b Naïve Patients in Chile. PLoS One. 2015 Nov 6;10(11):e0141660. | CrossRef | PubMed |
Vargas CL, Espinoza MA, Giglio A, Soza A. Cost Effectiveness of Daclatasvir/Asunaprevir Versus Peginterferon/Ribavirin and Protease Inhibitors for the Treatment of Hepatitis c Genotype 1b Naïve Patients in Chile. PLoS One. 2015 Nov 6;10(11):e0141660. | CrossRef | PubMed | Marseille E, Larson B, Kazi DS, Kahn JG, Rosen S. Thresholds for the cost-effectiveness of interventions: alternative approaches. Bull World Health Organ. 2015 Feb 1;93(2):118-24. | CrossRef | PubMed |
Marseille E, Larson B, Kazi DS, Kahn JG, Rosen S. Thresholds for the cost-effectiveness of interventions: alternative approaches. Bull World Health Organ. 2015 Feb 1;93(2):118-24. | CrossRef | PubMed | Möller J, Nicklasson L, Murthy A. Cost-effectiveness of novel relapsed-refractory multiple myeloma therapies in Norway: lenalidomide plus dexamethasone vs bortezomib. J Med Econ. 2011;14(6):690-7. | CrossRef | PubMed |
Möller J, Nicklasson L, Murthy A. Cost-effectiveness of novel relapsed-refractory multiple myeloma therapies in Norway: lenalidomide plus dexamethasone vs bortezomib. J Med Econ. 2011;14(6):690-7. | CrossRef | PubMed | Fragoulakis V, Kastritis E, Psaltopoulou T, Maniadakis N. Economic evaluation of therapies for patients suffering from relapsed-refractory multiple myeloma in Greece. Cancer Manag Res. 2013 Apr 10;5:37-48. | CrossRef | PubMed |
Fragoulakis V, Kastritis E, Psaltopoulou T, Maniadakis N. Economic evaluation of therapies for patients suffering from relapsed-refractory multiple myeloma in Greece. Cancer Manag Res. 2013 Apr 10;5:37-48. | CrossRef | PubMed | Richardson PG, Sonneveld P, Schuster MW, Irwin D, Stadtmauer EA, Facon T, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med. 2005 Jun 16;352(24):2487-98. | PubMed |
Richardson PG, Sonneveld P, Schuster MW, Irwin D, Stadtmauer EA, Facon T, et al. Bortezomib or high-dose dexamethasone for relapsed multiple myeloma. N Engl J Med. 2005 Jun 16;352(24):2487-98. | PubMed |