 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: dermatomyositis, paraneoplastic syndrome, small cell carcinoma
La dermatomiositis es una miopatía inflamatoria autoinmune, asociada a manifestaciones dermatológicas. Su vinculación con neoplasias está ampliamente reportada, siendo más común en el cáncer pulmonar, especialmente en carcinoma de células pequeñas probablemente por su origen en precursores de células neuroendocrinas, así como también en cáncer de mama y ovario. La baja frecuencia de dermatomiositis dificulta la sospecha de las lesiones subyacentes entre las posibilidades diagnósticas de las enfermedades sistémicas con manifestaciones cutáneas. Por ello siempre se debe considerar la alta probabilidad de una neoplasia, con reportes de hasta 75% en la población oriental y cerca de 40% en general. En este artículo se presenta un caso poco frecuente de dermatomiositis con lesiones de distribución en chal, como debut sintomático de un carcinoma pulmonar de células pequeñas.
La dermatomiositis es una miopatía inflamatoria idiopática autoinmune, que se asocia a manifestaciones cutáneas típicas. Esta patología fue descrita en 1975 y se clasificó en cinco tipos: polimiositis idiopática primaria, dermatomiositis idiopática primaria, polimiositis/dermatomiositis asociadas a cáncer, polimiositis/dermatomiositis juveniles, polimiositis/dermatomiositis asociadas a vasculitis y enfermedades colágeno-vasculares [1],[2].
Para el diagnóstico de dermatomiositis se requiere la presencia de por lo menos tres de los siguientes síntomas:
a) Debilidad muscular simétrica y progresiva de las extremidades superiores e inferiores, con o sin disfagia o compromiso de la musculatura respiratoria asociada.
b) Biopsia muscular que confirme miositis.
c) Aumento de las enzimas musculares a nivel plasmático.
d) Alteraciones electromiográficas concordantes con daño muscular primario.
e) Lesiones cutáneas características [1],[2].
La biopsia muscular demuestra inflamación perivascular con una mezcla de linfocitos T y B, más atrofia perifascicular [3]. Los hallazgos histopatólogicos cutáneos incluyen hiperqueratosis, apoptosis, degeneración vacuolar celular basal epidérmica, depósito de mucina aumentado en dermis y una dermatitis de interfase con pobre celularidad [4].
Clásicamente se han considerado dos tipos de lesiones cutáneas como patognomónicas de esta patología. La primera es el eritema heliotropo facial, un eritema macular violáceo, localizado especialmente en zonas fotoexpuestas, fundamentalmente en región facial, aunque también se puede ubicar en hombros, brazos y espalda (distribución en chal). El otro tipo de lesiones son las pápulas de Gottron. Se trata de pápulas violáceas sobre eminencias óseas, habitualmente distribuidas en articulaciones metacarpofalángicas e interfalángicas proximales, codos y rodillas. Otras lesiones que se pueden observar en esta patología son telangectasias periungueales, hipertrofia cuticular, infartos periungueales, poiquilodermia, eritema pruriginoso del cuero cabelludo y fotosensibilidad [5].
A continuación se presenta un caso clínico de dermatomiositis como primera presentación de un carcinoma de células pequeñas. Se trata de un caso poco frecuente de dermatomiositis con lesiones de distribución en chal, como debut sintomático de un carcinoma pulmonar de células pequeñas
Paciente de sexo masculino de 56 años, con antecedentes de hipertensión arterial, tabaquismo crónico activo, con un índice de paquetes de cigarrillos al año mayor de 25 y antecedente de cáncer de colon en una hermana. Consultó en el servicio de urgencias por un cuadro de un mes de evolución, caracterizado por un rash cutáneo pruriginoso, que comenzó en la región torácica anterosuperior y que posteriormente se generalizó. Refirió, además, debilidad muscular proximal.
Al examen dermatológico destacó la presencia de placas eritematosas descamativas, asociadas a máculas eritematosas, poiquilodermatosas en región pectoral, abdomen, dorso, región lumbar, región axilar y extremidades superiores e inferiores, que cubrían aproximadamente un 30% de la superficie corporal del paciente. Las lesiones que se encontraban en hombros, brazos y espalda seguían una distribución “en chal”. Además se podían observar pápulas violáceas sobre articulaciones metacarpofalángicas e interfalángicas proximales, compatibles con pápulas de Gottron.
Se realizaron exámenes de laboratorio que evidenciaron anemia leve, normocítica, normocrómica con una transferrina sérica elevada, compatible con etiología inflamatoria, aumento de la enzima lactato deshidrogenasa y las enzimas musculares, anticuerpo anti-nuclear positivo con patrón moteado en un título de 1/160 y antígeno carcinoembrionario levemente elevado. Los estudios serológicos para hepatitis y virus de inmunodeficiencia humana fueron negativos.
El estudio electromiográfico reveló un gran aumento de la actividad insercional, ondas agudas positivas y fibrilaciones en reposo, con patrón de interferencia precoz de baja amplitud y con abundantes polifásicos en músculos proximales. Todo esto es compatible con un patrón miopático inflamatorio severo.
Se practicó una biopsia cutánea de las lesiones. Esta evidenció una dermatitis de interfase vacuolar con clivaje subepidérmico y mucinosis dérmica, compatible con dermatomiositis.
Al diagnosticarse la dermatomiositis, en reunión clínica se acordó realizar una tomografía computarizada de tórax, abdomen y pelvis para descartar una posible neoplasia oculta. El resultado de este examen arrojó la presencia de adenopatías hiliares y mediastínicas, asociado a esplenomegalia. Se consiguieron muestras histológicas de las adenopatías mediastínicas a través de videotoracoscopía. El estudio histopatológico e inmunohistoquímico confirmó la presencia de carcinoma indiferenciado de células pequeñas.
Figura 2. Tomografía computarizada.
Figura 3. Biopsia con hematoxilina-eosina.
Con el diagnóstico de carcinoma pulmonar de células pequeñas confirmado, se decidió iniciar esquema de quimioterapia con intención paliativa. En controles sucesivos se demostró resolución casi completa de las lesiones cutáneas, con lesiones residuales pequeñas. El paciente se mantiene en control ambulatorio.
Los síndromes paraneoplásicos pueden ser la primera manifestación de enfermedades malignas o bien de su recurrencia [6]. El cáncer pulmonar, particularmente el carcinoma de células pequeñas, es uno de los que más frecuentemente se asocia a síndromes paraneoplásicos debido a su origen en precursores de células neuroendocrinas [3].
Se ha observado que la frecuencia de cáncer en pacientes con dermatomiositis está aumentada [7]. El primer caso fue publicado por Stertz en 1916, quien describió un caso asociado a cáncer gástrico [8]. Ese mismo año Kankeleit describió un caso relacionado a cáncer de mama [9]. La frecuencia de neoplasias en pacientes con dermatomiositis es variable de acuerdo a las características de los pacientes estudiados. Sin embargo, se ha estimado entre 4,4% y 43% en población caucásica [10] y hasta en el 75% de los casos en países orientales [11].
Una revisión sistemática de 2014 estimó una prevalencia de cáncer de hasta 20,5%, similar a lo reportado en la mayoría de los estudios poblacionales más precisos (25% del total de casos de dermatomiositis) [7],[8],[9],[10],[11],[12],[13],[14],[15],[16]. No obstante, esta asociación varía con la edad, puesto que se ha visto que pacientes con más de 40 años tendrían mayor riesgo de cáncer [11],[17],[18]. La información de acuerdo al sexo es contradictoria [7],[17],[18],[19],[20], aunque un metanálisis de casos y controles demostró mayor asociación en el sexo masculino [21].
Dourmishev reportó mayor asociación con cáncer pulmonar en el sexo masculino, así como de ovario y mama en el femenino [18]. Sin embargo, un metanálisis realizado en 2015 mostró el elevado riesgo que tienen los pacientes con dermatomiositis de desarrollar una neoplasia hematológica como linfoma no Hodgkin, leucemia y mieloma múltiple [22]. A pesar de ello, en la población oriental la asociación con el carcinoma nasofaríngeo es significativamente más alta que con otras neoplasias [11],[17],[19],[23], probablemente debido a una predisposición genética [24].
Un estudio retrospectivo de 115 casos de dermatomiositis asociada a neoplasia maligna reportó que 17,4% de los casos se asociaba a cáncer pulmonar [17]. En 2015 Tyler y colaboradores, reportaron un caso de dermatomiositis como primera manifestación clínica de un cáncer pulmonar de células pequeñas en un paciente sin otros síntomas [5]. Otros casos similares fueron reportados por Lee y colaboradores en 2012 y por Chao y colaboradores el mismo año [25],[26].
Diversos estudios han pretendido establecer el perfil de paciente con mayor riesgo de presentar una neoplasia subyacente, con tal de buscar un cáncer de forma dirigida. La presencia de disfagia, disnea, eritema heliotropo, debilidad muscular, artralgia y anticuerpos 155/140 se ha asociado a un mayor riesgo de malignidad [12].
Por otra parte, la enfermedad pulmonar intersticial [21],[27],[28],[29],[30],[31], la artritis [21],[27],[29],[30],[31], fenómeno de Raynaud [18],[27],[29],[31],[32],[33], la presencia de fiebre [29], [34], altos títulos de positividad de anticuerpos antinucleares [27],[29],[31] y la positividad de anticuerpos anti Jo-1 y anti anticuerpos contra antígenos nucleares extraíbles [12] se han asociado a menor riesgo de malignidad. Ha sido reportado que los anticuerpos anti-p155 tienen una sensibilidad y especificidad de 78% y 89% respectivamente para predecir la presencia de malignidad [35].
Asimismo, en 2007 se evidenció que ante la combinación de anticuerpos anti-p155 positivos y anticuerpos anti Jo-1, anti Ku, anti PM-Scl y anti U1RNP negativos, la sensibilidad y especificidad para diagnosticar dermatomiositis paraneoplásica se elevaba a 94% y 99% respectivamente [36]. También se ha visto que aquellos pacientes que presentaban estos anticuerpos tenían más rash heliotropo, pápulas de Gottron y rash en cuello de camisa [37].
Los mecanismos por los cuales las enfermedades neoplásicas generan dermatomiositis no están totalmente comprendidos. Clásicamente se ha considerado como una enfermedad mediada humoralmente a través de la producción de anticuerpos contra las células tumorales, las que generan una reacción cruzada con las células musculares propias [38]. No obstante, evidencia más actual sugiere mecanismos de inmunidad celular y alteraciones en la respuesta inmune innata que jugarían un rol patogénico fundamental [39]. Existen autoantígenos específicos de dermatomiositis que se expresan en altos niveles tanto en células musculares como tumorales en división [40],[41],[42].
El pilar del tratamiento de la dermatomiositis son los corticoides [43], sin embargo estos síndromes suelen responder menos a la terapia comparados con aquellos no paraneoplásicos [44],[45]. El tratamiento específico del cáncer mejora la sintomatología, pero hasta un 30% de los pacientes podría presentar un déficit motor residual [6].
La baja frecuencia de dermatomiositis dificulta la sospecha de las lesiones subyacentes entre las posibilidades diagnósticas de las enfermedades sistémicas con manifestaciones cutáneas, por lo que siempre se debe tener en cuenta la alta probabilidad de una neoplasia subyacente, con reportes de hasta 75% en la población oriental y cerca de 40% en general.
Es importante recordar que la dermatomiositis en adultos se asocia con un riesgo aumentado de cáncer y que el manejo de la neoplasia puede mejorar el cuadro músculo-cutáneo, aunque en ocasiones su curso es independiente. Las lesiones subyacentes más importantes a sospechar son tumores ováricos, pulmonares, de mama y del tracto gastrointestinal. De los tumores pulmonares, el más relevante es el cáncer de células pequeñas. En población asiática debe considerarse el carcinoma nasofaríngeo.
Para llegar a un diagnóstico adecuado es necesaria una elevada sospecha clínica, exámenes de imagen y estudios histopatológicos. Creemos que este caso representa un aporte al reconocimiento de esta presentación infrecuente del cáncer pulmonar.
Agradecimientos
Los autores gradecen a: Héctor Opazo por la entrega de imágenes y descripción de la lesión biopsiada; a Mario Santamarina por la entrega de imágenes y descripción de la tomografía computada y a Cristian González por su aporte en la adquisición de datos y aprobación final del manuscrito.
Aspectos éticos
El consentimiento informado solicitado por Medwave, ha sido firmado por el paciente; una copia de este fue remitido a la dirección editorial de la Revista.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

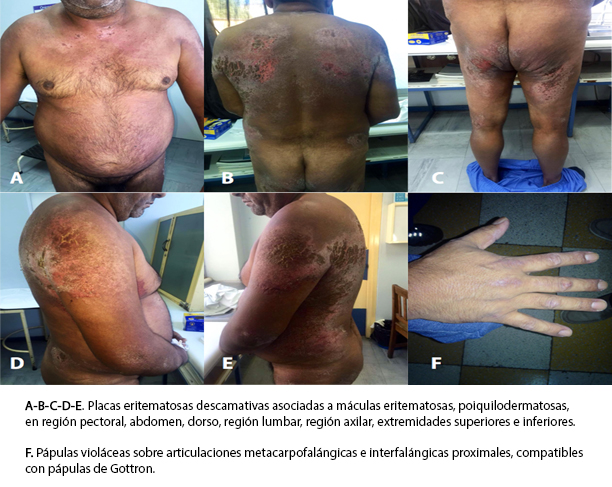 Figura 1. Lesiones cutáneas.
Figura 1. Lesiones cutáneas.

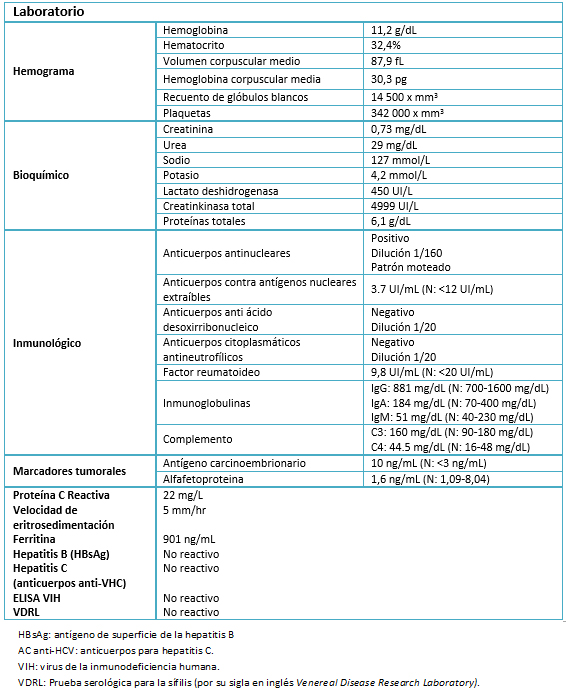 Tabla 1. Analítica en sangre.
Tabla 1. Analítica en sangre.

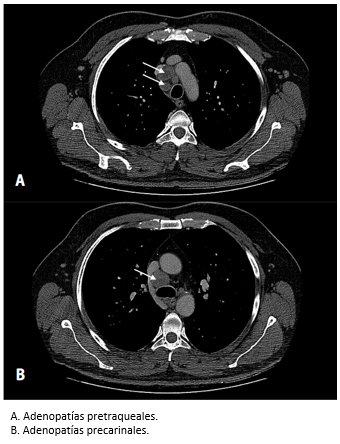 Figura 2. Tomografía computarizada.
Figura 2. Tomografía computarizada.

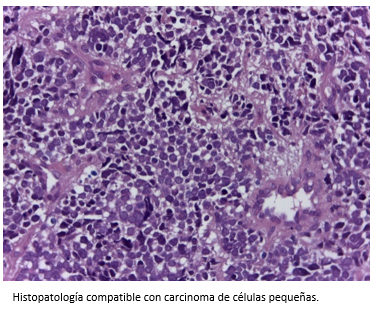 Figura 3. Biopsia con hematoxilina-eosina.
Figura 3. Biopsia con hematoxilina-eosina.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Dermatomyositis is an autoimmune inflammatory myopathy associated with dermatologic findings. Its association with neoplasms is widely reported and has been shown to be higher in lung cancer, particularly small-cell carcinoma, probably as it originates from neuroendocrine cell precursors, as well as breast and ovarian cancer. The low frequency of dermatomyositis makes it difficult to suspect the underlying lesions among the diagnostic possibilities of systemic diseases with cutaneous manifestations. Therefore, the high probability of a neoplasm should always be considered, with reports of up to 75% in the eastern population and about 40% in general. In this report, we present a rare case of dermatomyositis with lesions in a shawl-like distribution, as a symptomatic debut of a small cell lung carcinoma.
 Autores:
Herman Ahumada Piña[1], Luis Fuentes Cabrera[1], Rodrigo Selamé Glena[1], Daniel García Oneto[1], Andrea Jiménez Aguilar[1,2], Claudia Durán Herrera[1,2], Jorge Ávila Pérez[1,2], Maximiliano Cortés Latorre[1,2]
Autores:
Herman Ahumada Piña[1], Luis Fuentes Cabrera[1], Rodrigo Selamé Glena[1], Daniel García Oneto[1], Andrea Jiménez Aguilar[1,2], Claudia Durán Herrera[1,2], Jorge Ávila Pérez[1,2], Maximiliano Cortés Latorre[1,2]

Citación: Ahumada Piña H, Fuentes Cabrera L, Selamé Glena R, García Oneto D, Jiménez Aguilar A, Durán Herrera C, et al. Dermatomyositis as the first manifestation of small cell carcinoma: case report and literature review. Medwave 2016 Nov;16(10):e6609 doi: 10.5867/medwave.2016.10.6609
Fecha de envío: 18/8/2016
Fecha de aceptación: 20/10/2016
Fecha de publicación: 15/11/2016
Origen: no solicitado
Tipo de revisión: con revisión por dos pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Bohan A, Peter JB. Polymyositis and dermatomyositis (first of two parts). N Engl J Med. 1975 Feb 13;292(7):344-7. | PubMed |
Bohan A, Peter JB. Polymyositis and dermatomyositis (first of two parts). N Engl J Med. 1975 Feb 13;292(7):344-7. | PubMed | Bohan A, Peter JB. Polymyositis and dermatomyositis (second of two parts). N Engl J Med. 1975 Feb 20;292(8):403-7. | PubMed |
Bohan A, Peter JB. Polymyositis and dermatomyositis (second of two parts). N Engl J Med. 1975 Feb 20;292(8):403-7. | PubMed | Paraschiv B, Diaconu CC, Toma CL, Bogdan MA. Paraneoplastic syndromes: the way to an early diagnosis of lung cancer. Pneumologia. 2015;64(2):14-9. | PubMed |
Paraschiv B, Diaconu CC, Toma CL, Bogdan MA. Paraneoplastic syndromes: the way to an early diagnosis of lung cancer. Pneumologia. 2015;64(2):14-9. | PubMed | Casciola-Rosen L, Nagaraju K, Plotz P, Wang K, Levine S, Gabrielson E, et al. Enhanced autoantigen expression in regenerating muscle cells in idiopathic inflammatory myopathy. J Exp Med. 2005 Feb 21;201(4):591-601. | PubMed |
Casciola-Rosen L, Nagaraju K, Plotz P, Wang K, Levine S, Gabrielson E, et al. Enhanced autoantigen expression in regenerating muscle cells in idiopathic inflammatory myopathy. J Exp Med. 2005 Feb 21;201(4):591-601. | PubMed | Albert TJ, Bastawrous S, Raugi GJ, Hirschmann JV. A 62-year-old man with skin rash and an abnormal chest radiograph. Chest. 2015 Mar;147(3):e90-4. | CrossRef | PubMed |
Albert TJ, Bastawrous S, Raugi GJ, Hirschmann JV. A 62-year-old man with skin rash and an abnormal chest radiograph. Chest. 2015 Mar;147(3):e90-4. | CrossRef | PubMed | Pelosof LC, Gerber DE. Paraneoplastic syndromes: an approach to diagnosis and treatment. Mayo Clin Proc. 2010 Sep;85(9):838-54. | CrossRef | PubMed |
Pelosof LC, Gerber DE. Paraneoplastic syndromes: an approach to diagnosis and treatment. Mayo Clin Proc. 2010 Sep;85(9):838-54. | CrossRef | PubMed | Sigurgeirsson B, Lindelöf B, Edhag O, Allander E. Risk of cancer in patients with dermatomyositis or polymyositis. A population-based study. N Engl J Med. 1992 Feb 6;326(6):363-7. | PubMed |
Sigurgeirsson B, Lindelöf B, Edhag O, Allander E. Risk of cancer in patients with dermatomyositis or polymyositis. A population-based study. N Engl J Med. 1992 Feb 6;326(6):363-7. | PubMed | Stertz G. Polymiositis. BerlKlinWochenschr. 1916;53:489.
Stertz G. Polymiositis. BerlKlinWochenschr. 1916;53:489.  Kankeleit H. Uber primairenicheitrigepolymiositis. Dtsch Arch Klin Med. 1916;120:335-39.
Kankeleit H. Uber primairenicheitrigepolymiositis. Dtsch Arch Klin Med. 1916;120:335-39.  Bernard P, Bonnetblanc JM. Dermatomyositis and malignancy. J Invest Dermatol. 1993 Jan;100(1):128S-132S. | PubMed |
Bernard P, Bonnetblanc JM. Dermatomyositis and malignancy. J Invest Dermatol. 1993 Jan;100(1):128S-132S. | PubMed | Leow YH, Goh CL. Malignancy in adult dermatomyositis. Int J Dermatol. 1997 Dec;36(12):904-7. | PubMed |
Leow YH, Goh CL. Malignancy in adult dermatomyositis. Int J Dermatol. 1997 Dec;36(12):904-7. | PubMed | Di Rollo D, Abeni D, Tracanna M, Capo A, Amerio P. Cancer risk in dermatomyositis: a systematic review of the literature. G Ital Dermatol Venereol. 2014 Oct;149(5):525-37.
| PubMed |
Di Rollo D, Abeni D, Tracanna M, Capo A, Amerio P. Cancer risk in dermatomyositis: a systematic review of the literature. G Ital Dermatol Venereol. 2014 Oct;149(5):525-37.
| PubMed | Airio A, Pukkala E, Isomäki H. Elevated cancer incidence in patients with dermatomyositis: a population based study. J Rheumatol. 1995 Jul;22(7):1300-3. | PubMed |
Airio A, Pukkala E, Isomäki H. Elevated cancer incidence in patients with dermatomyositis: a population based study. J Rheumatol. 1995 Jul;22(7):1300-3. | PubMed | Buchbinder R, Forbes A, Hall S, Dennett X, Giles G. Incidence of malignant disease in biopsy-proven inflammatory myopathy. A population-based cohort study. Ann Intern Med. 2001 Jun 19;134(12):1087-95. | PubMed |
Buchbinder R, Forbes A, Hall S, Dennett X, Giles G. Incidence of malignant disease in biopsy-proven inflammatory myopathy. A population-based cohort study. Ann Intern Med. 2001 Jun 19;134(12):1087-95. | PubMed | Chow WH, Gridley G, Mellemkjaer L, McLaughlin JK, Olsen JH, Fraumeni JF Jr. Cancer risk following polymyositis and dermatomyositis: a nationwide cohort study in Denmark. Cancer Causes Control. 1995 Jan;6(1):9-13. | PubMed |
Chow WH, Gridley G, Mellemkjaer L, McLaughlin JK, Olsen JH, Fraumeni JF Jr. Cancer risk following polymyositis and dermatomyositis: a nationwide cohort study in Denmark. Cancer Causes Control. 1995 Jan;6(1):9-13. | PubMed | Stockton D, Doherty VR, Brewster DH. Risk of cancer in patients with dermatomyositis or polymyositis, and follow-up implications: a Scottish population-based cohort study. Br J Cancer. 2001 Jul 6;85(1):41-5. | PubMed |
Stockton D, Doherty VR, Brewster DH. Risk of cancer in patients with dermatomyositis or polymyositis, and follow-up implications: a Scottish population-based cohort study. Br J Cancer. 2001 Jul 6;85(1):41-5. | PubMed | Zhang W, Jiang SP, Huang L. Dermatomyositis and malignancy: a retrospective study of 115 cases. Eur Rev Med Pharmacol Sci. 2009 Mar-Apr;13(2):77-80.
| PubMed |
Zhang W, Jiang SP, Huang L. Dermatomyositis and malignancy: a retrospective study of 115 cases. Eur Rev Med Pharmacol Sci. 2009 Mar-Apr;13(2):77-80.
| PubMed | Dourmishev LA, Popov JM, Rusinova D. Paraneoplastic dermatomyositis associated with testicular cancer: a case report and literature review. Acta Dermatovenerol Alp Pannonica Adriat. 2010;19(1):39-43. | PubMed |
Dourmishev LA, Popov JM, Rusinova D. Paraneoplastic dermatomyositis associated with testicular cancer: a case report and literature review. Acta Dermatovenerol Alp Pannonica Adriat. 2010;19(1):39-43. | PubMed | Fung WK, Chan HL, Lam WM. Amyopathic dermatomyositis in Hong Kong --association with nasopharyngeal carcinoma. Int J Dermatol. 1998 Sep;37(9):659-63. | PubMed |
Fung WK, Chan HL, Lam WM. Amyopathic dermatomyositis in Hong Kong --association with nasopharyngeal carcinoma. Int J Dermatol. 1998 Sep;37(9):659-63. | PubMed | Selvaag E, Thune P, Austad J. [Dermatomyositis and cancer. A retrospective study]. Tidsskr Nor Laegeforen. 1994 Aug 30;114(20):2378-80. | PubMed |
Selvaag E, Thune P, Austad J. [Dermatomyositis and cancer. A retrospective study]. Tidsskr Nor Laegeforen. 1994 Aug 30;114(20):2378-80. | PubMed | Wang J, Guo G, Chen G, Wu B, Lu L, Bao L. Meta-analysis of the association of dermatomyositis and polymyositis with cancer. Br J Dermatol. 2013 Oct;169(4):838-47. | CrossRef | PubMed |
Wang J, Guo G, Chen G, Wu B, Lu L, Bao L. Meta-analysis of the association of dermatomyositis and polymyositis with cancer. Br J Dermatol. 2013 Oct;169(4):838-47. | CrossRef | PubMed | Olazagasti JM, Baez PJ, Wetter DA, Ernste FC. Cancer risk in dermatomyositis: a meta-analysis of cohort studies. Am J Clin Dermatol. 2015 Apr;16(2):89-98. | CrossRef | PubMed |
Olazagasti JM, Baez PJ, Wetter DA, Ernste FC. Cancer risk in dermatomyositis: a meta-analysis of cohort studies. Am J Clin Dermatol. 2015 Apr;16(2):89-98. | CrossRef | PubMed | Peng JC, Sheen TS, Hsu MM. Nasopharyngeal carcinoma with dermatomyositis. Analysis of 12 cases. Arch Otolaryngol Head Neck Surg. 1995 Nov;121(11):1298-301. | PubMed |
Peng JC, Sheen TS, Hsu MM. Nasopharyngeal carcinoma with dermatomyositis. Analysis of 12 cases. Arch Otolaryngol Head Neck Surg. 1995 Nov;121(11):1298-301. | PubMed | Wong KO. Dermatomyositis: a clinical investigation of twenty-three cases in Hong Kong. Br J Dermatol. 1969 Jul;81(7):544-7. | PubMed |
Wong KO. Dermatomyositis: a clinical investigation of twenty-three cases in Hong Kong. Br J Dermatol. 1969 Jul;81(7):544-7. | PubMed | Chao G, Fang L, Lu C, Chen Z. Small cell lung cancer presenting as dermatomyositis: mistaken for single connective tissue disease. Rheumatol Int. 2012 Jun;32(6):1737-40. | CrossRef | PubMed |
Chao G, Fang L, Lu C, Chen Z. Small cell lung cancer presenting as dermatomyositis: mistaken for single connective tissue disease. Rheumatol Int. 2012 Jun;32(6):1737-40. | CrossRef | PubMed | Lee WY, Kastelik J, Campbell A, Avery G, McGivern D, Lind M. A case report of dermatomyositis associated with small cell lung cancer. Tumori. 2012 Nov;98(6):158e-61e. | CrossRef | PubMed |
Lee WY, Kastelik J, Campbell A, Avery G, McGivern D, Lind M. A case report of dermatomyositis associated with small cell lung cancer. Tumori. 2012 Nov;98(6):158e-61e. | CrossRef | PubMed | Azuma K, Yamada H, Ohkubo M, Yamasaki Y, Yamasaki M, Mizushima M, et al. Incidence and predictive factors for malignancies in 136 Japanese patients with dermatomyositis, polymyositis and clinically amyopathic dermatomyositis. Mod Rheumatol. 2011 Apr;21(2):178-83. | CrossRef | PubMed |
Azuma K, Yamada H, Ohkubo M, Yamasaki Y, Yamasaki M, Mizushima M, et al. Incidence and predictive factors for malignancies in 136 Japanese patients with dermatomyositis, polymyositis and clinically amyopathic dermatomyositis. Mod Rheumatol. 2011 Apr;21(2):178-83. | CrossRef | PubMed | Chen YJ, Wu CY, Shen JL. Predicting factors of interstitial lung disease in dermatomyositis and polymyositis. Acta Derm Venereol. 2007;87(1):33-8. Erratum in: Acta Derm Venereol. 2007;87(3):286. | PubMed |
Chen YJ, Wu CY, Shen JL. Predicting factors of interstitial lung disease in dermatomyositis and polymyositis. Acta Derm Venereol. 2007;87(1):33-8. Erratum in: Acta Derm Venereol. 2007;87(3):286. | PubMed | Ponyi A, Constantin T, Garami M, András C, Tállai B, Váncsa A, et al. Cancer-associated myositis: clinical features and prognostic signs. Ann N Y Acad Sci. 2005 Jun;1051:64-71. | PubMed |
Ponyi A, Constantin T, Garami M, András C, Tállai B, Váncsa A, et al. Cancer-associated myositis: clinical features and prognostic signs. Ann N Y Acad Sci. 2005 Jun;1051:64-71. | PubMed | Al-Ballaa ST, Al-Dalaan AN, El-Ramahi KM, Al-Janadi MA, Al-Shaikh A, Bahabri S. Pattern of adult onset of polymyositis and dermatomyositis and association with malignancy. Ann Saudi Med. 1993 Nov;13(6):525-9. | PubMed |
Al-Ballaa ST, Al-Dalaan AN, El-Ramahi KM, Al-Janadi MA, Al-Shaikh A, Bahabri S. Pattern of adult onset of polymyositis and dermatomyositis and association with malignancy. Ann Saudi Med. 1993 Nov;13(6):525-9. | PubMed | András C, Ponyi A, Constantin T, Csiki Z, Szekanecz E, Szodoray P, et al. Dermatomyositis and polymyositis associated with malignancy: a 21-year retrospective study. J Rheumatol. 2008 Mar;35(3):438-44. | PubMed |
András C, Ponyi A, Constantin T, Csiki Z, Szekanecz E, Szodoray P, et al. Dermatomyositis and polymyositis associated with malignancy: a 21-year retrospective study. J Rheumatol. 2008 Mar;35(3):438-44. | PubMed | Sparsa A, Liozon E, Herrmann F, Ly K, Lebrun V, Soria P, et al. Routine vs extensive malignancy search for adult dermatomyositis and polymyositis: a study of 40 patients. Arch Dermatol. 2002 Jul;138(7):885-90. | PubMed |
Sparsa A, Liozon E, Herrmann F, Ly K, Lebrun V, Soria P, et al. Routine vs extensive malignancy search for adult dermatomyositis and polymyositis: a study of 40 patients. Arch Dermatol. 2002 Jul;138(7):885-90. | PubMed | Parodi A, Caproni M, Marzano AV, De Simone C, La Placa M, Quaglino P, et al. Dermatomyositis in 132 patients with different clinical subtypes: cutaneous signs, constitutional symptoms and circulating antibodies. Acta Derm Venereol. 2002;82(1):48-51. | PubMed |
Parodi A, Caproni M, Marzano AV, De Simone C, La Placa M, Quaglino P, et al. Dermatomyositis in 132 patients with different clinical subtypes: cutaneous signs, constitutional symptoms and circulating antibodies. Acta Derm Venereol. 2002;82(1):48-51. | PubMed | Duncan AG, Richardson JB, Klein JB, Targoff IN, Woodcock TM, Callen JP. Clinical, serologic, and immunogenetic studies in patients with dermatomyositis. Acta Derm Venereol. 1991;71(4):312-6. | PubMed |
Duncan AG, Richardson JB, Klein JB, Targoff IN, Woodcock TM, Callen JP. Clinical, serologic, and immunogenetic studies in patients with dermatomyositis. Acta Derm Venereol. 1991;71(4):312-6. | PubMed | Trallero-Araguás E, Rodrigo-Pendás JÁ, Selva-O'Callaghan A, Martínez-Gómez X, Bosch X, Labrador-Horrillo M, et al. Usefulness of anti-p155 autoantibody for diagnosing cancer-associated dermatomyositis: a systematic review and meta-analysis. Arthritis Rheum. 2012 Feb;64(2):523-32. | CrossRef | PubMed |
Trallero-Araguás E, Rodrigo-Pendás JÁ, Selva-O'Callaghan A, Martínez-Gómez X, Bosch X, Labrador-Horrillo M, et al. Usefulness of anti-p155 autoantibody for diagnosing cancer-associated dermatomyositis: a systematic review and meta-analysis. Arthritis Rheum. 2012 Feb;64(2):523-32. | CrossRef | PubMed | Chinoy H, Fertig N, Oddis CV, Ollier WE, Cooper RG. The diagnostic utility of myositis autoantibody testing for predicting the risk of cancer-associated myositis. Ann Rheum Dis. 2007 Oct;66(10):1345-9. | PubMed |
Chinoy H, Fertig N, Oddis CV, Ollier WE, Cooper RG. The diagnostic utility of myositis autoantibody testing for predicting the risk of cancer-associated myositis. Ann Rheum Dis. 2007 Oct;66(10):1345-9. | PubMed | Spiro SG, Gould MK, Colice GL; American College of Chest Physicians. Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests, and paraneoplastic syndromes: ACCP evidenced-based clinical practice guidelines (2nd edition). Chest. 2007 Sep;132(3 Suppl):149S-160S. | PubMed |
Spiro SG, Gould MK, Colice GL; American College of Chest Physicians. Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests, and paraneoplastic syndromes: ACCP evidenced-based clinical practice guidelines (2nd edition). Chest. 2007 Sep;132(3 Suppl):149S-160S. | PubMed | Krathen MS, Fiorentino D, Werth VP. Dermatomyositis. Curr Dir Autoimmun. 2008;10:313-32. | CrossRef | PubMed |
Krathen MS, Fiorentino D, Werth VP. Dermatomyositis. Curr Dir Autoimmun. 2008;10:313-32. | CrossRef | PubMed | Levine SM. Cancer and myositis: new insights into an old association. Curr Opin Rheumatol. 2006 Nov;18(6):620-4. | PubMed |
Levine SM. Cancer and myositis: new insights into an old association. Curr Opin Rheumatol. 2006 Nov;18(6):620-4. | PubMed | Soejima M, Kang EH, Gu X, Katsumata Y, Clemens PR, Ascherman DP. Role of innate immunity in a murine model of histidyl-transfer RNA synthetase (Jo-1)-mediated myositis. Arthritis Rheum. 2011 Feb;63(2):479-87. | CrossRef | PubMed |
Soejima M, Kang EH, Gu X, Katsumata Y, Clemens PR, Ascherman DP. Role of innate immunity in a murine model of histidyl-transfer RNA synthetase (Jo-1)-mediated myositis. Arthritis Rheum. 2011 Feb;63(2):479-87. | CrossRef | PubMed | Howard OM, Dong HF, Yang D, Raben N, Nagaraju K, Rosen A, et al. Histidyl-tRNA synthetase and asparaginyl-tRNA synthetase, autoantigens in myositis, activate chemokine receptors on T lymphocytes and immature dendritic cells. J Exp Med. 2002 Sep 16;196(6):781-91. | PubMed |
Howard OM, Dong HF, Yang D, Raben N, Nagaraju K, Rosen A, et al. Histidyl-tRNA synthetase and asparaginyl-tRNA synthetase, autoantigens in myositis, activate chemokine receptors on T lymphocytes and immature dendritic cells. J Exp Med. 2002 Sep 16;196(6):781-91. | PubMed | Iorizzo LJ 3rd, Jorizzo JL. The treatment and prognosis of dermatomyositis: an updated review. J Am Acad Dermatol. 2008 Jul;59(1):99-112. | CrossRef | PubMed |
Iorizzo LJ 3rd, Jorizzo JL. The treatment and prognosis of dermatomyositis: an updated review. J Am Acad Dermatol. 2008 Jul;59(1):99-112. | CrossRef | PubMed |