 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La proteinosis alveolar es una rara enfermedad, sobre la que se han ido conociendo progresivamente sus características y su etiopatología, lo que ha permitido tener un poco más de claridad sobre ella. En general son pocos los casos reportados en el mundo. Por este motivo es de suma importancia realizar el reporte de caso y revisar la literatura actual, donde se encontraron nuevas opciones terapéuticas con resultados adecuados que permitieron manejar a los pacientes sin respuesta al tratamiento convencional. Es necesario considerar que el 25% de los casos tiene resolución espontánea, pero otro alto porcentaje requiere tratamiento convencional con lavado pulmonar total que muchas veces no mejora el pronóstico de la enfermedad. El caso reportado se asoció a diabetes y a infección por Mycobacterium tuberculosis, por lo que se puede considerar que el diagnóstico de proteinosis alveolar primaria presenta en este tipo de pacientes una relación directa con las patologías asociadas.
Se hace referencia al cuadro clínico de una paciente de sexo femenino, de 69 años de edad, con síntomas gripales de un año de evolución aproximadamente, por lo que asistió en varias oportunidades al servicio de medicina general por consulta externa y al servicio de urgencias. En ambos lugares se le diagnosticó reiteradamente neumonía, ante lo cual recibió tratamiento con antibióticos orales y corticoides en múltiples ocasiones. Quince días después fue evaluada por el servicio de medicina interna. En el examen físico se encontró disminución del murmullo vesicular de predominio basal izquierdo. Al analizar radiografía de tórax se observa ocupación del espacio alveolar parahiliar bilateral (Figura 1), por esta razón se le ordenó realizar tomografía computarizada de tórax y se le derivó al servicio de neumología.
Se observa además radioopacidad parenquimatosa poco definida, con tendencia a la confluencia en el segmento basal del lóbulo inferior derecho con broncograma en su interior. Esto puede deberse a zona de consolidación neumónica.
Al momento de la consulta en el servicio de neumología, manifestó la persistencia de los síntomas consistentes en disnea y disminución de su clase funcional: sólo podía caminar una cuadra. No reportó pérdida de peso, fiebre, ni otros síntomas. Hasta ese momento sólo había recibido tratamiento con beclometasona y salbutamol.
Como antecedentes personales, se encontró que la paciente era hipertensa y diabética en tratamiento médico con losartan e insulina. También presentaba exposición a biocombustibles y tres años antes había sido hospitalizada por cuadro neumónico.
Respecto a antecedentes familiares, se registró un carcinoma pulmonar en su padre.
Las condiciones generales fueron aparentemente buenas, tolerando adecuadamente sin oxígeno.
La tomografía computarizada de tórax reportó los siguientes hallazgos (Figura 2):
Teniendo en cuenta los hallazgos en la tomografía que evidenciaron cambios fibrosos y lesiones en vidrio esmerilado, junto con la clínica del paciente se considera cuadro de fibrosis pulmonar. Por esta razón se solicita espirometría y fibrobroncoscopía.
La fibrobroncoscopía se realizó en dos oportunidades, donde no se encontraron daños estructurales. Sin embargo, se observó un material de color blanquecino del cual se tomaron muestras para estudio citológico. Dicho estudio reportó células epiteliales bronquiales asociadas a macrófagos y fondo proteináceo eosinófilo, con material amorfo y granular, con tinción PAS positivo. No evidenció estructuras compatibles con hongos. Estos hallazgos son compatibles con proteinosis alveolar pulmonar.
El hemograma registró leve aumento de los leucocitos (12500), sin alteración en neutrófilos o linfocitos. Presentó un control metabólico adecuado (glicemia: 121 mg/dL), y no se evidenció anemia (hemoglobina: 12,6 mg/dL). La espirometría reportó un leve patrón restrictivo. Además se valora una nueva tomografía computarizada de tórax de alta resolución que mostró los siguientes resultados (Figura 3):
Ocho meses después de la consulta inicial en el servicio de neumología, asistió a control. En ese momento manifestó sentirse con disnea leve, no refirió fiebre, ni pérdida de peso y en su condición física no se mostró deterioro.
Se consideró toma de exámenes de laboratorio ya que se encontraba con tos persistente, para descartar deterioro de su patología o documentar algún proceso infeccioso asociado. De los exámenes solicitados, el único alterado fue la presencia de tres baciloscopias positivas, por lo cual se gestionó el reporte de tuberculosis pulmonar para inicio del tratamiento antifímico.
Durante ocho meses la paciente recibió tratamiento antifímico con negativización de las baciloscopías. No obstante, la paciente presentó deterioro de su estado general, deterioro de su clase funcional, aumento de la dificultad respiratoria y mal patrón respiratorio, por lo que requirió asistencia en el servicio de urgencia. Dado su estado general, la paciente presentó fallo respiratorio y requirió ser intubada para manejo de su vía aérea. En consecuencia, requirió manejo en unidad de cuidados intensivos, ventilación mecánica y se le realizó lavado pulmonar total, sin mejoría. No se logró desconectarla del ventilador, por lo que requirió traqueostomía. Se le trasladó a unidad de cuidado crónico, donde falleció por su condición de base.
Todos los datos anteriormente mencionados, muestran que la proteinosis alveolar es una enfermedad que presenta en la gran mayoría de los pacientes un deterioro progresivo de la función pulmonar, aumenta la morbimortalidad y tiene un desenlace final catastrófico.
La proteinosis alveolar es un desorden poco común, donde el material lipoproteinaceo se acumula dentro del alveolo, con un rango clínico variable desde una falla respiratoria hasta la resolución espontánea1.
Los primeros reportes de la enfermedad se registraron en una revisión de casos en 1958 con una muestra de 26 pacientes2. En los últimos años esta patología ha adquirido mayor importancia por su fisiopatología un poco confusa. De ésta se conocen tres variantes1,2:
Las hipótesis desarrolladas hasta ahora, consideran que las causas congénita y adquirida se relacionan con genes que codifican para la proteína B o C del surfactante o la cadena βc del receptor del factor estimulante de granulocitos. En tanto, la proteinosis alveolar adquirida se asociaría a anticuerpos contra el receptor2.
Su prevalencia es de aproximadamente 0,39 por cada 100.000 personas2. Otras series han reportado prevalencia de 3,7 por cada millón de habitantes en Israel3,4 y con una incidencia de 0,2/1 millón de personas/año en Pittsburgh3,5. En otras series se han reportado incidencia de 2 por millón, con aumento de los casos mostrados a nivel mundial que se estiman entre 300 y 500 casos, por lo que se considera una enfermedad poco común5.
La patogénesis de la enfermedad no es muy clara, sin embargo en los últimos años se han acrecentado las bases fisiopatológicas de la proteinosis alveolar. Se sabe que los anticuerpos contra el factor estimulante de granulocitos-macrófagos cumplen una función importante al producir una sustancia vital denominada PU.1 (factor de transcripción). La ausencia de dicha sustancia afecta múltiples funciones fundamentales en los macrófagos, entre ellas la alteración en la adhesión celular, catabolismo de las proteínas y lípidos del surfactante. También incide en la alteración en los receptores tipo toll, inicio en la señalización de fagocitosis, destrucción intracelular de bacterias y disminución de la liberación de Il 12, Il 18. De esta forma se disminuye la respuesta del macrófago al interferón γ para controlar la infección pulmonar, necesaria para la inmunidad innata – celular3,6.
Las principales manifestaciones clínicas de la proteinosis alveolar son la disnea de esfuerzo (64%) y tos (41%). Otros menos frecuentes son hemoptisis, fiebre y pérdida de peso. En algunas series se ha reportado que los signos clínicos más frecuentes son los crépitos (entre 28 y 50% de los pacientes) y cianosis (entre 14 y 25%). El menos presente es el hipocratismo digital3,7.
El diagnóstico de proteinosis alveolar se puede realizar de múltiples formas, entre ellas la clínica y los hallazgos radiológicos. Éstos pueden suponer el diagnóstico en el 75% de los casos. El lavado broncoalveolar puede confirmar el diagnóstico8.
El lavado broncoalveolar y la biopsia transbronquial es de consistencia lechosa y su análisis muestra material PAS positivo, Alcian Blue, con aumento en la concentración de fosfolípidos totales y cuerpos lamelares en la microscopía electrónica9.
La biopsia pulmonar a cielo abierto, que sigue siendo el gold standard, no es un procedimiento de elección debido a que puede aumentar el riesgo de complicaciones y dar algunos falsos negativos. Por esta razón se recomienda en casos adecuadamente seleccionados, ya que los criterios previamente mencionados logran establecer el diagnóstico en aproximadamente el 95% de los casos10.
La presencia circulante de anticuerpos contra la colonia estimulante de granulocitos – macrófagos puede ayudar en el diagnóstico de la enfermedad, a pesar de que es un examen de laboratorio que no se encuentra alcance de todas las instituciones de salud por su alto costo y complejidad. Sin embargo, permite mejorar el conocimiento sobre la proteinosis alveolar, así como de sus características de autoinmunidad7,11.
En la actualidad el tratamiento estándar de esta patología es el lavado pulmonar total10-12, el cual está indicado en todos los pacientes con disnea progresiva, en pacientes que necesiten de oxigeno complementario (PaO2 < 60 mmHg al aire ambiente o fracción shunt > 10 – 12%), e intolerancia a la actividad con impacto en la vida diaria8,13. Como todo procedimiento clínico, no está exento de complicaciones, entre las cuales se encuentran neumonía, sepsis, hidroneumotórax y síndrome de dificultad respiratoria del adulto8,14. En algunas ocasiones se ha presentado poca respuesta al tratamiento convencional (lavado pulmonar total), por lo que se han buscado nuevas formas para disminuir la evolución progresiva.
Las opciones terapéuticas actuales se convierten en buenas posibilidades, dando alternativas a aquellos pacientes que no mejoran con el tratamiento estándar. A manera de ejemplo, la plasmaféresis es una nueva opción para aquellos pacientes que no responden al lavado pulmonar total, observándose un mejoramiento de los sintomas, acrecentando la saturación sanguínea de oxígeno y la disminución de los anticuerpos en la sangre de forma progresiva hasta por 24 meses después de terminado el proceso15.
Respecto a las relaciones entre la proteinosis alveolar y otras patologías, ésta se ha visto asociada a enfermedades autoinmunes. Es por ello que se han utilizado, con alguna respuesta, medicamentos que pueden producir la disminución de la respuesta inmune. Se ha reportado la utilización de rituximab (anti CD-20), con buenos desenlaces en pacientes que no requieren una terapia de forma urgente y que no han respondido positivamente al lavado pulmonar total12,16.
Como otra opción terapéutica y que contribuye al conocimiento de la fisiopatología de la enfermedad, se ha utilizado el factor estimulante de colonia de granulocitos – macrófagos de forma subcutánea con resultados adecuados. Asimismo, desde hace dos años aproximadamente se ha usado en forma inhalada con resultados promisorios en una enfermedad progresiva y con pocas opciones terapéuticas8,15.
Los pacientes con proteinosis alveolar y diabéticos tienen mayor riesgo de infección por gérmenes que afectan con menos frecuencia a pacientes sin estas comorbilidades. Se ha encontrado una alta frecuencia de infecciones por gérmenes como Aspergillus spp, Nocardia spp, Mycobacterium spp, Cryptococcus spp, Histoplasma capsulatum, Pneumocystisjirovecci y con menor frecuencia se ha asociado con Mycobacterium tuberculosis16.
Es importante tener en cuenta que el patrón de vidrio esmerilado a nivel de la tomografía axial computarizada de alta resolución, es altamente sugestivo de proteinosis alveolar. No obstante, se deben descartar otras patologías como infección por Pneumocystisjirovecci, neoplasias (carcinoma bronquioalveolar), enfermedades idiopáticas (sarcoidosis, neumonía intersticial no especificada y neumonía organizada), enfermedades inhalatorias (neumonía lipoidea) y enfermedades sanguíneas como el síndrome de hemorragia pulmonar17,18.
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del artículo; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. El formulario puede ser solicitado contactando al autor responsable.
Los autores obtuvieron el consentimiento informado de los parientes del sujeto del estudio, para el uso de los datos y la posterior publicación de los resultados en Medwave. El formulario puede ser solicitado contactando al autor responsable.

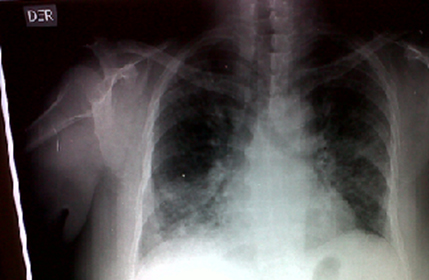 Figura 1. Silueta cardíaca con ventrículo izquierdo de tamaño normal. Se observa ocupación del espacio alveolar parahiliar bilateral.
Figura 1. Silueta cardíaca con ventrículo izquierdo de tamaño normal. Se observa ocupación del espacio alveolar parahiliar bilateral.

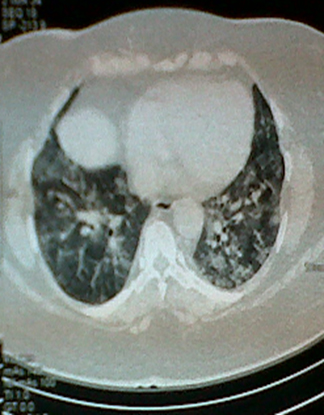 Figura 2. Se observan opacidades difusas no homogéneas, en algunos segmentos con tendencia a la consolidación, evidenciándose broncograma aéreo, con engrosamiento septal e imágenes en vidrio esmerilado.
Figura 2. Se observan opacidades difusas no homogéneas, en algunos segmentos con tendencia a la consolidación, evidenciándose broncograma aéreo, con engrosamiento septal e imágenes en vidrio esmerilado.

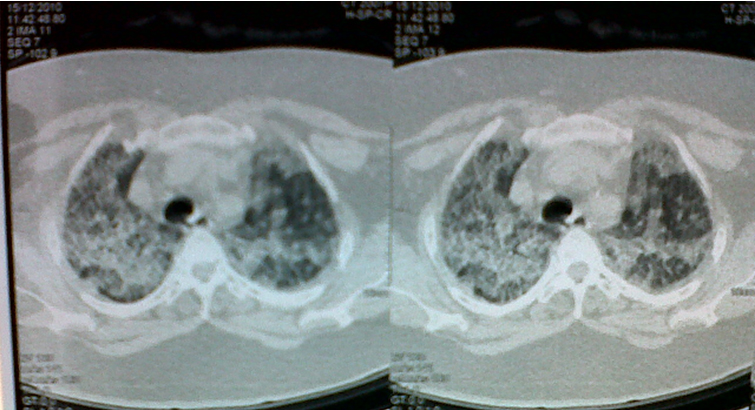 Figura 3. Se observan opacidades en vidrio esmerilado, con engrosamiento septal y patrón en adoquinamiento errático (crazy-paving), característico de la proteinosis alveolar.
Figura 3. Se observan opacidades en vidrio esmerilado, con engrosamiento septal y patrón en adoquinamiento errático (crazy-paving), característico de la proteinosis alveolar.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Alveolar proteinosis is a rare disease. Its etiology, pathology, and manifestations are becoming increasingly more apparent. Few cases have been reported, which highlights the importance of reporting this case and reviewing current literature. New therapeutic options are being introduced with adequate outcomes thereby making it possible to manage patients who were previously unresponsive to conventional treatment. 25% of cases resolve spontaneously, while most patients require conventional treatment with total lung lavage that often does not improve prognosis. The case reported in this article was associated to Mycobacterium tuberculosis infection and diabetes. Primary alveolar proteinosis can have a direct relationship to these concomitant conditions.
 Autores:
Daniel Alberto Trujillo[1], Alejandro Vargas[1]
Autores:
Daniel Alberto Trujillo[1], Alejandro Vargas[1]

Citación: Trujillo DA, Vargas A. Alveolar proteinosis: case report and literature review. Medwave 2013;13(6):e5739 doi: 10.5867/medwave.2013.06.5739
Fecha de envío: 5/5/2013
Fecha de aceptación: 8/7/2013
Fecha de publicación: 12/7/2013
Origen: no solicitado
Tipo de revisión: con revisión por dos pares revisores, a doble ciego
Citaciones asociadas
1. Editores. Masthead Jul;13(6). Medwave 2013;13(6):e5744 doi: 10.5867/medwave.2013.06.5744 | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Trapnell BC, Whitsett JA, Nakata K. Pulmonary alveolar proteinosis. N Engl J Med. 2003 Dec 25;349(26):2527-39. | CrossRef | PubMed |
Trapnell BC, Whitsett JA, Nakata K. Pulmonary alveolar proteinosis. N Engl J Med. 2003 Dec 25;349(26):2527-39. | CrossRef | PubMed | Venkateshiah SB, Yan TD, Bonfield TL, Thomassen MJ, Meziane M, Czich C, et al. An open-label trial of granulocyte macrophage colony stimulating factor therapy for moderate symptomatic pulmonary alveolar proteinosis. Chest. 2006 Jul;130(1):227-37. | CrossRef | PubMed |
Venkateshiah SB, Yan TD, Bonfield TL, Thomassen MJ, Meziane M, Czich C, et al. An open-label trial of granulocyte macrophage colony stimulating factor therapy for moderate symptomatic pulmonary alveolar proteinosis. Chest. 2006 Jul;130(1):227-37. | CrossRef | PubMed | Mazzone P, Thomassen MJ, Kavuru M. Our new understanding of pulmonary alveolar proteinosis: what an internist needs to know. Cleve Clin J Med. 2001 Dec;68(12):977-8, 981-2, 984-5 passim. | CrossRef | PubMed |
Mazzone P, Thomassen MJ, Kavuru M. Our new understanding of pulmonary alveolar proteinosis: what an internist needs to know. Cleve Clin J Med. 2001 Dec;68(12):977-8, 981-2, 984-5 passim. | CrossRef | PubMed | Hoffman RM, Rogers RM. Pulmonary alveolar proteinosis. Chapter M12. En: Pulmonary and critical care medicine. United States: St Louis: Mosby Year Book, 1993:1-7.
Hoffman RM, Rogers RM. Pulmonary alveolar proteinosis. Chapter M12. En: Pulmonary and critical care medicine. United States: St Louis: Mosby Year Book, 1993:1-7.  Brasch F, Birzele J, Ochs M, Guttentag SH, Schoch OD, Boehler A, et al. Surfactant proteins in pulmonary alveolar proteinosis in adults. Eur Respir J. 2004 Sep;24(3):426-35. | CrossRef | PubMed |
Brasch F, Birzele J, Ochs M, Guttentag SH, Schoch OD, Boehler A, et al. Surfactant proteins in pulmonary alveolar proteinosis in adults. Eur Respir J. 2004 Sep;24(3):426-35. | CrossRef | PubMed | Bonfield TL, Russell D, Burgess S, Malur A, Kavuru MS, Thomassen MJ. Autoantibodies against granulocyte macrophage colony-stimulating factor are diagnostic for pulmonary alveolar proteinosis. Am J Respir Cell Mol Biol. 2002 Oct;27(4):481-6. | CrossRef | PubMed |
Bonfield TL, Russell D, Burgess S, Malur A, Kavuru MS, Thomassen MJ. Autoantibodies against granulocyte macrophage colony-stimulating factor are diagnostic for pulmonary alveolar proteinosis. Am J Respir Cell Mol Biol. 2002 Oct;27(4):481-6. | CrossRef | PubMed | Xaubet A, Ancochea J, Blanquer R, Montero C, Morell F, Rodríguez Becerra E, et al. Diagnóstico y tratamiento de las enfermedades pulmonares intersticiales difusas. Arch Bronconeumol. 2003 Dec;39(12):580-600. | PubMed |
Xaubet A, Ancochea J, Blanquer R, Montero C, Morell F, Rodríguez Becerra E, et al. Diagnóstico y tratamiento de las enfermedades pulmonares intersticiales difusas. Arch Bronconeumol. 2003 Dec;39(12):580-600. | PubMed | Gómez-de Antonio D, Campo-Cañaveral JL. Asistencia respiratoria como puente al trasplante. Arch Bronconeumol. 2009;45(4):208.
| CrossRef |
Gómez-de Antonio D, Campo-Cañaveral JL. Asistencia respiratoria como puente al trasplante. Arch Bronconeumol. 2009;45(4):208.
| CrossRef | Huizar I, Kavuru M, Alveolar Proteinosis Syndrome: Pathogenesis, diagnosis and management. Curr Opin Pulm Med. 2009 Sep;15(5):491-8. | CrossRef | PubMed |
Huizar I, Kavuru M, Alveolar Proteinosis Syndrome: Pathogenesis, diagnosis and management. Curr Opin Pulm Med. 2009 Sep;15(5):491-8. | CrossRef | PubMed | Luisetti M, Rodi G, Perotti C, Campo I, Mariani F, Pozzi E, et al. Plasmapheresis for treatment of pulmonary alveolar proteinosis. Eur Respir J. 2009 May;33(5):1220-2. | CrossRef | PubMed |
Luisetti M, Rodi G, Perotti C, Campo I, Mariani F, Pozzi E, et al. Plasmapheresis for treatment of pulmonary alveolar proteinosis. Eur Respir J. 2009 May;33(5):1220-2. | CrossRef | PubMed | Borie R, Debray MP, Laine C, Aubier M, Crestani B. Rituximab therapy in autoimmune pulmonary alveolar proteinosis. Eur Respir J. 2009 Jun;33(6):1503-6.
| CrossRef | PubMed |
Borie R, Debray MP, Laine C, Aubier M, Crestani B. Rituximab therapy in autoimmune pulmonary alveolar proteinosis. Eur Respir J. 2009 Jun;33(6):1503-6.
| CrossRef | PubMed | Ben-Dov I, Kishinevski Y, Roznman J, Soliman A, Bishara H, Zelligson E, et al. Pulmonary alveolar proteinosis in Israel: ethnic clustering. Isr Med Assoc J. 1999 Oct;1(2):75-8. | PubMed |
Ben-Dov I, Kishinevski Y, Roznman J, Soliman A, Bishara H, Zelligson E, et al. Pulmonary alveolar proteinosis in Israel: ethnic clustering. Isr Med Assoc J. 1999 Oct;1(2):75-8. | PubMed | Vancheeswaran R, Morgan C, Wells A. Pulmonary alveolar proteinosis. Investigation and management – A review. Clin Pulmonary Med. 2007 Nov;14(6):360-364.
| CrossRef |
Vancheeswaran R, Morgan C, Wells A. Pulmonary alveolar proteinosis. Investigation and management – A review. Clin Pulmonary Med. 2007 Nov;14(6):360-364.
| CrossRef | Rodríguez J, Rodríguez E, Sánchez A. Proteinosis Alveoloar. Respuesta al tratamiento con factor estimulante de colonias de granulocitos y macrófagos por vía inhalada. Arch Bronconeumol. 2009 Mar;45(3):150-2. | CrossRef | PubMed |
Rodríguez J, Rodríguez E, Sánchez A. Proteinosis Alveoloar. Respuesta al tratamiento con factor estimulante de colonias de granulocitos y macrófagos por vía inhalada. Arch Bronconeumol. 2009 Mar;45(3):150-2. | CrossRef | PubMed | Pereira-Silva JL, Marinho MM, Veloso TV, Coelho JC. Pulmonary alveolar proteinosis and tuberculosis in a diabetic patient: a rare or a seldom diagnosed association? Braz J Infect Dis. 2002 Aug;6(4):188-95. | CrossRef | PubMed |
Pereira-Silva JL, Marinho MM, Veloso TV, Coelho JC. Pulmonary alveolar proteinosis and tuberculosis in a diabetic patient: a rare or a seldom diagnosed association? Braz J Infect Dis. 2002 Aug;6(4):188-95. | CrossRef | PubMed | Wang BM, Stern EJ, Schmidt RA, Pierson DJ. Diagnosing pulmonary alveolar proteinosis. A review and an update. Chest. 1997 Feb;111(2):460-6. | CrossRef | PubMed |
Wang BM, Stern EJ, Schmidt RA, Pierson DJ. Diagnosing pulmonary alveolar proteinosis. A review and an update. Chest. 1997 Feb;111(2):460-6. | CrossRef | PubMed | Johkoh T, Itoh H, Müller NL, Ichikado K, Nakamura H, Ikezoe J, et al. Crazy-paving appearance at thin-section CT: spectrum of disease and pathologic findings. Radiology. 1999 Apr;211(1):155-60. | PubMed |
Johkoh T, Itoh H, Müller NL, Ichikado K, Nakamura H, Ikezoe J, et al. Crazy-paving appearance at thin-section CT: spectrum of disease and pathologic findings. Radiology. 1999 Apr;211(1):155-60. | PubMed | Modalidades ventilatorias espontáneas en ventilación mecánica y sus beneficios en UCI
Modalidades ventilatorias espontáneas en ventilación mecánica y sus beneficios en UCI