 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas de la Unidad General de Cuidados del Niño del Hospital Padre Hurtado. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Unidad. El jefe de la UGCN es el Dr. Alejandro Donoso y el Encargado de las Reuniones Clínicas es el Dr. Mario Vildoso.
Las secuelas infecciosas pulmonares se definen como una lesión permanente del árbol respiratorio, a partir, la mayoría de las veces de una infección viral aguda que afecta al niño en el período de lactancia precoz, provocando daño tisular, hiperreactividad bronquial e hipersecreción. En alrededor de 50% de los casos estas características desaparecen entre los 6 y 8 años de edad, pero en el restante 50% persiste algún grado de hiperreactividad e hipersecreción después de esa edad, lo que favorece la aparición de múltiples exacerbaciones respiratorias gatilladas por sobreinfecciones virales o bacterianas, que a su vez van aumentando el grado de inflamación local y favorecen la progresión del daño pulmonar.
El daño pulmonar está determinado en gran medida por la cantidad e intensidad de las exacerbaciones más la inflamación que las acompaña. Su principal etiología es la sobreinfección, que en adultos y adolescentes es por microorganismos como Chlamydia pneumoniae, Mycoplasma pneumoniae y Legionella; en cambio en preescolares y escolares los cultivos de expectoración suelen ser positivos para Haemophilus influenzae, Moraxella catarrhalis y Streptococcus pneumoniae. Otros agentes menos frecuentes son Haemophilus parainfluenzae, Staphylococcus aureus, bacilos gramnegativos y la Pseudomona aeruginosa, que se asocia a ciertas patologías de base como la fibrosis quística.
La exposición a bacterias desconocidas por el sistema inmunológico del individuo produciría nuevas exacerbaciones en estos pacientes, por lo que se ha planteado que la administración de cursos de antibióticos, de entre 14 y 21 días de duración o en forma permanente, podrían mantener al paciente libre de enfermedad durante más tiempo, siempre y cuando se logre erradicar al patógeno del cultivo de expectoración. Se han desarrollado múltiples protocolos de investigación con el objetivo de identificar el esquema antibiótico más eficaz. Los resultados obtenidos entregan evidencia a favor de los macrólidos, que actúan a través de la unión a la unidad 50S de los ribosomas, bloqueando la síntesis de péptidos; además tendrían un efecto inmunomodulador al reducir el daño por neutrófilos, lo que se ha observado tanto in vitro como in vivo.
Los datos disponibles sugieren que los pulsos de tratamiento podrían incluso mejorar las pruebas de función pulmonar y reducir el débito diario de expectoración bronquial, aunque la eficacia relativa difiere en ambos aspectos entre los diferentes macrólidos probados.
A continuación se describirán las principales complicaciones infecciosas pulmonares: neumatoceles, abscesos pulmonares, atelectasias, bronquiectasias y empiemas.
El neumatocele se define como una cavitación parenquimatosa distal, tanto bronquiolar como alveolar, asociada a un mecanismo valvular que favorece el atrapamiento de aire y la acumulación de éste a nivel intersticial. La sobreinfección bacteriana de esta cavidad es muy frecuente y puede determinar la formación de un absceso pulmonar periférico.
El neumatocele es poco frecuente dentro del universo de las neumopatías (2% a 8%), pero su frecuencia relativa cambia de acuerdo al método diagnóstico utilizado, al cuadro clínico de presentación y al agente etiológico involucrado. Es así que su frecuencia llegaría a 20% en pleuroneumonías y empiemas estudiados con tomografía axial computada (TAC).
En la radiografía de tórax el neumatocele comienza como un patrón de condensación clásico de neumonía (Fig. 1).
Figura 1. Radiografía de tórax: neumonía del lóbulo superior derecho.
Posteriormente este patrón evoluciona a múltiples pequeñas cavidades que después coalescen y forman una cavidad visible (Fig. 2). En la TAC se observa una evolución similar.
La gran mayoría de los neumatoceles se asocian a Streptococcus pneumoniae o Klebsiella pneumoniae.
En Israel se hizo un estudio en 111 niños con neumonía neumocócica; el promedio de edad fue 2,2 años; 39% de los pacientes presentó algún tipo de complicación, como derrame pleural, empiema, neumotórax, neumatocele o atelectasia; los factores asociados a estas complicaciones fueron: peso bajo el percentil 10; distrés respiratorio manifestado como polipnea y disnea; anemia y recuento de glóbulos blancos menor de 15.000 al ingreso (1).
En Turquía, por otro lado, se estudió en forma retrospectiva a 134 niños que presentaron un empiema paraneumónico, entre 1997 y 2003. El promedio de edad fue 3,8 años; 58 pacientes (43%) se complicaron con neumatocele. De los 58 niños, en 37 (63,7%) hubo resolución completa del cuadro en dos meses tras el cese de la infección; 13 tuvieron una reducción espontánea dentro de seis meses, sin intervención; 7 requirieron drenaje guiado por imágenes, con resolución completa en 5 de ellos; 2 pacientes requirieron cirugía por lesión quística persistente y otro más se complicó con un absceso pulmonar que necesitó resolución quirúrgica (2).
En resumen, estos estudios grafican el hecho de que la mayoría de los neumatoceles se resuelven en forma espontánea entre los dos y seis primeros meses de evolución. En forma ocasional alguno no regresa y continúa creciendo, por lo que requeriría algún otro procedimiento, como un drenje percutáneo o incluso resolución quirúrgica.
El absceso pulmonar se define como una cavidad parenquimatosa pulmonar con pared establecida (a diferencia del neumatocele que se caracteriza por una pared virtual).
La flora predominante en los abscesos, en adultos y niños, está conformada por microorganismos aerobios y anaerobios de la cavidad bucal, tales como Prevotella, fusobacterium y estreptococos del grupo milleri. Siempre se debe considerar la posibilidad de una aspiración o eventos convulsivos asociados a la aparición de un absceso pulmonar.
Un grupo seleccionado de pacientes pueden desarrollan neumonías estafilocócicas de la comunidad, graves, complicadas con abscesos; en esos casos se debe sospechar la presencia de un estafilococo comunitario portador de un fago, es decir, un virus bacteriano que confiere capacidad de sintetizar péptidos incluidos en el genoma viral y ajenos a la bacteria, que se multiplica al interior de las bacterias y tiene la capacidad de pasar de un estafilococo a otro. Este fago confiere la capacidad de síntesis de dos subunidades que se polimerizan y forman un verdadero poro en la membrana celular de los leucocitos, evitando su acción normal de defensa. Este péptido se denomina factor de virulencia Panton-Valentine leucocidina y provoca la hidrólisis de los leucocitos alrededor del sitio de infección, con el consiguiente defecto en la localización y combate de la enfermedad.
Los émbolos sépticos también pueden ser una causa de abscesos pulmonares, especialmente en presencia de prótesis o catéteres. Los microorganismos asociados a esta etiología son Staphylococcus aureus, Staphylococcus epidermidis y Streptococcus pneumoniae. Se denomina Síndrome de Lemierre a la tromboflebitis séptica de la yugular interna asociada a catéteres y es causada por el Fusobacterium necrophorum, lo que también se asocia a abscesos pulmonares. La Salmonella sp, por su parte, adquiere un rol relevante sólo en pacientes inmunodeficientes.
En la siguiente imagen, en la TAC de tórax se observa un absceso pulmonar con su pared definida y un nivel hidroaéreo (Fig. 3).
La mayoría de los abscesos pulmonares responden adecuadamente al tratamiento médico y sólo algunos casos seleccionados requieren tratamiento quirúrgico, como será en presencia de sepsis refractaria a tratamiento y en caso de vaciamiento del absceso al espacio pleural con empiema secundario. La cirugía consiste en realizar un drenaje adecuado del contenido del absceso pulmonar para controlar la sepsis, en primer lugar, y en segundo lugar se debe tratar la fístula broncopleural residual que eventualmente se genere. En el caso de empiemas secundarios se debe realizar un aseo toracoscópico, o un aseo pleural abierto en caso de diagnóstico más tardío.
Atelectasia es el colapso de un segmento pulmonar o un lóbulo pulmonar completo, pudiendo ser aguda o crónica. Las atelectasias agudas pueden ser causadas por diferentes mecanismos y esto permite determinar su forma de tratamiento. No hay evidencias de que alguna terapia sea superior a otra y para todas se ha demostrado algún grado de utilidad, por ello se utilizan en forma combinada. A continuación se describen los tipos de atelectasia y las terapias disponibles:
No existe una definición precisa sobre el límite temporal para hablar de atelectasia crónica, después del cual la zona afectada pierde su capacidad para reexpandirse, pero algunas publicaciones señalan tres meses como referencia. La eventual presencia de bronquiectasias en el mismo segmento de la atelectasia hace difícil determinar cuál lesión es primaria. Habitualmente se combinan en las lesiones crónicas.
En la siguiente imagen se observa la TAC de un paciente portador de atelectasia crónica del lóbulo pulmonar inferior izquierdo (Fig. 4).
Figura 4. Atelectasia crónica del lóbulo pulmonar inferior izquierdo.
En la reconstrucción se observan las bronquiectasias, pero además se puede ver la presencia de grandes adenopatías hiliares, que son frecuentes en este tipo de lesiones crónicas (Fig. 5).
Se denomina bronquiectasia a la dilatación permanente, anormal, de bronquios lobares, segmentarios o subsegmentarios. Habitualmente se acompaña de alteraciones inflamatorias transmurales de la pared del bronquio, con linfocitos T CD4+ y macrófagos. En el lavado bronquioalveolar se detecta elastasa y TNF alfa. La descripción original fue realizada en 1819 por Laënnec, quien caracterizó a estas lesiones como bronquios ectásicos. Las causas de las bronquiectasias son múltiples y varían de acuerdo a las diferentes condiciones sociodemográficas, de forma tal que en los países desarrollados la primera causa es la fibrosis quística del páncreas y en los países en vías de desarrollo son secuelas de infecciones.
En un estudio efectuado en niños aborígenes de Australia se evaluaron las causas de las bronquiectasias no asociadas a fibrosis quística. Se definió como población de estudio a pacientes en control periódico por médico broncopulmonar, con más de cuatro meses de tos productiva y se hizo una revisión retrospectiva de todos los pacientes que tenían fibrobroncoscopía, por las siguientes razones: más de dos episodios de neumonía en el mismo lóbulo, con exclusión de cuerpo extraño si tenían un solo lóbulo comprometido; atelectasia de uno o más lóbulos de más de tres meses de evolución; necesidad de estudiar la vía aérea por episodios de aspiración repetida o por estridor; o clínica no concordante con TAC. En 33 de 65 niños con supuración pulmonar, la fibrobroncoscopía ya estaba hecha. 28 de los 33 niños tenían bronquiectasias radiológicas y 5 tenían supuración crónica sin alteración radiológica. No hubo en este estudio pacientes con hemoptisis y en 32 de 33 pacientes se asumió que el origen de la lesión fue postinfeccioso.
La ubicación de las bronquiectasias fue la siguiente: 34% de los casos, en el lóbulo inferior izquierdo; 20,8%, en el lóbulo inferior derecho; 17% en el lóbulo medio; 11,3% en el lóbulo superior derecho; 3,8% en lóbulo superior izquierdo y 3,8 % en la língula (Fig. 6).
Figura 6. Ubicación de las bronquiectasias según frecuencia.
Los hallazgos en la fibrobroncoscopía del sitio pulmonar afectado se describieron según la clasificación de Nunn y se encontraron en la siguiente frecuencia:
La Tabla I muestra las etiologías de las bronquiectasias y su frecuencia, según otro estudio publicado recientemente, en un grupo de 66 pacientes. En 21% de los casos la causa fue infecciosa; en 12%, neumonia bacteriana; en 17%, asma bronquial; en 33% son desconocidas y en 4% de los casos se encontró disquinesia ciliar primaria, cifra muy elevada en comparación con la incidencia de esta etiologia en nuestro medio (4).
Tabla I. Etiología de las bronquiectasias y su frecuencia de aparición (4).
El diagnóstico de las bronquiectasias es radiológico, con base en una sospecha clínica y principalmente elementos de la historia. La imagen de elección es la TAC de tórax.
En la siguiente figura se observa una imagen típica de una bronquiectasia. Un elemento muy útil para determinar si existe una bronquiectasia en el examen imageneológico es observar la relación que existe entre los bronquios segmentarios y la rama de la arteria pulmonar que lo acompaña; normalmente esta relación es <1, es decir, el diámetro del bronquio es menor que el de la arteria; si es igual o >1 significa que hay una bronquiectasia (Fig. 7).
Otro signo importante es el signo de la línea de ferrocarril, que se puede apreciar en la tomografía cuando se logra hacer un corte longitudinal del bronquio, en el que no se ve una disminución progresiva de su diámetro, como es habitual, sino que las paredes bronquiales van paralelas entre sí.
En cuanto al tratamiento de las bronquiectasias, éste puede ser médico o quirúrgico. El tratamiento médico consiste en:
El tratamiento quirúrgico está indicado en pacientes con:
La técnica quirúrgica de elección es la lobectomía, que se realiza a través de una toracotomía anterolateral sin sección muscular, lo que favorece la recuperación funcional óptima y reduce el dolor postoperatorio. La siguiente imagen muestra una lobectomía; se observa el músculo dorsal disecado y el músculo serrato anterolateral rechazado hacia adelante, con lo que aparece el plano intercostal en forma evidente (Fig. 8).
Figura 8. Toracotomía para lobectomía (véase explicación en el texto).
En la Fig. 9 se muestra el momento en que se liga un vaso segmentario; cada vaso recibe tres ligaduras, dos quedan hacia proximal para cerrar la rama segmentaria de la arteria, como mecanismo de seguridad, y una queda a distal saliendo con la pieza quirúrgica.
En la siguiente imagen se muestra un lóbulo bronquiectásico de color normal, pero con algunas regiones pálido-amarillentas que corresponden a loci de pus en un lóbulo con múltiples bronquiectasias. Durante la lobectomía de estos pacientes no es raro que el anestesista tenga que cambiar el tubo endotraqueal durante la cirugía debido a que se obstruye con pus por la movilización de estos segmentos (Fig. 10).
Figura 10. Lóbulo pulmonar con múltiples bronquiectasias.
Finalmente, cabe mencionar el empiema como una complicación infecciosa capaz de dejar secuelas, pero corresponde a un capítulo aparte.

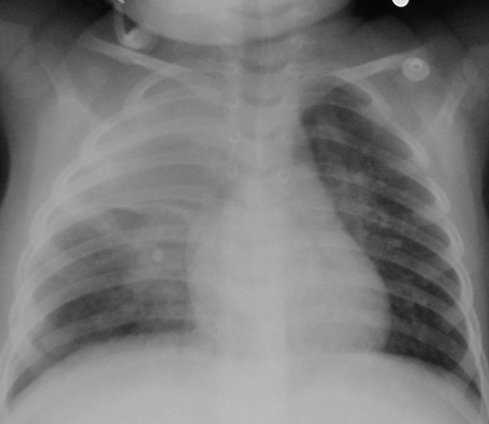 Figura 1. Radiografía de tórax: neumonía del lóbulo superior derecho.
Figura 1. Radiografía de tórax: neumonía del lóbulo superior derecho.

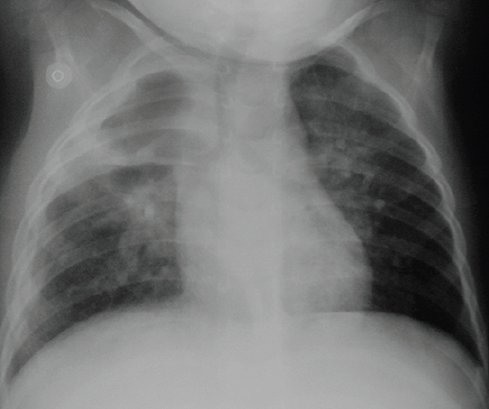 Figura 2. Radiografía de tórax del paciente anterior: la neumonía evolucionó hacia el desarrollo de un neumatocele.
Figura 2. Radiografía de tórax del paciente anterior: la neumonía evolucionó hacia el desarrollo de un neumatocele.

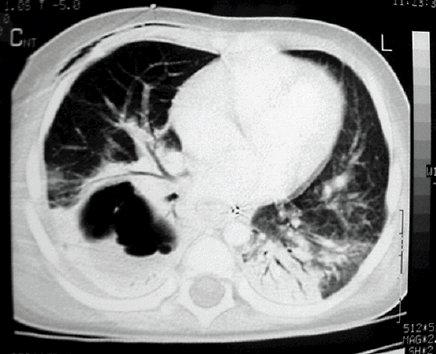 Figura 3. Absceso pulmonar.
Figura 3. Absceso pulmonar.

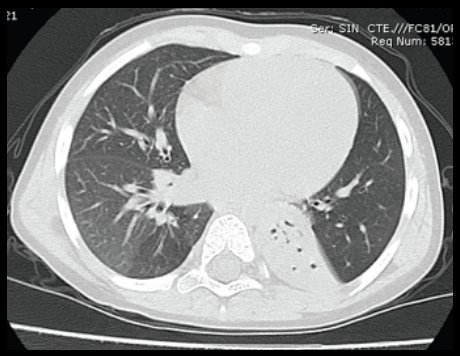 Figura 4. Atelectasia crónica del lóbulo pulmonar inferior izquierdo.
Figura 4. Atelectasia crónica del lóbulo pulmonar inferior izquierdo.

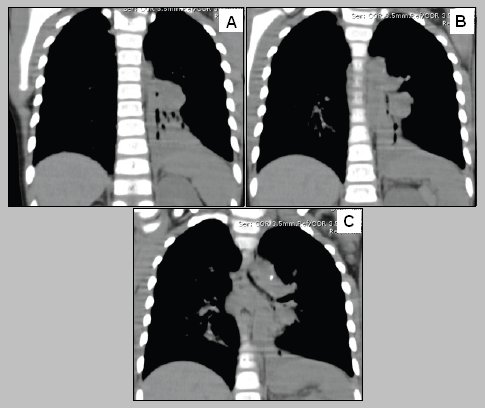 Figura 5. Reconstrucción en paciente portador de atelectasia crónica del lóbulo pulmonar inferior izquierdo, con bronquiectasias e hipertrofia compensatoria del pulmón derecho.
Figura 5. Reconstrucción en paciente portador de atelectasia crónica del lóbulo pulmonar inferior izquierdo, con bronquiectasias e hipertrofia compensatoria del pulmón derecho.


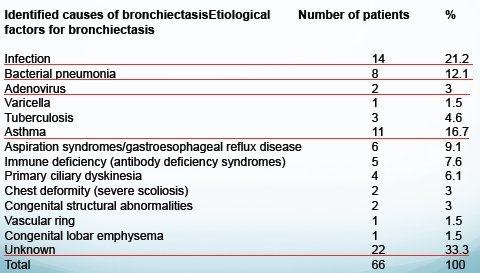 Tabla I. Etiología de las bronquiectasias y su frecuencia de aparición (4).
Tabla I. Etiología de las bronquiectasias y su frecuencia de aparición (4).

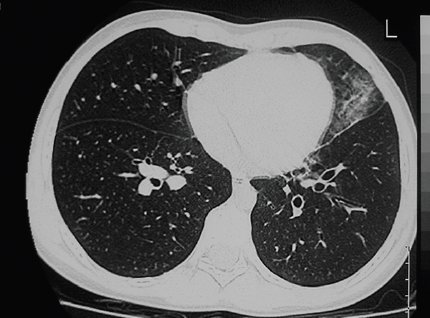 Figura 7. Bronquiectasias: observar la relación entre el diámetro de la arteria y el del bronquio en lóbulo inferior izquierdo, en comparación con el lado derecho.
Figura 7. Bronquiectasias: observar la relación entre el diámetro de la arteria y el del bronquio en lóbulo inferior izquierdo, en comparación con el lado derecho.

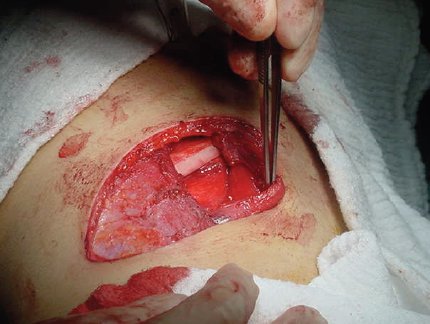 Figura 8. Toracotomía para lobectomía (véase explicación en el texto).
Figura 8. Toracotomía para lobectomía (véase explicación en el texto).

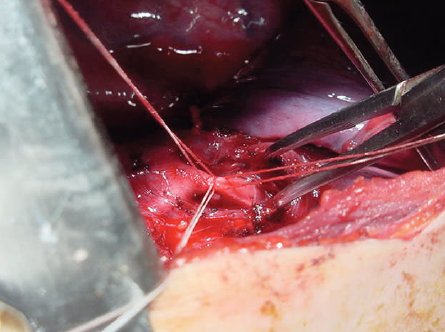 Figura 9. Ligadura de un vaso segmentario pulmonar durante una lobectomía (véase explicación en el texto).
Figura 9. Ligadura de un vaso segmentario pulmonar durante una lobectomía (véase explicación en el texto).

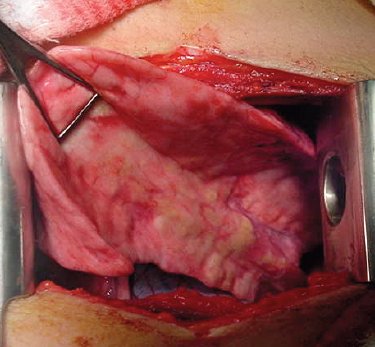 Figura 10. Lóbulo pulmonar con múltiples bronquiectasias.
Figura 10. Lóbulo pulmonar con múltiples bronquiectasias.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en el marco de las reuniones clínicas de la Unidad General de Cuidados del Niño del Hospital Padre Hurtado. La publicación de estas actas científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Unidad. El jefe de la UGCN es el Dr. Alejandro Donoso y el Encargado de las Reuniones Clínicas es el Dr. Mario Vildoso.
 Autor:
Patricio Herrera[1]
Autor:
Patricio Herrera[1]

Citación: Herrera P. Sequelae from lung infections. Medwave 2009 Dic;9(12):e4313 doi: 10.5867/medwave.2009.12.4313
Fecha de publicación: 1/12/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Wexler ID, Knoll S, Picard E, Villa Y, Shoseyov D, Engelhard D, et al. Clinical characteristics and outcome of complicated pneumococcal pneumonia in a pediatric population. Pediatr Pulmonol. 2006 Aug;41(8):726-34. | CrossRef | PubMed |
Wexler ID, Knoll S, Picard E, Villa Y, Shoseyov D, Engelhard D, et al. Clinical characteristics and outcome of complicated pneumococcal pneumonia in a pediatric population. Pediatr Pulmonol. 2006 Aug;41(8):726-34. | CrossRef | PubMed | Imamoðlu M, Cay A, Koþucu P, Ozdemir O, Cobanoðlu U, Orhan F, et al. Pneumatoceles in postpneumonic empyema: an algorithmic approach. J Pediatr Surg. 2005 Jul;40(7):1111-7. | CrossRef | PubMed |
Imamoðlu M, Cay A, Koþucu P, Ozdemir O, Cobanoðlu U, Orhan F, et al. Pneumatoceles in postpneumonic empyema: an algorithmic approach. J Pediatr Surg. 2005 Jul;40(7):1111-7. | CrossRef | PubMed |