 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La creciente cantidad de información disponible en el área de la salud limita seriamente la posibilidad de los clínicos de mantenerse completamente actualizados en la práctica profesional. Muchos profesionales optan por continuar su formación mediante la lectura periódica de revisiones narrativas, artículos amplios y comúnmente preparados por expertos en un tema, que resumen el manejo de determinadas condiciones de acuerdo a sus visiones y experiencias [1]. No obstante, estas publicaciones no siempre contienen recomendaciones basadas en evidencia, lo que las expone a errores sistemáticos que podrían transmitirse al cuidado de pacientes individuales.
Por otro lado, las revisiones sistemáticas corresponden a estudios formales respecto de un elemento específico de una patología que ofrecen sintetizar la evidencia disponible para informar la práctica clínica. En ocasiones los hallazgos pueden ser resumidos estadísticamente en un proceso llamado metanálisis, para el que han sido descritas múltiples técnicas [2],[3],[4]. No obstante, la fortaleza del diseño no yace en este proceso analítico, sino que en el uso de metodologías explícitas orientadas a la detección de literatura relevante y a la evaluación crítica del material incluido, todo lo cual permite establecer estimadores fiables respecto a la utilidad de una intervención o una prueba diagnóstica [3],[5]. Estas características las han hecho progresivamente populares entre los investigadores, objetivándose un exponencial incremento en su disponibilidad y uso en guías clínicas de diversas especialidades [6].
Múltiples pautas han establecido los aspectos metodológicos que hacen fiable a una revisión sistemática [7],[8]. Toda revisión sistemática debiera tener una pregunta clínica focalizada, la que debería especificar al menos una población, una intervención o exposición, un comparador y un desenlace de interés.
El proceso de búsqueda de la información debe ser descrito minuciosamente, incluyendo las bases de datos utilizadas, términos de búsqueda y los periodos considerados. La Colaboración Cochrane ha establecido que la búsqueda se realice en al menos tres bases de datos: PubMed/MEDLINE, EMBASE y Cochrane CENTRAL [3], siendo además deseable la inclusión de otros registros especializados según el tipo de pregunta. Algunos ejemplos son PsycINFO para psiquiatría, PEDro para fisioterapia, entre otras.
No deberían utilizarse restricciones de idioma. Asimismo, el incluir a la llamada literatura gris, es decir material no publicado o publicado informalmente (como tesis de grado, abstracts o reportes técnicos), es altamente deseable por cuanto aporta realismo a los estimadores obtenidos [9]. Los investigadores debieran además ser muy claros respecto a los tipos de estudio a incluir, siendo recomendable la inclusión única de ensayos aleatorizados para revisiones sistemáticas de intervenciones. En casos en que los datos estén disponibles, puede ser aceptable recurrir a estudios controlados para informar al clínico, aunque el nivel de evidencia de la respuesta será indudablemente menor. Toda revisión sistemática debería reportar su estrategia de búsqueda en forma escrita y en un flujograma como el que se muestra en la Figura 1.
Figura 1. Estrategia de búsqueda de una revisión sistemática hipotética.
El siguiente paso crítico está en la evaluación de la calidad de los estudios incluidos. Las evaluaciones de calidad debieran ser efectuadas utilizando pautas y criterios estándar [3],[10]. Es preferible que los investigadores no utilicen puntajes cuantitativos, por cuanto éstos pueden dar una falsa imagen del verdadero potencial de error de estudios individuales. Desde hace algunos años ha aparecido un nuevo concepto de ensayos clínicos llamado “adaptables”. Ello significa que se puede incluir durante el diseño, planificada y prospectivamente, espacios que permitan modificar post hoc algunos de los aspectos del diseño basados en análisis de los datos interinos de los propios sujetos del estudio. Este elemento antes era implanteable en la conducción de ensayos clínicos [11]. La evaluación de sesgo de los estudios incluidos pasa a ser uno de los controles de calidad más importantes en el desarrollo de una revisión sistemática. Los errores sistemáticos que pueden aparecer en la ejecución de un estudio son múltiples, pero los más importantes son:
Sesgo de selección (selection bias): se produce al comparar pacientes que difieren en factores determinantes para el desenlace estudiado. La generación de secuencias aleatorias para la asignación de los participantes a uno u otro grupo, permite controlarlo eficazmente.
Sesgo de desarrollo (performance bias): consiste en la presencia de diferencias sistemáticas entre grupos, respecto a los cuidados entregados que son distintos de la intervención. Por ejemplo, es posible que pacientes asignados a un placebo sean tratados con otros medicamentos que diluyan los efectos de una intervención si sus tratantes, o ellos mismos, saben que están recibiendo placebo. El enmascaramiento permite controlar esta fuente de error.
Sesgo de desgaste (attrition bias): corresponde a la existencia de diferencias sistemáticas en el seguimiento de los participantes del estudio. Las pérdidas de seguimiento llevan a resultados incompletos con la correspondiente incertidumbre respecto a los desenlaces. Se evalúa revisando si se analizaron los datos de todos los pacientes incluidos inicialmente, incluso a aquellos que no completaron el estudio.
Sesgo de detección (detection bias): se trata de la presencia de diferencias en la detección del desenlace de interés entre los grupos, lo que puede llevar a resultados diferentes. Puede controlarse enmascarando al evaluador de los resultados. Es especialmente importante cuando el último define la presencia del desenlace sobre la base de elementos con componentes subjetivos, como una entrevista.
Sesgo de reporte (reporting bias): se refiere al reporte preferencial de algunos hallazgos dentro de un ensayo. Hallazgos estadísticamente significativos tienen mayor propensión a ser publicados. Esta forma de sesgo es similar al sesgo de publicación (ver más abajo) y se controla revisando los protocolos iniciales de los ensayos incluidos.
Una vez revisada la calidad de los estudios se recolectan, analizan e interpretan los datos. Es recomendable que al menos dos personas lleven a cabo esta tarea, puesto que puede existir cierta subjetividad entre autores respecto a la exclusión y valoración de los artículos individuales [11]. Incluir estudios de mala calidad para el análisis afectará al estimador final de la revisión, de la misma forma en que un ingrediente podrido afecta el resultado de un plato gourmet completo.
Dado que las revisiones sistemáticas reúnen resultados de múltiples estudios, es esperable que exista cierta variabilidad entre ellos. Esta última puede ser causada por características de participantes, la forma en que se administra una intervención o se miden los resultados, entre otras. Este fenómeno llamado heterogeneidad, puede detectarse de varias maneras y explorarse mediante análisis de subgrupo o técnicas avanzadas como las metaregresiones [4],[12],[13].
La primera manera de detectar heterogeneidad es simplemente mirar el gráfico en el que se resumen los estudios individuales o forest plot. Estudios con estimadores dispersos, como el que se ve en la Figura 2, evidencian la existencia de heterogeneidad. Pruebas estadísticas como el estadístico Q y el I2 también pueden asistir en detectar esta última. Un estadístico Q significativo (p<0,1 por el bajo poder de esta prueba [4][14]), indica que la variabilidad entre los estudios está más allá de lo esperable por el azar, mientras que el I2 refleja la proporción de esta última variabilidad no atribuible al azar. Un valor de I2 del 0% denota ausencia de heterogeneidad, mientras que 25%, 50% y 75% denotan heterogeneidad leve, moderada y severa, respectivamente [15],[16],[17],[18].
Figura 2. Forest plot hipotético de intervenciones homogéneas y heterogéneas.
En el primer forest plot, los cuadrados representan los riesgos relativos detectados por cada estudio en particular, mientras que la línea horizontal equivale a sus intervalos de confianza del 95%. Se puede apreciar que todos están alineados. Consecuentemente, la prueba del estadístico Q de heterogeneidad no evidencia significancia estadística (p=0,94) y el estadístico I2 muestra un valor de 0%. Esto indica que no existen evidencias de efectos diferenciales entre los estudios que no sean atribuibles al azar. El segundo gráfico en cambio muestra una importante dispersión de los resultados de cada estudio, los que incluso están a ambos lados de la línea de no significancia. Las pruebas estadísticas también muestran la heterogeneidad, detectándose variabilidad importante (I2 de 94%) y no atribuible al azar (p<0,00001).
Pese a todas sus virtudes, las revisiones sistemáticas presentan también algunas debilidades. Una de las más temibles es la posibilidad de no incluir información relevante al momento de realizar la síntesis de la información, lo que claramente puede llevar a cambios en las conclusiones. Esto puede ocurrir cuando no es posible acceder a la información por no estar publicada, fenómeno especialmente frecuente cuando los resultados de un estudio son negativos [19],[20]. Lo anterior es conocido como sesgo de publicación.
Existen múltiples herramientas para enfrentarse a este error, empezando por asegurar una estrategia de búsqueda sensible. El incluir registros de protocolos (tales como www.clinicaltrials.gov o www.alltrials.net) permite detectar ensayos y datos que no hayan sido reportados por los autores. Algunos repositorios, como la iniciativa OpenGrey, permiten detectar material no publicado para ser incluido en la revisión. Otras herramientas son gráficos como el popular gráfico de embudo o funnel plot y pruebas estadísticas formales, tales como la Prueba de Egger o la de McCaskill [3],[21],[22]. En estas últimas, el detectar un valor p significativo (<0,05 o <0,15 para varios autores) indican que existe la posibilidad de haber cometido sesgo de publicación en las estimaciones finales.
Una revisión sistemática es un tipo de diseño que permite recopilar e integrar toda la evidencia disponible para la respuesta de una pregunta clínica focalizada. Esto facilita el proceso de implementación de intervenciones o pruebas diagnósticas en salud. Su validez depende fundamentalmente de evitar hacer omisiones relevantes en cuanto a estudios disponibles y evaluar críticamente todo el material reunido. Sus fortalezas las convierten en fuentes de evidencia científica de alta calidad en tanto cumplan con la aplicación de metodologías explícitas y universales que tienen por objetivo minimizar errores sistemáticos.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no tener conflictos de intereses con la materia de este artículo.

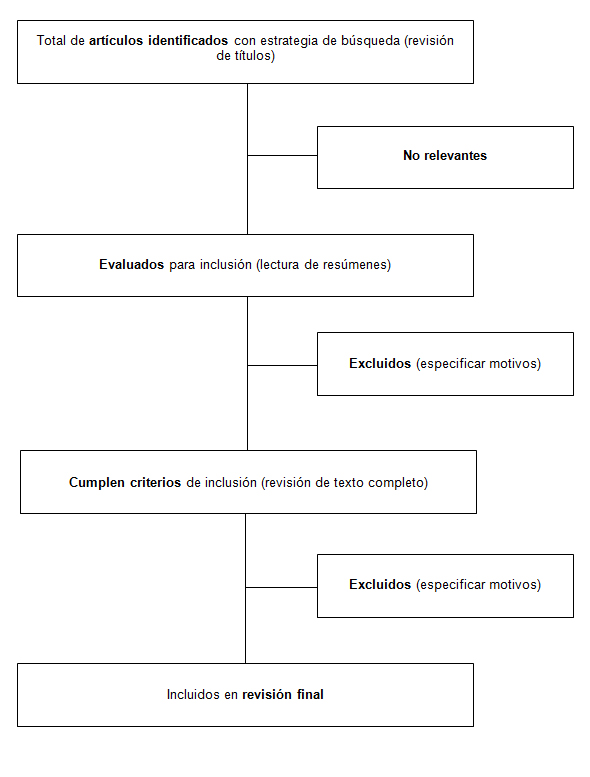 Figura 1. Estrategia de búsqueda de una revisión sistemática hipotética.
Figura 1. Estrategia de búsqueda de una revisión sistemática hipotética.

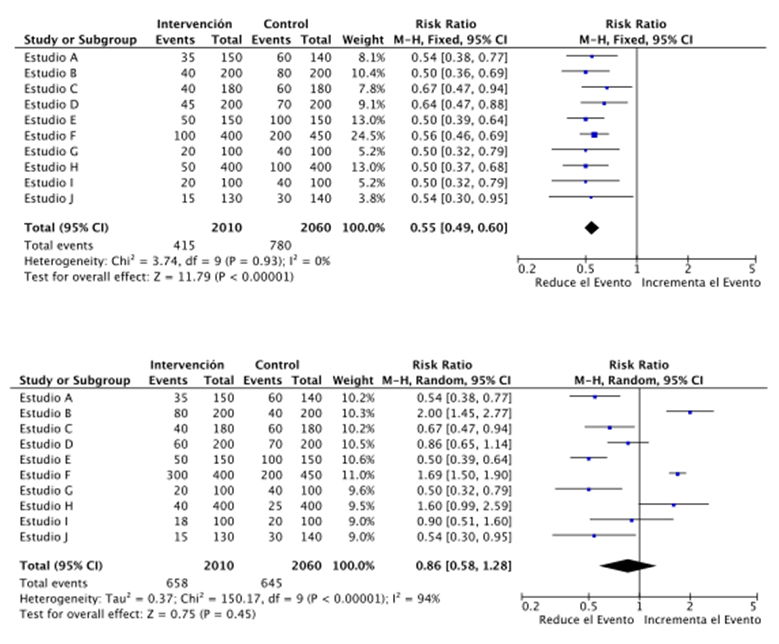 Figura 2. Forest plot hipotético de intervenciones homogéneas y heterogéneas.
Figura 2. Forest plot hipotético de intervenciones homogéneas y heterogéneas.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Autores:
Felipe Martínez Lomakin[1,2,3], Eva Madrid Aris[3]
Autores:
Felipe Martínez Lomakin[1,2,3], Eva Madrid Aris[3]

Citación: Martínez F, Madrid E. Systematic reviews of biomedical literature: an introduction for busy clinicians. Medwave 2014;14(4):e5955 doi: 10.5867/medwave.2014.04.5955
Fecha de envío: 7/4/2014
Fecha de aceptación: 16/5/2014
Fecha de publicación: 23/5/2014
Origen: solicitado
Tipo de revisión: con revisión por cinco pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Manchikanti L, Benyamin RM, Helm S, Hirsch JA. Evidence-based medicine, systematic reviews, and guidelines in interventional pain management: part 3: systematic reviews and meta-analyses of randomized trials. Pain Physician. 2009;12(1):35-72. | PubMed | Link |
Manchikanti L, Benyamin RM, Helm S, Hirsch JA. Evidence-based medicine, systematic reviews, and guidelines in interventional pain management: part 3: systematic reviews and meta-analyses of randomized trials. Pain Physician. 2009;12(1):35-72. | PubMed | Link | van Houwelingen HC, Arends LR, Stijnen T. Advanced methods in meta-analysis: multivariate approach and meta-regression. Stat Med. 2002;21(4):589-624. | CrossRef | PubMed |
van Houwelingen HC, Arends LR, Stijnen T. Advanced methods in meta-analysis: multivariate approach and meta-regression. Stat Med. 2002;21(4):589-624. | CrossRef | PubMed | Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. [on line] | Link |
Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. [on line] | Link | Egger M, Smith GD, Altman D. Systematic reviews in health care: meta-analysis in context. Oxforf, UK: BMJ books, 2008. | Link |
Egger M, Smith GD, Altman D. Systematic reviews in health care: meta-analysis in context. Oxforf, UK: BMJ books, 2008. | Link | Letelier LM, Manríquez JJ, Rada G. Systematic reviews and metaanalysis: are the best evidence? Rev Med Chil. 2005;133(2):246–9. | CrossRef | PubMed |
Letelier LM, Manríquez JJ, Rada G. Systematic reviews and metaanalysis: are the best evidence? Rev Med Chil. 2005;133(2):246–9. | CrossRef | PubMed | Crowther M, Lim W, Crowther MA. Systematic review and meta-analysis methodology. Blood. 2010;116(17):3140-6. | CrossRef | PubMed |
Crowther M, Lim W, Crowther MA. Systematic review and meta-analysis methodology. Blood. 2010;116(17):3140-6. | CrossRef | PubMed | Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 2007;7:10. | CrossRef | PubMed |
Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 2007;7:10. | CrossRef | PubMed | Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions: explanation and elaboration. BMJ. 2009;339:b2700. | CrossRef | PubMed |
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions: explanation and elaboration. BMJ. 2009;339:b2700. | CrossRef | PubMed | McAuley L, Pham B, Tugwell P, Moher D. Does the inclusion of grey literature influence estimates of intervention effectiveness reported in meta-analyses? Lancet. 2000;356(9237):1228-31. | CrossRef | PubMed |
McAuley L, Pham B, Tugwell P, Moher D. Does the inclusion of grey literature influence estimates of intervention effectiveness reported in meta-analyses? Lancet. 2000;356(9237):1228-31. | CrossRef | PubMed | Schulz KF1, Altman DG, Moher D; CONSORT Group. CONSORT 2010 statement: updated guidelines for reporting parallel group randomized trials. Ann Intern Med. 2010;152(11):726-32. | CrossRef | PubMed |
Schulz KF1, Altman DG, Moher D; CONSORT Group. CONSORT 2010 statement: updated guidelines for reporting parallel group randomized trials. Ann Intern Med. 2010;152(11):726-32. | CrossRef | PubMed | Coffey CS1, Levin B, Clark C, Timmerman C, Wittes J, Gilbert P, et al. Overview, hurdles, and future work in adaptive designs: perspectives from a National Institutes of Health-funded workshop. Clin Trials. 2012;9(6):671-80. | CrossRef | PubMed |
Coffey CS1, Levin B, Clark C, Timmerman C, Wittes J, Gilbert P, et al. Overview, hurdles, and future work in adaptive designs: perspectives from a National Institutes of Health-funded workshop. Clin Trials. 2012;9(6):671-80. | CrossRef | PubMed | Oxman AD, Guyatt GH. A consumer's guide to subgroup analyses. Ann Intern Med. 1992;116(1):78-84. | CrossRef | PubMed |
Oxman AD, Guyatt GH. A consumer's guide to subgroup analyses. Ann Intern Med. 1992;116(1):78-84. | CrossRef | PubMed | Berlin JA, Antman EM. Advantages and limitations of metaanalytic regressions of clinical trials data. Online J Curr Clin Trials. 1994;Doc No. 134.
| PubMed |
Berlin JA, Antman EM. Advantages and limitations of metaanalytic regressions of clinical trials data. Online J Curr Clin Trials. 1994;Doc No. 134.
| PubMed | Thompson SG, Higgins JP. Treating individuals 4: can meta-analysis help target interventions at individuals most likely to benefit? Lancet. 2005;365(9456):341-6. | CrossRef | PubMed |
Thompson SG, Higgins JP. Treating individuals 4: can meta-analysis help target interventions at individuals most likely to benefit? Lancet. 2005;365(9456):341-6. | CrossRef | PubMed | Khoshdel A, Attia J, Carney SL. Basic concepts in meta-analysis: A primer for clinicians. Int J Clin Pract. 2006;60(10):1287-94. | CrossRef | PubMed |
Khoshdel A, Attia J, Carney SL. Basic concepts in meta-analysis: A primer for clinicians. Int J Clin Pract. 2006;60(10):1287-94. | CrossRef | PubMed | Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis. Stat Med. 2002;21(11):1539-58. | CrossRef | PubMed |
Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis. Stat Med. 2002;21(11):1539-58. | CrossRef | PubMed | Petitti DB. Approaches to heterogeneity in meta-analysis. Stat Med. 2001 Dec 15;20(23):3625-33. | CrossRef | PubMed |
Petitti DB. Approaches to heterogeneity in meta-analysis. Stat Med. 2001 Dec 15;20(23):3625-33. | CrossRef | PubMed | Huedo-Medina TB, Sánchez-Meca J, Marín-Martínez F, Botella J. Assessing heterogeneity in meta-analysis: Q statistic or I2 index? Psychol Methods. 2006;11(2):193-206. | CrossRef | PubMed |
Huedo-Medina TB, Sánchez-Meca J, Marín-Martínez F, Botella J. Assessing heterogeneity in meta-analysis: Q statistic or I2 index? Psychol Methods. 2006;11(2):193-206. | CrossRef | PubMed | Hopewell S, Loudon K, Clarke MJ, Oxman AD, Dickersin K. Publication bias in clinical trials due to statistical significance or direction of trial results. Cochrane Database Syst Rev. 2009;(1):MR000006. | CrossRef | PubMed |
Hopewell S, Loudon K, Clarke MJ, Oxman AD, Dickersin K. Publication bias in clinical trials due to statistical significance or direction of trial results. Cochrane Database Syst Rev. 2009;(1):MR000006. | CrossRef | PubMed | Dwan K, Altman DG, Arnaiz JA, Bloom J, Chan AW, Cronin E, et al. Systematic review of the empirical evidence of study publication bias and outcome reporting bias. PLoS One. 2008;3(8):e3081. | CrossRef | PubMed |
Dwan K, Altman DG, Arnaiz JA, Bloom J, Chan AW, Cronin E, et al. Systematic review of the empirical evidence of study publication bias and outcome reporting bias. PLoS One. 2008;3(8):e3081. | CrossRef | PubMed | Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997;315(7109):629-34. | CrossRef | PubMed |
Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997;315(7109):629-34. | CrossRef | PubMed | Peters JL, Sutton AJ, Jones DR, Abrams KR, Rushton L. Comparison of two methods to detect publication bias in meta-analysis. JAMA. 2006;295(6):676-80. | CrossRef | PubMed |
Peters JL, Sutton AJ, Jones DR, Abrams KR, Rushton L. Comparison of two methods to detect publication bias in meta-analysis. JAMA. 2006;295(6):676-80. | CrossRef | PubMed | Estadística para aterrorizados: interpretando intervalos de confianza y valores p
Estadística para aterrorizados: interpretando intervalos de confianza y valores p