 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: review, evidence-based medicine
La divulgación de información biomédica se expande de manera exponencial, lo que representa un desafío para aquellos profesionales de la salud que deseen obtener información integrada de alta calidad y relevancia. Las revisiones, en sus distintos formatos, son herramientas que pueden abordar este problema. Este artículo describe los principales tipos de síntesis de información biomédica, sus estructuras, la utilidad de cada una de ellas, y presenta los últimos formatos desarrollados por las diferentes organizaciones que se dedican a la síntesis de información.
El número de artículos que un médico debe leer para mantenerse actualizado, tal como citaba David Sackett en su libro[1], ha crecido de manera exponencial[2]. Para ese entonces, Archie Cochrane ya había previsto que para que un médico se mantuviera actualizado se necesitarían “resúmenes periódicos por especialidad” que asistan al profesional de la salud para la toma de decisiones[3]. Teniendo en cuenta la complejidad cognitiva que implica la tarea de leer de forma adecuada los artículos científicos, en términos del desarrollo de una capacidad crítica y constructiva, como también de conocimientos acerca de la metodología con la cual se realizan las investigaciones biomédicas y la posible existencia de fuentes importantes de sesgos, incluida la manipulación y ocultamiento de datos; hacen que la “valoración crítica de la evidencia científica” sea una tarea ardua para el profesional de salud a la hora de responder sus dudas clínicas y mantenerse actualizado. Las revisiones de la literatura intentan acercar el conocimiento de la evidencia biomédica en sus distintos formatos.
Las revisiones son artículos que sintetizan la información científica utilizando como fuente, en su mayoría, publicaciones primarias de investigaciones originales. Siguiendo el esquema de la medicina basada en evidencia[4],[5], algunos pasos fundamentales para una revisión incluirían:
1) La formulación de una pregunta clínica estructurada bajo el esquema PICO (Patient, Intervention, Comparison, and Outcome,) /tópico de revisión.
2) La búsqueda bibliográfica de información científica.
3) La valoración crítica de los hallazgos.
4) La formulación de conclusiones con base a la evidencia sintetizada.
Considerando lo previamente descrito, existe una amplia gama de artículos denominados indistintamente “revisiones”, pero con diferencias sustanciales en cuanto a los métodos de elaboración y objetivos propuestos[6]. De esta manera, el objetivo de este análisis es esquematizar algunas diferencias entre los diferentes tipos de revisiones y describir los aspectos básicos de cada una de ellas. También señalaremos el rol de algunas organizaciones involucradas en el desarrollo de síntesis y metodología para la síntesis de información biomédica.
La rigurosidad y la reproducibilidad con la que se realizan los pasos anteriormente señalados, permiten subclasificar a las revisiones en narrativas y sistemáticas.
1. Revisiones narrativas
Son revisiones que sintetizan un tema, sin metodología específica ni declarada previamente. A diferencia de las revisiones sistemáticas, las revisiones narrativas seleccionan la evidencia a sintetizar de un modo no reproducible y sin una búsqueda exhaustiva, por cuanto el lector o investigador no podría seguir los pasos que el autor ejecutó para llegar a las mismas conclusiones. Además, al no utilizar una metodología definida existe un alto riesgo de que la información seleccionada para la síntesis resulte estar sesgada o manipulada, lo que limita las conclusiones y resta confianza en los resultados de este tipo de estudio.
Sin embargo, las revisiones narrativas ocupan un importante lugar en la educación continua, pues actualizan a los lectores respecto de temáticas específicas. Pueden tener distintas denominaciones en virtud de su objetivo específico[6] (Tabla 1), y se diferencian de las revisiones sistemáticas en múltiples aspectos estructurales y procedimentales[7] (Tabla 2).
Las revisiones narrativas pueden ser útiles cuando se requiere responder a preguntas amplias (preguntas tipo “déficit global”)[8] relacionadas con conceptos básicos, por ejemplo, ¿qué es el síndrome de Ehlers-Danlos?, ¿cuál es el curso natural de la infección por varicela? También pueden ser una forma de relevar la opinión de individuos o grupos referentes en una determinada temática. En este sentido, un ejemplo típico de revisión narrativa son los capítulos de los libros de medicina. No obstante, a la hora de responder preguntas más específicas mediante el uso de revisiones narrativas (preguntas tipo “grieta”, por ejemplo ¿el uso de antivirales en adultos con varicela reduce la incidencia de complicaciones secundarias?)[8], la evidencia sintetizada puede ser incompleta, seleccionada de manera sesgada (cherry picking)[9] y difícil de interpretar, debido a la falta de valoración de su calidad y aplicabilidad.
Frecuentemente están desarrolladas por los expertos disciplinares del tema, pero no suelen incluir metodólogos en el desarrollo de este tipo de trabajos. Una única revisión narrativa puede incorporar diferentes poblaciones de estudio, estudios en humanos, modelos animales o estudios in vitro. Puede abordar tópicos sobre etiología, diagnóstico, tratamiento y/o pronóstico.
Con el advenimiento de las revisiones sistemáticas (ver abajo), a veces se ha dado preeminencia a este tipo de revisiones por sobre las narrativas, especialmente en revistas biomédicas. Sin embargo, las revisiones narrativas proveen un entendimiento profundo, reflexivo e interpretativo de las problemáticas con las que el profesional de la salud se encuentra en su cotidianeidad[10]. Esto es especialmente importante cuando se reflexiona sobre los elementos que constituyen la complejidad de la pregunta clínica. Por ejemplo, una pregunta terapéutica puede ser “acotada” en su espectro, pero necesitará sintetizar la información de decenas de ensayos clínicos (para lo cual una revisión sistemática cuenta con métodos para garantizar la transparencia y reproducibilidad de sus hallazgos). Sin embargo, una pregunta sobre las implicancias de una determinada terapéutica puede ser “acotada” en la evidencia que sustenta su respuesta, pero puede requerir una gran elaboración reflexiva y crítica basada en fuentes filosóficas, sociales y nosológicas, entre otras.
Tabla 1. Distintas denominaciones para las revisiones narrativas[6].
Tabla 2. Diferencias entre una revisión narrativa y una revisión sistemática [7].
2. Revisiones sistemáticas
Estas revisiones permiten responder a una duda clínica específica o sintetizar un tópico utilizando una metodología reproducible, consignada al cumplimiento estricto de un protocolo de investigación previamente establecido y en muchos casos publicado en bases de datos especializadas. Este protocolo incorpora criterios de elegibilidad para los estudios a incluir, un apartado de métodos y análisis estadístico. Este tipo de revisión asimila los cuatro pasos de la medicina basada en evidencia y vincula herramientas específicas para su adecuado y riguroso desarrollo[4]. En la Tabla 3 se muestra un resumen de la relación entre medicina basada en evidencia y la metodología de las revisiones sistemáticas.
Un aspecto central en las revisiones sistemáticas de la literatura, es que se sustentan sobre los hallazgos de búsquedas sistemáticas de todas las fuentes posibles (búsqueda exhaustiva de evidencia publicada y no publicada), lo que intenta minimizar el sesgo de selección, a diferencia de las revisiones narrativas, en las que, la intuición del autor, su experiencia y aún las opiniones de experto podrían influenciar los hallazgos mediante el fenómeno de cherry picking mencionado arriba[11]. Esto no implica que la visión de un experto en la temática puede ser de vital importancia en los métodos y conducción de revisiones sistemáticas, si bien existe cierto debate sobre el rol de estos expertos y la posibilidad de introducir sesgos en el proceso de revisión[12].
Tabla 3. Pasos de la medicina basada en evidencia y metodología de las revisiones sistemáticas [5].
Las revisiones sistemáticas son muy útiles para las preguntas clínicas tipo “grieta” antes mencionadas. Estas preguntas pueden asociarse, por ejemplo, a la evaluación de la efectividad y seguridad de opciones terapéuticas/preventivas, la evaluación de la precisión de métodos diagnósticos o la identificación de los factores pronósticos de una enfermedad (en la Tabla 4 se indican algunos ejemplos). De esta manera, las revisiones sistemáticas surgieron dentro del marco de la medicina basada en evidencia, integrando todos los pasos necesarios para la de información científica en la toma de decisiones en salud.
Tabla 4. Preguntas clínicas y formulación en formato PICO para revisio-nes sistemáticas.
Las revisiones sistemáticas utilizan como fuente de información los datos primarios de investigación científica relevante para la pregunta clínica, publicada o no publicada (literatura gris). Así, se prioriza la información proveniente de los ensayos clínicos para las preguntas terapéuticas, de los estudios de cohortes para las preguntas pronósticas y de estudios de corte transversal para aquellas relacionadas con la precisión diagnóstica.
2.1 Calidad de las revisiones sistemáticas
Nos referimos a calidad en revisiones sistemáticas cuando se responde a la pregunta ¿Cuán adecuadamente fue realizada esta revisión?. El instrumento más utilizado para valorar esta pregunta es AMSTAR (A Measurement Tool to Assess Systematic Reviews)[13], que ha sido recientemente actualizado a su versión AMSTAR 2[14] (Tabla 4). También existe otra herramienta llamada ROBIS (Risk of bias in systematic reviews)[15],[16], que intenta determinar si las revisiones sistemáticas pueden haber incurrido en sesgos durante su conducción, los denominados “meta-sesgos”[17] que pudiesen afectar sus conclusiones.
Tabla 5. Criterios AMSTAR 2 para la evaluación de la calidad de las revisiones sistemáticas
2.2 Revisiones sistemáticas y Cochrane
En 1993 se fundó la organización originalmente llamada Cochrane Collaboration, ahora denominada Cochrane. Esta organización está integrada por más de 43 000 profesionales de la salud voluntarios y su misión es “promover la toma de decisiones informada en salud mediante la producción de revisiones sistemáticas accesibles, actualizadas, relevantes y de alta calidad, y otros datos de la investigación resumidos”[18]. Las revisiones sistemáticas realizadas por esta colaboración habitualmente tienen mejor calidad que las revisiones sistemáticas que se realizan por fuera de la misma (revisiones no-Cochrane)[19]. Cochrane cuenta con dos guías metodológicas que asisten al proceso de revisión: el Manual Cochrane[4] y el Manual de Expectativas Metodológicas (MECIR)[20]. Aun así, las revisiones no-Cochrane que utilizan esta rigurosa metodología para la síntesis de información pueden tener igualmente alta calidad. Las revisiones Cochrane, a pesar de tener un proceso de evaluación riguroso durante su elaboración, pueden sufrir también de limitaciones metodológicas[19],[21],[22],[23],[24],[25].
Cochrane tiene una organización geográfica en centros de diversa jerarquía localizados en distintas partes del mundo, que tienen como objetivo contribuir a la misión y las metas de Cochrane. En los países hispanoparlantes se destaca la Red Cochrane Iberoamericana, muy activa en la producción y diseminación de revisiones sistemáticas. La red cuenta con proyectos de trabajo colaborativo entre países, como el proyecto de búsqueda manual[26] que intenta identificar ensayos clínicos no publicados o de difícil acceso con el objetivo de disminuir el sesgo de diseminación.
Una de las innovaciones metodológicas más importantes que ha incorporado Cochrane en sus revisiones es la metodología GRADE[27]. GRADE es un sistema de valoración crítica de la evidencia que permite sintetizar la confianza en los hallazgos con una metodología estructurada y transparente, y mediante un lenguaje simplificado, lo que permite la integración de la calidad de la evidencia con los resultados, resumiéndola en calidad como alta, moderada, baja y muy baja. Esta gradación de la evidencia tiene implicancias tanto en el ámbito clínico (que se relaciona con el nivel de incertidumbre que se tiene al momento de adoptar una decisión clínica), como investigativo (al analizar el área en que esta incertidumbre requiera de estudios esclarecedores).
2.3 Otras organizaciones que desarrollan revisiones sistemáticas
Existen otras organizaciones similares a Cochrane que promueven la producción de revisiones sistemáticas de alta calidad en diversos tópicos. Algunos ejemplos incluyen a la Colaboración BEME (www.bemecollaboration.org), enfocada en temáticas de educación médica, y la Colaboración Campbell (www.campbellcollaboration.org), enfocada en tópicos sociales. Las revisiones sistemáticas han cobrado relevancia también en otros campos como el de la investigación básica y traslacional[28]. Dos organizaciones que han promovido iniciativas para el desarrollo de revisiones sistemáticas en estas áreas son CAMARADES (Collaborative Approach to Meta-Analysis and Review of Animal Data from Experimental Studies – www.dcn.ed.ac.uk/camarades/) y SYRCLE (Systematic Review Center for Laboratory animal Experimentation – www.syrcle.nl).
3. Otras formas de síntesis de información emergentes
Existen otros formatos de revisión que utilizan métodos sistemáticos (reproducibles) para formular documentos que asisten a la toma de decisiones en salud:
3.1. Umbrella Reviews (“revisiones paraguas”) u Overviews: son revisiones que compilan hallazgos de un grupo de revisiones sistemáticas. Habitualmente no siguen un formato PICO, sino que se abocan a un tópico más general, por ejemplo intervenciones para enuresis[29]. Esta umbrella review compila los datos de varias revisiones sistemáticas que abarcan distintas estrategias para el manejo de una condición (Figura 1).
Figura 1. Ejemplo de Overview/Umbrella Review..
3.2 Scoping reviews (“revisiones panorámicas”): son revisiones que compilan la evidencia sobre una temática, generalmente con un alcance amplio, sin valoración crítica de la evidencia incluida[30]. Sin embargo, existe gran variabilidad en los métodos utilizados para realizarlas y éstos podrían ser flexibles[31].
3.3 Global Evidence Mapping (“mapeo de la evidencia”): es una herramienta que permite identificar los estudios o revisiones dentro de un determinado tópico, pero no realiza una síntesis de los hallazgos, sino que localiza la evidencia en preguntas individuales de una temática[32]. Es particularmente útil para identificar “vacíos en la evidencia” (“evidence gaps”) en los cuales no hay estudios que evalúen una determinada intervención[33] (Figura 2).
Figura 2. Fragmento de mapa de la evidencia: salud sexual y reproductiva de adolescentes.
3.4 Rapid reviews (“revisión rápida”): son similares a las revisiones sistemáticas en su estructura, no obstante, sus métodos son simplificados para lograr la formulación de un informe dentro de un periodo limitado de tiempo (habitualmente 10 a 12 semanas), a razón de asistir a la toma de decisiones[34].
3.5. Realist reviews (“revisiones realistas”): incorporan conceptos de investigación cualitativa, lo que comprende la complejidad de determinados fenómenos en salud (educación, comunicación y otras intervenciones complejas). Se enfocan en el componente contextual de las intervenciones y los mecanismos que llevan a un determinado resultado (contexto + mecanismo = resultado). Para construir este enfoque explicativo, estas revisiones utilizan un marco teórico de referencia para el análisis cualitativo[35].
Existen distintos tipos de revisiones en salud. Las revisiones narrativas, que no usan métodos sistemáticos, suelen tener gran valor en la información sobre temáticas amplias o de background. Pueden proveer una mirada interpretativa y reflexiva sobre una determinada problemática nutriéndose de diversas fuentes bibliográficas. Por otro lado, las revisiones sistemáticas responden una pregunta focalizada mediante una metodología reproducible que intenta minimizar y transparentar sesgos en el cuerpo de la evidencia. Éstas y otras nuevas formas de revisión, junto a la información del contexto y del paciente, asisten al proceso de toma de decisiones en salud.
Rol de los autores
JF, EM, DS: conceptualización. JF y MA: escritura del manuscrito original. EM y DS: revisión y edición del manuscrito. MA: administración del proyecto. EM y MA: financiamiento de la publicación.
Conflictos de intereses
Los autores declaran no tener conflictos de interés.
Fuente de financiamiento
Este proyecto no contó con fuentes de financiamiento específicas. El costo de la publicación estuvo a cargo de la Universidad de Valparaíso. Las instituciones mencionadas en la filiaciones contribuyeron con el tiempo de trabajo de cada uno de los autores.
Aprobación ética
Este proyecto no requiere de revisión por comité de ética.

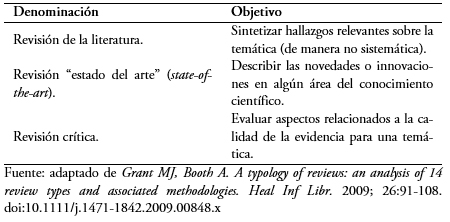 Tabla 1. Distintas denominaciones para las revisiones narrativas[6].
Tabla 1. Distintas denominaciones para las revisiones narrativas[6].

 Tabla 2. Diferencias entre una revisión narrativa y una revisión sistemática [7].
Tabla 2. Diferencias entre una revisión narrativa y una revisión sistemática [7].

 Tabla 3. Pasos de la medicina basada en evidencia y metodología de las revisiones sistemáticas [5].
Tabla 3. Pasos de la medicina basada en evidencia y metodología de las revisiones sistemáticas [5].

 Tabla 4. Preguntas clínicas y formulación en formato PICO para revisio-nes sistemáticas.
Tabla 4. Preguntas clínicas y formulación en formato PICO para revisio-nes sistemáticas.

 Tabla 5. Criterios AMSTAR 2 para la evaluación de la calidad de las revisiones sistemáticas
Tabla 5. Criterios AMSTAR 2 para la evaluación de la calidad de las revisiones sistemáticas

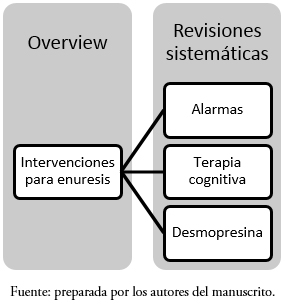 Figura 1. Ejemplo de Overview/Umbrella Review..
Figura 1. Ejemplo de Overview/Umbrella Review..

 Figura 2. Fragmento de mapa de la evidencia: salud sexual y reproductiva de adolescentes.
Figura 2. Fragmento de mapa de la evidencia: salud sexual y reproductiva de adolescentes.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Biomedical information dissemination has expanded exponentially, and this can represent a challenge for those health professionals who wish to obtain high quality and relevant integrated information. Reviews, in their different formats, are tools that can address this problem. This article describes the main types of syntheses of biomedical information, their structures, their usefulness, and presents the latest information synthesis formats that were developed by different organizations committed to this purpose.
 Autores:
Juan Víctor Ariel Franco[1], Marcelo Arancibia[2], Daniel Simancas-Racines[3], Eva Madrid[2]
Autores:
Juan Víctor Ariel Franco[1], Marcelo Arancibia[2], Daniel Simancas-Racines[3], Eva Madrid[2]

Citación: Franco JVA, Arancibia M, Simancas-Racines D, Madrid E. Syntheses of biomedical information: narrative reviews, systematic reviews and emerging formats. Medwave 2018;18(7):e7354 doi: 10.5867/medwave.2018.07.7354
Fecha de envío: 31/8/2018
Fecha de aceptación: 12/11/2018
Fecha de publicación: 27/11/2018
Origen: no solicitado
Tipo de revisión: con revisión por dos pares revisores externos, a doble ciego
Fe de Errata
1. Se corrigen citación y filiaciones en este artículo | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Sackett DL. Evidence-based medicine : how to practice and teach EBM. Churchill Livingstone; 1997.
Sackett DL. Evidence-based medicine : how to practice and teach EBM. Churchill Livingstone; 1997.  Bastian H, Glasziou P, Chalmers I. Seventy-five trials and eleven systematic reviews a day: how will we ever keep up? PLoS Med. 2010 Sep 21;7(9):e1000326. | CrossRef | PubMed |
Bastian H, Glasziou P, Chalmers I. Seventy-five trials and eleven systematic reviews a day: how will we ever keep up? PLoS Med. 2010 Sep 21;7(9):e1000326. | CrossRef | PubMed | Cochrane AL. Archie Cochrane in his own words. Selections arranged from his 1972 introduction to "Effectiveness and Efficiency: Random Reflections on the Health Services" 1972. Control Clin Trials. 1989 Dec;10(4):428-33. | PubMed |
Cochrane AL. Archie Cochrane in his own words. Selections arranged from his 1972 introduction to "Effectiveness and Efficiency: Random Reflections on the Health Services" 1972. Control Clin Trials. 1989 Dec;10(4):428-33. | PubMed | Green S, Higgins JP, Alderson P, et al. Chapter 1: Introduction. In: Higgins JPT, Green S (editors), Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 (updated March 2011). The Cochrane Collaboration 2011. handbook.cochrane.org [on line] . | Link |
Green S, Higgins JP, Alderson P, et al. Chapter 1: Introduction. In: Higgins JPT, Green S (editors), Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 (updated March 2011). The Cochrane Collaboration 2011. handbook.cochrane.org [on line] . | Link | Grant MJ, Booth A. A typology of reviews: an analysis of 14 review types and associated methodologies. Health Info Libr J. 2009 Jun;26(2):91-108. | CrossRef | PubMed |
Grant MJ, Booth A. A typology of reviews: an analysis of 14 review types and associated methodologies. Health Info Libr J. 2009 Jun;26(2):91-108. | CrossRef | PubMed | Pae CU. Why Systematic Review rather than Narrative Review? Psychiatry Investig. 2015 Jul;12(3):417-9. | CrossRef | PubMed |
Pae CU. Why Systematic Review rather than Narrative Review? Psychiatry Investig. 2015 Jul;12(3):417-9. | CrossRef | PubMed | Kopitowski K. Medicina Basada en la Evidencia ¿Cómo formular una pregunta efectiva ? Evid en Atención Primaria. 2002;5:92-4. | Link |
Kopitowski K. Medicina Basada en la Evidencia ¿Cómo formular una pregunta efectiva ? Evid en Atención Primaria. 2002;5:92-4. | Link | Kopitowski K. La falacia de la evidencia incompleta o “cherry picking”. Evid Act Pr Ambul. 2016;19:35-6.
| Link |
Kopitowski K. La falacia de la evidencia incompleta o “cherry picking”. Evid Act Pr Ambul. 2016;19:35-6.
| Link | Greenhalgh T, Thorne S, Malterud K. Time to challenge the spurious hierarchy of systematic over narrative reviews? Eur J Clin Invest. 2018 Jun;48(6):e12931. | CrossRef | PubMed |
Greenhalgh T, Thorne S, Malterud K. Time to challenge the spurious hierarchy of systematic over narrative reviews? Eur J Clin Invest. 2018 Jun;48(6):e12931. | CrossRef | PubMed | Gøtzsche PC, Ioannidis JPA. Content area experts as authors: helpful or harmful for systematic reviews and meta-analyses? BMJ 2012;345:e7031. | CrossRef | PubMed |
Gøtzsche PC, Ioannidis JPA. Content area experts as authors: helpful or harmful for systematic reviews and meta-analyses? BMJ 2012;345:e7031. | CrossRef | PubMed | Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 2007 Feb 15;7:10.
| PubMed |
Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 2007 Feb 15;7:10.
| PubMed | Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017 Sep 21;358:j4008. | CrossRef | PubMed |
Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017 Sep 21;358:j4008. | CrossRef | PubMed | Whiting P, Savović J, Higgins JPT, Caldwell DM, Reeves BC, Shea B, et al. [ROBIS: a new tool to assess risk of bias in systematic reviews was developed]. Recenti Prog Med. 2018 Sep;109(9):421-431. | CrossRef | PubMed |
Whiting P, Savović J, Higgins JPT, Caldwell DM, Reeves BC, Shea B, et al. [ROBIS: a new tool to assess risk of bias in systematic reviews was developed]. Recenti Prog Med. 2018 Sep;109(9):421-431. | CrossRef | PubMed | University of Bristol. ROBIS : Tool to assess risk of bias in systematic reviews. 2015. .bristol.ac.uk.[on line]. | Link |
University of Bristol. ROBIS : Tool to assess risk of bias in systematic reviews. 2015. .bristol.ac.uk.[on line]. | Link | Goodman S, Dickersin K. Metabias: a challenge for comparative effectiveness research. Ann Intern Med. 2011 Jul 5;155(1):61-2. | CrossRef | PubMed |
Goodman S, Dickersin K. Metabias: a challenge for comparative effectiveness research. Ann Intern Med. 2011 Jul 5;155(1):61-2. | CrossRef | PubMed | Page MJ, Shamseer L, Altman DG, Tetzlaff J, Sampson M, Tricco AC, et al. Epidemiology and Reporting Characteristics of Systematic Reviews of Biomedical Research: A Cross-Sectional Study. PLoS Med. 2016 May 24;13(5):e1002028. | CrossRef | PubMed |
Page MJ, Shamseer L, Altman DG, Tetzlaff J, Sampson M, Tricco AC, et al. Epidemiology and Reporting Characteristics of Systematic Reviews of Biomedical Research: A Cross-Sectional Study. PLoS Med. 2016 May 24;13(5):e1002028. | CrossRef | PubMed | Higgins JPT, Lasserson T, Chandler J, et al. Methodological Expectations of Cochrane Intervention Reviews (MECIR). 2016:1-65. [on line] | Link |
Higgins JPT, Lasserson T, Chandler J, et al. Methodological Expectations of Cochrane Intervention Reviews (MECIR). 2016:1-65. [on line] | Link | Franco JVA, Garrote VL, Escobar Liquitay CM, Vietto V. Identification of problems in search strategies in Cochrane Reviews. Res Synth Methods. 2018 Sep;9(3):408-416. | CrossRef | PubMed |
Franco JVA, Garrote VL, Escobar Liquitay CM, Vietto V. Identification of problems in search strategies in Cochrane Reviews. Res Synth Methods. 2018 Sep;9(3):408-416. | CrossRef | PubMed | Yoshii A, Plaut DA, McGraw KA, Anderson MJ, Wellik KE. Analysis of the reporting of search strategies in Cochrane systematic reviews. J Med Libr Assoc. 2009 Jan;97(1):21-9. | CrossRef | PubMed |
Yoshii A, Plaut DA, McGraw KA, Anderson MJ, Wellik KE. Analysis of the reporting of search strategies in Cochrane systematic reviews. J Med Libr Assoc. 2009 Jan;97(1):21-9. | CrossRef | PubMed | Castellini G, Bruschettini M, Gianola S, Gluud C, Moja L. Assessing imprecision in Cochrane systematic reviews: a comparison of GRADE and Trial Sequential Analysis. Syst Rev. 2018 Jul 28;7(1):110. | CrossRef | PubMed |
Castellini G, Bruschettini M, Gianola S, Gluud C, Moja L. Assessing imprecision in Cochrane systematic reviews: a comparison of GRADE and Trial Sequential Analysis. Syst Rev. 2018 Jul 28;7(1):110. | CrossRef | PubMed | Propadalo I, Tranfic M, Vuka I, Barcot O, Pericic TP, Puljak L. In Cochrane reviews risk of bias assessments for allocation concealment were frequently not in line with Cochrane's Handbook guidance. J Clin Epidemiol. 2018 Oct 9. pii: S0895-4356(18)30625-5.
| CrossRef | PubMed |
Propadalo I, Tranfic M, Vuka I, Barcot O, Pericic TP, Puljak L. In Cochrane reviews risk of bias assessments for allocation concealment were frequently not in line with Cochrane's Handbook guidance. J Clin Epidemiol. 2018 Oct 9. pii: S0895-4356(18)30625-5.
| CrossRef | PubMed | Sampson M, McGowan J. Errors in search strategies were identified by type and frequency. J Clin Epidemiol. 2006 Oct;59(10):1057-63. | PubMed |
Sampson M, McGowan J. Errors in search strategies were identified by type and frequency. J Clin Epidemiol. 2006 Oct;59(10):1057-63. | PubMed | Guyatt GH, Oxman AD, Kunz R, Vist GE, Falck-Ytter Y, Schünemann HJ, et al. What is "quality of evidence" and why is it important to clinicians? BMJ. 2008 May 3;336(7651):995-8. | CrossRef | PubMed |
Guyatt GH, Oxman AD, Kunz R, Vist GE, Falck-Ytter Y, Schünemann HJ, et al. What is "quality of evidence" and why is it important to clinicians? BMJ. 2008 May 3;336(7651):995-8. | CrossRef | PubMed | Ritskes-Hoitinga M, Leenaars M, Avey M, Rovers M, Scholten R. Systematic reviews of preclinical animal studies can make significant contributions to health care and more transparent translational medicine. Cochrane Database Syst Rev. 2014 Mar 28;(3):ED000078. | CrossRef | PubMed |
Ritskes-Hoitinga M, Leenaars M, Avey M, Rovers M, Scholten R. Systematic reviews of preclinical animal studies can make significant contributions to health care and more transparent translational medicine. Cochrane Database Syst Rev. 2014 Mar 28;(3):ED000078. | CrossRef | PubMed | Russell K, Kiddoo D. The Cochrane Library and nocturnal enuresis; an umbrella review. Evidence-Based Child Heal A Cochrane Rev J. 2006;1(1):5-8. | CrossRef |
Russell K, Kiddoo D. The Cochrane Library and nocturnal enuresis; an umbrella review. Evidence-Based Child Heal A Cochrane Rev J. 2006;1(1):5-8. | CrossRef | Peterson J, Pearce PF, Ferguson LA, Langford CA. Understanding scoping reviews: Definition, purpose, and process. J Am Assoc Nurse Pract. 2017 Jan;29(1):12-16. | CrossRef | PubMed |
Peterson J, Pearce PF, Ferguson LA, Langford CA. Understanding scoping reviews: Definition, purpose, and process. J Am Assoc Nurse Pract. 2017 Jan;29(1):12-16. | CrossRef | PubMed | Pham MT, Rajić A, Greig JD, Sargeant JM, Papadopoulos A, McEwen SA. A scoping review of scoping reviews: advancing the approach and enhancing the consistency. Res Synth Methods. 2014 Dec;5(4):371-85. | CrossRef | PubMed |
Pham MT, Rajić A, Greig JD, Sargeant JM, Papadopoulos A, McEwen SA. A scoping review of scoping reviews: advancing the approach and enhancing the consistency. Res Synth Methods. 2014 Dec;5(4):371-85. | CrossRef | PubMed | Miake-Lye IM, Hempel S, Shanman R, Shekelle PG. What is an evidence map? A systematic review of published evidence maps and their definitions, methods, and products. Syst Rev. 2016 Feb 10;5:28. | CrossRef | PubMed |
Miake-Lye IM, Hempel S, Shanman R, Shekelle PG. What is an evidence map? A systematic review of published evidence maps and their definitions, methods, and products. Syst Rev. 2016 Feb 10;5:28. | CrossRef | PubMed | International Initiative for Impact Evaluation. Adolescent Sexual and Reproductive Health Evidence Gap Map. gapmaps.3ieimpact.org [on line] | Link |
International Initiative for Impact Evaluation. Adolescent Sexual and Reproductive Health Evidence Gap Map. gapmaps.3ieimpact.org [on line] | Link | Garritty C, Stevens A, Gartlehner G, King V, Kamel C; Cochrane Rapid Reviews Methods Group. Cochrane Rapid Reviews Methods Group to play a leading role in guiding the production of informed high-quality, timely research evidence syntheses. Syst Rev. 2016 Oct 28;5(1):184. | PubMed |
Garritty C, Stevens A, Gartlehner G, King V, Kamel C; Cochrane Rapid Reviews Methods Group. Cochrane Rapid Reviews Methods Group to play a leading role in guiding the production of informed high-quality, timely research evidence syntheses. Syst Rev. 2016 Oct 28;5(1):184. | PubMed | Pawson R, Greenhalgh T, Harvey G, Walshe K. Realist review--a new method of systematic review designed for complex policy interventions. J Health Serv Res Policy. 2005 Jul;10 Suppl 1:21-34. | PubMed |
Pawson R, Greenhalgh T, Harvey G, Walshe K. Realist review--a new method of systematic review designed for complex policy interventions. J Health Serv Res Policy. 2005 Jul;10 Suppl 1:21-34. | PubMed |