 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: coronavirus, cardiovascular diseases, coronavirus infections
En diciembre de 2019 se reportó en Wuhan, China, la aparición de una nueva cepa de coronavirus SARS-CoV-2 que producía un compromiso pulmonar severo y progresaba a estrés respiratorio agudo. A la fecha, son más de diecisiete millones los casos confirmados y más de medio millón los fallecidos en todo el mundo a causa de COVID-19. Los estudios reportan que los pacientes con enfermedad cardiovascular son más susceptibles a contraer esta enfermedad y a presentar más complicaciones. El propósito de esta revisión es proporcionar información actualizada para los profesionales de la salud que atienden a pacientes con COVID-19 y que tienen además enfermedad cardiovascular y por ende un riesgo elevado de complicaciones y mortalidad. Realizamos una búsqueda de bibliografía científica acerca de la asociación de enfermedad cardiovascular y COVID-19 en diferentes bases de datos como Scopus, MEDLINE vía PubMed y Cochrane Library. El tratamiento con inhibidores de la enzima convertidora de angiotensina y bloqueadores del receptor de angiotensina ha sido motivo de discusión y no hay evidencia sólida para contraindicarlo en pacientes con COVID-19. Respecto al tratamiento con hidroxicloroquina asociado o no con azitromicina, hay evidencia que demuestra un mayor riesgo con su utilización, que beneficio clínico y/o disminución de mortalidad. En este contexto, los pacientes con insuficiencia cardíaca representan un grupo importante de riesgo por su condición per se y por el dilema diagnóstico generado al evaluar un paciente con COVID-19, en el que los signos de insuficiencia cardíaca aguda podrían enmascararse. Por otro lado, en los pacientes con síndrome coronario agudo, el enfoque terapéutico inicial podría cambiar en el contexto de la pandemia, aunque sólo sobre la base de opiniones de expertos. Quedan, sin embargo, muchos temas en controversia que serán motivo de investigaciones futuras.
|
Ideas clave
|
Hasta el 2 de agosto de 2020, fecha de término de esta revisión, son más de 17 millones los casos confirmados y más de 600 mil fallecidos por enfermedad por coronavirus 2019 (COVID-19) en el mundo[1], cifras que la posicionan como una de las pandemias más nocivas en la historia de la humanidad, sólo superada en muertes por la viruela, la peste negra y la gripe española H1N1 a inicios del siglo XX[2].
La rápida propagación de la enfermedad y la mortalidad asociada, han centrado la atención en los grupos más vulnerables a desarrollar formas severas de la enfermedad, siendo aquellos de mayor edad y con alguna patología de fondo los más afectados[3],[4], con tasas de mortalidad de hasta 13,2% versus 0,9% en aquellos sin comorbilidades[5],[6]. El objetivo de la presente revisión es proporcionar información actualizada para los profesionales de la salud que atienden a pacientes con COVID-19 y que tienen además enfermedad cardiovascular, y por ende, un riesgo elevado de complicaciones y mortalidad.
Se realizó una búsqueda de bibliografía científica para identificar evidencia sobre la asociación de enfermedad cardiovascular y COVID-19 en las diferentes bases de datos, incluyendo Scopus, MEDLINE vía PubMed y Cochrane Library. Se efectuaron búsquedas con las palabras clave (en inglés y español) en título o abstract“COVID-19”, “Coronavirus” o “Cardiovascular disease” como concepto suplementario. Se usaron los términos booleanos “AND” y “OR”. Asimismo, se realizó una búsqueda manual en las páginas web de grupos dedicados a la investigación en salud y entidades rectoras de la salud en el mundo, incluidos la Organización Mundial de la Salud (OMS) y Organización Panamericana de la Salud (OPS). Finalmente, con una estrategia de “bola de nieve“, se extrajo información de listas de referencias de los estudios primarios y revisiones narrativas seleccionadas.
1) Infección por SARS-CoV-2 y comorbilidad cardiovascular
Los pacientes con factores de riesgo cardiovascular o enfermedad cardiovascular establecida, parecen tener curso clínico más agresivo al asociarse a una infección por SARS-CoV-2 causante del Síndrome Respiratorio Agudo Severo (SARS), así como a un peor pronóstico. Si bien el compromiso respiratorio es característico; la inflamación sistémica producida puede ocasionar compromiso de otros órganos o sistemas, como el cardiovascular, asociándose a altas tasas de mortalidad[5],[6],[7].
Según los datos de mortalidad publicados por la Comisión de Salud Nacional de China (NHC, del inglés National Health Commission), el 35% de los pacientes con infección por SARS-CoV-2 tenía antecedente de hipertensión arterial y el 17% de enfermedad coronaria. En relación a la edad, los pacientes mayores de 60 años tuvieron más síntomas sistémicos y cuadros respiratorios más graves que los menores de dicha edad[8].
Varios estudios reportan que, dentro de las patologías cardiovasculares, la hipertensión arterial fue la que se presentó con mayor frecuencia en los pacientes hospitalizados con COVID-19, relacionándose con mayores tasas de morbilidad y mortalidad. Wu y colaboradores[9] en Wuhan, encontraron que la hipertensión arterial aumentaba 0,7 veces el riesgo de muerte y 0,8 veces el riesgo de desarrollar síndrome respiratorio agudo severo en una serie de 201 pacientes con COVID-19. Además, Zhou y colaboradores[10], evidenciaron que los pacientes hipertensos tenían dos veces más riesgo de mortalidad durante la hospitalización por COVID-19 que los no hipertensos. Esto ubica a la patología cardiovascular como una comorbilidad frecuente en estos pacientes, asociada a un peor pronóstico.
Existe también una importante relación entre la existencia de comorbilidades cardiovasculares y complicaciones sistémicas, que requerirán el ingreso a una unidad de cuidados intensivos. En un reporte de 138 pacientes hospitalizados por COVID-19, los tributarios de unidad de cuidados intensivos tuvieron mayores comorbilidades incluyendo hipertensión arterial con 21 casos (58,3%) versus 22 (21,6%); diabetes con 8 (22,2%) versus 6 (5,9%); enfermedad cardiovascular con 9 (25,0%) versus 11 (10,8%); y enfermedad cerebrovascular con 6 (16,7%) versus 1 (1,0%) que aquellos que no requirieron ingreso a dicha unidad[11].
Hay evidencia de la posible precipitación de daño miocárdico, por distintos mecanismos, secundario a una infección por SARS-CoV-2. Se observó en los registros de la National Health Commission que, entre los fallecidos por este virus, el 11,8% de pacientes aun sin enfermedad cardiovascular subyacente tenían daño cardíaco importante, con niveles elevados de troponina I o desarrollaron infarto agudo de miocardio durante la hospitalización. Asimismo, el desarrollo de injuria miocárdica se asoció con el requerimiento de ingreso a una unidad de cuidados intensivos[11]. Huang y colaboradores[3], encontraron que cinco de los primeros 41 pacientes diagnosticados con COVID-19 en Wuhan China, presentaron un aumento en los niveles de troponina I cardíaca de alta sensibilidad (superior a 28 pico gramos por mililitro), y cuatro de ellos ingresaron a unidad de cuidados intensivos.
2) ¿Hay evidencia para suspender el tratamiento antihipertensivo?
La enzima convertidora de angiotensina 2 es una aminopeptidasa, homóloga de la enzima convertidora de angiotensina 1, pero con actividad opuesta. Se encuentra en mayor porcentaje unida a la membrana del neumocito tipo 2 (forma estructural), con niveles plasmáticos muy bajos (forma soluble) y juega un papel fundamental en el sistema cardiovascular, respiratorio e inmune. La enzima convertidora de angiotensina 2 se encarga de convertir la angiotensina 2 en angiotensina 1-7 y la angiotensina 1 en angiotensina 1-9, ambas con acciones vasodilatadoras[8].
Hoffman y colaboradores[12], demostraron que la enzima convertidora de angiotensina 2 juega un rol como receptor funcional para este tipo de virus, incluidos coronavirus tipo 1 causante del síndrome respiratorio agudo severo (SARS-CoV) y SARS-CoV-2, convirtiéndose en el sitio de entrada y anclaje del virus a las células humanas. Esta interacción se muestra en la Figura 1.
Figura 1. Sistema renina angiotensina aldosterona y SARS-CoV-2.
La proteína S viral posee dos subunidades: S1, que se une al receptor enzima convertidora de angiotensina 2, y S2 que facilita la fusión de la membrana del neumocito con el virus para ser incorporado a la célula mediante una vesícula endosómica. La escisión de la proteína S viral, necesaria para tal fin, es mediante la proteína transmembrana serina 2 (Transmembrane Serine Protease 2, TMPRSS2, por su sigla en inglés) identificada por Hoffman y colaboradores[12]. A su vez, la enzima convertidora de angiotensina 2 puede ejercer sus efectos de dos maneras: en su forma estructural, unida a la membrana celular, como receptor funcional para el anclaje e ingreso de SARS-CoV-2 al neumocito tipo 2; y en su forma soluble, resultado de la liberación de la primera membrana celular por la metaloproteinasa ADAM17, la que a su vez es estimulada por los receptores tipo 1 de angiotensina 2 (AT1). Esta forma es incapaz de mediar el ingreso del virus a la célula al unirse a la subunidad S1, bloqueando al mismo tiempo su punto de anclaje a la forma estructural. Bajo este postulado, altas concentraciones de enzima convertidora de angiotensina 2 solubles, tendrían un efecto protector en la infección por SARS-CoV-2, convirtiendo el mecanismo mencionado en un posible blanco terapéutico[13].
Existe controversia en diversos estudios respecto al uso de fármacos inhibidores de la enzima convertidora de angiotensina, bloqueadores del receptor de angiotensina u otros antagonistas de sistema renina angiotensina aldosterona en pacientes que padecen COVID-19[14]. Esto es debido a que su uso podría causar una sobreexpresión de enzima convertidora de angiotensina 2 en el tejido cardiaco, lo que ha llevado a especular respecto a que dicha regulación positiva de enzima convertidora de angiotensina 2 podría aumentar el riesgo y la susceptibilidad a la infección por COVID-19 en los usuarios de inhibidores de enzima convertidora de angiotensina y bloqueadores del receptor de angiotensina, pero la evidencia es insuficiente a la fecha.
Por otro lado, la expresión tisular de la enzima convertidora de angiotensina 2 varía entre los distintos tipos de tejidos según la integridad de los mismos: será distinta en un pulmón sano, en el pulmón de un paciente con enfermedad cardiovascular o un pulmón afectado por COVID-19[7],[14]. Al respecto, algunos estudios muestran que el uso de inhibidores de enzima convertidora de angiotensina o bloqueadores del receptor de angiotensina puede evitar las formas graves de afección pulmonar, gracias a la regulación positiva en la enzima convertidora de angiotensina 2 y de la angiotensina 1-7, produciendo un efecto vasodilatador y antiinflamatorio. Estos efectos son opuestos a los de la enzima convertidora de angiotensina 1[12],[14].
El conocimiento de la fisiopatología de la infección por SARS-CoV-2 y el sistema renina angiotensina aldosterona ha motivado investigaciones sobre nuevas dianas terapéuticas. Una propuesta es la de Rice y colaboradores[16], quienes plantearon una posible inhibición directa de enzima convertidora de angiotensina 2 mediante el uso de inhibidores de enzima convertidora de angiotensina. Sin embargo, se sabe que la enzima convertidora de angiotensina 2 es una carboxipeptidasa y su homología con la enzima convertidora de angiotensina 1 no concierne al sitio activo, por lo tanto, no puede ser inhibida por el fármaco en cuestión.
Por otro lado, la proteína celular metaloproteasa transmembrana serina 2 y su papel imprescindible para la entrada del SARS-CoV-2 en las células pulmonares, se ha convertido en un objetivo potencial para la intervención terapéutica. Al respecto, el mesilato de camostat ha sido probado en un virus aislado de un paciente infectado, observándose que impedía su ingreso a las células pulmonares[12]. Estos resultados marcan el inicio de futuros ensayos clínicos en el tratamiento de esta enfermedad.
No se cuenta en la actualidad con evidencia sólida para contraindicar estas terapias en pacientes con indicación previa. Al respecto, el American College of Cardiology (ACC, por sus siglas en inglés) y la American Heart Association (AHA), recomiendan la continuación de los mismos para entidades como hipertensión arterial, falla cardíaca o cardiopatía isquémica. La decisión terapéutica debe ser individualizada según el estado hemodinámico y la presentación clínica de la enfermedad[13],[14].
3) ¿Es seguro aún utilizar hidroxicloroquina y/o azitromicina?
No existe, en la actualidad, un tratamiento específico basado en la evidencia para la infección por SARS-CoV-2. La administración de hidroxicloroquina con o sin azitromicina fue uno de los primeros esquemas en plantearse. Sin embargo, a la luz de los hallazgos de los últimos meses, la hidroxicloroquina ha sido retirada de las recomendaciones para el tratamiento de esta patología[17],[18].
La plausibilidad fisiopatológica que se atribuyó a hidroxicloroquina y azitromicina consistía en su capacidad de incrementar del pH endosomial, comprometiendo la ruta endosómica que requieren la mayoría de virus encapsulados para su replicación. Esto implicaría una reducción de la exocitosis en la célula huésped, disminuyendo su diseminación[19]. No obstante, a la fecha no se ha demostrado beneficio en cuanto a mortalidad hospitalaria. Si bien algún reporte demostró reducción del tiempo de recuperación clínica, por la naturaleza de dicho estudio, no se puede afirmar su beneficio basado en la evidencia[20],[21],[22].
Estos fármacos, además de no lograr demostrar beneficios in vivo, tienen la capacidad de producir múltiples efectos adversos. Tanto la hidroxicloroquina como azitromicina generan la prolongación del tiempo de repolarización y, por ende, del intervalo QT mediante el bloqueo del canal de potasio IKr. Por este motivo, se encuentran catalogados como fármacos con riesgo de producir torsade de pointes. Además, su administración conjunta incrementa la frecuencia de presentación de arritmias malignas y muerte súbita[23]. No obstante, existen fármacos que prolongan el intervalo QT y no están asociados necesariamente a incremento de la mortalidad a causa de arritmias[24]. Incluso, otros fármacos usados contra el SARS-CoV-2 como lopinavir/ritonavir son clasificados también como drogas con riesgo de producir torsade de pointes, reportándose casos en los que se observó que provocan alteración en la conducción cardíaca, mediante prolongación del intervalo PR[25].
Aunque estos efectos adversos son infrecuentes, la gran cantidad de infectados que podrían llegar a recibir estos tratamientos, vuelve relevante el conocer su perfil farmacológico y los riesgos inherentes a su uso[26].
Es probable que los pacientes que son hospitalizados por COVID-19 tengan un riesgo arrítmico incrementado, así como el intervalo QT corregido basal prolongado debido a alteraciones metabólicas, fallo orgánico múltiple o presencia de comorbilidades[24]. Por lo tanto, es importante identificar a estos pacientes y prevenir desenlaces no deseados[27],[28]. En 2013 Tisdale y colaboradores[27], desarrollaron y validaron un puntaje con ese propósito, el cual se muestra en la Tabla 1. El mismo permite agrupar a los pacientes en tres categorías según el riesgo: bajo riesgo (menos de 7 puntos), moderado riesgo (entre 7 y 10 puntos) y alto riesgo (11 puntos o más).
Tabla 1. Puntuación de Tisdale para riesgo de prolongación del intervalo QTc.
El objetivo de esta estratificación no es contraindicar el uso de estos medicamentos, sino reconocer a los pacientes en riesgo que podrían beneficiarse de un monitoreo estricto y una prescripción farmacológica cuidadosa[26].
Las recomendaciones propuestas en varias investigaciones para pacientes con COVID-19 a los que se ha administrado estas drogas, sugieren monitoreo cercano y corrección de aquellos factores de riesgo modificables con la finalidad de mitigar el riesgo arrítmico[26],[29],[30] (Figura 2).
El QT corregido representa actualmente la mejor forma de valorar dicho riesgo (el QT corregido superior a 500 milisegundos representa un riesgo incrementado de torsade de pointes y muerte súbita). Una publicación reciente sugirió que la corrección del intervalo QT según la frecuencia cardíaca se debe realizar mediante las fórmulas de Fridericia o Framingham, por tener mejor estimación de la mortalidad[24], en comparación con la fórmula de Bazzet que podría sobreestimar el valor del QT corregido, conllevando medidas preventivas innecesarias[31].
Finalmente, nueva evidencia muestra carencia de beneficios con el uso de hidroxicloroquina y un aumento de efectos adversos[18],[32],[33]. Una serie de ensayos clínicos, algunos aún en desarrollo, demostraron que este fármaco no reduce la mortalidad por COVID-19 y no es efectivo para el tratamiento o la profilaxis post exposición[34],[35]. Teniendo esto como base, recientemente fue excluido por la OMS mediante el ensayo clínico Solidarity[36]. Por este motivo, la decisión de utilizar estos medicamentos debe estar sujeta a la evidencia científica actual[32],[33],[34],[35],[36].
4) Falla cardíaca y COVID-19 ¿Es posible diferenciarlas?
No se conoce del todo el mecanismo por el cual el SARS-CoV-2 altera el curso de la falla cardíaca en los pacientes que la padecen[37], pero se postula que estaría relacionado con el rol que juegan el sistema renina angiotensina aldosterona y la enzima convertidora de angiotensina 2 en la patogénesis de esta enfermedad y, a su vez, en la primoinfección y la fisiopatología. Por lo tanto, constituye un grupo de alto riesgo[10],[38],[39].
Aunque no existe evidencia sólida sobre cómo abordar estas entidades juntas, las sociedades de cardiología más importantes en el mundo han dado algunos detalles al respecto, lo que ha posibilitado plantear tres escenarios[40]:
Escenario 1: descompensación de falla cardíaca sin sospecha de COVID-19
Los pacientes con falla cardíaca se pueden descompensar por diversas causas, que van desde la falta del tratamiento hasta infecciones oportunistas que empeoran su pronóstico. Por ello, es importante que tengan el mínimo contacto con los establecimientos de salud, para evitar exposiciones innecesarias y posibles contagios[10].
Para el tratamiento de estos pacientes es importante identificar el perfil hemodinámico e instaurar el manejo más adecuado, cuyas recomendaciones se basan en las guías de práctica clínica vigentes (Tabla 2)[41],[42]. Deben priorizarse el seguimiento no presencial por telemedicina y la visita domiciliaria, en segunda instancia, para la regulación de la medicación.
Escenario 2: descompensación de falla cardíaca y sospecha de COVID-19
Lograr diferenciarlas resulta un gran reto para el clínico, debido a que síntomas como disnea y tos suelen ser comunes a ambas entidades. Una historia clínica y examen físico exhaustivos, junto a herramientas auxiliares (Tabla 3) pueden orientarnos a un diagnóstico más exacto y un tratamiento oportuno[10],[15],[43],[44]. Sin embargo, si la sospecha de COVID-19 es alta se sugiere seguir los algoritmos de manejo y aislamiento según los protocolos de cada región[10]. Con respecto al manejo se recomienda el tratamiento concomitante de insuficiencia cardíaca según los perfiles hemodinámicos[40]. El uso de la ventilación no invasiva no debe ser de elección en estos pacientes, y sólo en ausencia de mejoría se debe optar un manejo con ventilación mecánica[40],[41].
Escenario 3: pacientes trasplantados en tiempos de COVID-19
Los pacientes trasplantados son el grupo de mayor riesgo, ya que por su condición son tratados con inmunosupresores, lo cual los predispone a contraer infecciones más severas. No se cuenta con evidencia sobre la forma de presentación y comportamiento de la infección por COVID-19 en estos pacientes, aunque algunas sociedades de cardiología han recomendado en los casos leves y/o moderados continuar la terapia inmunosupresora habitual, y en los casos severos disminuir la dosis o suspenderla[40].
Los pacientes con insuficiencia cardíaca son un grupo de riesgo para contraer la infección por COVID-19, con un pronóstico más sombrío, por lo cual debe evitarse por el mayor tiempo posible, el contacto con el sistema sanitario, priorizando el seguimiento no presencial.
5) Síndrome coronario agudo en pacientes con COVID-19 ¿Estrategia farmacológica o invasiva?
El espectro clínico de los pacientes con infección por SARS-CoV-2 es muy variable, desde formas asintomáticas hasta severas, donde se documenta mayor afectación cardiovascular. La evidencia de injuria miocárdica aguda en este grupo de pacientes denota diferentes mecanismos fisiopatológicos como la cardiotoxicidad directa por el virus, cardiomiopatía de estrés, síndrome de respuesta inflamatoria sistémica, entre otros[29],[45],[46].
En algunos reportes de pacientes con COVID-19, la enfermedad coronaria estuvo presente hasta en 11,1% de los casos[4], siendo más frecuente en aquellos que requirieron atención en una unidad de cuidados intensivos[3]. El compromiso cardíaco en pacientes con enfermedad por coronavirus puede determinarse a través de biomarcadores de injuria miocárdica, resultado obtenido a su vez por Zhou y colaboradores[10], en 59% de pacientes fallecidos por COVID-19 en Wuhan, China.
Dado el importante componente inflamatorio en la fisiopatología de la infección por SARS-CoV-2, la isquemia miocárdica puede producirse principalmente por desequilibrio entre el aporte y requerimiento de oxígeno, constituyendo así un infarto agudo de miocardio tipo 2, con tasas de mortalidad de 2,5% según un reporte italiano[46],[47].
La presentación clínica de los pacientes con COVID-19 puede enmascarar la de un síndrome coronario agudo como la disnea y el dolor torácico[11]. Por este motivo, el diagnóstico clínico puede resultar todo un reto en los servicios de urgencias, donde las pruebas de laboratorio e imágenes resultarán de mucha ayuda para el diagnóstico diferencial. Las alteraciones en el electrocardiograma de un paciente con COVID-19 no suelen ser diferentes de los pacientes sin esta enfermedad. Sin embargo, esta población presenta algunas particularidades como una mayor frecuencia de supradesnivel persistente del segmento ST, probablemente relacionado con casos de miocarditis aguda y no necesariamente a enfermedad coronaria ateroesclerótica. Wang y colaboradores[11], documentaron arritmias en 23 (16,7%) de 138 pacientes hospitalizados con diagnóstico de COVID-19, de los cuales la mayoría fueron los admitidos en unidad de cuidados intensivos.
Los biomarcadores cardíacos son determinantes para el diagnóstico de injuria miocárdica y pueden elevarse más allá del percentil 99 entre el día 14 y 21 del inicio de síntomas[10]. Sin embargo, esto depende de la etiopatogenia del cuadro y de la coexistencia o no de patología cardiovascular. En los casos leves de pacientes con COVID-19 y antecedente de enfermedad cardiovascular, los biomarcadores pueden elevarse sin llegar a superar el límite de normalidad. En cambio en los casos severos, la elevación puede ser mayor a cinco veces el valor normal. Por otro lado, en patologías como síndrome coronario agudo, miocarditis o síndrome de Takotsubo, la elevación de biomarcadores suele ser de hasta 10 veces el límite superior de normalidad[37], de lo que se puede inferir que la elevación de biomarcadores es mayor si el compromiso miocárdico es directo o de causa primaria. Si persiste la duda diagnóstica, es posible optar por métodos no invasivos como la ecocardiografía rápida y la angiotomografía de coronarias. Ambas son de buen rendimiento diagnóstico, evitando así la exposición innecesaria del personal de salud[45]. Por su parte, el síndrome coronario agudo sin elevación persistente del ST en pacientes con COVID-19, debe ser manejado en función de la estratificación de riesgo tal como suele realizarse en pacientes sin esta enfermedad[29].
En el caso de síndrome coronario agudo con elevación persistente del segmento ST, las medidas farmacológicas, e idealmente los tiempos de reperfusión, deberían cumplirse de la misma manera como en aquellos pacientes sin diagnóstico de COVID-19, teniendo en cuenta todas las medidas de bioseguridad. Es importante recalcar que el tratamiento no debería ser retrasado bajo ningún contexto, en la espera de una prueba confirmatoria de infección por SARS-CoV-2. Hay consensos importantes como el europeo y el americano, que han sugerido priorizar el uso de una reperfusión farmacológica mediante fibrinólisis sobre una estrategia invasiva, solo si el tiempo de evolución es menor de tres horas, incluso en centros que cuentan con laboratorio de cateterismo cardíaco[29].
Preferir la estrategia no invasiva se justifica para algunos casos, debido a los retrasos advertidos desde el inicio de los síntomas hasta el primer contacto médico paciente[48], el tiempo que toma realizar pruebas para detección de infección por SARS-CoV-2 en el servicio de urgencias, así como la demora en cumplir con todas las medidas bioseguridad para un procedimiento invasivo, seguro y con el menor tiempo de exposición por el personal del laboratorio de cateterismo cardíaco[49]. Sin embargo, algunos consideran esta visión como contradictoria, debido a que, al realizar una fibrinólisis y luego la intervención coronaria percutánea, en un significativo porcentaje de casos, se expone al personal de salud a un mayor tiempo de contacto total con el paciente. Por otro lado, la eficacia de la primera es significativamente menor con mayores tasas de mortalidad, reinfarto y sangrado[50]. Estas últimas objeciones pueden ser válidas si se tiene un sistema de salud que soporte la factibilidad de la intervención coronaria percutánea como primera opción terapéutica, cuyos estándares en tiempos y disponibilidad de recursos se asemejen a aquellos encontrados en los estudios. En ellos se demostraron sus bondades y ventajas sobre la estrategia no invasiva, además de garantizar una bioseguridad adecuada. Lamentablemente en nuestro medio, la intervención coronaria percutánea es una alternativa que no está a disposición en los tiempos que marcan las guías. Por esta razón, la fibrinólisis, si no está contraindicada, suele ser la primera opción.
Se sabe, además, con respecto a la reperfusión, que el tratamiento de la arteria culpable del evento coronario agudo, tiene mayor impacto durante la intervención coronaria percutánea primaria, y según el estado clínico del paciente se podría intervenir las arterias no culpables, para evitar una exposición posterior en un tratamiento por fases[29].
En conclusión, los pacientes con o sin COVID-19 que desarrollan un síndrome coronario agudo deben ser sometidos a los mismos protocolos, tomando en cuenta todas las medidas de bioseguridad[46],[50].
COVID-19 es una pandemia que constituye una amenaza para aquellos pacientes con enfermedades cardiovasculares, con altas tasas de morbilidad y mortalidad. Los mecanismos no se conocen del todo, pero el curso catastrófico de la enfermedad se atribuye a la alta carga inflamatoria subyacente. Los biomarcadores cardíacos se muestran como un gran aliado en la identificación temprana de los pacientes con alto riesgo de complicaciones.
Queda aún mucho por investigar respecto a infección por SARS-CoV-2 y sus implicancias a nivel cardiovascular, así como los aspectos relacionados con la terapéutica.
Roles de autoría
MBGS, RRRG: conceptualización del manuscrito, aspectos metodológicos y administración de la investigación, recopilación de información, análisis formal de los datos obtenidos, así como en la redacción, revisión y aprobación del informe final de la investigación. EVP, MCA, RP, RA: recopilación de información y análisis formal de la misma, así como en la redacción del informe final. RAR, CCA: redacción, revisión y aprobación de la versión final de la investigación.
Declaración de conflictos de intereses
No hay conflictos de intereses con la materia de este artículo por parte de los autores.
Financiamiento
Investigación autofinanciada por los autores.

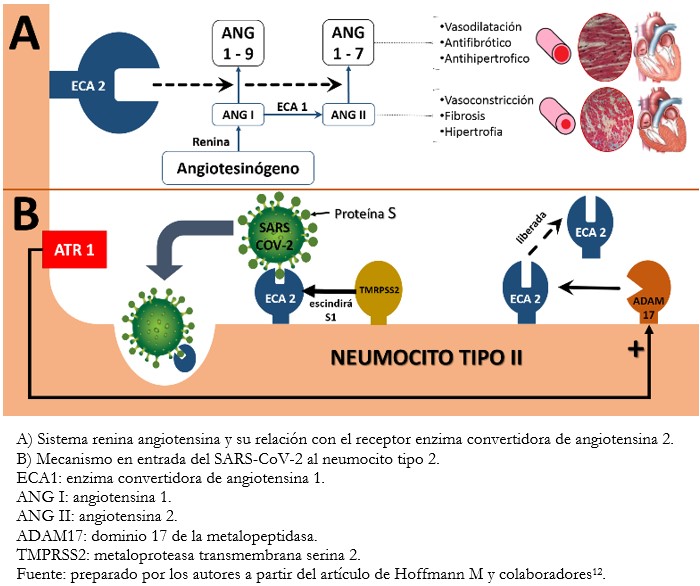 Figura 1. Sistema renina angiotensina aldosterona y SARS-CoV-2.
Figura 1. Sistema renina angiotensina aldosterona y SARS-CoV-2.

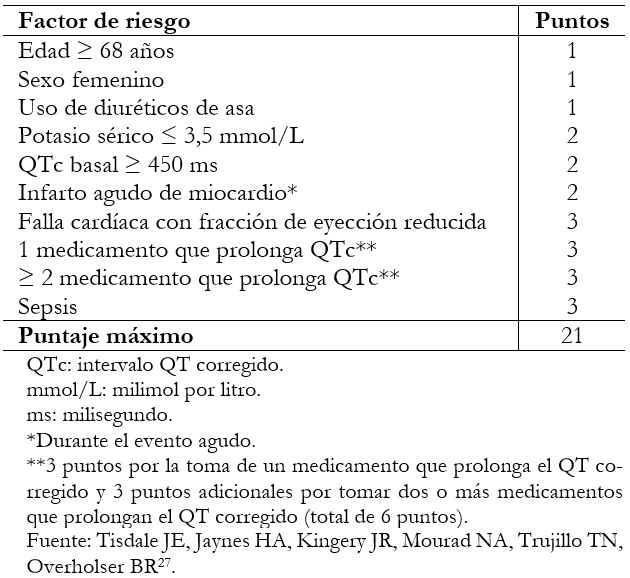 Tabla 1. Puntuación de Tisdale para riesgo de prolongación del intervalo QTc.
Tabla 1. Puntuación de Tisdale para riesgo de prolongación del intervalo QTc.

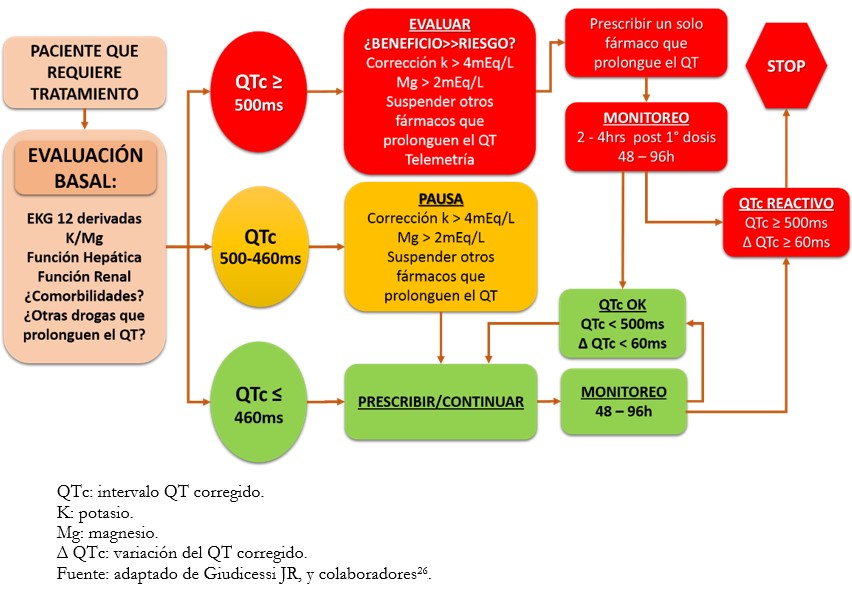 Figura 2. Algoritmo de monitoreo para pacientes que requieren tratamiento con drogas que prolonguen el intervalo QT.
Figura 2. Algoritmo de monitoreo para pacientes que requieren tratamiento con drogas que prolonguen el intervalo QT.

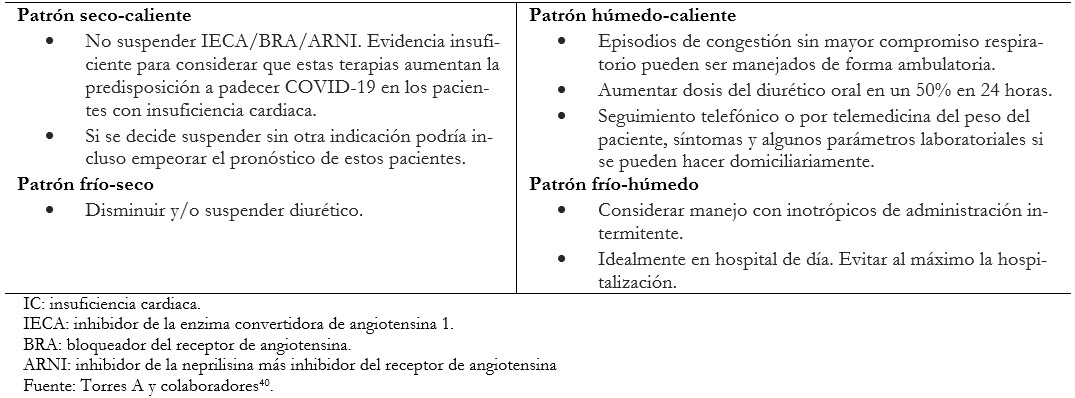 Tabla 2. Tratamiento de falla cardíaca según perfiles hemodinámicos de pacientes con IC sin sospecha de infección por SARS-CoV2.
Tabla 2. Tratamiento de falla cardíaca según perfiles hemodinámicos de pacientes con IC sin sospecha de infección por SARS-CoV2.

 Tabla 3. Diagnóstico diferencial de sospecha entre IC y COVID-19 basado en datos analíticos y radiológicos.
Tabla 3. Diagnóstico diferencial de sospecha entre IC y COVID-19 basado en datos analíticos y radiológicos.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

In December 2019, a new strain of the SARS-CoV-2 coronavirus was reported in Wuhan, China, which produced severe lung involvement and progressed to respiratory distress. To date, more than seventeen million confirmed cases and more than half a million died worldwide from COVID-19. Patients with cardiovascular disease are more susceptible to contracting this disease and presenting more complications. We did a literature search on the association of cardiovascular disease and COVID-19 in databases such as Scopus, PubMed/MEDLINE, and the Cochrane Library. The purpose of this review is to provide updated information for health professionals who care for patients with COVID-19 and cardiovascular disease, given that they have a high risk of complications and mortality. Treatment with angiotensin-converting enzyme inhibitors and receptor blockers is controversial, and there is no evidence not to use these medications in patients with COVID-19. Regarding treatment with hydroxychloroquine associated or not with azithromycin, there is evidence of a higher risk with its use than clinical benefit and decreased mortality. Likewise, patients with heart failure are an important risk group due to their condition per se. Patients with heart failure and COVID-19 are a diagnostic dilemma because the signs of acute heart failure could be masked. On the other hand, in patients with acute coronary syndrome, the initial therapeutic approach could change in the context of the pandemic, although only based on expert opinions. Nonetheless, many controversial issues will be the subject of future research.
 Autores:
Mario B García-Saavedra[1], Renzo R Rosales-Gutiérrez[2], Esmeralda Valverde[1], Maryuri Chumbes-Aguirre[2], Ricardo Alvarado[2], Robert Polo[2], Rubén Azañero[2], Carlos Chávez[1]
Autores:
Mario B García-Saavedra[1], Renzo R Rosales-Gutiérrez[2], Esmeralda Valverde[1], Maryuri Chumbes-Aguirre[2], Ricardo Alvarado[2], Robert Polo[2], Rubén Azañero[2], Carlos Chávez[1]

Citación: García-Saavedra MB, Rosales-Gutiérrez RR, Valverde E, Chumbes-Aguirre M, Alvarado R, Polo R, et al. Cardiovascular implications of SARS-CoV-2 infection: A literature review. Medwave 2020;20(7):e8008 doi: 10.5867/medwave.2020.07.8008
Fecha de envío: 17/5/2020
Fecha de aceptación: 3/8/2020
Fecha de publicación: 28/8/2020
Origen: No solicitado
Tipo de revisión: Revisión por pares externa, por tres árbitros a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Brueck H, Gal S. How the coronavirus death toll compares to other pandemics, including SARS, HIV, and the Black Death. Business Insider. 2020. [On line]. | Link |
Brueck H, Gal S. How the coronavirus death toll compares to other pandemics, including SARS, HIV, and the Black Death. Business Insider. 2020. [On line]. | Link | Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb 15;395(10223):497-506. | CrossRef | PubMed |
Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb 15;395(10223):497-506. | CrossRef | PubMed | Richardson S, Hirsch JS, Narasimhan M, Crawford JM, McGinn T, Davidson KW, et al. Presenting Characteristics, Comorbidities, and Outcomes Among 5700 Patients Hospitalized With COVID-19 in the New York City Area. JAMA. 2020 Apr 22;323(20):2052–9. | CrossRef | PubMed |
Richardson S, Hirsch JS, Narasimhan M, Crawford JM, McGinn T, Davidson KW, et al. Presenting Characteristics, Comorbidities, and Outcomes Among 5700 Patients Hospitalized With COVID-19 in the New York City Area. JAMA. 2020 Apr 22;323(20):2052–9. | CrossRef | PubMed | World Health Organization. Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID 19). WHO; 2020. [On line]. | Link |
World Health Organization. Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID 19). WHO; 2020. [On line]. | Link | Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, et al. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020 Mar 27;5(7):1–8. | CrossRef | PubMed |
Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, et al. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020 Mar 27;5(7):1–8. | CrossRef | PubMed | Zheng YY, Ma YT, Zhang JY, Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol. 2020 May;17(5):259-260. | CrossRef | PubMed |
Zheng YY, Ma YT, Zhang JY, Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol. 2020 May;17(5):259-260. | CrossRef | PubMed | Chan JF, Yuan S, Kok KH, To KK, Chu H, Yang J, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020 Feb 15;395(10223):514-523. | CrossRef | PubMed |
Chan JF, Yuan S, Kok KH, To KK, Chu H, Yang J, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020 Feb 15;395(10223):514-523. | CrossRef | PubMed | Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020 Mar 13;180(7):1–11. | CrossRef | PubMed |
Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020 Mar 13;180(7):1–11. | CrossRef | PubMed | Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. | CrossRef | PubMed |
Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. | CrossRef | PubMed | Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020 Feb 7;323(11):1061–9. | CrossRef | PubMed |
Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020 Feb 7;323(11):1061–9. | CrossRef | PubMed | Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020 Apr 16;181(2):271-280.e8. | CrossRef | PubMed |
Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020 Apr 16;181(2):271-280.e8. | CrossRef | PubMed | Danser AHJ, Epstein M, Batlle D. Renin-Angiotensin System Blockers and the COVID-19 Pandemic: At Present There Is No Evidence to Abandon Renin-Angiotensin System Blockers. Hypertension. 2020 Jun;75(6):1382-1385. | CrossRef | PubMed |
Danser AHJ, Epstein M, Batlle D. Renin-Angiotensin System Blockers and the COVID-19 Pandemic: At Present There Is No Evidence to Abandon Renin-Angiotensin System Blockers. Hypertension. 2020 Jun;75(6):1382-1385. | CrossRef | PubMed | Patel AB, Verma A. COVID-19 and Angiotensin-Converting Enzyme Inhibitors and Angiotensin Receptor Blockers: What Is the Evidence? JAMA. 2020 Mar 24. | CrossRef | PubMed |
Patel AB, Verma A. COVID-19 and Angiotensin-Converting Enzyme Inhibitors and Angiotensin Receptor Blockers: What Is the Evidence? JAMA. 2020 Mar 24. | CrossRef | PubMed | Bozkurt B, Kovacs R, Harrington B. HFSA/ACC/AHA Statement Addresses Concerns Re: Using RAAS Antagonists in COVID-19. ACC News Story. 2020. [On line]. | Link |
Bozkurt B, Kovacs R, Harrington B. HFSA/ACC/AHA Statement Addresses Concerns Re: Using RAAS Antagonists in COVID-19. ACC News Story. 2020. [On line]. | Link | Rice GI, Thomas DA, Grant PJ, Turner AJ, Hooper NM. Evaluation of angiotensin-converting enzyme (ACE), its homologue ACE2 and neprilysin in angiotensin peptide metabolism. Biochem J. 2004 Oct 1;383(Pt 1):45-51. | CrossRef | PubMed |
Rice GI, Thomas DA, Grant PJ, Turner AJ, Hooper NM. Evaluation of angiotensin-converting enzyme (ACE), its homologue ACE2 and neprilysin in angiotensin peptide metabolism. Biochem J. 2004 Oct 1;383(Pt 1):45-51. | CrossRef | PubMed | Rosenberg ES, Dufort EM, Udo T, Wilberschied LA, Kumar J, Tesoriero J, et al. Association of Treatment With Hydroxychloroquine or Azithromycin With In-Hospital Mortality in Patients With COVID-19 in New York State. JAMA. 2020 May 11;323(24):2493–502. | CrossRef | PubMed |
Rosenberg ES, Dufort EM, Udo T, Wilberschied LA, Kumar J, Tesoriero J, et al. Association of Treatment With Hydroxychloroquine or Azithromycin With In-Hospital Mortality in Patients With COVID-19 in New York State. JAMA. 2020 May 11;323(24):2493–502. | CrossRef | PubMed | Geleris J, Sun Y, Platt J, Zucker J, Baldwin M, Hripcsak G, et al. Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med. 2020 Jun 18;382(25):2411-2418. | CrossRef | PubMed |
Geleris J, Sun Y, Platt J, Zucker J, Baldwin M, Hripcsak G, et al. Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med. 2020 Jun 18;382(25):2411-2418. | CrossRef | PubMed | Homolak J, Kodvanj I. Widely available lysosome targeting agents should be considered as potential therapy for COVID-19. Int J Antimicrob Agents. 2020 Aug;56(2):106044. | CrossRef | PubMed |
Homolak J, Kodvanj I. Widely available lysosome targeting agents should be considered as potential therapy for COVID-19. Int J Antimicrob Agents. 2020 Aug;56(2):106044. | CrossRef | PubMed | Sinha N, Balayla G. Hydroxychloroquine and covid-19. Postgrad Med J. 2020 Apr 15:postgradmedj-2020-137785. | CrossRef | PubMed |
Sinha N, Balayla G. Hydroxychloroquine and covid-19. Postgrad Med J. 2020 Apr 15:postgradmedj-2020-137785. | CrossRef | PubMed | Dixon DL, Van Tassell BW, Vecchié A, Bonaventura A, Talasaz AH, Kakavand H, et al. Cardiovascular Considerations in Treating Patients With Coronavirus Disease 2019 (COVID-19). J Cardiovasc Pharmacol. 2020 May;75(5):359-367. | CrossRef | PubMed |
Dixon DL, Van Tassell BW, Vecchié A, Bonaventura A, Talasaz AH, Kakavand H, et al. Cardiovascular Considerations in Treating Patients With Coronavirus Disease 2019 (COVID-19). J Cardiovasc Pharmacol. 2020 May;75(5):359-367. | CrossRef | PubMed | Cramer CL, Patterson A, Alchakaki A, Soubani AO. Immunomodulatory indications of azithromycin in respiratory disease: a concise review for the clinician. Postgrad Med. 2017 Jun;129(5):493-499. | CrossRef | PubMed |
Cramer CL, Patterson A, Alchakaki A, Soubani AO. Immunomodulatory indications of azithromycin in respiratory disease: a concise review for the clinician. Postgrad Med. 2017 Jun;129(5):493-499. | CrossRef | PubMed | Roden DM, Harrington RA, Poppas A, Russo AM. Considerations for Drug Interactions on QTc in Exploratory COVID-19 Treatment. Circulation. 2020 Jun 16;141(24):e906-e907. | CrossRef | PubMed |
Roden DM, Harrington RA, Poppas A, Russo AM. Considerations for Drug Interactions on QTc in Exploratory COVID-19 Treatment. Circulation. 2020 Jun 16;141(24):e906-e907. | CrossRef | PubMed | Simpson TF, Kovacs RJ, Stecker E. Ventricular Arrhythmia Risk Due to Hydroxychloroquine-Azithromycin Treatment For COVID 19. Cardiology Magazine. 2020. [On line]. | Link |
Simpson TF, Kovacs RJ, Stecker E. Ventricular Arrhythmia Risk Due to Hydroxychloroquine-Azithromycin Treatment For COVID 19. Cardiology Magazine. 2020. [On line]. | Link | Ky B, Mann DL. COVID-19 Clinical Trials: A Primer for the Cardiovascular and Cardio-Oncology Communities. JACC CardioOncol. 2020 Apr 17;2(2):254–69. | CrossRef | PubMed |
Ky B, Mann DL. COVID-19 Clinical Trials: A Primer for the Cardiovascular and Cardio-Oncology Communities. JACC CardioOncol. 2020 Apr 17;2(2):254–69. | CrossRef | PubMed | Giudicessi JR, Noseworthy PA, Friedman PA, Ackerman MJ. Urgent Guidance for Navigating and Circumventing the QTc-Prolonging and Torsadogenic Potential of Possible Pharmacotherapies for Coronavirus Disease 19 (COVID-19). Mayo Clin Proc. 2020 Jun;95(6):1213-1221. | CrossRef | PubMed |
Giudicessi JR, Noseworthy PA, Friedman PA, Ackerman MJ. Urgent Guidance for Navigating and Circumventing the QTc-Prolonging and Torsadogenic Potential of Possible Pharmacotherapies for Coronavirus Disease 19 (COVID-19). Mayo Clin Proc. 2020 Jun;95(6):1213-1221. | CrossRef | PubMed | Tisdale JE, Jaynes HA, Kingery JR, Mourad NA, Trujillo TN, Overholser BR, et al. Development and validation of a risk score to predict QT interval prolongation in hospitalized patients. Circ Cardiovasc Qual Outcomes. 2013 Jul;6(4):479-87. | CrossRef | PubMed |
Tisdale JE, Jaynes HA, Kingery JR, Mourad NA, Trujillo TN, Overholser BR, et al. Development and validation of a risk score to predict QT interval prolongation in hospitalized patients. Circ Cardiovasc Qual Outcomes. 2013 Jul;6(4):479-87. | CrossRef | PubMed | Tisdale JE. Drug-induced QT interval prolongation and torsades de pointes: Role of the pharmacist in risk assessment, prevention and management. Can Pharm J (Ott). 2016 May;149(3):139-52. | CrossRef | PubMed |
Tisdale JE. Drug-induced QT interval prolongation and torsades de pointes: Role of the pharmacist in risk assessment, prevention and management. Can Pharm J (Ott). 2016 May;149(3):139-52. | CrossRef | PubMed | The European Society of Cardiology. Guidance for the Diagnosis and Management of CV Disease during the COVID 19 Pandemic. ESC; 2020. [On line]. | Link |
The European Society of Cardiology. Guidance for the Diagnosis and Management of CV Disease during the COVID 19 Pandemic. ESC; 2020. [On line]. | Link | Kapoor A, Pandurangi U, Arora V, Gupta A, Jaswal A, Nabar A, et al. Cardiovascular risks of hydroxychloroquine in treatment and prophylaxis of COVID-19 patients: A scientific statement from the Indian Heart Rhythm Society. Indian Pacing Electrophysiol J. 2020 May-Jun;20(3):117-120. | CrossRef | PubMed |
Kapoor A, Pandurangi U, Arora V, Gupta A, Jaswal A, Nabar A, et al. Cardiovascular risks of hydroxychloroquine in treatment and prophylaxis of COVID-19 patients: A scientific statement from the Indian Heart Rhythm Society. Indian Pacing Electrophysiol J. 2020 May-Jun;20(3):117-120. | CrossRef | PubMed | Vandenberk B, Vandael E, Robyns T, Vandenberghe J, Garweg C, Foulon V, et al. Which QT Correction Formulae to Use for QT Monitoring? J Am Heart Assoc. 2016 Jun 17;5(6):e003264. | CrossRef | PubMed |
Vandenberk B, Vandael E, Robyns T, Vandenberghe J, Garweg C, Foulon V, et al. Which QT Correction Formulae to Use for QT Monitoring? J Am Heart Assoc. 2016 Jun 17;5(6):e003264. | CrossRef | PubMed | Tang W, Cao Z, Han M, Wang Z, Chen J, Sun W, et al. Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial. BMJ. 2020 May 14;369:m1849. | CrossRef | PubMed |
Tang W, Cao Z, Han M, Wang Z, Chen J, Sun W, et al. Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial. BMJ. 2020 May 14;369:m1849. | CrossRef | PubMed | Mahévas M, Tran VT, Roumier M, Chabrol A, Paule R, Guillaud C, et al. Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data. BMJ. 2020 May 14;369:m1844. | CrossRef | PubMed |
Mahévas M, Tran VT, Roumier M, Chabrol A, Paule R, Guillaud C, et al. Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data. BMJ. 2020 May 14;369:m1844. | CrossRef | PubMed | Randomised Evaluation of COVID-19 therapy. No clinical benefit from use of hydroxychloroquine in hospitalised patients with COVID-19.RECOVERY Trial; 2020. [On line]. | Link |
Randomised Evaluation of COVID-19 therapy. No clinical benefit from use of hydroxychloroquine in hospitalised patients with COVID-19.RECOVERY Trial; 2020. [On line]. | Link | Boulware DR, Pullen MF, Bangdiwala AS, Pastick KA, Lofgren SM, Okafor EC, et al. A Randomized Trial of Hydroxychloroquine as Postexposure Prophylaxis for Covid-19. N Engl J Med. 2020 Aug 6;383(6):517-525. | CrossRef | PubMed |
Boulware DR, Pullen MF, Bangdiwala AS, Pastick KA, Lofgren SM, Okafor EC, et al. A Randomized Trial of Hydroxychloroquine as Postexposure Prophylaxis for Covid-19. N Engl J Med. 2020 Aug 6;383(6):517-525. | CrossRef | PubMed | World Health Organization. Solidarity clinical trial for COVID-19 treatments. WHO; 2020. [On line]. | Link |
World Health Organization. Solidarity clinical trial for COVID-19 treatments. WHO; 2020. [On line]. | Link | Dong N, Cai J, Zhou Y, Liu J, Li F. End-Stage Heart Failure With COVID-19: Strong Evidence of Myocardial Injury by 2019-nCoV. JACC Heart Fail. 2020 Jun;8(6):515-517. | CrossRef | PubMed |
Dong N, Cai J, Zhou Y, Liu J, Li F. End-Stage Heart Failure With COVID-19: Strong Evidence of Myocardial Injury by 2019-nCoV. JACC Heart Fail. 2020 Jun;8(6):515-517. | CrossRef | PubMed | Fang L, Karakiulakis G, Roth M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Lancet Respir Med. 2020 Apr;8(4):e21. | CrossRef | PubMed |
Fang L, Karakiulakis G, Roth M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Lancet Respir Med. 2020 Apr;8(4):e21. | CrossRef | PubMed | Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 2020 Apr;46(4):586-590. | CrossRef | PubMed |
Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 2020 Apr;46(4):586-590. | CrossRef | PubMed | Torres A, Rivera A, García A, Arias CA, Saldarriaga CI, Gómez EA, et al. Evaluación y tratamiento de la insuficiencia cardíaca durante la pandemia de COVID 19: resumen ejecutivo. Rev Colomb Cardiol. 2020. [On line]. | Link |
Torres A, Rivera A, García A, Arias CA, Saldarriaga CI, Gómez EA, et al. Evaluación y tratamiento de la insuficiencia cardíaca durante la pandemia de COVID 19: resumen ejecutivo. Rev Colomb Cardiol. 2020. [On line]. | Link | Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020 Feb 15;395(10223):507-513. | CrossRef | PubMed |
Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020 Feb 15;395(10223):507-513. | CrossRef | PubMed | Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016 Jul 14;37(27):2129-2200. | CrossRef | PubMed |
Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016 Jul 14;37(27):2129-2200. | CrossRef | PubMed | Felker GM, Ellison DH, Mullens W, Cox ZL, Testani JM. Diuretic Therapy for Patients With Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020 Mar 17;75(10):1178-1195. | CrossRef | PubMed |
Felker GM, Ellison DH, Mullens W, Cox ZL, Testani JM. Diuretic Therapy for Patients With Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020 Mar 17;75(10):1178-1195. | CrossRef | PubMed | Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020 Apr 30;382(18):1708-1720. | CrossRef | PubMed |
Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020 Apr 30;382(18):1708-1720. | CrossRef | PubMed | Mahmud E, Dauerman HL, Welt FGP, Messenger JC, Rao SV, Grines C, et al. Management of acute myocardial infarction during the COVID-19 pandemic: A Consensus Statement from the Society for Cardiovascular Angiography and Interventions (SCAI), the American College of Cardiology (ACC), and the American College of Emergency Physicians (ACEP). Catheter Cardiovasc Interv. 2020 Aug;96(2):336-345. | CrossRef | PubMed |
Mahmud E, Dauerman HL, Welt FGP, Messenger JC, Rao SV, Grines C, et al. Management of acute myocardial infarction during the COVID-19 pandemic: A Consensus Statement from the Society for Cardiovascular Angiography and Interventions (SCAI), the American College of Cardiology (ACC), and the American College of Emergency Physicians (ACEP). Catheter Cardiovasc Interv. 2020 Aug;96(2):336-345. | CrossRef | PubMed | Madjid M, Safavi-Naeini P, Solomon SD, Vardeny O. Potential Effects of Coronaviruses on the Cardiovascular System: A Review. JAMA Cardiol. 2020 Mar 27. | CrossRef | PubMed |
Madjid M, Safavi-Naeini P, Solomon SD, Vardeny O. Potential Effects of Coronaviruses on the Cardiovascular System: A Review. JAMA Cardiol. 2020 Mar 27. | CrossRef | PubMed | Cosentino N, Assanelli E, Merlino L, Mazza M, Bartorelli AL, Marenzi G. An In-hospital Pathway for Acute Coronary Syndrome Patients During the COVID-19 Outbreak: Initial Experience Under Real-World Suboptimal Conditions. Can J Cardiol. 2020 Jun;36(6):961-964. | CrossRef | PubMed |
Cosentino N, Assanelli E, Merlino L, Mazza M, Bartorelli AL, Marenzi G. An In-hospital Pathway for Acute Coronary Syndrome Patients During the COVID-19 Outbreak: Initial Experience Under Real-World Suboptimal Conditions. Can J Cardiol. 2020 Jun;36(6):961-964. | CrossRef | PubMed | Tam CF, Cheung KS, Lam S, Wong A, Yung A, Sze M, et al. Impact of Coronavirus Disease 2019 (COVID-19) Outbreak on ST-Segment-Elevation Myocardial Infarction Care in Hong Kong, China. Circ Cardiovasc Qual Outcomes. 2020 Apr;13(4):e006631. | CrossRef | PubMed |
Tam CF, Cheung KS, Lam S, Wong A, Yung A, Sze M, et al. Impact of Coronavirus Disease 2019 (COVID-19) Outbreak on ST-Segment-Elevation Myocardial Infarction Care in Hong Kong, China. Circ Cardiovasc Qual Outcomes. 2020 Apr;13(4):e006631. | CrossRef | PubMed |