 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: antimalarials, retina, toxicity, retinopathy, chloroquine, hydroxychloroquine
Los antipalúdicos son fármacos ampliamente utilizados en varios países para el control de enfermedades reumatológicas como el lupus eritematoso sistémico y la artritis reumatoide. En México continúan siendo muy aceptados por su bajo costo y pocos efectos adversos, la mayoría de ellos no graves y reversibles. Sin embargo, a nivel oftalmológico se produce acúmulo de los metabolitos de estos medicamentos que provoca un daño visual que puede llegar a ser irreversible. Por esta razón es importante una evaluación oftalmológica y un seguimiento adecuado de estos pacientes. A través de un caso clínico ejemplificamos los hallazgos oftalmológicos característicos así como los factores de riesgo de la toxicidad retiniana y finalmente se discuten los lineamientos actuales para el diagnóstico y seguimiento en pacientes que utilizan estos medicamentos.
Los medicamentos antipalúdicos, cloroquina e hidroxicloroquina, son medicamentos ampliamente conocidos y utilizados desde su introducción en 1943 y 1955 respectivamente [1]. Se utilizan con frecuencia como fármacos modificadores de las enfermedades autoinmunes reumáticas, tales como la artritis reumatoide [2] y el lupus eritematoso sistémico [3], entre otras.
Los medicamentos antipalúdicos son ampliamente utilizados en México y otros países en vías de desarrollo debido a su bajo costo y su buen perfil de seguridad, al compararlos con otros medicamentos de segunda línea [4], o cuando se combinan con otros medicamentos [5]. Aunque la hidroxicloroquina es menos tóxica que la cloroquina [6], el uso de esta última es más común en México debido a su menor costo.
La razón más importante para suspender el uso de los medicamentos antipalúdicos son los efectos adversos asociados a su uso. Se han descrito múltiples efectos adversos, los más frecuentes son los gastrointestinales (anorexia, pérdida de peso, dolor abdominal, pirosis, náuseas y vómitos) (10-20%) y cutáneos (alopecia, cambios en la pigmentación, sequedad, prurito, exantema: exfoliativo, maculopapular, urticarial, liquenoide) (10%) [1], la mayoría de ellos no graves y reversibles. El daño tóxico de la retina es el efecto adverso más grave de estos medicamentos por el riesgo de producir pérdida visual irreversible. Además de la toxicidad retiniana, los medicamentos antipalúdicos pueden presentar otras manifestaciones de toxicidad a nivel ocular, entre las que se incluyen la queratopatía epitelial con patrón espiral, las cataratas subcapsulares, la retinopatía, la atrofia óptica, la parálisis para la acomodación, y la parálisis de los músculos extraoculares [7],[8].
Aunque se han descrito efectos tóxicos retinianos a los pocos meses de iniciado el tratamiento [9],[10], en la inmensa mayoría de los casos el riesgo aumenta a través del tiempo de su uso, se calcula en alrededor de 1%, después de 5 a 7 años del uso de cloroquina [11]. El depósito de los medicamentos antipalúdicos a nivel retiniano es una enfermedad descrita desde hace muchos años; la descripción original de la toxicidad por cloroquina data de 1959 por Hobbs et al. [12], mientras que la toxicidad por hidroxicloroquina se describió inicialmente en 1967 por Schearer et al. [13]. Su incidencia varía de acuerdo al medicamento utilizado, los criterios diagnósticos y las estrategias de cribaje. Beinsten reportó una incidencia de toxicidad inicial por cloroquina del 10% y solo un 0,5% con retinopatía avanzada [8], mientras que la incidencia de toxicidad por hidroxicloroquina ha sido reportada desde 0,08% [14] hasta 3,4% [15].
El mecanismo exacto de la toxicidad retiniana por los antipalúdicos no está bien dilucidado, sin embargo, debido a que la cloroquina es un agente lisosomotrópico, (que se acumula en el interior de los lisosomas, incrementando el pH intralisosomal e induciendo un edema osmótico y la salida de hidrolasas lisosomales) [16], estudios en modelos animales sugieren que el daño en la función lisosomal produce una acumulación de lipofuscina [17],[18], la cual es tóxica para los fotorreceptores y las células del epitelio pigmentado de la retina (EPR). Esto produce una degeneración de la retina similar a la descrita en la degeneración macular relacionada a la edad [19] o algunas distrofias retinianas asociadas a mutación del gen ABCA4 [20]. Otros cambios encontrados por microscopía electrónica son: la presencia de cuerpos citoplasmáticos membranosos en las células ganglionares, amácrinas, horizontales y bipolares además de acumulación de gránulos autófagos en los fotorreceptores, sobre todo en los conos [17], con una afectación tardía de los fotorreceptores y el epitelio pigmentado de la retina [21]. Estudios in vivo con tomografía de coherencia óptica (Optical Coherence Tomography, OCT) en pacientes que utilizan hidroxicloroquina sugieren que -a diferencia de aquellos que utilizan la cloroquina- en estos pacientes existe una afectación primaria de los fotorreceptores además de su unión a la melanina del epitelio pigmentario retinal lo que prolongaría los efectos tóxicos del medicamento [11]. Sugieren además que el grosor de la capa de células ganglionares se preserva sin cambios durante todo el tiempo de uso, aún en los casos que desarrollan toxicidad retiniana [22].
Las manifestaciones clínicas de la toxicidad retiniana por antipalúdicos han sido ampliamente descritas; en etapas iniciales los cambios son poco evidentes pero es posible observar una reducción del brillo foveolar o cambios pigmentarios sutiles en ambos ojos. Generalmente durante esta etapa el paciente se mantiene asintomático o únicamente presenta dificultades leves para la lectura; a medida que la enfermedad progresa, los síntomas pueden aparecer como la visualización de escotomas o una mayor dificultad para leer debido a que ésta es una función que se realiza únicamente con las células maculares. En la exploración oftalmológica se puede presentar la imagen característica en “ojo de buey” que se presenta por una despigmentación del epitelio pigmentario retinal a nivel macular que respeta una pequeña isla central. Si la exposición a los medicamentos continúa, se presenta una atrofia del epitelio pigmentario retinal inicialmente en la región macular pero que puede progresar por fuera de ella y se acompaña de atrofia de la retina. Esto producirá en el paciente una disminución de la agudeza visual, la visión a los colores y la visión en la oscuridad. En la etapa final, los cambios fundoscópicos pueden semejar a una retinitis pigmentaria con cambios difusos en la retina y adelgazamiento vascular [23]. Recientemente se ha descrito una presentación diferente en pacientes asiáticos en quienes el daño inicial se presenta en la región extramacular muy cercana a las arcadas vasculares [24],[25].
Por la gravedad del daño ocular asociado al uso de medicamentos antipalúdicos, diversas asociaciones han desarrollado guías para el seguimiento de estos pacientes. Una de las primeras y más utilizadas fueron las propuestas por la Academia Americana de Oftalmología (AAO) en el 2002 [23] las cuales mencionan que existen varios factores a considerar, el más importante es la dosis utilizada; se considera riesgosa una dosis mayor de 400 mg/día de hidroxicloroquina o mayor de 6,5 mg/kg de peso ideal para personas pequeñas, y 250 mg/día o más de 3 mg/kg de peso ideal para la cloroquina.
A la luz de nuevos estudios, en el 2011 la Academia Americana de Oftalmología realizó una revisión de estos lineamientos [26] en la que se consideró que la dosis acumulada (mayor de 1000 g para hidroxicloroquina y mayor de 460 g para cloroquina) es un parámetro más adecuado para monitorizar. Además de la dosis, el tiempo de tratamiento también es un factor importante; aunque la literatura describe que el riesgo de padecer toxicidad retiniana se incrementa a partir de los cinco años de uso, existen algunos factores de riesgo para su presentación más temprana: edad mayor de 60 años, aumento de la grasa corporal, enfermedad renal o hepática o una enfermedad macular previa [26]. Los lineamientos más recientes publicados en mayo de 2016 [27] vuelven a considerar la dosis diaria como el factor de riesgo más importante pero ahora se basan en el peso real del paciente; sugieren que dosis mayores de 5,0 mg/kg de hidroxicloroquina y mayores de 2,3 mg/kg de cloroquina incrementan de forma dramática el riesgo, además del tiempo de uso previamente descrito y el uso de Tamoxifeno que aumenta en cinco veces el riesgo de toxicidad.
Otros factores de riesgo no incluidos en los reportados por las recomendaciones de la Academia Americana de Oftalmología, se han descrito solo en algunos estudios pequeños. Palma Sanchez et al. mencionan la hipertensión arterial sistémica [6]. Un estudio en pacientes mexicanos (Araiza-Casillas et al.) encontró que el hallazgo de cloroquina a nivel corneal incrementa el riesgo de desarrollar toxicidad retiniana en cinco veces, contrario al consenso general que sugiere que la presencia de córnea verticilata por depósitos de antipalúdicos no se correlaciona con toxicidad retiniana, además de ser un proceso reversible al suspender el medicamento [28],[29].
Abordaje diagnóstico de la toxicidad retiniana asociada a antipalúdicos
Las recomendaciones actuales aconsejan las pruebas de referencia dentro de los primeros seis meses de inicio con el medicamento y de forma anual si hay hallazgos clínicos sugerentes de toxicidad inminente o a más tardar a partir del quinto año de terapia continua [26].
Nuevas herramientas de la oftalmología permiten detectar de forma temprana los primeros cambios de retinopatía a través del electroretinograma multifocal, la tomografía de coherencia óptica de dominio espectral o la autofluorescencia del fondo de ojo [26]. El objetivo de realizar estudios paraclínicos aún en pacientes asintomáticos obedece a que las alteraciones estructurales preceden a los síntomas y a que la pérdida visual en estadios avanzados es irreversible. Hasta la actualidad el único tratamiento que existe es la interrupción del medicamento. Si bien las alteraciones retinianas pueden progresar aún después de suspender el medicamento, la progresión después de la interrupción es mucho menor si se diagnostica en etapas iniciales cuando todavía no hay daño del epitelio pigmentado de la retina versus etapas tardías [22].
Estudios auxiliares
Además de la historia clínica y la exploración oftalmológica, diversos estudios auxiliares han sido evaluados para la monitorización y diagnóstico oportuno de la enfermedad. De acuerdo a los estudios previos al 2002, la Academia Americana de Oftalmología sugería el uso de fotografías de fondo, la cartilla de Amsler, la campimetría automatizada (CA) Humphrey 10-2 y las pruebas de visión al color. Muchos de estos estudios han sido sustituidos por nuevos equipos capaces de evaluar cambios más sutiles que los estudios previamente utilizados.
Estudios subjetivos
La campimetría Humphrey continúa siendo una estrategia adecuada de cribaje; es importante utilizar una estrategia de evaluación de los 10 grados centrales (10-2) ya que si se utilizan las estrategias usuales para el estudio de pacientes glaucomatosos (24-2 o 30-2), la cantidad de puntos evaluados a nivel foveal es muy pequeña lo que disminuye de forma importante su sensibilidad. Estudios iniciales sugerían el uso de estímulo rojo por tener una mayor sensibilidad [30], con la desventaja de ser menos específico y que requiere una curva de aprendizaje para su evaluación, mientras que el uso de estímulo blanco es ampliamente conocido por su uso en pacientes con glaucoma y es el actualmente sugerido por la Academia Americana de Oftalmología [26],[27]. La presencia de escotomas en los dos a ocho grados centrales puede preceder a los hallazgos clínicos o la sintomatología del paciente. Sin embargo, Browing y Lee [31], que comparan los hallazgos campimétricos en 10 pacientes con retinopatía por hidroxicloroquina con los de 21 pacientes usuarios del medicamento pero sin datos clínicos o paraclínicos de retinopatía (campimetría, tomografía de coherencia óptica de dominio espectral (OCT/DE) y electroretinograma multifocal (ERGm)), encontraron que todos los pacientes sin retinopatía presentaban escotomas aislados y evanescentes durante su evaluación, por lo que su presencia debe corroborarse con estudios posteriores.
En etapas iniciales, el único hallazgo puede ser una disminución de la sensibilidad foveal de más de 5 dB, que, si la exposición a los antipalúdicos continúa, evolucionará a un escotoma paracentral entre los dos y ocho grados del punto de fijación [31] que puede evolucionar a escotomas más avanzados.
Debido a la variabilidad de los resultados y la fuerte dependencia de la correcta realización, la cartilla de Amsler se ha eliminado de las recomendaciones hechas por la Academia Americana de Oftalmología desde el 2011 [26].
Estudios objetivos
La introducción de este tipo de estudios es el mayor avance en la evaluación de la toxicidad retiniana. Desde las recomendaciones de 2002, se mencionaba la preferencia por realizar estudios que no dependan de la respuesta del paciente. Sin embargo, el uso del electro-retinograma o el electro-oculograma no producía buenos resultados por la focalización del daño inicial en la mácula, lo que impedía detectarlo al promediar la respuesta eléctrica de toda la retina, por lo que sus resultados solo se alteraban en etapas muy tardías [23],[32]. Este problema fue resuelto con el desarrollo del electroretinograma multifocal que, aunque fue descrito inicialmente en 1992 por Sutter et al. [33], comenzó a utilizarse para el seguimiento de pacientes con tratamiento antipalúdico en el año 2000 [34] y se utilizó de forma más frecuente a partir del 2003 [35],[36]. Esto se produjo debido a que el electroretinograma multifocal puede detectar toxicidad retiniana aún antes de presentar signos clínicos [37] y daño en la campimetría automatizada 10-2. Los datos iniciales que podemos encontrar son la depresión de la respuesta eléctrica paracentral que puede progresar a una depresión total macular en casos más avanzados. Una revisión sistemática realizada por Tsang et al. [38] publicada a mediados de 2015 demostró que al tomar como estándar de oro la campimetría automatizada (CA), el electroretinograma multifocal tiene una sensibilidad de 0,90 (IC del 95% 0,62 a 0,98) y una especificidad de 0,52 (IC del 95% 0,29 a 0,74).
La tomografía de coherencia de dominio espectral (OCT/SD) también ha sido recientemente utilizada como parte de los métodos de seguimiento. En etapas iniciales, es posible encontrar un adelgazamiento perifoveal de las capas internas (capa plexiforme interna y de células ganglionares) [39],[40], que puede progresar hasta presentar un adelgazamiento generalizado [41]. Además, es posible evaluar daño a nivel de los fotorreceptores con la pérdida de la línea de unión de los segmentos internos y externos [26] o la pérdida de la línea elipsoide en la región parafoveal, alteración descrita como el signo del platillo volante [42],[43],[44]. Al igual que el electroretinograma multifocal, es posible detectar cambios iniciales en la tomografía de coherencia de dominio espectral antes de que se demuestren alteraciones en la campimetría automatizada, aunque en hasta en 10% de los casos con tomografía de coherencia de dominio espectral normal podemos encontrar escotomas en anillo [45], por lo que siempre se deben complementar ambos estudios. La sensibilidad de este estudio ha sido reportada en 78,6% y la especificidad en 98 % [46]. Además de su uso en el diagnóstico temprano, la tomografía de coherencia de dominio espectral puede ser de ayuda para el seguimiento de pacientes a los que se les detecta toxicidad retiniana, ya que en algunos casos, esta se puede complicar con el desarrollo de edema macular quístico o membranas epirretinianas [47].
La inclusión más reciente en el arsenal diagnóstico es el estudio de autofluorescencia de la retina (AF), esto debido a que se trata de un procedimiento diagnóstico no invasivo que permite evaluar la distribución de la lipofuscina y de otros fluoróforos en el epitelio pigmentado de la retina . En etapas iniciales cuando el daño al epitelio pigmentado de la retina es muy sutil, la autofluorescencia puede evidenciarlo mediante una reducción en su autofluorescencia, mientras que si el daño es a nivel de los fotorreceptores, este se manifestaría con un aumento de la autofluorescencia debido a la acumulación de detritus de los segmentos externos [48],[49]. Al igual que la tomografía de coherencia de dominio espectral y el electroretinograma multifocal, las alteraciones en la autofluorescencia pueden en algunos casos preceder a los daños en la campimetría automatizada.
Recomendaciones de cribado
Aunque la Academia Americana de Oftalmología ha publicado lineamientos para el cribado de pacientes que utilizan antipalúdicos, estos siempre deben individualizarse y tomar en cuenta cuántos factores de riesgo presenta nuestro paciente (Tabla 1). Idealmente, se debe realizar una evaluación oftalmológica completa antes de iniciar el uso de los antipalúdicos ya que la presencia de enfermedades retinianas o maculares es una contraindicación relativa para el uso de estos medicamentos. Además, debido a que el primer signo puede ser un adelgazamiento macular, es recomendable que se realicen estudios auxiliares basales en los que se debe incluir a la campimetría automatizada y uno o más de los estudios objetivos (tomografía de coherencia de dominio espectral, electroretinograma multifocal o autofluorescencia). Finalmente, se podrá ofrecer un asesoramiento personalizado sobre la necesidad de evaluaciones oftalmológicas periódicas y de los síntomas iniciales de toxicidad retiniana como disminución en la sensibilidad de la agudeza visual, dificultades para leer o visión de un escotoma en el campo visual.

Tabla 1. Factores de riesgo para toxicidad retiniana por Cloroquina/Hidroxicoroquina.
Para los pacientes que no presentan ningún factor de riesgo y debido a que el factor de riesgo de desarrollar toxicidad más importante es la dosis acumulada, se ha estimado que antes de los cinco años de uso el riesgo de padecerla es bajo, por lo tanto en los lineamientos de la Academia Americana de Oftalmología se sugiere que se debe empezar un cribado anual a los cinco años de uso. Sin embargo, un estudio en México por Araiza-Casillas et al. [50] encontró que el tiempo de uso de cloroquina en 16 pacientes que presentaron toxicidad detectada por campimetría automatizada o angiografía fue en promedio 54,1±27,8 meses (rango 30 a 197 meses), la dosis promedio fue de 212,3 mg (rango 122 a 272 mg) y la dosis media acumulada fue menor de 288 g (rango de 178 a 909 g). Todos estos valores son menores a los reportados como factores de riesgo además de que el 50% de ellos estaba asintomático. Una situación similar reportan Palma-Sánchez et al. [6] en España quienes estudiaron 40 pacientes que utilizaban antipalúdicos y encontraron una toxicidad retiniana en el 13,1 % (IC del 95%, 5 a 21%) con una dosis media diaria de 254 mg y dosis media acumulada de 251,3 ± 182,2 g para la hidroxicloroquina y una dosis media diaria de cloroquina de 250 mg y la dosis media acumulada fue de 371,5 ± 377,2 g. Consideramos entonces que no es posible extrapolar al pie de la letra las sugerencias descritas en otras poblaciones, por lo que debe de discutirse con el paciente sobre los pros y contras de esperar cinco años para la siguiente revisión.
En la actualidad, no existe ningún tratamiento para revertir el daño retiniano por los antipalúdicos, por lo que el diagnóstico oportuno es vital para disminuir el riesgo de daño visual grave. La conducta a seguir una vez realizado el diagnóstico es la suspensión inmediata del medicamento. No obstante, aún después de suspendido el medicamento, la toxicidad retiniana puede continuar por varios meses y en algunos casos años; esto es debido a que los antipalúdicos se encuentran unidos a la melanina de los tejidos pigmentados de todo el cuerpo [51] entre ellos el globo ocular y se mantienen ahí durante un tiempo prolongado aún después de suspendido su uso [52]. Debido a esto, se debe continuar el seguimiento del paciente hasta tener una estabilización de la toxicidad.
En casos en los que uno de los estudios sugiere daños iniciales de toxicidad, es recomendable repetir los estudios para asegurarse del resultado además de realizar una exploración minuciosa para descartar otras causas de alteración de los mismos. Si vuelven a reportarse datos anormales, se debe comentar con el paciente sobre los riesgos y beneficios de continuar con el medicamento; en caso de que se decida continuar con el medicamento, se debe tener un seguimiento clínico y de estudios auxiliares más estrecho cada tres meses para confirmar la presencia de toxicidad. Una vez confirmada la toxicidad retiniana se debe discutir con el médico tratante sobre el cambio del medicamento.
Acude a consulta oftalmológica una paciente femenina de 56 años de edad que refiere presentar disminución de la agudeza visual de tres años de evolución, la cual ha sido lentamente progresiva y empeora en ambientes con poca luz, acompañada de visión con halos de colores. La paciente niega dolor ocular, presencia de escotomas o miodesopsias.
Entre sus antecedentes sistémicos importantes, la paciente tiene un diagnóstico de lupus eritematoso generalizado de nueve años de evolución tratado inicialmente con prednisona, metotrexato (7,5mg/semana), ácido fólico (5mg/día) y cloroquina (Aralen®, Sanofi-Aventis: México; a dosis variable, ver Tabla 2) por seis años. Previo al inicio del tratamiento, la paciente fue evaluada por un oftalmólogo quien no encontró contraindicación para el uso de la cloroquina. A los seis años de uso, la paciente acude a un oftalmólogo por disminución de visión quien indica la suspensión del medicamento, indicación comentada y apoyada por el reumatólogo. A pesar de esto, la paciente menciona que en los últimos tres años ha continuado con disminución de la agudeza visual.
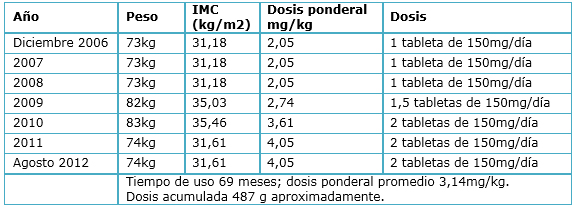
Tabla 2. Variación de peso y dosis en la paciente.
En la exploración oftalmológica se observa agudeza visual de 20/200 en ambos ojos sin mejoría con estenopeico y una capacidad visual de 20/30 con lentes en ambos ojos. Movimientos oculares y reflejos pupilares conservados. Presión intraocular de 12 mmHg en ojo derecho y 11mmHg en ojo izquierdo.
En la biomicroscopía, en ambos ojos se observa: conjuntiva con lesión pigmentada en limbo, córnea transparente con depósitos retroqueráticos de pigmento sin datos de acumulación de medicamento, cámara anterior amplia sin células y cristalino transparente. En la fundoscopía se observan las siguientes características en ambos ojos: vítreo transparente, retina aplicada sin lesiones, papila de bordes bien definidos con emergencia central de los vasos y excavación de 0,6, mácula con alteración pigmentaria (Figura 1a y 1b). Se realizó estudio de autofluorescencia (Topcon TRCNW8S Plus, Tokio, Japón) que demuestra una lesión hipoautofluorescente en forma de anillo que rodea a la fóvea rodeada de un área hiperautofluorescente por acumulación de detritus de los segmentos externos, “imagen en ojo de buey” (Figura 1c y 1d). Con estos hallazgos se realiza el diagnóstico de toxicidad macular por cloroquina.
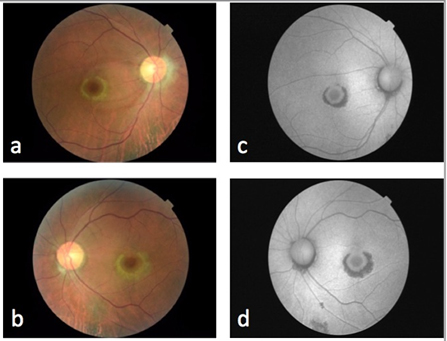
Figura 1. Fotografía de fondo de ojo mostrando cambios maculares en ojo derecho (a) y ojo izquierdo (b). Autofluorescencia de ojo derecho (c) y ojo izquierdo (d).
Se realizaron estudios auxiliares para determinar el grado de daño retiniano: estudio de campimetría automatizada Humphrey 10-2 con estimulo blanco y estrategia SITA-Standard, el cual fue confiable y demuestra un escotoma absoluto de localización paracentral con predominio en cuadrantes superiores en el ojo derecho y escotoma absoluto de localización central en forma anular en el ojo izquierdo (Figura 2a y 2b).
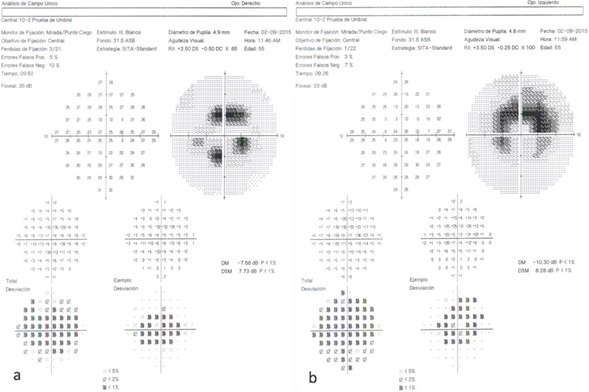
Figura 2. Campos visuales Humphrey 10-2 ojo derecho (a) y ojo izquierdo (b).
La Tabla 2 muestra la fluctuación de la dosis y el peso de la paciente a lo largo de la duración del tratamiento. La estatura de la paciente es de 1,53 m. La dosis acumulada fue de 487g aproximadamente y la dosis ponderal promedio fue de 3,14 mg/kg. En el interrogatorio dirigido y de acuerdo a los estudios de laboratorio la paciente no presentaba daño renal o hepático secundario a la enfermedad de base.
La tomografía de coherencia óptica de dominio espectral (CIRRUS Versión 7; Zeiss Jena, Alemania) de cubo macular de 512x128 (intensidad 9/10) demuestra zonas de adelgazamiento retiniano y pérdida de la capa de unión del segmento interior/exterior de los fotorreceptores (imágenes de alta definición, Figura 3a y 3b).
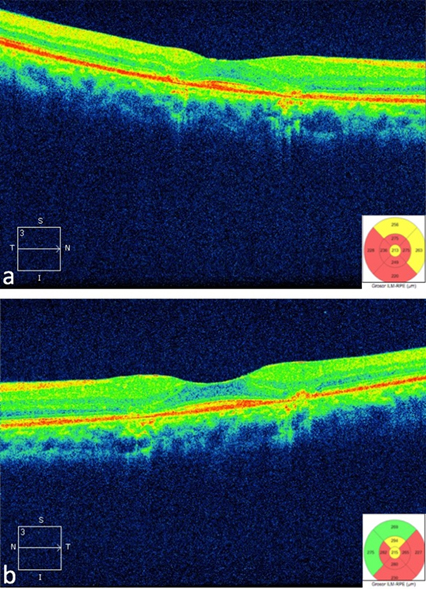
Figura 3. Tomografía de coherencia óptica que demuestra borramiento de la capa de unión interna/externa en ojo derecho (a) y ojo izquierdo (b).
La paciente presenta datos clásicos de toxicidad por cloroquina como es la maculopatía en ojo de buey; esto a pesar de que presenta factores de riesgo limítrofes de acuerdo a lo descrito por la Academia Americana de Oftalmología [26],[27], ya que la dosis utilizada durante los primeros 25 meses fue menor a la descrita para toxicidad, el tiempo de uso de una dosis mayor fue de 54 meses y la dosis acumulada de cloroquina fue de 487 g cifra muy cercana a los 460 gramos sugeridos por la Academia Americana de Oftalmología. Finalmente, el tiempo de uso del medicamento (69 meses) también es muy cercano a los 60 meses (5 años) descritos como seguros en los lineamientos. La edad de la paciente (56 años) es menor a los 60 años descritos, y finalmente la paciente no presentaba daño renal o uso concomitante de Tamoxifeno y de acuerdo a la revisión inicial descrita por la paciente, no había una enfermedad macular o retiniana previa al inicio del medicamento. Todo esto coincide con lo descrito por Araiza-Casillas et al. [50] en pacientes mexicanos que encontraron toxicidad retiniana aún en pacientes sin factores de riesgo o en valores limítrofes, lo que sugiere una predisposición racial u otro factor no bien estudiado que nos obliga a tener un seguimiento más cercano en nuestra población.
Además de los factores de riesgo, la paciente refleja los hallazgos previamente descritos en los estudios auxiliares que permiten un diagnóstico definitivo, como es la pérdida de las uniones de los segmentos internos y externos de los fotorreceptores encontrado en la tomografía de coherencia óptica [26], además de un adelgazamiento macular generalizado [41]. En la autofluorescencia alternan áreas de hiperautofluorescencia por daño a nivel de los fotorreceptores con áreas de hipoautofluorescencia por daño al epitelio pigmentado de la retina [48],[49]. Finalmente, la campimetría automatizada demostró un escotoma absoluto paracentral de predominio superior en el ojo derecho y anular en el ojo izquierdo en los dos a ocho grados centrales.
La toxicidad retiniana por el uso de cloroquina/hidroxicloroquina es un padecimiento que puede producir pérdida visual grave e irreversible, hasta la actualidad, el mejor tratamiento es el diagnóstico oportuno por lo que se deben de realizar estudios de cribaje a todos los pacientes que los utilizan, ya que como se ejemplifica en este caso, las alteraciones visuales pueden continuar una vez suspendido el tratamiento.
De los autores
El interés por publicar este caso es el de mencionar los cambios en los lineamientos de la Academia Americana de Oftalmología para el cribaje de este grupo de pacientes, además de evidenciar que aunque los lineamientos de la Academia Americana de Oftalmología son una buena orientación, es importante personalizar el cribaje y discutirlo con el paciente.
Conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Antimalarial drugs are widely used in several countries for control of rheumatologic diseases such as systemic lupus erythematosus and rheumatoid arthritis. They are still used in Mexico because of their low cost and few secondary effects, most of which are mild and reversible. Even so, at an ophthalmological level, they could produce irreversible visual damage, which is why it is important to have ophthalmological evaluation and proper follow up. We present a clinical case as an example of characteristic ophthalmological findings as well as risk factors for retinal toxicity. We then discuss guidelines for diagnosis and follow up of patients who use antimalarial drugs for the treatment of rheumatologic illnesses.
 Autores:
Manuel Garza-Leon[1], Diana Elsa Flores-Alvarado[2], Juan Manuel Muñoz-Bravo[3]
Autores:
Manuel Garza-Leon[1], Diana Elsa Flores-Alvarado[2], Juan Manuel Muñoz-Bravo[3]

Citación: Garza-Leon M, Flores-Alvarado DE, Muñoz-Bravo JM. Retinal toxicity induced by antimalarial drugs: literature review and case report. Medwave 2016 Jun;16(5):e6471 doi: 10.5867/medwave.2016.05.6471
Fecha de envío: 6/4/2016
Fecha de aceptación: 3/6/2016
Fecha de publicación: 17/6/2016
Origen: no solicitado
Tipo de revisión: con revisión por cuatro pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Jiménez Palop M. [Antimalarials: an update in rheumatic diseases]. Reumatol Clin. 2006 Jul;2(4):190-201. | CrossRef | PubMed |
Jiménez Palop M. [Antimalarials: an update in rheumatic diseases]. Reumatol Clin. 2006 Jul;2(4):190-201. | CrossRef | PubMed | Jover JA, Leon L, Pato E, Loza E, Rosales Z, Matias MA, et al. Long-term use of antimalarial drugs in rheumatic diseases. Clin Exp Rheumatol. 2012 May-Jun;30(3):380-7. | PubMed |
Jover JA, Leon L, Pato E, Loza E, Rosales Z, Matias MA, et al. Long-term use of antimalarial drugs in rheumatic diseases. Clin Exp Rheumatol. 2012 May-Jun;30(3):380-7. | PubMed | Albrecht K, Huscher D, Richter J, Backhaus M, Bischoff S, Kötter I, et al. Changes in referral, treatment and outcomes in patients with systemic lupus erythematosus in Germany in the 1990s and the 2000s. Lupus Sci Med. 2014 Dec 12;1(1):e000059. | CrossRef | PubMed |
Albrecht K, Huscher D, Richter J, Backhaus M, Bischoff S, Kötter I, et al. Changes in referral, treatment and outcomes in patients with systemic lupus erythematosus in Germany in the 1990s and the 2000s. Lupus Sci Med. 2014 Dec 12;1(1):e000059. | CrossRef | PubMed | Felson DT, Anderson JJ, Meenan RF. Use of short-term efficacy/toxicity tradeoffs to select second-line drugs in rheumatoid arthritis. A metaanalysis of published clinical trials. Arthritis Rheum. 1992 Oct;35(10):1117-25. | PubMed |
Felson DT, Anderson JJ, Meenan RF. Use of short-term efficacy/toxicity tradeoffs to select second-line drugs in rheumatoid arthritis. A metaanalysis of published clinical trials. Arthritis Rheum. 1992 Oct;35(10):1117-25. | PubMed | Choy EH, Smith C, Doré CJ, Scott DL. A meta-analysis of the efficacy and toxicity of combining disease-modifying anti-rheumatic drugs in rheumatoid arthritis based on patient withdrawal. Rheumatology (Oxford). 2005 Nov;44(11):1414-21. | PubMed |
Choy EH, Smith C, Doré CJ, Scott DL. A meta-analysis of the efficacy and toxicity of combining disease-modifying anti-rheumatic drugs in rheumatoid arthritis based on patient withdrawal. Rheumatology (Oxford). 2005 Nov;44(11):1414-21. | PubMed | Palma Sánchez D, Rubio Velazquez E, Soro Marín S, Reyes García R. Retinal toxicity due to antimalarials: frequency and risk factors. Reumatol Clin. 2013 Sep-Oct;9(5):259-62. doi: http://dx.doi.org/10.1016/j.reuma.2012.10.011 | PubMed |
Palma Sánchez D, Rubio Velazquez E, Soro Marín S, Reyes García R. Retinal toxicity due to antimalarials: frequency and risk factors. Reumatol Clin. 2013 Sep-Oct;9(5):259-62. doi: http://dx.doi.org/10.1016/j.reuma.2012.10.011 | PubMed | Bernstein HN. Chloroquine ocular toxicity. Surv Ophthalmol. 1967 Oct;12(5):415-47.
4980087
Bernstein HN. Chloroquine ocular toxicity. Surv Ophthalmol. 1967 Oct;12(5):415-47.
4980087
 Bernstein HN. Ophthalmologic considerations and testing in patients receiving long-term antimalarial therapy. Am J Med. 1983 Jul 18;75(1A):25-34. | PubMed |
Bernstein HN. Ophthalmologic considerations and testing in patients receiving long-term antimalarial therapy. Am J Med. 1983 Jul 18;75(1A):25-34. | PubMed | Navajas EV, Krema H, Hammoudi DS, Lipton JH, Simpson ER, Boyd S, et al. Retinal toxicity of high-dose hydroxychloroquine in patients with chronic graft-versus-host disease. Can J Ophthalmol. 2015 Dec;50(6):442-50. | CrossRef | PubMed |
Navajas EV, Krema H, Hammoudi DS, Lipton JH, Simpson ER, Boyd S, et al. Retinal toxicity of high-dose hydroxychloroquine in patients with chronic graft-versus-host disease. Can J Ophthalmol. 2015 Dec;50(6):442-50. | CrossRef | PubMed | Leung LS, Neal JW, Wakelee HA, Sequist LV, Marmor MF. Rapid Onset of Retinal Toxicity From High-Dose Hydroxychloroquine Given for Cancer Therapy. Am J Ophthalmol. 2015 Oct;160(4):799-805.e1. | CrossRef | PubMed |
Leung LS, Neal JW, Wakelee HA, Sequist LV, Marmor MF. Rapid Onset of Retinal Toxicity From High-Dose Hydroxychloroquine Given for Cancer Therapy. Am J Ophthalmol. 2015 Oct;160(4):799-805.e1. | CrossRef | PubMed | Wolfe F, Marmor MF. Rates and predictors of hydroxychloroquine retinal toxicity in patients with rheumatoid arthritis and systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2010 Jun;62(6):775-84. | CrossRef | PubMed |
Wolfe F, Marmor MF. Rates and predictors of hydroxychloroquine retinal toxicity in patients with rheumatoid arthritis and systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2010 Jun;62(6):775-84. | CrossRef | PubMed | Hobbs HE, Sorsby A, Freedman A. Retinopathy following chloroquine therapy. Lancet. 1959 Oct 3;2(7101):478-80. | PubMed |
Hobbs HE, Sorsby A, Freedman A. Retinopathy following chloroquine therapy. Lancet. 1959 Oct 3;2(7101):478-80. | PubMed | Shearer RV, Dubois EL. Ocular changes induced by long-term hydroxychloroquine (plaquenil) therapy. Am J Ophthalmol. 1967 Aug;64(2):245-52. | PubMed |
Shearer RV, Dubois EL. Ocular changes induced by long-term hydroxychloroquine (plaquenil) therapy. Am J Ophthalmol. 1967 Aug;64(2):245-52. | PubMed | Levy GD, Munz SJ, Paschal J, Cohen HB, Pince KJ, Peterson T. Incidence of hydroxychloroquine retinopathy in 1,207 patients in a large multicenter outpatient practice. Arthritis Rheum. 1997 Aug;40(8):1482-6. | PubMed |
Levy GD, Munz SJ, Paschal J, Cohen HB, Pince KJ, Peterson T. Incidence of hydroxychloroquine retinopathy in 1,207 patients in a large multicenter outpatient practice. Arthritis Rheum. 1997 Aug;40(8):1482-6. | PubMed | Mavrikakis I, Sfikakis PP, Mavrikakis E, Rougas K, Nikolaou A, Kostopoulos C, et al. The incidence of irreversible retinal toxicity in patients treated with hydroxychloroquine: a reappraisal. Ophthalmology. 2003 Jul;110(7):1321-6. | PubMed |
Mavrikakis I, Sfikakis PP, Mavrikakis E, Rougas K, Nikolaou A, Kostopoulos C, et al. The incidence of irreversible retinal toxicity in patients treated with hydroxychloroquine: a reappraisal. Ophthalmology. 2003 Jul;110(7):1321-6. | PubMed | Michihara A, Toda K, Kubo T, Fujiwara Y, Akasaki K, Tsuji H. Disruptive effect of chloroquine on lysosomes in cultured rat hepatocytes. Biol Pharm Bull. 2005 Jun;28(6):947-51. | PubMed |
Michihara A, Toda K, Kubo T, Fujiwara Y, Akasaki K, Tsuji H. Disruptive effect of chloroquine on lysosomes in cultured rat hepatocytes. Biol Pharm Bull. 2005 Jun;28(6):947-51. | PubMed | Mahon GJ, Anderson HR, Gardiner TA, McFarlane S, Archer DB, Stitt AW. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Curr Eye Res. 2004 Apr;28(4):277-84. | PubMed |
Mahon GJ, Anderson HR, Gardiner TA, McFarlane S, Archer DB, Stitt AW. Chloroquine causes lysosomal dysfunction in neural retina and RPE: implications for retinopathy. Curr Eye Res. 2004 Apr;28(4):277-84. | PubMed | Sundelin SP, Terman A. Different effects of chloroquine and hydroxychloroquine on lysosomal function in cultured retinal pigment epithelial cells. APMIS. 2002 Jun;110(6):481-9. | PubMed |
Sundelin SP, Terman A. Different effects of chloroquine and hydroxychloroquine on lysosomal function in cultured retinal pigment epithelial cells. APMIS. 2002 Jun;110(6):481-9. | PubMed | Suter M, Remé C, Grimm C, Wenzel A, Jäättela M, Esser P, et al. The lipofusion component N-retinyl-N-retinylidene ethanolamine detaches proapoptotic proteins from mitochondria and induces apoptosis in mammalian retinal pigment epithelial cells.J Biol Chem. 2000 Dec 15;275(50):39625-30. | PubMed |
Suter M, Remé C, Grimm C, Wenzel A, Jäättela M, Esser P, et al. The lipofusion component N-retinyl-N-retinylidene ethanolamine detaches proapoptotic proteins from mitochondria and induces apoptosis in mammalian retinal pigment epithelial cells.J Biol Chem. 2000 Dec 15;275(50):39625-30. | PubMed | Radu RA, Yuan Q, Hu J, Peng JH, Lloyd M, Nusinowitz S, et al. Accelerated accumulation of lipofuscin pigments in the RPE of a mouse model for ABCA4-mediated retinal dystrophies following Vitamin A supplementation. Invest Ophthalmol Vis Sci. 2008 Sep;49(9):3821-9. | CrossRef | PubMed |
Radu RA, Yuan Q, Hu J, Peng JH, Lloyd M, Nusinowitz S, et al. Accelerated accumulation of lipofuscin pigments in the RPE of a mouse model for ABCA4-mediated retinal dystrophies following Vitamin A supplementation. Invest Ophthalmol Vis Sci. 2008 Sep;49(9):3821-9. | CrossRef | PubMed | Gregory MH, Rutty DA, Wood RD. Differences in the retinotoxic action of chloroquine and phenothiazine derivatives. J Pathol. 1970 Nov;102(3):139-50. | PubMed |
Gregory MH, Rutty DA, Wood RD. Differences in the retinotoxic action of chloroquine and phenothiazine derivatives. J Pathol. 1970 Nov;102(3):139-50. | PubMed | de Sisternes L, Hu J, Rubin DL, Marmor MF. Localization of damage in progressive hydroxychloroquine retinopathy on and off the drug: inner versus outer retina, parafovea versus peripheral fovea. Invest Ophthalmol Vis Sci. 2015 May;56(5):3415-26. | CrossRef | PubMed |
de Sisternes L, Hu J, Rubin DL, Marmor MF. Localization of damage in progressive hydroxychloroquine retinopathy on and off the drug: inner versus outer retina, parafovea versus peripheral fovea. Invest Ophthalmol Vis Sci. 2015 May;56(5):3415-26. | CrossRef | PubMed | Marmor MF, Carr RE, Easterbrook M, Farjo AA, Mieler WF; American Academy of Ophthalmology. Recommendations on screening for chloroquine and hydroxychloroquine retinopathy: a report by the American Academy of Ophthalmology. Ophthalmology. 2002 Jul;109(7):1377-82. | PubMed |
Marmor MF, Carr RE, Easterbrook M, Farjo AA, Mieler WF; American Academy of Ophthalmology. Recommendations on screening for chloroquine and hydroxychloroquine retinopathy: a report by the American Academy of Ophthalmology. Ophthalmology. 2002 Jul;109(7):1377-82. | PubMed | Lee DH, Melles RB, Joe SG, Lee JY, Kim JG, Lee CK, et al. Pericentral hydroxychloroquine retinopathy in Korean patients. Ophthalmology. 2015 Jun;122(6):1252-6. doi: | CrossRef | PubMed |
Lee DH, Melles RB, Joe SG, Lee JY, Kim JG, Lee CK, et al. Pericentral hydroxychloroquine retinopathy in Korean patients. Ophthalmology. 2015 Jun;122(6):1252-6. doi: | CrossRef | PubMed | Melles RB, Marmor MF. Pericentral retinopathy and racial differences in hydroxychloroquine toxicity. Ophthalmology. 2015 Jan;122(1):110-6. | CrossRef | PubMed |
Melles RB, Marmor MF. Pericentral retinopathy and racial differences in hydroxychloroquine toxicity. Ophthalmology. 2015 Jan;122(1):110-6. | CrossRef | PubMed | Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF; American Academy of Ophthalmology. Revised recommendations on screening for chloroquine and hydroxychloroquine retinopathy. Ophthalmology. 2011 Feb;118(2):415-22. doi: | CrossRef | PubMed |
Marmor MF, Kellner U, Lai TY, Lyons JS, Mieler WF; American Academy of Ophthalmology. Revised recommendations on screening for chloroquine and hydroxychloroquine retinopathy. Ophthalmology. 2011 Feb;118(2):415-22. doi: | CrossRef | PubMed | Marmor MF, Kellner U, Lai TY, Melles RB, Mieler WF; American Academy of Ophthalmology. Recommendations on Screening for Chloroquine and Hydroxychloroquine Retinopathy (2016 Revision). Ophthalmology. 2016 Jun;123(6):1386-94. | CrossRef | PubMed |
Marmor MF, Kellner U, Lai TY, Melles RB, Mieler WF; American Academy of Ophthalmology. Recommendations on Screening for Chloroquine and Hydroxychloroquine Retinopathy (2016 Revision). Ophthalmology. 2016 Jun;123(6):1386-94. | CrossRef | PubMed | Tehrani R, Ostrowski RA, Hariman R, Jay WM. Ocular toxicity of hydroxychloroquine. Semin Ophthalmol. 2008 May-Jun;23(3):201-9. | CrossRef | PubMed |
Tehrani R, Ostrowski RA, Hariman R, Jay WM. Ocular toxicity of hydroxychloroquine. Semin Ophthalmol. 2008 May-Jun;23(3):201-9. | CrossRef | PubMed | Easterbrook M. Is corneal deposition of antimalarial any indication of retinal toxicity? Can J Ophthalmol. 1990 Aug;25(5):249-51. | PubMed |
Easterbrook M. Is corneal deposition of antimalarial any indication of retinal toxicity? Can J Ophthalmol. 1990 Aug;25(5):249-51. | PubMed | Easterbrook M, Trope G. Value of Humphrey perimetry in the detection of early chloroquine retinopathy. Lens Eye Toxic Res. 1989;6(1-2):255-68. | PubMed |
Easterbrook M, Trope G. Value of Humphrey perimetry in the detection of early chloroquine retinopathy. Lens Eye Toxic Res. 1989;6(1-2):255-68. | PubMed | Browning DJ, Lee C. Scotoma analysis of 10-2 visual field testing with a white target in screening for hydroxychloroquine retinopathy. Clin Ophthalmol. 2015 May 27;9:943-52. | CrossRef | PubMed |
Browning DJ, Lee C. Scotoma analysis of 10-2 visual field testing with a white target in screening for hydroxychloroquine retinopathy. Clin Ophthalmol. 2015 May 27;9:943-52. | CrossRef | PubMed | Reijmer CN, Tijssen JG, Kok GA, van Lith GH. Interpretation of the electro-oculogram of patients taking chloroquine. Doc Ophthalmol. 1980 Apr 15;48(2):273-6. | PubMed |
Reijmer CN, Tijssen JG, Kok GA, van Lith GH. Interpretation of the electro-oculogram of patients taking chloroquine. Doc Ophthalmol. 1980 Apr 15;48(2):273-6. | PubMed | Sutter EE, Tran D. The field topography of ERG components in man--I. The photopic luminance response. Vision Res. 1992 Mar;32(3):433-46. | PubMed |
Sutter EE, Tran D. The field topography of ERG components in man--I. The photopic luminance response. Vision Res. 1992 Mar;32(3):433-46. | PubMed | Kellner U, Kraus H, Foerster MH. Multifocal ERG in chloroquine retinopathy: regional variance of retinal dysfunction. Graefes Arch Clin Exp Ophthalmol. 2000 Jan;238(1):94-7. | PubMed |
Kellner U, Kraus H, Foerster MH. Multifocal ERG in chloroquine retinopathy: regional variance of retinal dysfunction. Graefes Arch Clin Exp Ophthalmol. 2000 Jan;238(1):94-7. | PubMed | Penrose PJ, Tzekov RT, Sutter EE, Fu AD, Allen AW Jr, Fung WE, et al. Multifocal electroretinography evaluation for early detection of retinal dysfunction in patients taking hydroxychloroquine. Retina. 2003 Aug;23(4):503-12. | PubMed |
Penrose PJ, Tzekov RT, Sutter EE, Fu AD, Allen AW Jr, Fung WE, et al. Multifocal electroretinography evaluation for early detection of retinal dysfunction in patients taking hydroxychloroquine. Retina. 2003 Aug;23(4):503-12. | PubMed | So SC, Hedges TR, Schuman JS, Quireza ML. Evaluation of hydroxychloroquine retinopathy with multifocal electroretinography. Ophthalmic Surg Lasers Imaging. 2003 May-Jun;34(3):251-8. | PubMed |
So SC, Hedges TR, Schuman JS, Quireza ML. Evaluation of hydroxychloroquine retinopathy with multifocal electroretinography. Ophthalmic Surg Lasers Imaging. 2003 May-Jun;34(3):251-8. | PubMed | Teoh SC, Lim J, Koh A, Lim T, Fu E. Abnormalities on the multifocal electroretinogram may precede clinical signs of hydroxychloroquine retino-toxicity. Eye (Lond). 2006 Jan;20(1):129-32. | PubMed |
Teoh SC, Lim J, Koh A, Lim T, Fu E. Abnormalities on the multifocal electroretinogram may precede clinical signs of hydroxychloroquine retino-toxicity. Eye (Lond). 2006 Jan;20(1):129-32. | PubMed | Tsang AC, Ahmadi Pirshahid S, Virgili G, Gottlieb CC, Hamilton J, Coupland SG. Hydroxychloroquine and chloroquine retinopathy: a systematic review evaluating the multifocal electroretinogram as a screening test. Ophthalmology.2015 Jun;122(6):1239-1251.e4. | CrossRef | PubMed |
Tsang AC, Ahmadi Pirshahid S, Virgili G, Gottlieb CC, Hamilton J, Coupland SG. Hydroxychloroquine and chloroquine retinopathy: a systematic review evaluating the multifocal electroretinogram as a screening test. Ophthalmology.2015 Jun;122(6):1239-1251.e4. | CrossRef | PubMed | Pasadhika S, Fishman GA, Choi D, Shahidi M. Selective thinning of the perifoveal inner retina as an early sign of hydroxychloroquine retinal toxicity. Eye (Lond). 2010 May;24(5):756-62; quiz 763. doi: | CrossRef | PubMed |
Pasadhika S, Fishman GA, Choi D, Shahidi M. Selective thinning of the perifoveal inner retina as an early sign of hydroxychloroquine retinal toxicity. Eye (Lond). 2010 May;24(5):756-62; quiz 763. doi: | CrossRef | PubMed | Ulviye Y, Betul T, Nur TH, Selda C. Spectral domain optical coherence tomography for early detection of retinal alterations in patients using hydroxychloroquine. Indian J Ophthalmol. 2013 Apr;61(4):168-71. doi: | CrossRef | PubMed |
Ulviye Y, Betul T, Nur TH, Selda C. Spectral domain optical coherence tomography for early detection of retinal alterations in patients using hydroxychloroquine. Indian J Ophthalmol. 2013 Apr;61(4):168-71. doi: | CrossRef | PubMed | Kahn JB, Haberman ID, Reddy S. Spectral-domain optical coherence tomography as a screening technique for chloroquine and hydroxychloroquine retinal toxicity. Ophthalmic Surg Lasers Imaging. 2011 Nov-Dec;42(6):493-7. | CrossRef | PubMed |
Kahn JB, Haberman ID, Reddy S. Spectral-domain optical coherence tomography as a screening technique for chloroquine and hydroxychloroquine retinal toxicity. Ophthalmic Surg Lasers Imaging. 2011 Nov-Dec;42(6):493-7. | CrossRef | PubMed | Ascaso FJ, Rodríguez NA, San Miguel R, Huerva V. The "flying saucer" sign on spectral domain optical coherence tomography in chloroquine retinopathy.Arthritis Rheum. 2013 Sep;65(9):2322. doi: | CrossRef | PubMed |
Ascaso FJ, Rodríguez NA, San Miguel R, Huerva V. The "flying saucer" sign on spectral domain optical coherence tomography in chloroquine retinopathy.Arthritis Rheum. 2013 Sep;65(9):2322. doi: | CrossRef | PubMed | Chen E, Brown DM, Benz MS, Fish RH, Wong TP, Kim RY, et al. Spectral domain optical coherence tomography as an effective screening test for hydroxychloroquine retinopathy (the "flying saucer" sign). Clin Ophthalmol. 2010 Oct 21;4:1151-8. | CrossRef | PubMed |
Chen E, Brown DM, Benz MS, Fish RH, Wong TP, Kim RY, et al. Spectral domain optical coherence tomography as an effective screening test for hydroxychloroquine retinopathy (the "flying saucer" sign). Clin Ophthalmol. 2010 Oct 21;4:1151-8. | CrossRef | PubMed | Asensio-Sánchez VM. [SD-OCT As screening test for hydroxychloroquine retinopathy: The «flying saucer» sign]. Arch Soc Esp Oftalmol. 2015 Jul;90(7):338-40. | CrossRef | PubMed |
Asensio-Sánchez VM. [SD-OCT As screening test for hydroxychloroquine retinopathy: The «flying saucer» sign]. Arch Soc Esp Oftalmol. 2015 Jul;90(7):338-40. | CrossRef | PubMed | Marmor MF, Melles RB. Disparity between visual fields and optical coherence tomography in hydroxychloroquine retinopathy. Ophthalmology. 2014 Jun;121(6):1257-62. | CrossRef | PubMed |
Marmor MF, Melles RB. Disparity between visual fields and optical coherence tomography in hydroxychloroquine retinopathy. Ophthalmology. 2014 Jun;121(6):1257-62. | CrossRef | PubMed | Allam RS, Abd-Elmohsen MN, Khafagy MM, Raafat KA, Sheta SM. Spectral-Domain Optical Coherence Tomography of Preclinical Chloroquine Maculopathy in Egyptian Rheumatoid Arthritis Patients. J Ophthalmol. 2015;2015:292357. | CrossRef | PubMed |
Allam RS, Abd-Elmohsen MN, Khafagy MM, Raafat KA, Sheta SM. Spectral-Domain Optical Coherence Tomography of Preclinical Chloroquine Maculopathy in Egyptian Rheumatoid Arthritis Patients. J Ophthalmol. 2015;2015:292357. | CrossRef | PubMed | Kellner S, Weinitz S, Farmand G, Kellner U. Cystoid macular oedema and epiretinal membrane formation during progression of chloroquine retinopathy after drug cessation. Br J Ophthalmol. 2014 Feb;98(2):200-6. | CrossRef | PubMed |
Kellner S, Weinitz S, Farmand G, Kellner U. Cystoid macular oedema and epiretinal membrane formation during progression of chloroquine retinopathy after drug cessation. Br J Ophthalmol. 2014 Feb;98(2):200-6. | CrossRef | PubMed | Kellner S, Weinitz S, Kellner U. Spectral domain optical coherence tomography detects early stages of chloroquine retinopathy similar to multifocal electroretinography, fundus autofluorescence and near-infrared autofluorescence. Br J Ophthalmol. 2009 Nov;93(11):1444-7. doi: | CrossRef | PubMed |
Kellner S, Weinitz S, Kellner U. Spectral domain optical coherence tomography detects early stages of chloroquine retinopathy similar to multifocal electroretinography, fundus autofluorescence and near-infrared autofluorescence. Br J Ophthalmol. 2009 Nov;93(11):1444-7. doi: | CrossRef | PubMed | Kellner U, Renner AB, Tillack H. Fundus autofluorescence and mfERG for early detection of retinal alterations in patients using chloroquine/hydroxychloroquine. Invest Ophthalmol Vis Sci. 2006 Aug;47(8):3531-8. | PubMed |
Kellner U, Renner AB, Tillack H. Fundus autofluorescence and mfERG for early detection of retinal alterations in patients using chloroquine/hydroxychloroquine. Invest Ophthalmol Vis Sci. 2006 Aug;47(8):3531-8. | PubMed | Araiza-Casillas R, Cárdenas F, Morales Y, Cardiel MH. Factors associated with chloroquine-induced retinopathy in rheumatic diseases. Lupus. 2004;13(2):119-24. | PubMed |
Araiza-Casillas R, Cárdenas F, Morales Y, Cardiel MH. Factors associated with chloroquine-induced retinopathy in rheumatic diseases. Lupus. 2004;13(2):119-24. | PubMed | Lindquist NG, Ullberg S. The melanin affinity of chloroquine and chlorpromazine studied by whole body autoradiography. Acta Pharmacol Toxicol (Copenh). 1972;2:Suppl 2:1-32. | PubMed |
Lindquist NG, Ullberg S. The melanin affinity of chloroquine and chlorpromazine studied by whole body autoradiography. Acta Pharmacol Toxicol (Copenh). 1972;2:Suppl 2:1-32. | PubMed | Bernstein H, Zvaifler N, Rubin M, Mansour AM. The ocular deposition of chloroquine. Invest Ophthalmol. 1963 Aug;2:384-92. | PubMed |
Bernstein H, Zvaifler N, Rubin M, Mansour AM. The ocular deposition of chloroquine. Invest Ophthalmol. 1963 Aug;2:384-92. | PubMed |