 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: respiratory tract infections, differential diagnosis, antibiotics
Las infecciones del tracto respiratorio suponen un motivo frecuente de consulta. Sin embargo, mientras que en algunas enfermedades (como el resfriado común, la laringitis y otras) el origen es generalmente viral y el uso de antibióticos debería ser excepcional, existen otros cuadros (como rinosinusitis, faringoamigdalitis, infecciones del tracto respiratorio inferior y reagudizaciones de la enfermedad pulmonar obstructiva crónica) en que la etiología bacteriana ocupa un porcentaje no desdeñable y con frecuencia se realizan tratamientos antibióticos de forma empírica. Este estudio tiene como objetivo conocer la validez de los datos obtenidos de la clínica, la exploración física y los métodos de diagnóstico rápido en las infecciones respiratorias, donde con frecuencia se plantea el uso de antibióticos con el objetivo de mejorar la capacidad diagnóstica y, por lo tanto, de influir en la decisión de prescribir o no dichos fármacos. La revisión concluye que la anamnesis, la exploración física y las pruebas de diagnóstico rápido son útiles para orientar la necesidad de tratamiento antibiótico en patologías como rinosinusitis aguda, faringoamigdalitis aguda, infección respiratoria de vías bajas y reagudización de la enfermedad pulmonar obstructiva crónica. No obstante, ningún dato de forma aislada es suficientemente preciso por sí mismo para confirmar o descartar la necesidad de dicho tratamiento y existen reglas de predicción clínica que, agrupando datos de anamnesis y exploración, consiguen mejorar la precisión para la decisión de pautar o no un antibiótico.
La aparición de los antibióticos y su utilización generalizada supuso, en el siglo pasado, uno de los mayores avances acontecidos en el campo de la medicina, contribuyendo de forma clara a la mejora de la salud de la población a través de una reducción significativa de la morbilidad y la mortalidad por patología infecciosa [1]. No obstante, en las últimas décadas asistimos a la aparición de niveles alarmantes de resistencia a los antibióticos, algo que constituye un problema de salud pública a nivel mundial [2]. Un reciente informe de la Organización Mundial de la Salud pone en evidencia las elevadas y crecientes tasas de resistencia existentes [3]. El origen de la aparición de resistencia a los antibióticos está estrechamente asociado al uso excesivo e inadecuado de estos medicamentos, lo que a su vez tiene un origen multifactorial [4],[5]. Por su relevancia en la práctica clínica diaria, entre los distintos factores implicados cabe mencionar la incertidumbre diagnóstica existente en un alto porcentaje de los casos. En ellos, los datos clínicos y de la exploración física no son suficientes para establecer la etiología y no es posible disponer o esperar al resultado de métodos diagnósticos de confirmación, lo que genera un alto porcentaje de tratamientos antibióticos pautados de forma empírica [2].
Las infecciones del tracto respiratorio suponen una parte importante de la patología infecciosa atendida, son motivo frecuente de consulta y una de las causas principales de prescripción de antibióticos [6]. Mientras que en algunos cuadros respiratorios (como el resfriado común o la laringitis) el uso de antibióticos debería ser excepcional [7], existen otros cuadros donde el empleo de dichos fármacos viene determinado por las características clínicas y circunstancias concretas de cada caso. Ejemplos de ellos son la faringoamigdalitis aguda y la infección respiratoria de vías bajas, entre otras [8]. Es en este marco que este articulo revisa la validez de los datos obtenidos a través de la clínica, la exploración física y los métodos de diagnóstico rápido, con el fin de mejorar la capacidad diagnóstica e influir en la decisión de prescribir o no un antibiótico en cuatro tipos de patologías respiratorias: rinosinusitis aguda, faringoamigdalitis aguda, infección respiratoria de vías bajas y reagudización de la enfermedad pulmonar obstructiva crónica.
Para ello, se realizó una búsqueda bibliográfica en MEDLINE/PubMed (desde enero de 1980 a mayo de 2014) sobre las cuatro patologías estudiadas utilizando un filtro (predict*[tiab] OR predictive value of tests[mh] OR scor*[tiab] OR observ*[tiab] OR observer variation[mh]) que permite buenos resultados de sensibilidad y especificidad [9]. La búsqueda se complementó con búsquedas en Google Académico y la Biblioteca Cochrane.
La sinusitis aguda consiste en la inflamación de las cavidades paranasales, de duración inferior a cuatro semanas y habitualmente ocasionada por un agente infeccioso, aunque también pueden desencadenarla procesos alérgicos o alteraciones ciliares como la fibrosis quística. Dada la afectación casi constante de la mucosa nasal, resulta más correcto el término de rinosinusitis. Esta revisión se refiere a la afectación de los senos maxilar y etmoidal que es la más frecuente. En ella, la obstrucción al drenaje de las secreciones de las cavidades paranasales es el factor desencadenante, habitualmente en el contexto de una infección de vías respiratorias altas de origen vírico, con etiología bacteriana en menos del 2% de los casos [10],[11]. La dificultad en establecer el diagnóstico diferencial entre la etiología viral y bacteriana por la sintomatología similar que presentan y la elevada prevalencia de la primera, hace que sea un motivo frecuente de uso inadecuado de antibióticos. Se estima que más del 80% de los casos de etiología viral son tratados con antibióticos [10].
La prueba considerada como gold standard para diferenciar el origen viral del bacteriano es el cultivo del contenido de las cavidades paranasales, obtenido mediante punción aspiración de aguja fina. Dada la poca aplicabilidad de este procedimiento en la práctica clínica diaria, se recurre a la información clínica. En caso necesario, también se utilizan otras pruebas complementarias, como la radiografía convencional, a pesar de que los resultados de validez de la misma son limitados para esta finalidad [12]. Se han publicado varios estudios que intentan analizar los factores clínicos predictores de sinusitis bacteriana y todos ellos coinciden en que ningún signo o síntoma por sí sólo puede determinar la etiología [13],[14],[15],[16],[17] (Tabla I). Además, la duración igual o superior a siete días de los síntomas es moderadamente sensible, pero poco específica para establecer la etiología bacteriana [17].
Tabla I. Validez diagnóstica de síntomas y signos para el diagnóstico de rinosinusitis bacteriana.
Usando como método de referencia la radiografía convencional, Williams et al. propusieron cinco predictores clínicos y evaluaron su validez para el diagnóstico de rinosinusitis aguda bacteriana [13] (Tabla II). Pese a que estos resultados pueden ser de utilidad, deben tomarse con cautela por el riesgo de sobrediagnóstico, ya que los hallazgos radiográficos pueden encontrarse también en rinosinusitis de etiología vírica.
Tabla II. Regla predicción clínica de rinosinusitis bacteriana.
Una guía de práctica clínica aprobada por el Centers for Disease Control and Prevention estadounidense indica, basándose en los datos ya comentados, que la etiología bacteriana debe sospecharse cuando el paciente presenta síntomas durante al menos siete días, secreción nasal purulenta y al menos uno de los siguientes síntomas: dolor maxilar, sensibilidad en la cara (preferentemente unilateral) o sensibilidad en los dientes (preferentemente unilateral) [10]. Una guía canadiense indica que debe existir dicha sospecha cuando los síntomas duran siete o más días y presenta al menos dos de los que define como criterios mayores: dolor facial, obstrucción nasal, secreción nasal purulenta e hiposmia/anosmia [18].
Por otro lado, el aumento de la velocidad de sedimentación globular y de la proteína C reactiva se asocian al diagnóstico de rinosinusitis bacteriana aguda, de manera que la combinación de la elevación de ambos (velocidad de sedimentación globular mayor de 10 mm/h en hombre y mayor de 20 mm/h en mujeres; proteína C reactiva mayor de 10 mg/l) tienen una sensibilidad de 82% y una especificidad de 57%, con un cociente de probabilidad positivo de 1,9 y un cociente de probabilidad negativo de 0,3 [15]. Con los datos etiológicos se comprende que la mayoría de los casos se resuelve sin tratamiento, por lo que su uso deberá restringirse, teniendo en cuenta la combinación de hallazgos clínicos, su gravedad, la comorbilidad de los pacientes y, en su caso, el aumento de reactantes de fase aguda.
La faringoamigdalitis aguda es un motivo frecuente de consulta que tiene una etiología viral en más de dos tercios de los casos. La faringoamigdalitis aguda causada por el streptococo ß-hemolítico del grupo A es la principal indicación para tratamiento antibiótico ya que, en estos casos, el antibiótico clínicamente reduce la duración y gravedad de los síntomas y la aparición de complicaciones. Además, desde el punto de vista epidemiológico, disminuye su transmisión [19]. Sin embargo, dicha etiología representa únicamente entre el 5 y 15% de los casos en el adulto [20].
Ante la presencia clínica de un cuadro compatible con faringoamigdalitis aguda, la probabilidad pre-test para faringoamigdalitis aguda por estreptococo ß-hemolítico A en el adulto, debido a su incidencia ya comentada, es de 5 a 15%. Esta enfermedad suele expresarse por la presencia de dolor faríngeo con dificultad para tragar, fiebre elevada, malestar general e inflamación o dolor en cuello por la presencia de adenopatías cervicales. En tanto, la faringoamigdalitis aguda de origen vírico suele cursar con mayor presencia de tos, rinorrea o congestión nasal y, con frecuencia, en el seno de brotes epidémicos [20]. Como datos exploratorios se puede mencionar que la faringoamigdalitis aguda por estreptococo ß-hemolítico A, tiende a cursar con hiperemia faríngea, hipertrofia de amígdalas, exudado amigdalino y adenopatías cervicales. Por su parte, la faringoamigdalitis aguda viral tiende a cursar sin los signos anteriores, con menor hiperemia/edema faríngeo y ocasionalmente con aftas orales [20].
Desafortunadamente, ningún elemento individual de la historia clínica o la exploración física es lo suficientemente preciso por sí mismo para confirmar o descartar la presencia de estreptococo ß-hemolítico como agente causal, aunque la presencia de exudado (principalmente amigdalar) presenta un cociente de probabilidad positivo cuyo intervalo de confianza tiene un límite inferior mayor de 1 (Tabla III) [21].
Se han estudiado varias reglas de predicción clínica que, agrupando síntomas y signos, tratan de ayudar en el establecimiento diagnóstico de faringoamigdalitis aguda por estreptococo ß-hemolítico del grupo A, siendo la más estudiada y validada la conocida como “criterios de Centor”, posteriormente modificada por McIsaac al introducir un quinto criterio relativo a la edad del paciente (Tabla IV) [22],[23],[24]. Si bien los resultados de validez del método son limitados, la utilización de estos criterios, junto a la recomendación de dar o no antibiótico recogida en la Tabla IV, ha demostrado la reducción de utilización de antibioterapia y son aceptados por distintas recomendaciones internacionales [25],[26].
Tabla IV. Criterios de Centor modificados y actitud terapéutica.
El método de referencia para establecer el diagnóstico de faringoamigdalitis aguda por estreptococo ß-hemolítico A es el cultivo, pero su utilidad es cuestionada en los adultos por la demora que ocasiona esperar sus resultados, entre otras causas [20]. Las técnicas de diagnóstico rápido a través de determinación antigénica son métodos sencillos de utilizar, que presentan resultados de validez que prácticamente los equiparan a los del cultivo: sensibilidad de 0,85 (intervalo de confianza de 95%: 0,84-0,87); especificidad de 0,96 (intervalo de confianza de 95%: 0,96-0,97); cociente probabilidad positivo de 22,21 (intervalo de confianza de 95%: 15,12-32,63); cociente probabilidad negativo de 0,15 (intervalo de confianza de 95%: 0,13-0,18) y odds ratio diagnóstico global de 117,50 (intervalo de confianza de 95%: 120,74-1382,24) [27]. En función de su validez, en la práctica clínica estaría indicada su realización en pacientes que presenten dos o tres criterios de Centor y su resultado determinaría la necesidad de tratar o no con antibiótico (Tabla IV)[20],[24],[25]. Existen evidencias de que el empleo de estas técnicas reduce el uso de antibióticos [28].
El concepto de infecciones respiratorias de vías bajas incluye procesos que afectan tanto al parénquima pulmonar (neumonía) como a las vías respiratorias (bronquitis), es importante su diferenciación para valorar si es necesaria o no la utilización de antibióticos. La neumonía adquirida en la comunidad es de etiología mayoritariamente bacteriana y precisa antibioterapia como norma general, mientras que la bronquitis aguda es de etiología predominantemente viral y en ella el beneficio de los antibióticos se equipara al riesgo de efectos adversos asociados a estos [7],[29]. Pese a que la neumonía adquirida en la comunidad representa sólo un pequeño porcentaje de las neumonías, más de dos tercios de los pacientes con infecciones respiratorias de vías bajas reciben antibióticos [30]. El estudio radiológico es la prueba de confirmación diagnóstica de neumonía adquirida en la comunidad, pero éste presenta limitaciones en su capacidad diagnóstica y tampoco debe ser realizado de forma rutinaria en toda persona con síntomas del tracto respiratorio inferior [29].
Dada la variabilidad de su presentación, una revisión sobre los estudios publicados al respecto, indica que es difícil diferenciar un cuadro de neumonía adquirida en la comunidad de un proceso bronquial a través de datos clínicos y de la exploración física ya que ninguno de los síntomas y signos existentes con frecuencia en dichos cuadros, permite confirmar o descartar que se trate de uno de ellos con un grado adecuado de certeza (Tabla V) [31]. Se destaca que algunos de los estudios incluidos en la revisión muestran que sólo la alteración de signos vitales (taquicardia, taquipnea, hipoxemia) diferencia a los pacientes que dan verdaderos positivos de los que dan falsos negativos.
Ante esta limitación se han desarrollado distintas reglas de predicción clínica que agrupan datos de la historia clínica y de la exploración. En general las reglas mejoran la precisión diagnóstica de los distintos síntomas/signos por separado, pero han sido evaluadas en distintos ámbitos, con porcentajes de neumonía adquirida en la comunidad muy distintos. Algunas incluyen parámetros de laboratorio y todas presentan limitaciones para realizar la confirmación diagnóstica (Tabla VI) [31],[32],[33].
Tabla VI. Reglas de predicción clínica de neumonía adquirida en la comunidad.
Con el mismo objetivo, pero con un enfoque diferente, también se ha evaluado la utilidad de los síntomas y signos en la diferenciación entre etiología viral y bacteriana de las infecciones respiratorias de vías bajas, pero ninguno de los datos permite predecir de forma nítida el origen del cuadro [34].
Respecto a la utilidad de pruebas de diagnóstico rápido (proteína C reactiva y procalcitonina), proteína C reactiva es más precisa para determinar la existencia de neumonía adquirida en la comunidad, pese a tener una validez limitada (sensibilidad 66-96%; especificidad 31-89%; valor predictivo positivo 17-42%; valor predictivo negativo 88-98%) o si el cuadro es bacteriano o viral (sensibilidad 51-89%; especificidad 31-72%; valor predictivo positivo 23-52%; valor predictivo negativo 70-89%) [35],[36]. La guía del National Institute for Health and Care Excellence, NICE, recomienda que si los datos clínicos no están claros, es necesario emplear antibióticos si la proteína C reactiva es mayor de 100 mg/l. La prescripción para el tratamiento diferido se considera en caso del empeoramiento del cuadro, en que la proteína C reactiva se ubica entre 20 y 100 mg/l [37].
Sobre la base de todas las limitaciones mencionadas, no existe una herramienta que a través de síntomas, signos o prueba de diagnóstico rápido permitan tomar la decisión de prescribir o no un antibiótico. La Scottish Intercollegiate Guideline Network indica que un paciente con infección respiratoria de vías bajas con confirmación de neumonía adquirida en la comunidad debe recibir antibioterapia siempre. En tanto, si no existe confirmación de la misma, sólo lo debe recibirla si cumple algún criterio de los recogidos en la Tabla VII, indicando asimismo que si estos pacientes estaban previamente sanos y sin ninguno de los criterios anteriores, de entrada no deben recibir antibióticos. De igual forma, la presencia de esputo purulento en ellos tampoco es indicación de antibiótico por si sola [29].
La exacerbación de la enfermedad pulmonar obstructiva crónica se define como un evento en el curso natural de la enfermedad, caracterizado por un aumento en la disnea, en la tos y/o en el esputo basal del paciente que va más allá de las variaciones diarias, que es agudo en su inicio y precisa un cambio en la medicación regular [38]. Sus desencadenantes comunes incluyen la contaminación del aire y la infección viral y/o bacteriana de las vías respiratorias, pero la causa de aproximadamente un tercio de éstas, no se identifica [39]. El papel de las bacterias en estas exacerbaciones es discutido y, pese a la amplia utilización de antibióticos en la enfermedad pulmonar obstructiva crónica, su papel en ella es controvertido y su utilización debería ser cuidadosa [38],[40].
La decisión de iniciar tratamiento antibiótico en la enfermedad pulmonar obstructiva crónica, se toma generalmente siguiendo los criterios clínicos de aumento de disnea, del volumen y la purulencia del esputo, descritos por Anthonisen para paciente con exacerbaciones en enfermedad pulmonar obstructiva crónica graves. Se basa en el éxito o fracaso del tratamiento con o sin antibiótico en función de presencia de uno, dos o tres de los criterios clínicos [41] (Tabla VIII), lo que hace que su validez predictiva en pacientes con agudizaciones leves o moderadas sea insuficiente [42],[43].
Varios estudios han demostrado que en la enfermedad pulmonar obstructiva crónica, entre los criterios clásicos de Anthonisen, únicamente la purulencia del esputo de forma aislada se asocia a infección bacteriana (Tabla IX) [43],[44],[45],[46]. Además, el color marrón del esputo se relaciona con mayor probabilidad a infección por microorganismos Gram negativos como Pseudomonas aeruginosa y enterobacterias [45]. Existen otros datos clínicos que pueden aportar información para ayudar en la toma de decisiones (más de cuatro exacerbaciones en el último año o algún ingreso en el último año), aunque sólo se han validado en exacerbaciones severas [46]. También existe una regla de predicción clínica que combina distintos datos clínicos para mejorar su capacidad diagnóstica [47] (Tabla IX).
Los niveles de proteína C reactiva también pueden contribuir a discriminar los pacientes que podrían beneficiarse del tratamiento antibiótico, ya que sus niveles son significativamente superiores en las enfermedad pulmonar obstructiva crónica con esputo purulento y en los casos de infección bacteriana; pudiéndose establecer un punto de corte significativo en torno a 40 mg/l [43],[48]. La utilidad de procalcitonina para valorar la necesidad de tratamiento antibiótico es más controvertida [48]. Un estudio concluye que los pacientes ambulatorios con exacerbaciones de enfermedad pulmonar obstructiva crónica de leve a moderada (FEV1 mayor de 50%) podrían tratarse de forma segura sin antibióticos, cuando no se incremente la purulencia del esputo y los niveles de proteína C reactiva sean inferiores a 40 mg/l (probabilidad de fallo 2,7%). En el caso de que la proteína C reactiva no esté disponible, la presencia de aumento de disnea, del volumen del esputo o ambos, sin un incremento de la purulencia del esputo, se asocia a una probabilidad de fallo inferior al 8% si no se administran antibióticos [43].
Fundados en las evidencias disponibles, distintas recomendaciones aconsejan el empleo de antibióticos en la enfermedad pulmonar obstructiva crónica en las siguientes situaciones: presencia de los tres criterios de Anthonisen, presencia de dos criterios (especialmente si uno de ellos es aumento de la purulencia del esputo), presencia de signos clínicos de neumonía, consolidación radiológica, necesidad de ventilación mecánica (invasiva o no) o de hospitalización. No existe total unanimidad en indicar antibióticos ante la presencia aislada de purulencia del esputo [38],[48],[49].
Un alto porcentaje de las infecciones del tracto respiratorio tienen una etiología viral, no estando indicada la utilización de antibióticos. La anamnesis, la exploración física y las pruebas de diagnóstico rápido son útiles para orientar la necesidad de tratamiento antibiótico en patologías como rinosinusitis aguda, faringoamigdalitis aguda, infección respiratoria de vías bajas y reagudización de la enfermedad pulmonar obstructiva crónica, aunque ningún dato de forma aislada es suficientemente preciso por sí mismo para confirmar o descartar la necesidad de dicho tratamiento. Existen reglas de predicción clínica que, agrupando datos de anamnesis y exploración, consiguen mejorar la precisión para la decisión de pautar o no un antibiótico.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del International Committee of Medical Journal Editors (ICMJE), traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del artículo, ni tener conflictos de intereses con la materia del artículo.

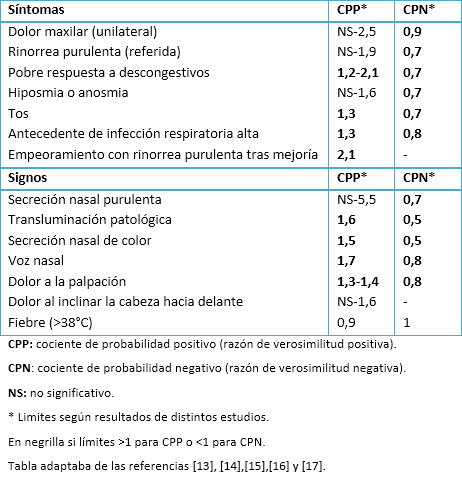 Tabla I. Validez diagnóstica de síntomas y signos para el diagnóstico de rinosinusitis bacteriana.
Tabla I. Validez diagnóstica de síntomas y signos para el diagnóstico de rinosinusitis bacteriana.

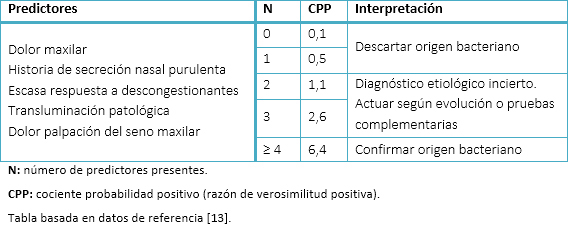 Tabla II. Regla predicción clínica de rinosinusitis bacteriana.
Tabla II. Regla predicción clínica de rinosinusitis bacteriana.

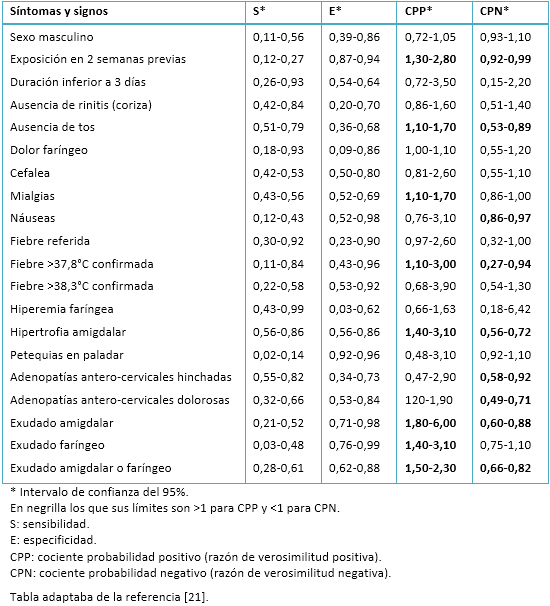 Tabla III. Indicadores de validez diagnóstica de datos clínico-epidemiológicos para la faringoamigdalitis aguda por el estreptococo ß-hemolítico del grupo A.
Tabla III. Indicadores de validez diagnóstica de datos clínico-epidemiológicos para la faringoamigdalitis aguda por el estreptococo ß-hemolítico del grupo A.

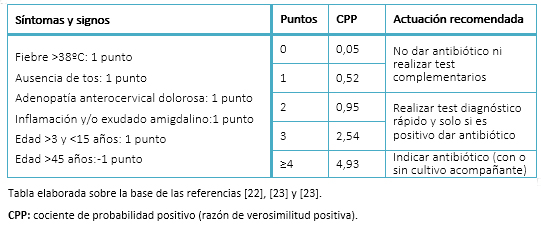 Tabla IV. Criterios de Centor modificados y actitud terapéutica.
Tabla IV. Criterios de Centor modificados y actitud terapéutica.

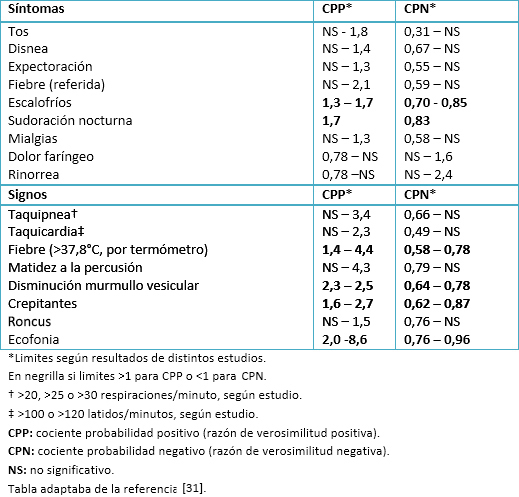 Tabla V. Validez diagnóstica de síntomas y signos para diagnóstico de neumonía adquirida en la comunidad.
Tabla V. Validez diagnóstica de síntomas y signos para diagnóstico de neumonía adquirida en la comunidad.

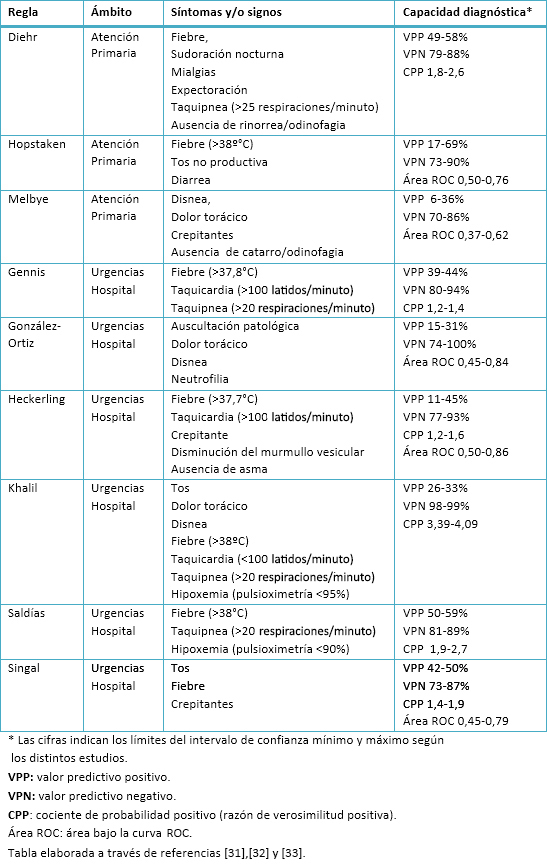 Tabla VI. Reglas de predicción clínica de neumonía adquirida en la comunidad.
Tabla VI. Reglas de predicción clínica de neumonía adquirida en la comunidad.

 Tabla VII. Indicación de antibioterapia en pacientes con síntomas de infección respiratoria de vías bajas, sin confirmación de neumonía adquirida en la comunidad.
Tabla VII. Indicación de antibioterapia en pacientes con síntomas de infección respiratoria de vías bajas, sin confirmación de neumonía adquirida en la comunidad.

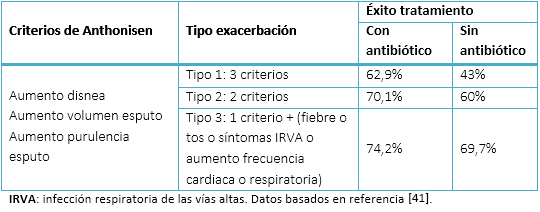 Tabla VIII. Resultados según tratamiento (con/sin antibiótico) de las exacerbaciones basadas en la presencia de los criterios de Anthonisen.
Tabla VIII. Resultados según tratamiento (con/sin antibiótico) de las exacerbaciones basadas en la presencia de los criterios de Anthonisen.

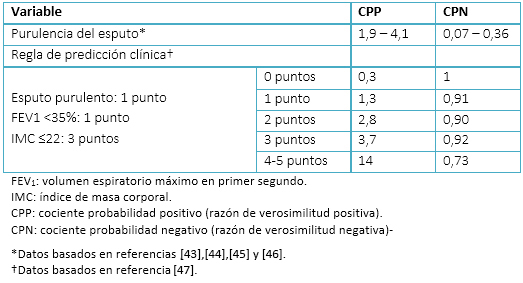 Tabla IX. Validez de purulencia del esputo y regla de predicción clínica para determinar origen bacteriano de las exacerbaciones de la enfermedad pulmonar obstructiva crónica.
Tabla IX. Validez de purulencia del esputo y regla de predicción clínica para determinar origen bacteriano de las exacerbaciones de la enfermedad pulmonar obstructiva crónica.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Respiratory tract infections are a common complaint and most of them, such as common cold and laryngitis, are viral in origin, so antibiotic use should be exceptional. However, there are other respiratory tract infections (sinusitis, pharyngitis, lower respiratory tract infections, and exacerbations of chronic obstructive pulmonary disease) where a bacterial etiology is responsible for a non-negligible percentage, and antibiotics are often empirically indicated. The aim of the study is to identify the strength of the data obtained from the symptoms, physical examination and rapid diagnostic methods in respiratory infections in which antibiotic use is frequently proposed in order to improve diagnosis and influence the decision to prescribe these drugs. The review concludes that history, physical examination and rapid tests are useful to guide the need for antibiotic treatment in diseases such as acute sinusitis, acute pharyngitis, exacerbation of lower respiratory tract infection and chronic obstructive pulmonary disease. However, no isolated data is accurate enough by itself to confirm or rule out the need for antibiotics. Therefore, clinical prediction rules bring together history and physical examination, thereby improving the accuracy of the decision to indicate or not antibiotics.
 Autores:
Pilar Toledano-Sierra[1], Maite Arriola-Hernández[2], Ramón Orueta-Sánchez[3]
Autores:
Pilar Toledano-Sierra[1], Maite Arriola-Hernández[2], Ramón Orueta-Sánchez[3]

Citación: Toledano-Sierra P, Arriola-Hernández M, Orueta-Sánchez R. Usefulness of clinical data and rapid diagnostic tests to identify bacterial etiology in adult respiratory infections. Medwave 2015 Ene;15(1):e6067 doi: 10.5867/medwave.2015.01.6067
Fecha de envío: 28/10/2014
Fecha de aceptación: 5/1/2015
Fecha de publicación: 19/1/2015
Origen: no solicitado
Tipo de revisión: con revisión por tres pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Armstrong GL, Conn LA, Pinner RW. Trends in infectious disease mortality in the United States during the 20th century. JAMA. 1999 Jan;281(1):61-6.
| CrossRef | PubMed |
Armstrong GL, Conn LA, Pinner RW. Trends in infectious disease mortality in the United States during the 20th century. JAMA. 1999 Jan;281(1):61-6.
| CrossRef | PubMed | Organización Mundial de la Salud. Estrategia mundial de la OMS para contener la resistencia a los antimicrobianos. OMS: Ginebra, Suiza, 2001. | Link |
Organización Mundial de la Salud. Estrategia mundial de la OMS para contener la resistencia a los antimicrobianos. OMS: Ginebra, Suiza, 2001. | Link | World Health Organization. Antimicrobial resistance. Global report on surveillance 2014. WHO: Geneva, 2014. | Link |
World Health Organization. Antimicrobial resistance. Global report on surveillance 2014. WHO: Geneva, 2014. | Link | van de Sande-Bruinsma N, Grundmann H, Verloo D, Tiemersma E, Monen J, Goossens H, et al. Antimicrobial drug use and resistance in Europe. Emerg Infect Dis. 2008 Nov;14(11):1722-30. | CrossRef | PubMed |
van de Sande-Bruinsma N, Grundmann H, Verloo D, Tiemersma E, Monen J, Goossens H, et al. Antimicrobial drug use and resistance in Europe. Emerg Infect Dis. 2008 Nov;14(11):1722-30. | CrossRef | PubMed | Lopez-Vazquez P, Vazquez-Lago JM, Figueiras A. Misprescription of antibiotics in primary care: a critical systematic review of its determinants. J Eval Clin Pract. 2012 Apr;18(2):473-84. | CrossRef | PubMed |
Lopez-Vazquez P, Vazquez-Lago JM, Figueiras A. Misprescription of antibiotics in primary care: a critical systematic review of its determinants. J Eval Clin Pract. 2012 Apr;18(2):473-84. | CrossRef | PubMed | Cars O, Molstad S, Melander A. Variation in antibiotic use in the European Union. Lancet. 2001;357(9271):1851-3.
Cars O, Molstad S, Melander A. Variation in antibiotic use in the European Union. Lancet. 2001;357(9271):1851-3.  Smith SM, Fahey T, Smucny J, Becker LA. Antibiotics for acute bronchitis. Cochrane Database Syst Rev. 2014 Mar 1;3:CD000245. | CrossRef | PubMed |
Smith SM, Fahey T, Smucny J, Becker LA. Antibiotics for acute bronchitis. Cochrane Database Syst Rev. 2014 Mar 1;3:CD000245. | CrossRef | PubMed | Ferech M, Coenen S, Malhotra-Kumar S, Dvorakova K, Hendrickx E, Suetens C, et al. European Surveillance of Antimicrobial Consumption (ESAC): outpatient antibiotic use in Europe. J Antimicrob Chemother. 2006 Aug;58(2):401-7.
| CrossRef | PubMed |
Ferech M, Coenen S, Malhotra-Kumar S, Dvorakova K, Hendrickx E, Suetens C, et al. European Surveillance of Antimicrobial Consumption (ESAC): outpatient antibiotic use in Europe. J Antimicrob Chemother. 2006 Aug;58(2):401-7.
| CrossRef | PubMed | Kastner M, Wilczynski NL, McKibbon AK, Garg AX, Haynes RB. Diagnostic test systematic reviews: bibliographic search filters ("Clinical Queries") for diagnostic accuracy studies perform well. J Clin Epidemiol. 2009 Sep;62(9):974-81. | CrossRef | PubMed |
Kastner M, Wilczynski NL, McKibbon AK, Garg AX, Haynes RB. Diagnostic test systematic reviews: bibliographic search filters ("Clinical Queries") for diagnostic accuracy studies perform well. J Clin Epidemiol. 2009 Sep;62(9):974-81. | CrossRef | PubMed | Hickner JM, Bartlett JG, Besser RE, Gonzales R, Hoffman JR, Sande MA. Principles of appropriate antibiotic use for acute rhinosinusitis in adults: background. Ann Intern Med. 2001 Mar 20;134(6):498-505. | CrossRef | PubMed |
Hickner JM, Bartlett JG, Besser RE, Gonzales R, Hoffman JR, Sande MA. Principles of appropriate antibiotic use for acute rhinosinusitis in adults: background. Ann Intern Med. 2001 Mar 20;134(6):498-505. | CrossRef | PubMed | Fica AF, Dçiaz JC. Enfoque diagnóstico y terapéutico de los pacientes adultos con sospecha de sinusitis aguda. Rev Chil Infect. 2003;20(3):184-92.
| CrossRef |
Fica AF, Dçiaz JC. Enfoque diagnóstico y terapéutico de los pacientes adultos con sospecha de sinusitis aguda. Rev Chil Infect. 2003;20(3):184-92.
| CrossRef | Lau J, Zucker D, Engels EA, Balk E, Barza M, Terrin N, et al. Diagnosis and treatment of acute bacterial rhinosinusitis. Evidence Report/Technology Assessment No.9. Rockville, MD: Agency for Health Care Policy and Research, 1999.
| Link |
Lau J, Zucker D, Engels EA, Balk E, Barza M, Terrin N, et al. Diagnosis and treatment of acute bacterial rhinosinusitis. Evidence Report/Technology Assessment No.9. Rockville, MD: Agency for Health Care Policy and Research, 1999.
| Link | Williams JW Jr, Simel DL, Roberts L, Samsa GP. Clinical evaluation for sinusitis. Making the diagnosis by history and physical examination. Ann Intern Med. 1992 Nov 1;117(9):705-10. | CrossRef | PubMed |
Williams JW Jr, Simel DL, Roberts L, Samsa GP. Clinical evaluation for sinusitis. Making the diagnosis by history and physical examination. Ann Intern Med. 1992 Nov 1;117(9):705-10. | CrossRef | PubMed | Williams JW Jr, Simel DL. Does this patient have sinusitis? Diagnosing acute sinusitis by history and physical examination. JAMA. 1993 Sep 8;270(10):1242-6. | CrossRef | PubMed |
Williams JW Jr, Simel DL. Does this patient have sinusitis? Diagnosing acute sinusitis by history and physical examination. JAMA. 1993 Sep 8;270(10):1242-6. | CrossRef | PubMed | Hansen JG, Schmidt H, Rosborg J, Lund E. Predicting acute maxillary sinusitis in a general practice population. BMJ. 1995 Jul 22;311(6999):233-6.
| CrossRef | PubMed |
Hansen JG, Schmidt H, Rosborg J, Lund E. Predicting acute maxillary sinusitis in a general practice population. BMJ. 1995 Jul 22;311(6999):233-6.
| CrossRef | PubMed | Lindbaek M1, Hjortdahl P. The clinical diagnosis of acute purulent sinusitis in general practice--a review. Br J Gen Pract. 2002 Jun;52(479):491-5.
| PubMed | Link |
Lindbaek M1, Hjortdahl P. The clinical diagnosis of acute purulent sinusitis in general practice--a review. Br J Gen Pract. 2002 Jun;52(479):491-5.
| PubMed | Link | Lindbaek M, Hjortdahl P, Johnsen UL. Use of symptoms, signs, and blood tests to diagnose acute sinus infections in primary care: comparison with computed tomography. Fam Med. 1996 Mar;28(3):183-8. | PubMed |
Lindbaek M, Hjortdahl P, Johnsen UL. Use of symptoms, signs, and blood tests to diagnose acute sinus infections in primary care: comparison with computed tomography. Fam Med. 1996 Mar;28(3):183-8. | PubMed | Desrosiers M, Evans GA, Keith PK, Wright ED, Kaplan A, Bouchard J, et al. Canadian clinical practice guidelines for acute and chronic rhinosinusitis. Allergy Asthma Clin Immunol. 2011 Feb;7(1):2. | CrossRef | PubMed |
Desrosiers M, Evans GA, Keith PK, Wright ED, Kaplan A, Bouchard J, et al. Canadian clinical practice guidelines for acute and chronic rhinosinusitis. Allergy Asthma Clin Immunol. 2011 Feb;7(1):2. | CrossRef | PubMed | Pichichero ME. Treatment and prevention of streptococcal tonsillopharyngitis, 2014. UpToDate.com [online]
| Link |
Pichichero ME. Treatment and prevention of streptococcal tonsillopharyngitis, 2014. UpToDate.com [online]
| Link | Ebell MH, Smith MA, Barry HC, Ives K, Carey M. The rational clinical examination. Does this patient have strep throat? JAMA. 2000;284(22):2912-8. | CrossRef | PubMed |
Ebell MH, Smith MA, Barry HC, Ives K, Carey M. The rational clinical examination. Does this patient have strep throat? JAMA. 2000;284(22):2912-8. | CrossRef | PubMed | Centor RM, Witherspoon JM, Dalton HP, Brody CE, Link K. The diagnosis of strep throat in adults in the emergency room. Med Decis Making. 1981;1(3):239-46. | PubMed |
Centor RM, Witherspoon JM, Dalton HP, Brody CE, Link K. The diagnosis of strep throat in adults in the emergency room. Med Decis Making. 1981;1(3):239-46. | PubMed | Aalbers J, O’Brien K, Chan WS, Falk GA, Teljeur C, Dimitrov BD, et al. Predicting streptococcal pharyngitis in adults in primary care: a systematic review of the diagnostic accuracy of symptoms and signs and validation of Centor store. BMC Med. 2011 Jun;9:67. | CrossRef | PubMed |
Aalbers J, O’Brien K, Chan WS, Falk GA, Teljeur C, Dimitrov BD, et al. Predicting streptococcal pharyngitis in adults in primary care: a systematic review of the diagnostic accuracy of symptoms and signs and validation of Centor store. BMC Med. 2011 Jun;9:67. | CrossRef | PubMed | Fine AM, Nizet V, Mandl KG. Large-scale validation of the Centor and McIsaac scores to predict group A streptococcal pharyngitis. Arch Intern Med. 2012;172(11):847-52. | CrossRef | PubMed |
Fine AM, Nizet V, Mandl KG. Large-scale validation of the Centor and McIsaac scores to predict group A streptococcal pharyngitis. Arch Intern Med. 2012;172(11):847-52. | CrossRef | PubMed | Shulman ST, Bisno AL, Clegg HW, Gerber MA, Kaplan EL, Lee G, et al. Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America. Clin Infect Dis. 2012;55(10):e86-102. | CrossRef | PubMed |
Shulman ST, Bisno AL, Clegg HW, Gerber MA, Kaplan EL, Lee G, et al. Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America. Clin Infect Dis. 2012;55(10):e86-102. | CrossRef | PubMed | Tan T, Little P, Strokes T, Guideline Development Group. Antibiotic prescribing for self limiting respiratory tract infections in primary care: summary of NICE guidance. BMJ. 2008;337:a437. | CrossRef | PubMed |
Tan T, Little P, Strokes T, Guideline Development Group. Antibiotic prescribing for self limiting respiratory tract infections in primary care: summary of NICE guidance. BMJ. 2008;337:a437. | CrossRef | PubMed | Ruiz-Aragón J, Rodríguez D, Molina JM. Evaluación de los métodos rápidos para la detección de Streptococcus pyogenes. Revisión sistemática y metaanálisis. An Pediatr (Barc). 2010;72(6):391-402. | CrossRef | PubMed |
Ruiz-Aragón J, Rodríguez D, Molina JM. Evaluación de los métodos rápidos para la detección de Streptococcus pyogenes. Revisión sistemática y metaanálisis. An Pediatr (Barc). 2010;72(6):391-402. | CrossRef | PubMed | Llor C, Madurell J, Balagué-Corbella, Gómez M, Cots JM. Impact on antibiotic prescription of rapid antigen detection testing in acute pharyngitis in adults: a randomised clinical trial. Br J Gen Pract. 2011;61(586):e244-51. | CrossRef | PubMed |
Llor C, Madurell J, Balagué-Corbella, Gómez M, Cots JM. Impact on antibiotic prescription of rapid antigen detection testing in acute pharyngitis in adults: a randomised clinical trial. Br J Gen Pract. 2011;61(586):e244-51. | CrossRef | PubMed | Scottish Intercollegiate Guideline Network. Community management of lower respiratory tract infection in adults. SIGN guideline. 2002 Jun;(59). [online] | Link |
Scottish Intercollegiate Guideline Network. Community management of lower respiratory tract infection in adults. SIGN guideline. 2002 Jun;(59). [online] | Link | Macfarlane J, Holmes W, Gard P, Macfarlane R, Rose D, Seston V, et al. Prospective study of the incidence, aetiology and outcome of adult lower respiratory tract illness in the community. Thorax. 2001;56(2):109-14. | CrossRef | PubMed |
Macfarlane J, Holmes W, Gard P, Macfarlane R, Rose D, Seston V, et al. Prospective study of the incidence, aetiology and outcome of adult lower respiratory tract illness in the community. Thorax. 2001;56(2):109-14. | CrossRef | PubMed | Metlay JP, Kapoor WN, Fine MJ. Does this patient have community-acquired pneumonia. Diagnosing pneumonia by history and physical examination. JAMA. 1997;278(17):1440-45. | CrossRef | PubMed |
Metlay JP, Kapoor WN, Fine MJ. Does this patient have community-acquired pneumonia. Diagnosing pneumonia by history and physical examination. JAMA. 1997;278(17):1440-45. | CrossRef | PubMed | Graffelman AW, le Cessie S, Knuistingh Neven A, Willemssen FE, Zonderland HM, van den Broek PJ. Can history and examen alone reliably predict pneumonia? J Fam Pract. 2007;56(6):465-70. | PubMed |
Graffelman AW, le Cessie S, Knuistingh Neven A, Willemssen FE, Zonderland HM, van den Broek PJ. Can history and examen alone reliably predict pneumonia? J Fam Pract. 2007;56(6):465-70. | PubMed | Saldías F, Cabrera D, de Solminihac I, Gederlini A, Agar V, Díaz A. Evaluación del juicio clínico y las guías de decisión en la pesquisa de pacientes adultos con neumonía adquirida en la comunidad en la unidad de emergencia. Rev Chil Enf Respir. 2007;23:87-93.
| CrossRef |
Saldías F, Cabrera D, de Solminihac I, Gederlini A, Agar V, Díaz A. Evaluación del juicio clínico y las guías de decisión en la pesquisa de pacientes adultos con neumonía adquirida en la comunidad en la unidad de emergencia. Rev Chil Enf Respir. 2007;23:87-93.
| CrossRef | Stolz D, Christ-Crain M, Gencay MM, Bingisser R, Huber PR, Muller B, et al. Diagnostic value of signs, symptoms and laboratory values in lower respiratory tract infection. Swiss Med Wkly. 2006;136(27-28):434-40. | PubMed | Link |
Stolz D, Christ-Crain M, Gencay MM, Bingisser R, Huber PR, Muller B, et al. Diagnostic value of signs, symptoms and laboratory values in lower respiratory tract infection. Swiss Med Wkly. 2006;136(27-28):434-40. | PubMed | Link | van der Meer V, Neven AK, van den Broek PJ, Assendelft WJ. Diagnostic value of C reactive protein in infections of the lower respiratory tract: systematic review. BMJ. 2005 Jul 2;331(7507):26. | CrossRef | PubMed |
van der Meer V, Neven AK, van den Broek PJ, Assendelft WJ. Diagnostic value of C reactive protein in infections of the lower respiratory tract: systematic review. BMJ. 2005 Jul 2;331(7507):26. | CrossRef | PubMed | Engel MF, Paling FP, Hoepelman AIM, van der Meer V, Oosterheert JJ. Evaluating the evidence for the implementation of C-reactive protein measurement in adult patients with suspected lower respiratory tract infection in primary care: a systematic review. Fam Pract. 2012 Aug;29(4):383-93. | CrossRef | PubMed |
Engel MF, Paling FP, Hoepelman AIM, van der Meer V, Oosterheert JJ. Evaluating the evidence for the implementation of C-reactive protein measurement in adult patients with suspected lower respiratory tract infection in primary care: a systematic review. Fam Pract. 2012 Aug;29(4):383-93. | CrossRef | PubMed | The National Institute for Clinical Excellence. Pneumonia. NICE Clinical Guideline, June 2014. Nice.org.uk [online]. | Link |
The National Institute for Clinical Excellence. Pneumonia. NICE Clinical Guideline, June 2014. Nice.org.uk [online]. | Link | Global Strategy for the Diagnosis, Management and Prevention of COPD. Global Initiative for Chronic Obstructive Lung Disease (GOLD), January 2014. [online]
| Link |
Global Strategy for the Diagnosis, Management and Prevention of COPD. Global Initiative for Chronic Obstructive Lung Disease (GOLD), January 2014. [online]
| Link | White AJ, Gompertz S, Stockley RA. Chronic obstructive pulmonary disease. 6. The aetiology of exacerbations of chronic obstructive pulmonary disease. Thorax. 2003;58(1):73-80.
| CrossRef | PubMed |
White AJ, Gompertz S, Stockley RA. Chronic obstructive pulmonary disease. 6. The aetiology of exacerbations of chronic obstructive pulmonary disease. Thorax. 2003;58(1):73-80.
| CrossRef | PubMed | Ram FS, Rodríguez-Roisin R, García-Aymerich J, Granados AN, Barnes NC. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006; 19(2):CD004403. | CrossRef | PubMed |
Ram FS, Rodríguez-Roisin R, García-Aymerich J, Granados AN, Barnes NC. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006; 19(2):CD004403. | CrossRef | PubMed | Anthonisen NR, Manfreda J, Warren CPW, Hershfield ES, Harding GKM, Nelson NA. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med. 1987;106(2):196-204. | CrossRef | PubMed |
Anthonisen NR, Manfreda J, Warren CPW, Hershfield ES, Harding GKM, Nelson NA. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med. 1987;106(2):196-204. | CrossRef | PubMed | Puhan MA, Vollenweider D, Latshang T, Steurer J, Steurer-Stey C. Exacerbations of chronic obstructive pulmonary disease: when are antibiotics indicated? A systematic review. Respir Res. 2007;8:30. | CrossRef | PubMed |
Puhan MA, Vollenweider D, Latshang T, Steurer J, Steurer-Stey C. Exacerbations of chronic obstructive pulmonary disease: when are antibiotics indicated? A systematic review. Respir Res. 2007;8:30. | CrossRef | PubMed | Miravitlles M, Moragas A, Hernandez S, Bayona C. Is it posible to identify exacerbations of mild to moderate COPD that do not require antibiotic treatment? Chest. 2013;144(5):1571-77. | CrossRef | PubMed |
Miravitlles M, Moragas A, Hernandez S, Bayona C. Is it posible to identify exacerbations of mild to moderate COPD that do not require antibiotic treatment? Chest. 2013;144(5):1571-77. | CrossRef | PubMed | Stockley RA, O’Brien C, Pye A, Hill SL. Relationship of sputum color to nature and outpatient management of acute exacerbations of COPD. Chest. 2000;117(6):1638-45. | CrossRef | PubMed |
Stockley RA, O’Brien C, Pye A, Hill SL. Relationship of sputum color to nature and outpatient management of acute exacerbations of COPD. Chest. 2000;117(6):1638-45. | CrossRef | PubMed | Allegra L, Blasi F, Diano P, Cosentini R. Sputum color as a marker of acute bacterial exacerbations of chronic obstructive pulmonary disease. J Respir Med. 2005;99(6):742-47. | PubMed |
Allegra L, Blasi F, Diano P, Cosentini R. Sputum color as a marker of acute bacterial exacerbations of chronic obstructive pulmonary disease. J Respir Med. 2005;99(6):742-47. | PubMed | Soler N, Agustí C, Angrill J, Puig De la Bellacasa J, Torres A. Bronchoscopic validation of the significance of sputum purulence in severe exacerbations of chronic obstructive pulmonary disease. Thorax. 2007;62(1):29-35 | CrossRef | PubMed |
Soler N, Agustí C, Angrill J, Puig De la Bellacasa J, Torres A. Bronchoscopic validation of the significance of sputum purulence in severe exacerbations of chronic obstructive pulmonary disease. Thorax. 2007;62(1):29-35 | CrossRef | PubMed | Tsimogianni AM, Papiris SA, Kanvaki S, Stathopoulos GT, Sotiropoulos C, Manali ED et al. Predictors of positive sputum cultures in exacerbations of chronic obstructive pulmonary disease. Respirology. 2009:14;1114-20. | CrossRef | PubMed |
Tsimogianni AM, Papiris SA, Kanvaki S, Stathopoulos GT, Sotiropoulos C, Manali ED et al. Predictors of positive sputum cultures in exacerbations of chronic obstructive pulmonary disease. Respirology. 2009:14;1114-20. | CrossRef | PubMed | Bartlett JG, Sethi S. Management of infection in acute exacerbations of chronic obstructive pulmonary disease. UpToDate.com [online]. | Link |
Bartlett JG, Sethi S. Management of infection in acute exacerbations of chronic obstructive pulmonary disease. UpToDate.com [online]. | Link | National Institute for Health and Clinical Excellence. Chronic obstructive pulmonary disease: Management of chronic obstructive pulmonary disease in adults in primary and secondary care (partial update). NICE guidelines GC101, June 2010. nice.org.uk [online]
| Link |
National Institute for Health and Clinical Excellence. Chronic obstructive pulmonary disease: Management of chronic obstructive pulmonary disease in adults in primary and secondary care (partial update). NICE guidelines GC101, June 2010. nice.org.uk [online]
| Link |