 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
INTRODUCCIÓN
La esclerosis múltiple se caracteriza por una respuesta inmune, inflamación crónica y degeneración neurológica, así como ataques agudos a lo largo del desarrollo de la enfermedad. Se ha observado que en dichos ataques se genera una inflamación de la mielina aumentando el estrés oxidativo y con ello la generación de especies reactivas de oxígeno. Dichas sustancias ocasionan un daño en la estructura y composición de las células neuronales, resultando en apoptosis celular. La etiología de la esclerosis múltiple sigue siendo desconocida y los tratamientos suelen ser agresivos y muy costosos. Recientemente se han propuesto alternativas para el control de la patogénesis y los síntomas de la enfermedad, como la medicina alternativa complementaria. Éstas podrían ayudar al paciente a retrasar la progresión de la esclerosis múltiple y mejorar la supervivencia de los pacientes.
MÉTODOS
Se realizó una búsqueda bibliográfica en MEDLINE/PubMed, utilizando términos del MeSH, con las palabras clave: dieta, esclerosis múltiple y antioxidantes. Se seleccionaron los principales artículos sobre esclerosis múltiple y dieta.
RESULTADOS
Se analizaron tres estudios de casos y controles que evaluaron diferentes alternativas dietéticas. Además de cinco artículos más de tipo experimental, en los cuales se estudió en humanos y roedores la eficacia del ácido lipoico en casos como esclerosis múltiple, encefalomielitis autoinmune experimental y cáncer de mama. El antioxidante con mayor evidencia científica que promete una importante efectividad en el tratamiento de la esclerosis múltiple es el ácido lipoico.
La esclerosis múltiple es una enfermedad mediada por inmunidad, caracterizada por una inflamación crónica y degeneración neurológica, lo cual contribuye a la desmielinización del sistema nervioso central [1]. Este padecimiento es común en adultos jóvenes de 20 a 40 años de edad [2], siendo mayor su incidencia en mujeres [2],[3]. Las incidencias y prevalencias de la esclerosis múltiple son mayores en latitudes del norte y sur del Ecuador, reportándose una incidencia que va desde 80 hasta 300 casos por cada 100 000 habitantes, incrementando el riesgo de desarrollar este padecimiento en aéreas como Cerdeña (Italia), Noruega y Suecia [4]. Actualmente, en México los estudios epidemiológicos que permiten conocer con certeza la prevalencia e incidencia de la esclerosis múltiple son insuficientes. Sin embargo, para el año 2000 se identificó una incidencia de 1,6 casos por cada 100 000 habitantes [5],[6], convirtiendo a esta enfermedad en una de las principales causas de consulta neurológica.
La etiología de esta enfermedad sigue siendo desconocida en su totalidad. No obstante, se han llevado a cabo distintos estudios para comprender su desarrollo. La esclerosis múltiple se conoce como un padecimiento complejo de origen multifactorial, debido a la interacción de factores genéticos, inmunológicos y ambientales. Cada uno de estos factores desencadena diversas posibilidades de que un sujeto padezca esta enfermedad.
Con respecto a los factores genéticos, se han identificado diversos polimorfismos asociados al incremento de riesgo para desarrollar esclerosis múltiple, tales como histocompatibilidad del haplotipo DR2, DRB1*1501-DQA1*0102-DQB1*0602 [7]. Por otra parte, los factores inmunológicos se relacionan indirectamente con la presencia de un virus, entre ellos destacan los virus del sarampión, de la varicela zoster, de la encefalitis por garrapatas, del herpes 6 y de Epstein−Barr [8],[9],[10]. El factor ambiental, en particular el factor geográfico, se encuentra asociado al grado de exposición solar que a su vez se relaciona con la baja absorción de vitamina D. Tal es el caso de la región nórdica europea [11].
Autores como Kremenchutzky (1998) y Ebers (2005), han descrito la evolución de la esclerosis múltiple desde el inicio, cuando los síntomas son inespecíficos, hasta la evolución con etapas más definidas. Considerando la frecuencia, gravedad de los ataques, discapacidad y déficit neurológico, es que se ha propuesto una clasificación con cuatro tipos básicos de esclerosis múltiple:
El diagnóstico de esclerosis múltiple es complicado, debido a un amplio número de padecimientos que cursan con síntomas similares a esta enfermedad. Se han desarrollado un número de criterios formales para diagnosticar esclerosis múltiple que han sido históricamente útiles, teniendo en cuenta la gran variabilidad de esta enfermedad. Los nuevos criterios para el diagnóstico de esclerosis múltiple introducidos por el comité Mac Donald en 2001, incorporaron estudios de potenciales evocados y neuroimágenes, entre ellas la resonancia magnética y el análisis de bandas oligoclonales en líquido cefalorraquídeo [13],[14],[15]. La mayoría de los casos, entre un 85% y 90%, se diagnostican dentro del primer grupo de esclerosis múltiple con recaídas y remisiones, el cual se caracteriza por periodos clínicos de estabilidad, interrumpida por ataques agudos de la enfermedad, presentando un empeoramiento clínico. Aproximadamente el 50 % de los pacientes con esclerosis múltiple de este tipo, desencadena esclerosis múltiple secundaria progresiva, en donde la pérdida neurológica es más grave [16].
En los ataques agudos de la esclerosis múltiple se observa una mayor inflamación de la mielina, aumentado el estrés oxidativo y con ello la generación de especies reactivas de oxígeno (reactive oxygen species). Estas especies reactivas de oxígeno son las causantes de daño en la estructura y composición de las células neuronales, resultando en apoptosis celular [1].
Los tratamientos actuales para esclerosis múltiple se dividen en dos categorías: la primera, cuya intención es controlar el proceso de la enfermedad, y la segunda enfocada en el control de los síntomas. La primera categoría se basa en controlar la autoinmunidad, dado que esta es la patogénesis más importante en el desarrollo de la esclerosis múltiple, por lo que se da un tratamiento de inmunosupresores como interferones β (1α-1β), azatioprina, mitoxantrona, natalizumab y acetato de glatiramer. Para la segunda categoría se encuentran medicamentos como metilprednisolona. Ninguno de estos medicamentos detiene la aparición de las formas progresivas de la esclerosis múltiple, sólo retrasan la progresión de la misma y disminuyen los síntomas presentes en cada ataque que se presenta en el paciente. Sin embargo, tienen efectos secundarios y son costosos [3],[17].
Por otra parte, se piensa que la medicina alternativa y complementaria podría ayudar a retrasar la progresión de la esclerosis múltiple y mejorar la supervivencia en pacientes que padecen esta enfermedad [3]. Esta alternativa incluye distintos métodos, tales como acupuntura y uso de suplementos dietéticos, entre ellos antioxidantes y ácidos grasos omega 3 y 6. El uso de antioxidantes ha tenido un gran éxito en modelos animales. No obstante, hay poca evidencia de que los antioxidantes demuestren eficiencia en el tratamiento de la esclerosis múltiple. Resultados de estudios clínicos que evalúan la terapia potencial del ácido lipoico han indicado que este compuesto fue bien tolerado y redujo significativamente los niveles de dos compuestos asociados a la esclerosis múltiple: la molécula de adhesión intracelular 1 (ICAM-1) y la metaloproteinasa- 9 (MMP-9). En la Tabla I se muestra una serie de estudios que analizan el consumo de antioxidantes como tratamiento alternativo de la esclerosis múltiple.
Este trabajo consiste en una revisión de la literatura mediante una búsqueda de artículos indexados en las bases de datos MEDLINE/PubMed y SciELO. Su objetivo es evaluar el uso de antioxidantes como terapia dietética en pacientes con esclerosis múltiple.
La esclerosis múltiple es una enfermedad crónica inflamatoria desmielinizante del sistema nervioso central. Se cree que la patogénesis de este padecimiento implica una respuesta autoinmune, que resulta en una desmielinización multifocal con diferentes lesiones axonales [3]. El conjunto de la desmielinización con el daño axonal conlleva a la progresión de la enfermedad. Sin embargo, la progresión y aparición de la enfermedad se manifiesta de forma diferente en cada sujeto. Se sabe que la fisiopatología de la esclerosis múltiple puede presentarse en cuatro formas diferentes, las cuales consisten en:
En un ataque agudo de esclerosis múltiple, los linfocitos T cruzan la barrera sangre cerebro en el sistema nervioso central, provocando una inflamación que resulta en la producción de especies reactivas de oxígeno conocidas como radicales libres. Estas sustancias atacan a los oligodendrocitos, células que forman y mantienen la vaina de la mielina, la cual es una capa protectora que rodea a la neurona. El conjunto de los altos niveles de radicales libres y la baja concentración de antioxidantes produce la apoptosis celular que tiene como resultado el daño y/o la afectación de la conducción de los impulsos nerviosos [11],[12],[17].
La mitocondria es la principal fuente de producción de especies reactivas de oxígeno. Se estima que en general del 1 al 4% del oxígeno total se convierte en especies reactivas de oxígeno, resultado de la reducción del oxígeno para la formación de agua [18]. Las especies reactivas de oxígeno en combinación de electrones desapareados, se vuelven altamente reactivos. Cumplen un papel importante en la proliferación celular, apoptosis, angiogénesis, funciones endocrinas conexas y oxidativas. Cuando se inicia la reducción del oxígeno, se forma un radical conocido como superóxido, para la segunda reacción se produce el peróxido de hidrógeno para obtener finalmente el radical hidroxilo, este último radical se conoce como el más reactivo y dañino para las células. La oxidación de células inflamatorias, tales como macrófagos y microglias favorecen la producción de las especies reactivas de oxígeno mencionadas previamente. Por otra parte, el óxido nítrico y las citocinas pro-inflamatorias, también contribuyen a la neuroinflamación, desmielinización y daño axonal, incrementando la progresión de la enfermedad. Las especies reactivas de oxígeno incrementan la adherencia y migración de las células T a través de las células endoteliales cerebrales, provocando la aparición de ataques agudos propios de la enfermedad.
El sistema nervioso central es particularmente susceptible al estrés oxidativo ya que la tasa de utilización de oxígeno es alta, mientras que las concentraciones de enzimas antioxidantes son relativamente bajas. Además, los altos contenidos de lípidos poliinsaturados son más vulnerables a la oxidación, favoreciendo la producción de especies reactivas de oxígeno, con ello ocasionan severos daños en componentes celulares como proteínas, lípidos y en el ADN [19].
Se considera antioxidante a cualquier sustancia que en concentraciones normales posea una afinidad mayor que cualquier otra molécula para interaccionar con un radical libre. El antioxidante en presencia del radical libre, cede un electrón oxidándose y se transforma en un radical libre débil no tóxico. Los antioxidantes se clasifican como endógenos (se encuentran en el organismo y son sintetizados por sus células) y exógenos (ingresan a través de la dieta) [17]. Dadas las propiedades conocidas de dichas sustancias, se ha tenido un reciente e importante interés en investigar el efecto que pudieran brindar como una terapia dietética alternativa complementaria para los pacientes con esclerosis múltiple. Por lo que se describirá una revisión de algunos antioxidantes exógenos que se han estudiado para el tratamiento complementario en los pacientes con esclerosis múltiple (Tabla II).
Tabla II. Los antioxidantes como las terapias de la encefalomielitis autoinmune experimental (EAE).
El ácido lipoico es una pequeña molécula de ácido graso, cuyas fuentes exógenas han demostrado presentar propiedades antiinflamatorias y antioxidantes [20]. El ácido lipoico inhibe la producción de la molécula de adhesión celular vascular (VCAM)-1 y de la molécula de adhesión intercelular (ICAM)-1, atenúa al factor de necrosis tumoral (TNFα), e inhibe la activación de las células natural Killer (NK) y la citotoxicidad [21]. Se ha demostrado que el ácido lipoico suprime la encefalomielitis autoinmune experimental en ratones [22]. Aunque el cuerpo produce pequeñas cantidades de ácido lipoico naturalmente, existen fuentes exógenas presentes en los alimentos, como son las vísceras de animales (hígado, riñones, corazón) y en verduras como el brócoli y espinacas.
Se han realizado estudios para determinar las dosis orales máximas tolerables de ácido lipoico, las cuales se estiman desde 600 mg hasta 1200 mg. Con esta última prescripción, un individuo presentó una erupción alérgica y trombocitopenia leve, sintomatología que desapareció al eliminar la dosis de 1200 mg de ácido lipoico. Los efectos secundarios más comunes registrados fueron orina maloliente, náuseas y malestar gastrointestinal leve [20]. Por estas razones, sería importante realizar más estudios clínicos sobre la relación del ácido lipoico y las fases en la esclerosis múltiple.
Los flavonoides pertenecen a un grupo de al menos 4000 compuestos naturales entre los que se encuentran una amplia gama de alimentos que los contienen. No obstante, la cantidad de flavonoides varía en cada alimento, según se observa en la Tabla III.
Tabla III. Lista de alimentos con un importante contenido de flavonoides.
Existen seis diferentes subclases de flavonoides, que se conocen como flavonoles, flavonas, isoflavonas, flavononas, antocianinas y flavonoides [23]. Los efectos que producen en la salud dependen de la ingesta y biodisponibilidad que mantenga el individuo. Sin embargo, se ha observado que los flavonoides representan una importante fuente de antioxidantes en la dieta humana. Debido a su hidrofilicidad, los flavonoides son propensos a concentrarse en la interfaz entre las bicapas de fosfolipidos y citosol, donde pueden prevenir la peroxidación de lípidos [24]. Los flavonoides pueden prevenir el estrés oxidativo mediante un barrido directo de los radicales libres. De esta manera los flavonoides pueden oxidarse y formar un radical más estable y menos reactivo [25]. La luteolina y quercetina, que pertenecen al grupo de flavonoles y flavonas, previenen el estrés oxidativo. Otro beneficio que nos brindan los flavonoides es su capacidad de inhibir la actividad de la enzima iNOS [26]. Produciendo un menor daño en los ataques agudos característicos de la esclerosis múltiple.
La esclerosis múltiple es una enfermedad neurológica, del sistema nervioso central, con un componente de respuesta inmune importante, que afecta en general a adultos jóvenes. El tratamiento principalmente es inmunomodulador, para evitar o retrasar posibles exacerbaciones o nuevos ataques de desmielinización. En atención a que síntomas como dolor o depresión no son enfocados directamente, han surgido diversas alternativas de tratamientos complementarios que van desde la suplementación nutricional y dieta, hasta terapias somáticas de relajación (yoga, acupuntura) o electro estimulación. Con la aprobación como medicina alternativa del yoga por parte de la Organización Mundial de la Salud en 1978, su uso se incrementó a nivel mundial [27],[28],[29],[30].
La prevalencia de uso de medicina alternativa complementaria en pacientes con esclerosis múltiple, es importante. Diversos reportes muestran su aplicación frecuente en al menos la mitad de los pacientes. Por ejemplo, un estudio realizado en países europeos reportó que su uso varió desde 46% en Suecia hasta 60% en Islandia [31]. Los tratamientos de medicina alternativa complementaria más promisorios son el uso dieta baja en grasas, ingesta de ácidos grasos omega 3, consumo de ácido lipoico y suplementación con vitamina D. Éstos han permitido evidenciar sus propiedades antiinflamatorias y neuroprotectoras, incidiendo en la ocurrencia de brotes de la esclerosis múltiple [3],[32].
Por otra parte se ha documentado la frecuencia del uso de medicina alternativa complementaria, de acuerdo a características socioeconómicas. Su uso es más frecuente en mujeres, jóvenes (menores de 40 años) y personas con mayor nivel educativo (bachillerato y más) [33]. Aunque sus resultados o efectos sobre la enfermedad aún son controvertidos, algunos estudios han reportado diferencias significativas. Por ejemplo, con el uso de medicina alternativa complementaria y tratamientos convencionales se ha registrado menor porcentaje de efectos secundarios y mejoría en el estado de ánimo [35].
Aunque se conoce el potencial poder del uso de antioxidantes en diversas enfermedades, entre ellas la esclerosis múltiple, la evidencia científica para conocer la eficacia concreta de los antioxidantes en el desarrollo de personas con esclerosis múltiple es insuficiente. Sin embargo, se busca con este tipo de artículos que los centros de investigación implementen proyectos que permitan evaluar el efecto de diversos tipos de medicina alternativa complementaria, entre ellas los antioxidantes en la dieta, durante el proceso de la enfermedad.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del International Committee of Medical Journal Editors (ICMJE), traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del artículo, ni tener conflictos de intereses con la materia del artículo.

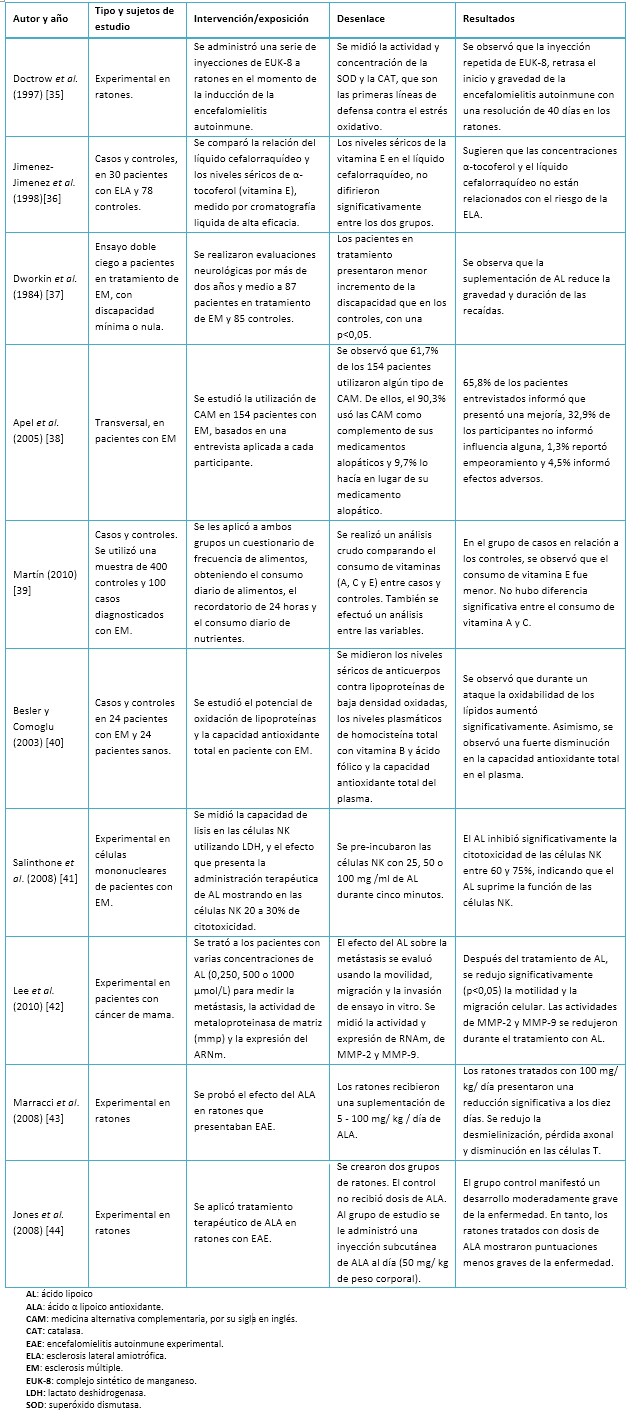 Tabla I. Se muestra una serie de estudios que analizan el consumo de antioxidantes como tratamiento alternativo de la esclerosis múltiple.
Tabla I. Se muestra una serie de estudios que analizan el consumo de antioxidantes como tratamiento alternativo de la esclerosis múltiple.

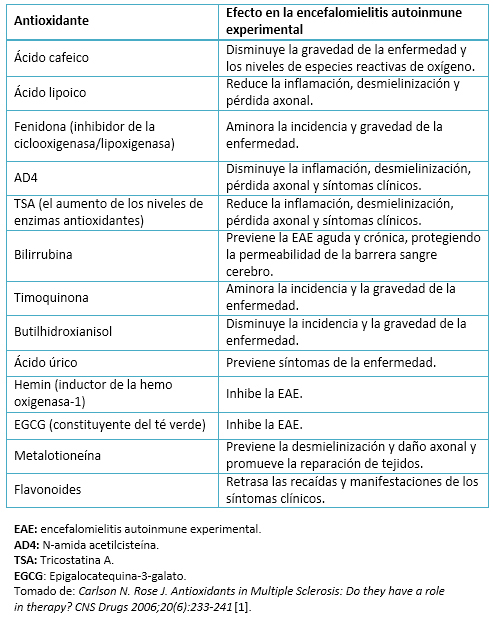 Tabla II. Los antioxidantes como las terapias de la encefalomielitis autoinmune experimental (EAE).
Tabla II. Los antioxidantes como las terapias de la encefalomielitis autoinmune experimental (EAE).

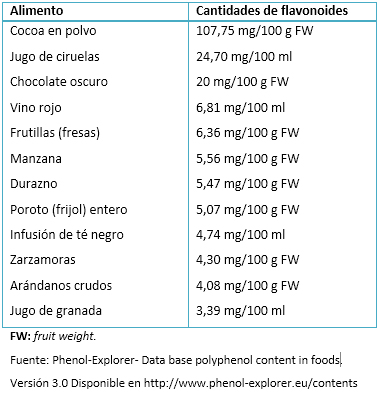 Tabla III. Lista de alimentos con un importante contenido de flavonoides.
Tabla III. Lista de alimentos con un importante contenido de flavonoides.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
Multiple sclerosis is an immune-mediated disease that produces chronic inflammation and neural degeneration. The disease progresses with acute attacks that result in myelin inflammation. This in turn increases oxidative stress and favors the appearance of reactive oxygen species. Reactive oxygen species damage neural cells causing apoptosis. The etiology of multiple sclerosis remains unknown and current therapy is aggressive and expensive. Recently, complementary and alternative medicine therapies have been proposed to control pathogenesis and symptoms of this disease. It is believed that these therapies help slow the progression of multiple sclerosis and improve survival.
METHODS
We conducted a MEDLINE/PubMed search using the following MeSH terms: diet, multiple sclerosis, antioxidants. We selected the main articles containing multiple sclerosis and diet.
RESULTS
We analyzed three case control studies that evaluated different dietary approaches in multiple sclerosis. For this review, we also included five experimental studies that studied the efficacy of lipoic acid in humans and rodents in diseases like multiple sclerosis, experimental autoimmune encephalomyelitis, and breast cancer.
 Autores:
Laura González-González[1], Jesús Giovanni Pérez-Cortéz[1], Mario Flores-Aldana[2], Nayeli Macías-Morales[2], Carlos Hernández-Girón[2]
Autores:
Laura González-González[1], Jesús Giovanni Pérez-Cortéz[1], Mario Flores-Aldana[2], Nayeli Macías-Morales[2], Carlos Hernández-Girón[2]

Citación: González-González L, Pérez-Cortéz JG, Flores-Aldana M, Macías-Morales N, Hernández-Girón C. Antioxidant use as dietary therapy in patients with multiple sclerosis. Medwave 2015 Ene;15(1):e6065 doi: 10.5867/medwave.2015.01.6065
Fecha de envío: 7/11/2014
Fecha de aceptación: 22/12/2014
Fecha de publicación: 9/1/2015
Origen: no solicitado
Tipo de revisión: con revisión por un par revisor externo, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Carlson NG, Rose JW. Antioxidants in multiple sclerosis: do they have a role in therapy? CNS Drugs. 2006;20(6):433-41.
| PubMed |
Carlson NG, Rose JW. Antioxidants in multiple sclerosis: do they have a role in therapy? CNS Drugs. 2006;20(6):433-41.
| PubMed | Habek M, Hojsak I, Brinar VV. Nutrition in multiple sclerosis. Clin Neurol Neurosurg. 2010 Sep;112(7):616-20. | CrossRef | PubMed |
Habek M, Hojsak I, Brinar VV. Nutrition in multiple sclerosis. Clin Neurol Neurosurg. 2010 Sep;112(7):616-20. | CrossRef | PubMed | Yadav V, Shinto L, Bourdette D. Complementary and alternative medicine for the treatment of multiple sclerosis. Expert Rev Clin Immunol. 2010 May;6(3):381-95. | CrossRef | PubMed |
Yadav V, Shinto L, Bourdette D. Complementary and alternative medicine for the treatment of multiple sclerosis. Expert Rev Clin Immunol. 2010 May;6(3):381-95. | CrossRef | PubMed | Poser CM. An atlas of multiple sclerosis. En: Multiple sclerosis. New York: Parthenon Publishing Group, 1998.
Poser CM. An atlas of multiple sclerosis. En: Multiple sclerosis. New York: Parthenon Publishing Group, 1998.  Gonzalez O, Sotelo J. Is the frequency of multiple sclerosis increasing in Mexico? J Neurol Neurosurg Psychiatry. 1995 Nov;59(5):528-30. | PubMed | Link |
Gonzalez O, Sotelo J. Is the frequency of multiple sclerosis increasing in Mexico? J Neurol Neurosurg Psychiatry. 1995 Nov;59(5):528-30. | PubMed | Link | Gonzalez O, Sotelo J. Is the frequency of multiple sclerosis increasing in Mexico? J Neurol Neurosurg Psychiatry. 1995 Nov;59(5):528-30. | PubMed | Link |
Gonzalez O, Sotelo J. Is the frequency of multiple sclerosis increasing in Mexico? J Neurol Neurosurg Psychiatry. 1995 Nov;59(5):528-30. | PubMed | Link | Porras-Betancourt M, Núñez-Orozco L, Plascencia-Álvarez NI, Quiñones-Aguilar S, Sauri-Suárez S. Esclerosis múltiple. Rev Mex Neuroci. 2007;8(1):57-66.
| Link |
Porras-Betancourt M, Núñez-Orozco L, Plascencia-Álvarez NI, Quiñones-Aguilar S, Sauri-Suárez S. Esclerosis múltiple. Rev Mex Neuroci. 2007;8(1):57-66.
| Link | Marrie RA, Wolfson C, Sturkenboom MC, Gout O, Heinzlef O, Roullet E, et al. Multiple sclerosis and antecedent infections: a case-control study. Neurology. 2000 Jun;54(12):2307-10.
| PubMed |
Marrie RA, Wolfson C, Sturkenboom MC, Gout O, Heinzlef O, Roullet E, et al. Multiple sclerosis and antecedent infections: a case-control study. Neurology. 2000 Jun;54(12):2307-10.
| PubMed | Ascherio A, Munger KL, Lennette ET, Spiegelman D, Hernán MA, Olek MJ, et al. Epstein-Barr virus antibodies and risk of multiple sclerosis: a prospective study. JAMA. 2001 Dec;286(24):3083-8. | CrossRef | PubMed |
Ascherio A, Munger KL, Lennette ET, Spiegelman D, Hernán MA, Olek MJ, et al. Epstein-Barr virus antibodies and risk of multiple sclerosis: a prospective study. JAMA. 2001 Dec;286(24):3083-8. | CrossRef | PubMed | Alvarez-Lafuente R, De las Heras V, Bartolomé M, Picazo JJ, Arroyo R. Relapsing-remitting multiple sclerosis and human herpesvirus 6 active infection. Arch Neurol. 2004 Oct;61(10):1523-7. | CrossRef | PubMed |
Alvarez-Lafuente R, De las Heras V, Bartolomé M, Picazo JJ, Arroyo R. Relapsing-remitting multiple sclerosis and human herpesvirus 6 active infection. Arch Neurol. 2004 Oct;61(10):1523-7. | CrossRef | PubMed | Namaka M, Crook A, Doupe A, Kler K, Vasconcelos M, Klowak M, et al. Examining the evidence: complementary adjunctive therapies for multiple sclerosis. Neurol Res. 2008 Sep;30(7):710-9. | CrossRef | PubMed |
Namaka M, Crook A, Doupe A, Kler K, Vasconcelos M, Klowak M, et al. Examining the evidence: complementary adjunctive therapies for multiple sclerosis. Neurol Res. 2008 Sep;30(7):710-9. | CrossRef | PubMed | Ebers GC. Prognostic factors for multiple sclerosis: the importance of natural history studies. J Neurol. 2005 Sep;252 Suppl 3:iii15-iii20. | PubMed |
Ebers GC. Prognostic factors for multiple sclerosis: the importance of natural history studies. J Neurol. 2005 Sep;252 Suppl 3:iii15-iii20. | PubMed | McAlpine D, Lumsden CE, Acheson ED. Multiple sclerosis: a reappraisal. Edinburgh: Livingstone, 1965.
McAlpine D, Lumsden CE, Acheson ED. Multiple sclerosis: a reappraisal. Edinburgh: Livingstone, 1965.  Poser CM, Paty DW, Scheinberg L, McDonald WI, Davis FA, Ebers GC, et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol. 1983 Mar;13(3):227-31. | PubMed |
Poser CM, Paty DW, Scheinberg L, McDonald WI, Davis FA, Ebers GC, et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol. 1983 Mar;13(3):227-31. | PubMed | Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria". Ann Neurol. 2005 Dec;58(6):840-6. | CrossRef | PubMed |
Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria". Ann Neurol. 2005 Dec;58(6):840-6. | CrossRef | PubMed | Payne A. Nutrition and diet in the clinical management of multiple sclerosis.J Hum Nutr Diet. 2001 Oct;14(5):349-57. | CrossRef | PubMed |
Payne A. Nutrition and diet in the clinical management of multiple sclerosis.J Hum Nutr Diet. 2001 Oct;14(5):349-57. | CrossRef | PubMed | Oxilia R. Estrés oxidativo y sistema de defensa antioxidante. R Rev Inst Med Trop. 2010;5(2):23-29 | Link |
Oxilia R. Estrés oxidativo y sistema de defensa antioxidante. R Rev Inst Med Trop. 2010;5(2):23-29 | Link | Mirshafiey A, Mohsenzadegan M. Antioxidant therapy in multiple sclerosis.
Immunopharmacol Immunotoxicol. 2009;31(1):13-29. | CrossRef | PubMed |
Mirshafiey A, Mohsenzadegan M. Antioxidant therapy in multiple sclerosis.
Immunopharmacol Immunotoxicol. 2009;31(1):13-29. | CrossRef | PubMed | Miller E, Walczak A, Saluk J, Ponczek MB, Majsterek I. Oxidative modification of patient's plasma proteins and its role in pathogenesis of multiple sclerosis. Clin Biochem. 2012 Jan;45(1-2):26-30. | CrossRef | PubMed |
Miller E, Walczak A, Saluk J, Ponczek MB, Majsterek I. Oxidative modification of patient's plasma proteins and its role in pathogenesis of multiple sclerosis. Clin Biochem. 2012 Jan;45(1-2):26-30. | CrossRef | PubMed | Yadav V, Marracci G, Lovera J, Woodward W, Bogardus K, Marquardt W, et al. Lipoic acid in multiple sclerosis: a pilot study. Mult Scler. 2005 Apr;11(2):159-65. | PubMed |
Yadav V, Marracci G, Lovera J, Woodward W, Bogardus K, Marquardt W, et al. Lipoic acid in multiple sclerosis: a pilot study. Mult Scler. 2005 Apr;11(2):159-65. | PubMed | Salinthone S, Yadav V, Schillace RV, Bourdette DN, Carr DW. Lipoic acid attenuates inflammation via cAMP and protein kinase A signaling. PLoS One. 2010 Sep;5(9). pii: e13058.
| CrossRef | PubMed |
Salinthone S, Yadav V, Schillace RV, Bourdette DN, Carr DW. Lipoic acid attenuates inflammation via cAMP and protein kinase A signaling. PLoS One. 2010 Sep;5(9). pii: e13058.
| CrossRef | PubMed | Marracci GH, Jones RE, McKeon GP, Bourdette DN. Alpha lipoic acid inhibits T cell migration into the spinal cord and suppresses and treats experimental autoimmune encephalomyelitis. J Neuroimmunol. 2002 Oct;131(1-2):104-14.
| CrossRef | PubMed |
Marracci GH, Jones RE, McKeon GP, Bourdette DN. Alpha lipoic acid inhibits T cell migration into the spinal cord and suppresses and treats experimental autoimmune encephalomyelitis. J Neuroimmunol. 2002 Oct;131(1-2):104-14.
| CrossRef | PubMed | Manach C, Scalbert A, Morand C, Rémésy C, Jiménez L. Polyphenols: food sources and bioavailability. Am J Clin Nutr. 2004 May;79(5):727-47. | PubMed | Link |
Manach C, Scalbert A, Morand C, Rémésy C, Jiménez L. Polyphenols: food sources and bioavailability. Am J Clin Nutr. 2004 May;79(5):727-47. | PubMed | Link | van Meeteren ME, Teunissen CE, Dijkstra CD, van Tol EA. Antioxidants and polyunsaturated fatty acids in multiple sclerosis. Eur J Clin Nutr. 2005 Dec;59(12):1347-61. | CrossRef | PubMed |
van Meeteren ME, Teunissen CE, Dijkstra CD, van Tol EA. Antioxidants and polyunsaturated fatty acids in multiple sclerosis. Eur J Clin Nutr. 2005 Dec;59(12):1347-61. | CrossRef | PubMed | van Meeteren ME, Hendriks JJ, Dijkstra CD, van Tol EA. Dietary compounds prevent oxidative damage and nitric oxide production by cells involved in demyelinating disease. Biochem Pharmacol. 2004 Mar 1;67(5):967-75. | PubMed |
van Meeteren ME, Hendriks JJ, Dijkstra CD, van Tol EA. Dietary compounds prevent oxidative damage and nitric oxide production by cells involved in demyelinating disease. Biochem Pharmacol. 2004 Mar 1;67(5):967-75. | PubMed | Kobuchi H, Virgili F, Packer L. Assay of inducible form of nitric oxide synthase activity: effect of flavonoids and plant extracts. Methods Enzymol. 1999;301:504-13. | PubMed |
Kobuchi H, Virgili F, Packer L. Assay of inducible form of nitric oxide synthase activity: effect of flavonoids and plant extracts. Methods Enzymol. 1999;301:504-13. | PubMed | Skovgaard L, Nicolajsen PH, Pedersen E, Kant M, Fredrikson S, Verhoef M, et al. Differences between users and non-users of complementary and alternative medicine among people with multiple sclerosis in Denmark: a comparison of descriptive characteristics. Scand J Public Health. 2013 Jul;41(5):492-9. | CrossRef | PubMed |
Skovgaard L, Nicolajsen PH, Pedersen E, Kant M, Fredrikson S, Verhoef M, et al. Differences between users and non-users of complementary and alternative medicine among people with multiple sclerosis in Denmark: a comparison of descriptive characteristics. Scand J Public Health. 2013 Jul;41(5):492-9. | CrossRef | PubMed | Mishra SK, Singh P, Bunch SJ, Zhang R. The therapeutic value of yoga in neurological disorders. Ann Indian Acad Neurol. 2012 Oct;15(4):247-54. | CrossRef | PubMed |
Mishra SK, Singh P, Bunch SJ, Zhang R. The therapeutic value of yoga in neurological disorders. Ann Indian Acad Neurol. 2012 Oct;15(4):247-54. | CrossRef | PubMed | Quispe-Cabanillas JG1, Damasceno A, von Glehn F, Brandão CO, Damasceno BP, Silveira WD, et al. Impact of electroacupuncture on quality of life for patients with Relapsing-Remitting Multiple Sclerosis under treatment with immunomodulators: a randomized study. BMC Complement Altern Med. 2012 Nov 5;12:209. | CrossRef | PubMed |
Quispe-Cabanillas JG1, Damasceno A, von Glehn F, Brandão CO, Damasceno BP, Silveira WD, et al. Impact of electroacupuncture on quality of life for patients with Relapsing-Remitting Multiple Sclerosis under treatment with immunomodulators: a randomized study. BMC Complement Altern Med. 2012 Nov 5;12:209. | CrossRef | PubMed | Stoll SS, Nieves C, Tabby DS, Schwartzman R. Use of therapies other than disease-modifying agents, including complementary and alternative medicine, by patients with multiple sclerosis: a survey study. J Am Osteopath Assoc. 2012 Jan;112(1):22-8. | PubMed |
Stoll SS, Nieves C, Tabby DS, Schwartzman R. Use of therapies other than disease-modifying agents, including complementary and alternative medicine, by patients with multiple sclerosis: a survey study. J Am Osteopath Assoc. 2012 Jan;112(1):22-8. | PubMed | Skovgaard L, Nicolajsen PH, Pedersen E, Kant M, Fredrikson S, Verhoef M, et al. Use of complementary and alternative medicine among people with multiple sclerosis in the nordic countries. Autoimmune Dis. 2012;2012:841085. | CrossRef | PubMed |
Skovgaard L, Nicolajsen PH, Pedersen E, Kant M, Fredrikson S, Verhoef M, et al. Use of complementary and alternative medicine among people with multiple sclerosis in the nordic countries. Autoimmune Dis. 2012;2012:841085. | CrossRef | PubMed | Schwarz S, Knorr C, Geiger H, Flachenecker P. Complementary and alternative medicine for multiple sclerosis. Mult Scler. 2008 Sep;14(8):1113-9. | CrossRef | PubMed |
Schwarz S, Knorr C, Geiger H, Flachenecker P. Complementary and alternative medicine for multiple sclerosis. Mult Scler. 2008 Sep;14(8):1113-9. | CrossRef | PubMed | Shinto L, Yadav V, Morris C, Lapidus JA, Senders A, Bourdette D. Demographic and health-related factors associated with complementary and alternative medicine (CAM) use in multiple sclerosis. Mult Scler. 2006 Feb;12(1):94-100. | CrossRef | PubMed |
Shinto L, Yadav V, Morris C, Lapidus JA, Senders A, Bourdette D. Demographic and health-related factors associated with complementary and alternative medicine (CAM) use in multiple sclerosis. Mult Scler. 2006 Feb;12(1):94-100. | CrossRef | PubMed | Bowling AC, Stewart TM. Current Complementary and Alternative Therapies for Multiple Sclerosis. Curr Treat Options Neurol. 2003 Jan;5(1):55-68. | PubMed |
Bowling AC, Stewart TM. Current Complementary and Alternative Therapies for Multiple Sclerosis. Curr Treat Options Neurol. 2003 Jan;5(1):55-68. | PubMed | Doctrow SR1, Huffman K, Marcus CB, Musleh W, Bruce A, Baudry M, et al. Salen-manganese complexes: combined superoxide dismutase/catalase mimics with broad pharmacological efficacy. Adv Pharmacol. 1997;38:247-69. | PubMed |
Doctrow SR1, Huffman K, Marcus CB, Musleh W, Bruce A, Baudry M, et al. Salen-manganese complexes: combined superoxide dismutase/catalase mimics with broad pharmacological efficacy. Adv Pharmacol. 1997;38:247-69. | PubMed | Jiménez-Jiménez FJ, de Bustos F, Molina JA, de Andrés C, Gasalla T, Ortí-Pareja M, et al. Cerebrospinal fluid levels of alpha-tocopherol in patients with multiple sclerosis. Neurosci Lett. 1998 Jun 12;249(1):65-7.
| CrossRef | PubMed |
Jiménez-Jiménez FJ, de Bustos F, Molina JA, de Andrés C, Gasalla T, Ortí-Pareja M, et al. Cerebrospinal fluid levels of alpha-tocopherol in patients with multiple sclerosis. Neurosci Lett. 1998 Jun 12;249(1):65-7.
| CrossRef | PubMed | Dworkin RH, Bates D, Millar JH, Paty DW. Linoleic acid and multiple sclerosis: a reanalysis of three double-blind trials. Neurology. 1984 Nov;34(11):1441-5. | PubMed |
Dworkin RH, Bates D, Millar JH, Paty DW. Linoleic acid and multiple sclerosis: a reanalysis of three double-blind trials. Neurology. 1984 Nov;34(11):1441-5. | PubMed | Apel A, Greim B, Zettl UK. How frequently do patients with multiple sclerosis use complementary and alternative medicine? Complement Ther Med. 2005 Dec;13(4):258-63.
| CrossRef | PubMed |
Apel A, Greim B, Zettl UK. How frequently do patients with multiple sclerosis use complementary and alternative medicine? Complement Ther Med. 2005 Dec;13(4):258-63.
| CrossRef | PubMed | Martín PA. Esclerosis Múltiple y hábitos alimentarios en Canarias. [Tesis de doctorado]. Facultad de medicina, Universidad de las Palmas de gran Canaria, España, 2010.
Martín PA. Esclerosis Múltiple y hábitos alimentarios en Canarias. [Tesis de doctorado]. Facultad de medicina, Universidad de las Palmas de gran Canaria, España, 2010.  Besler HT1, Comoğlu S. Lipoprotein oxidation, plasma total antioxidant capacity and homocysteine level in patients with multiple sclerosis. Nutr Neurosci. 2003 Jun;6(3):189-96. | CrossRef | PubMed |
Besler HT1, Comoğlu S. Lipoprotein oxidation, plasma total antioxidant capacity and homocysteine level in patients with multiple sclerosis. Nutr Neurosci. 2003 Jun;6(3):189-96. | CrossRef | PubMed | Salinthone S, Schillace RV, Marracci GH, Bourdette DN, Carr DW. Lipoic acid stimulates cAMP production via the EP2 and EP4 prostanoid receptors and inhibits IFN gamma synthesis and cellular cytotoxicity in NK cells. J Neuroimmunol. 2008 Aug;199(1-2):46-55. | CrossRef | PubMed |
Salinthone S, Schillace RV, Marracci GH, Bourdette DN, Carr DW. Lipoic acid stimulates cAMP production via the EP2 and EP4 prostanoid receptors and inhibits IFN gamma synthesis and cellular cytotoxicity in NK cells. J Neuroimmunol. 2008 Aug;199(1-2):46-55. | CrossRef | PubMed | Lee HS, Na MH, Kim WK. Alpha-Lipoic acid reduces matrix metalloproteinase activity in MDA-MB-231 human breast cancer cells. Nutr Res. 2010 Jun;30(6):403-9. | CrossRef | PubMed |
Lee HS, Na MH, Kim WK. Alpha-Lipoic acid reduces matrix metalloproteinase activity in MDA-MB-231 human breast cancer cells. Nutr Res. 2010 Jun;30(6):403-9. | CrossRef | PubMed |