 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: Helicobacter pylori, pediatría
Helicobacter pylori es una bacteria bacilo Gram negativo, microaerófilo, de forma helicoidal, curva o de u; puede presentar de dos a seis flagelos, y se caracteriza por ser catalasa, oxidasa y ureasa positivo.
Dentro de sus propiedades posee:
Historia
En un comienzo se creía que el Helicobacter pylori pertenecía a la familia de Campylobacter, primero llamándose Campylobacter pyloridis, y posteriormente Campylobacter pylori, y finalmente, cuando se demostró que no tenía características de esta familia, se le llamó Helicobacter pylori.
En 1893, Bizzozero descubre las bacterias en estómagos de perros y gatos, ya que anteriormente se creía que el estómago era una cavidad estéril. En 1906, Kreintz comunica hallazgos de estos microorganismos en enfermos de cáncer gástrico. En 1940, Freedberg y Barron detectan la presencia de estas bacterias en el 40% de las muestras de gastrectomías. A partir de 1975 se comienza a considerar seriamente una asociación entre bacterias espiriformes y patologías gástricas. En 1982, Robin Warren y Barry Marshall lo describen como el agente causal de gastritis y de ulcera péptica.
Epidemiología
La infección por Helicobacter pylori es la infección bacteriana crónica más frecuente en el mundo. Afecta a más del 50% de la población mundial, es adquirida a temprana edad, siendo en la mayoría de los casos asintomática, de los cuales aproximadamente el 20% desarrollará alguna complicación. Es tanta la población colonizada con Helicobacter pylori, que algunos lo describen como flora comensal del organismo.
Su prevalencia es baja en países desarrollados como Estados Unidos, describiéndose como inferior al 5% en menores de 5 años, y de un 10% en adolescentes. Pero en países en vías de desarrollo aumenta a 50% en menores de 5 años y a un 90% en adultos. En el caso de Chile se ha descrito que los niños a los 4 años están colonizados en un 40% y los adolescentes en un 60%.
Factores que afectan la prevalencia
Formas de transmisión
Transmisión Directa
Transmisión Indirecta
En un estudio realizado el año 1997 en Chile, se atribuye la infección a la ingesta de mariscos crudos, verduras, vegetales y agua de pozo.
Asociación de infección por Helicobacter pylori con enfermedades digestivas
Asociación con enfermedades extradigestivas
Diagnóstico
Métodos invasivos: los que más comúnmente se utilizan son las biopsias obtenidas por endoscopía digestiva alta, realizándole a la muestra obtenida cultivo, estudio histológico, test de ureasa y también se puede realizar PCR.
Un estudio3 muestra que en biopsias realizadas, la histopatología posee una sensibilidad de un 66 a un 100% y una especificidad de un 94 a un 100%. El test rápido de ureasa muestra entre un 75 y un 100% de sensibilidad, y un 100% de especificidad. El cultivo posee una sensibilidad del 55 al 96%, y una especificidad del 94 al 100%.
Métodos no invasivos: técnicas que se intentan realizar especialmente en pacientes pediátricos, ya que representan un menor riesgo para el paciente, aunque significan un mayor gasto económico.
Serología:
Test de ureasa en aire espirado.
La detección de Helicobacter pylori en deposiciones:
En otro estudio6 se demuestra que la serología de la IgG tiene una sensibilidad del 50 al 100%, lo cual es muy variable, y una especificidad del 70 al 98%. La IgA de un 24 a un 85% de sensibilidad y un 53 a un 98% de especificidad.
Tratamiento
No se ha encontrado la cura definitiva para tratar esta enfermedad, ya que presenta una alta tasa de resistencia antibiótica.
Los objetivos del tratamiento son: erradicar el microorganismo, curar el daño de la mucosa gástrica, prevenir la infección recurrente y la aparición de microorganismos resistentes.
Tipos de terapia:
Terapia Dual (Biterapia)
Se asocia un inhibidor de la bomba de protones, principalmente omeprazol, asociado a amoxicilina o claritromicina por 7 a 14 días. Este tipo de terapia ha demostrado una baja tasa de erradicación, con una alta tasa de resistencia antibiótica, específicamente a claritromicina.
Terapia Triple (Triterapia)
La más utilizada principalmente en Chile, en la cual se asocia un inhibidor de la bomba de protones con amoxicilina y claritromicina por 7 a 14 días.
Terapia Secuencial
También se ha descrito una terapia secuencial, en la que se usan los tres componentes anteriormente mencionados, pero los primeros cinco días se usa solamente el inhibidor de la bomba de protones en dos dosis diarias asociadas a amoxicilina, y en los cinco días posteriores se le agrega la claritromicina o tinidazol, completando un total de 10 días de tratamiento.
Terapia Cuádruple (Cuatriterapia)
En esta indicación, los tres compuestos anteriormente mencionados se asocian a salicilato de bismuto, completando 14 días de tratamiento.
Clasificación según línea de tratamiento
Primera línea: generalmente se escoge el inhibidor de la bomba de protones (omeprazol), asociado a claritromicina con una dosis de 15mg/kg/día cada 12 horas, y a amoxicilina con una dosis 50mg/kg/día cada 12 horas por 7 a 14 días. Lográndose así una erradicación del 87,8%.
Resistencia a Claritromicina: Cuando se ha demostrado una resistencia antibiótica muy alta a la claritromicina se puede utilizar metronidazol en su defecto, que también se podría utilizar en pacientes que sean alérgicos a la amoxicilina.
Terapia Secuencial: Anteriormente descrita, tiene una mayor tasa de erradicación (93,4%).
Segunda línea: Se utiliza cuando el tratamiento de primera línea ha fracasado. La tasa de erradicación depende según días de tratamiento, ya que si éste se realiza por 10 días la tasa de erradicación es de 76%, y al aumentar el tratamiento a 14 días, ésta aumenta a 95%.
Otro esquema de tratamiento de segunda línea descrito es la cuatriterapia (inhibidores de la bomba de protones, con salicilato de bismuto, tetraciclina y metronidazol).
Se ha descrito como esquema de tratamiento de segunda línea el levofloxacino, utilizado principalmente en adultos, y lo más probable es que se comience su utilización en niños.
Tercera línea: Utilizada en casos de no respuesta a los esquemas de tratamiento anteriormente mencionados. En la literatura se menciona como esquema de tratamiento de tercera línea: inhibidores de la bomba de protones, rifabutina (150 mg) y amoxicilina (1gc/12hrs) por 14 días. La tasa de erradicación de este esquema de tratamiento varía según si se utiliza como manejo de segunda o tercera línea, ya que en el primer caso es de 95%, y al utilizarla como tercera línea disminuye a 68%.
Erradicación:La erradicación se evalúa entre 6 semanas y tres meses después de terminado el tratamiento, realizando un nuevo test de ureasa, o examen de antígeno en deposiciones. La falla de erradicación se podría justificar por mala adherencia a tratamiento y resistencia antibiótica, que se ha descrito principalmente en claritromicina y metronidazol.
En distintas publicaciones, la tasa de erradicación en niños tratados con Triterapia es de 68 a 75%. En un estudio realizado en niños7 la tasa de erradicación encontrada fue de 94% con Triterapia y 82,5% con terapia secuencial, destacando que el tamaño muestral fue de 38 y 40 pacientes respectivamente.
Revisión bibliográfica sobre tratamiento de infección por Helicobacter Pylori
“Sequential Therapy or Triple Therapy for Helicobacter pylori Infection: Systematic Review and Meta-Analysis of Randomized Controlled Trials in Adults and Children”8: no se encontró diferencia estadística significativa entre la eficacia de ambos tratamientos en niños.
“Empiric quadruple vs. triple therapy for primary treatment of Helicobacter pylori infection: Systematic review and meta-analysis of efficacy and tolerability”9: no encontró evidencia estadísticamente significativa entre ambos esquemas de tratamiento.
Probióticos
Existen diversos estudios que refieren el uso de probióticos como útiles en el tratamiento y erradicación del Helicobacter pylori, en pacientes infectados. Existen distintos tipos de probióticos, dentro de los cuales Lactobacillus reuteries es el más estudiado respecto a este tema. El mecanismo de acción de probióticos propuesto para justificar su uso en infecciones por Helicobacter pylori incluye:
Estudios sobre el uso de probióticos en infección por Helicobacter pylori:
Estudios sobre el uso de probióticos en infección por Helicobacter pylori:
“Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial”10: respecto a la tasa de erradicación no se encontró diferencia significativa entre ambos grupos (85% [95%CI: 68-100] terapia asociada a probióticos y 95% [95%CI:61-99] grupo control); en cambio se observó mayor mejoría sintomática en el grupo caso, por ejemplo, la presencia de dolor abdominal se observó en 15% de los pacientes tratados con probióticos y 45% grupo Control (p<0,04); no se observó distensión abdominal en pacientes tratados con probióticos, en cambio el 15% del grupo control presentó esta molestia (p<0,02), alteraciones del tránsito intestinal observadas en el 15% del primer grupo y 35% del caso control (p<0,04); Halitosis se detectó en 5% y 35% respectivamente (p<0,04).
“Helicobacter pylori and probiotics”11: en la revisión de tres estudios se evidenció la disminución de los síntomas de gastritis activa en pacientes tratados con probióticos.
“Role of Probiotics in Pediatric Patients with Helicobacter pylori Infection: A Comprehensive Review of the Literature”12: se evalúa la asociación de distintos probióticos a la Triterapia, describiendo que el uso de Saccharomyces boulardi (con mayor disponiblilidad en Chile) asociado al tratamiento convencional muestra una tasa de erradicación de 93,7%, comparado con un 80,91% de los pacientes del grupo control.
“Meta-analysis: the effects of Saccharomyces boulardii on the eradication rate and side effects to medications for the treatment of Helicobacter pylori infection”13: no se encontró evidencia significativa entre ambos grupos respecto a la tasa de erradicación.
Estudios sobre uso de Levofloxacino en tratamiento para la infección por Helicobacter pylori, en adultos: no muestra mayor eficacia en la tasa de erradicación al compararlo con cuatriterapia o al utilizarlo en lugar de claritromicina en la Triterapia.
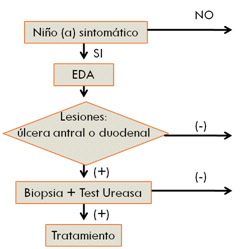 |
| Figura 1: Diagrama Esquema de estudio y manejo |
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Autor:
Carmen Cofré Navarro[1]
Autor:
Carmen Cofré Navarro[1]

Citación: Cofré C. An update on Helicobacter pylori in pediatrics. Medwave 2011 Jul;11(07):e5056 doi: 10.5867/medwave.2011.07.5056
Fecha de envío: 16/4/2011
Fecha de aceptación: 16/5/2011
Fecha de publicación: 1/7/2011
Origen: solicitado
Tipo de revisión: con revisión editorial interna

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Vera JF, Gotteland M, Chavez E, Vial MT, Kakarieka E, Brunser O. Sucrose permeability in children with gastric damage and Helicobacter pylori infection. J Pediatr Gastroenterol Nutr. 1997 May;24(5):506-11. | CrossRef | PubMed |
Vera JF, Gotteland M, Chavez E, Vial MT, Kakarieka E, Brunser O. Sucrose permeability in children with gastric damage and Helicobacter pylori infection. J Pediatr Gastroenterol Nutr. 1997 May;24(5):506-11. | CrossRef | PubMed | Harris PR, Godoy A, Arenillas S, Riera F, García D, Einisman H, Peña A, Rollán A, Duarte I, Guiraldes E, Perez-Perez G. CagA antibodies as a marker of virulence in chilean patients with Helicobacter pylori infection. J Pediatr Gastroenterol Nutr. 2003 Nov;37(5):596-602. | CrossRef | PubMed |
Harris PR, Godoy A, Arenillas S, Riera F, García D, Einisman H, Peña A, Rollán A, Duarte I, Guiraldes E, Perez-Perez G. CagA antibodies as a marker of virulence in chilean patients with Helicobacter pylori infection. J Pediatr Gastroenterol Nutr. 2003 Nov;37(5):596-602. | CrossRef | PubMed | Guarner J, Kalach N, Elitsur Y, Koletzko S. Helicobacter pylori diagnostic tests in children: review of the literature from 1999 to 2009. Eur J Pediatr. 2010 Jan;169(1):15-25. Epub 2009 Jul 18. | CrossRef | PubMed |
Guarner J, Kalach N, Elitsur Y, Koletzko S. Helicobacter pylori diagnostic tests in children: review of the literature from 1999 to 2009. Eur J Pediatr. 2010 Jan;169(1):15-25. Epub 2009 Jul 18. | CrossRef | PubMed | González F CG, Serrano H C, Harris PR. [Diagnosis of Helicobacter pylori infection in children based on stool antigen test]. Rev Med Chil. 2007 Feb;135(2):182-8. Epub 2007 Mar 28. | PubMed |
González F CG, Serrano H C, Harris PR. [Diagnosis of Helicobacter pylori infection in children based on stool antigen test]. Rev Med Chil. 2007 Feb;135(2):182-8. Epub 2007 Mar 28. | PubMed | Falsafi T, Favaedi R, Mahjoub F, Najafi M. Application of stool-PCR test for diagnosis of Helicobacter pylori infection in children. World J Gastroenterol. 2009 Jan 28;15(4):484-8. | CrossRef | PubMed | PMC |
Falsafi T, Favaedi R, Mahjoub F, Najafi M. Application of stool-PCR test for diagnosis of Helicobacter pylori infection in children. World J Gastroenterol. 2009 Jan 28;15(4):484-8. | CrossRef | PubMed | PMC | Rosenberg JJ. Helicobacter pylori. Pediatr Rev. 2010 Feb;31(2):85-6; discussion 86. | CrossRef | PubMed |
Rosenberg JJ. Helicobacter pylori. Pediatr Rev. 2010 Feb;31(2):85-6; discussion 86. | CrossRef | PubMed | Zullo A, De Francesco V, Hassan C, Morini S, Vaira D. The sequential therapy regimen for Helicobacter pylori eradication: a pooled-data analysis. Gut. 2007 Oct;56(10):1353-7. Epub 2007 Jun 12. | CrossRef | PubMed | PMC |
Zullo A, De Francesco V, Hassan C, Morini S, Vaira D. The sequential therapy regimen for Helicobacter pylori eradication: a pooled-data analysis. Gut. 2007 Oct;56(10):1353-7. Epub 2007 Jun 12. | CrossRef | PubMed | PMC | Gatta L, Vakil N, Leandro G, Di Mario F, Vaira D. Sequential therapy or triple therapy for Helicobacter pylori infection: systematic review and meta-analysis of randomized controlled trials in adults and children. Am J Gastroenterol. 2009 Dec;104(12):3069-79; quiz 1080. Epub 2009 Oct 20. | CrossRef | PubMed |
Gatta L, Vakil N, Leandro G, Di Mario F, Vaira D. Sequential therapy or triple therapy for Helicobacter pylori infection: systematic review and meta-analysis of randomized controlled trials in adults and children. Am J Gastroenterol. 2009 Dec;104(12):3069-79; quiz 1080. Epub 2009 Oct 20. | CrossRef | PubMed | Luther J, Higgins PD, Schoenfeld PS, Moayyedi P, Vakil N, Chey WD. Empiric quadruple vs. triple therapy for primary treatment of Helicobacter pylori infection: Systematic review and meta-analysis of efficacy and tolerability. Am J Gastroenterol. 2010 Jan;105(1):65-73. Epub 2009 Sep 15. | CrossRef | PubMed |
Luther J, Higgins PD, Schoenfeld PS, Moayyedi P, Vakil N, Chey WD. Empiric quadruple vs. triple therapy for primary treatment of Helicobacter pylori infection: Systematic review and meta-analysis of efficacy and tolerability. Am J Gastroenterol. 2010 Jan;105(1):65-73. Epub 2009 Sep 15. | CrossRef | PubMed | Lionetti E, Miniello VL, Castellaneta SP, Magistá AM, de Canio A, Maurogiovanni G, Ierardi E, Cavallo L, Francavilla R. Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial. Aliment Pharmacol Ther. 2006 Nov 15;24(10):1461-8. Epub 2006 Oct 10. | CrossRef | PubMed |
Lionetti E, Miniello VL, Castellaneta SP, Magistá AM, de Canio A, Maurogiovanni G, Ierardi E, Cavallo L, Francavilla R. Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial. Aliment Pharmacol Ther. 2006 Nov 15;24(10):1461-8. Epub 2006 Oct 10. | CrossRef | PubMed | Lesbros-Pantoflickova D, Corthésy-Theulaz I, Blum AL. Helicobacter pylori and probiotics. J Nutr. 2007 Mar;137(3 Suppl 2):812S-8S. | PubMed |
Lesbros-Pantoflickova D, Corthésy-Theulaz I, Blum AL. Helicobacter pylori and probiotics. J Nutr. 2007 Mar;137(3 Suppl 2):812S-8S. | PubMed | Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr;15(2):79-87. | CrossRef | PubMed |
Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr;15(2):79-87. | CrossRef | PubMed | Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment. Aliment Pharmacol Ther. 2010 Nov;32(9):1069-79. doi: 10.1111/j.1365-2036.2010.04457.x. Epub 2010 Sep 16. | CrossRef | PubMed |
Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment. Aliment Pharmacol Ther. 2010 Nov;32(9):1069-79. doi: 10.1111/j.1365-2036.2010.04457.x. Epub 2010 Sep 16. | CrossRef | PubMed | Baggett HC, Parkinson AJ, Muth PT, Gold BD, Gessner BD. Endemic iron deficiency associated with Helicobacter pylori infection among school-aged children in Alaska. Pediatrics. 2006 Mar;117(3):e396-404. Epub 2006 Feb 1. | CrossRef | PubMed |
Baggett HC, Parkinson AJ, Muth PT, Gold BD, Gessner BD. Endemic iron deficiency associated with Helicobacter pylori infection among school-aged children in Alaska. Pediatrics. 2006 Mar;117(3):e396-404. Epub 2006 Feb 1. | CrossRef | PubMed | Windle HJ, Kelleher D, Crabtree JE. Childhood Helicobacter pylori infection and growth impairment in developing countries: a vicious cycle? Pediatrics. 2007 Mar;119(3):e754-9. Epub 2007 Feb 26. | CrossRef | PubMed |
Windle HJ, Kelleher D, Crabtree JE. Childhood Helicobacter pylori infection and growth impairment in developing countries: a vicious cycle? Pediatrics. 2007 Mar;119(3):e754-9. Epub 2007 Feb 26. | CrossRef | PubMed | Roma E, Panayiotou J, Pachoula J, Kafritsa Y, Constantinidou C, Mentis A, Syriopoulou V. Intrafamilial spread of Helicobacter pylori infection in Greece. J Clin Gastroenterol. 2009 Sep;43(8):711-5. | CrossRef | PubMed |
Roma E, Panayiotou J, Pachoula J, Kafritsa Y, Constantinidou C, Mentis A, Syriopoulou V. Intrafamilial spread of Helicobacter pylori infection in Greece. J Clin Gastroenterol. 2009 Sep;43(8):711-5. | CrossRef | PubMed | Khurana R, Fischbach L, Chiba N, VAN Zanten SV, Sherman PM, George BA, Goodman KJ, Gold BD. Meta-analysis: Helicobacter pylori eradication treatment efficacy in children. Aliment Pharmacol Ther. 2007 Mar 1;25(5):523-36. | CrossRef | PubMed |
Khurana R, Fischbach L, Chiba N, VAN Zanten SV, Sherman PM, George BA, Goodman KJ, Gold BD. Meta-analysis: Helicobacter pylori eradication treatment efficacy in children. Aliment Pharmacol Ther. 2007 Mar 1;25(5):523-36. | CrossRef | PubMed | Frenck RW Jr, Fathy HM, Sherif M, Mohran Z, El Mohammedy H, Francis W, Rockabrand D, Mounir BI, Rozmajzl P, Frierson HF. Sensitivity and specificity of various tests for the diagnosis of Helicobacter pylori in Egyptian children. Pediatrics. 2006 Oct;118(4):e1195-202. Epub 2006 Sep 18. | CrossRef | PubMed |
Frenck RW Jr, Fathy HM, Sherif M, Mohran Z, El Mohammedy H, Francis W, Rockabrand D, Mounir BI, Rozmajzl P, Frierson HF. Sensitivity and specificity of various tests for the diagnosis of Helicobacter pylori in Egyptian children. Pediatrics. 2006 Oct;118(4):e1195-202. Epub 2006 Sep 18. | CrossRef | PubMed | Gisbert JP. "Rescue" regimens after Helicobacter pylori treatment failure. World J Gastroenterol. 2008 Sep 21;14(35):5385-402. | CrossRef | PubMed | PMC |
Gisbert JP. "Rescue" regimens after Helicobacter pylori treatment failure. World J Gastroenterol. 2008 Sep 21;14(35):5385-402. | CrossRef | PubMed | PMC | Janssen MJ, Laheij RJ, de Boer WA, Jansen JB. Meta-analysis: the influence of pre-treatment with a proton pump inhibitor on Helicobacter pylori eradication. Aliment Pharmacol Ther. 2005 Feb 15;21(4):341-5. | CrossRef | PubMed |
Janssen MJ, Laheij RJ, de Boer WA, Jansen JB. Meta-analysis: the influence of pre-treatment with a proton pump inhibitor on Helicobacter pylori eradication. Aliment Pharmacol Ther. 2005 Feb 15;21(4):341-5. | CrossRef | PubMed | Kindermann A, Lopes AI. Helicobacter pylori infection in pediatrics. Helicobacter. 2009 Sep;14 Suppl 1:52-7. | CrossRef | PubMed |
Kindermann A, Lopes AI. Helicobacter pylori infection in pediatrics. Helicobacter. 2009 Sep;14 Suppl 1:52-7. | CrossRef | PubMed | Braden B, Posselt HG, Ahrens P, Kitz R, Dietrich CF, Caspary WF. New immunoassay in stool provides an accurate noninvasive diagnostic method for Helicobacter pylori screening in children. Pediatrics. 2000 Jul;106(1 Pt 1):115-7. | CrossRef | PubMed |
Braden B, Posselt HG, Ahrens P, Kitz R, Dietrich CF, Caspary WF. New immunoassay in stool provides an accurate noninvasive diagnostic method for Helicobacter pylori screening in children. Pediatrics. 2000 Jul;106(1 Pt 1):115-7. | CrossRef | PubMed | O'Connor A, Gisbert J, O'Morain C. Treatment of Helicobacter pylori infection. Helicobacter. 2009 Sep;14 Suppl 1:46-51. | CrossRef | PubMed |
O'Connor A, Gisbert J, O'Morain C. Treatment of Helicobacter pylori infection. Helicobacter. 2009 Sep;14 Suppl 1:46-51. | CrossRef | PubMed | Harris PR, Godoy A, Arenillas S, Riera F, García D, Einisman H, Peña A, Rollán A, Duarte I, Guiraldes E, Perez-Perez G. CagA antibodies as a marker of virulence in chilean patients with Helicobacter pylori infection. J Pediatr Gastroenterol Nutr. 2003 Nov;37(5):596-602. | CrossRef | PubMed |
Harris PR, Godoy A, Arenillas S, Riera F, García D, Einisman H, Peña A, Rollán A, Duarte I, Guiraldes E, Perez-Perez G. CagA antibodies as a marker of virulence in chilean patients with Helicobacter pylori infection. J Pediatr Gastroenterol Nutr. 2003 Nov;37(5):596-602. | CrossRef | PubMed | Qu XH, Huang XL, Xiong P, Zhu CY, Huang YL, Lu LG, Sun X, Rong L, Zhong L, Sun DY, Lin H, Cai MC, Chen ZW, Hu B, Wu LM, Jiang YB, Yan WL. Does Helicobacter pylori infection play a role in iron deficiency anemia? A meta-analysis. World J Gastroenterol. 2010 Feb 21;16(7):886-96. | PubMed | PMC |
Qu XH, Huang XL, Xiong P, Zhu CY, Huang YL, Lu LG, Sun X, Rong L, Zhong L, Sun DY, Lin H, Cai MC, Chen ZW, Hu B, Wu LM, Jiang YB, Yan WL. Does Helicobacter pylori infection play a role in iron deficiency anemia? A meta-analysis. World J Gastroenterol. 2010 Feb 21;16(7):886-96. | PubMed | PMC | Pacifico L, Anania C, Osborn JF, Ferraro F, Chiesa C. Consequences of Helicobacter pylori infection in children. World J Gastroenterol. 2010 Nov 7;16(41):5181-94. | CrossRef | PubMed | PMC |
Pacifico L, Anania C, Osborn JF, Ferraro F, Chiesa C. Consequences of Helicobacter pylori infection in children. World J Gastroenterol. 2010 Nov 7;16(41):5181-94. | CrossRef | PubMed | PMC | Amjad N, Osman HA, Razak NA, Kassian J, Din J, bin Abdullah N. Clinical significance of Helicobacter pylori cagA and iceA genotype status. World J Gastroenterol. 2010 Sep 21;16(35):4443-7. | CrossRef | PubMed | PMC |
Amjad N, Osman HA, Razak NA, Kassian J, Din J, bin Abdullah N. Clinical significance of Helicobacter pylori cagA and iceA genotype status. World J Gastroenterol. 2010 Sep 21;16(35):4443-7. | CrossRef | PubMed | PMC | Lionetti E, Miniello VL, Castellaneta SP, Magistá AM, de Canio A, Maurogiovanni G, Ierardi E, Cavallo L, Francavilla R. Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial. Aliment Pharmacol Ther. 2006 Nov 15;24(10):1461-8. Epub 2006 Oct 10. | CrossRef | PubMed |
Lionetti E, Miniello VL, Castellaneta SP, Magistá AM, de Canio A, Maurogiovanni G, Ierardi E, Cavallo L, Francavilla R. Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial. Aliment Pharmacol Ther. 2006 Nov 15;24(10):1461-8. Epub 2006 Oct 10. | CrossRef | PubMed | Castro-Fernández M, Lamas E, Pérez-Pastor A, Pabón M, Aparcero R, Vargas-Romero J, Larraona JL, Romero-Gómez M. Efficacy of triple therapy with a proton pump inhibitor, levofloxacin, and amoxicillin as first-line treatment to eradicate Helicobacter pylori. Rev Esp Enferm Dig. 2009 Jun;101(6):395-8, 399-402. | PubMed |
Castro-Fernández M, Lamas E, Pérez-Pastor A, Pabón M, Aparcero R, Vargas-Romero J, Larraona JL, Romero-Gómez M. Efficacy of triple therapy with a proton pump inhibitor, levofloxacin, and amoxicillin as first-line treatment to eradicate Helicobacter pylori. Rev Esp Enferm Dig. 2009 Jun;101(6):395-8, 399-402. | PubMed |