 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Las enfermedades cardíacas y renales coexisten con frecuencia. Las dos patologías comparten mecanismos patogénicos comunes, son de difícil manejo y conllevan un alto costo por las frecuentes hospitalizaciones y algunos procedimientos no habituales requeridos, y además tienen un efecto significativo sobre la morbimortalidad. Por esta razón, se ha definido la existencia de un síndrome cardio-renal, en el que ambos órganos están comprometidos, y en el que la interacción entre ellos es bidireccional. En este artículo se describen los cinco tipos en que se clasifica este síndrome, con la explicación de sus distintas características, y se analizan diversas posibilidades de terapia para estos casos, en base a estudios y experiencias documentadas, resaltando riesgos y ventajas de cada una de ellas.
No existe aún una definición muy clara del síndrome cardio-renal, lo cual sería importante para determinar la epidemiología, el diagnóstico precoz, las estrategias terapéuticas y preventivas, así como la realización de investigaciones científicas.
Una de las primeras definiciones conceptuales del síndrome cardio-renal fue realizado por un grupo de trabajo en Estados Unidos en el año 2004: “cuando la terapia para aliviar los síntomas congestivos de la insuficiencia cardíaca está limitada por el desarrollo de deterioro de la función renal” 1.
La definición más considerada en la actualidad es la del consenso de la Iniciativa de Calidad de Diálisis Aguda (ADQI, Acute Dialysis Quality Initiative) que lo ha definido como: “los trastornos del corazón y de los riñones donde la disfunción aguda o crónica de un órgano puede inducir disfunción aguda o crónica del otro” 2 4 38. Esta definición tiene tres características: la primera es que tienen importancia similar los dos órganos, ya que muchas veces no queda claro dónde se produjo la injuria inicial; la segunda, es que esta disfunción puede ser aguda o crónica y también puede ser funcional o estructural; y la tercera recalca el hecho de que la interacción es bidireccional.
Este síndrome se presenta generalmente en pacientes que sufren insuficiencia cardíaca, por lo que se les indica tratamiento con diuréticos o inhibidores de la enzima convertidora de angiotensina, mejorando su capacidad desde el punto de vista cardíaco, pero deteriorando su función renal. Para mejorar la función renal se procede a liberar al paciente del consumo de sal y a disminuir las dosis de diuréticos, con lo cual la función renal se recupera parcialmente, pero con el costo del deterioro de la capacidad funcional. Este es un círculo difícil de manejar y muchas veces se deberá aceptar un discreto estado congestivo y cierto deterioro de la función renal.
Como parte de la definición, debe existir una interrelación bidireccional entre la insuficiencia cardíaca y la enfermedad renal crónica3. Estos son conocidos como “conectores cardio-renales”, y son principalmente el sistema renina-angiotensina-aldosterona, el sistema nervioso simpático, la inflamación, el óxido nítrico, la oxidación por radicales libres y la anemia (Figura 1).
De acuerdo a la ADQI, el síndrome cardio-renal se clasifica en cinco tipos.
Los dos primeros son cardíacos y los dos segundos son renales. En ocasiones puede ser difícil establecer la diferencia, principalmente entre los tipos 2 y 4, en los que no se conoce si el evento primario fue cardíaco y posteriormente se comprometió la función renal o viceversa.
El tipo 1 se refiere a un deterioro agudo de la función cardíaca que lleva a disfunción renal. Por lo general son insuficiencias cardíacas agudas -miocarditis o infartos- que después desarrollan insuficiencia cardíaca aguda.
El tipo 2 consiste en anomalías crónicas de la función cardíaca, es decir una insuficiencia cardíaca crónica que lleva a disfunción renal.
En el tipo 3 o síndrome reno-cardíaco agudo, se asume que el evento primario es el daño renal y que este deterioro agudo, generalmente una insuficiencia renal aguda, lleva a insuficiencia cardíaca.
El tipo 4, el síndrome reno-cardíaco crónico, presenta anormalidades crónicas de la función renal que llevan posteriormente a disfunción cardíaca. Por lo general es difícil diferenciar del tipo 2, síndrome cardio-renal crónico.
Se agregó un quinto tipo que corresponde al síndrome cardio-renal secundario, en el que simultáneamente se afectan los dos órganos. Esto se presenta por lo general en enfermedades sistémicas como sepsis, vasculitis o amiloidosis, en las cuales la enfermedad tiene mecanismos que llevan a disfunción simultánea de los órganos.
A continuación, se procederá a explicar y describir cada uno de estos tipos en que se clasifica el síndrome cardio-renal.
Tipo 1: síndrome cardio-renal agudo
En Estados Unidos hay un millón de hospitalizaciones anuales por insuficiencia cardíaca descompensada, y alrededor de siete millones de pacientes sufren insuficiencia cardíaca, convirtiéndola en una patología muy frecuente.
En este caso las causas más frecuentes son la insuficiencia cardíaca aguda descompensada, los síndromes coronarios agudos, el shock cardiogénico y el síndrome de hipodébito posterior a cirugía cardíaca. Estos pacientes tienen entre 30 y 40% de riesgo de desarrollar injuria renal aguda (insuficiencia renal aguda). En el 90% de los casos la injuria se produce durante la primera semana de hospitalización. Esto se asocia a un aumento de la morbimortalidad, un incremento de los costos, de la estadía hospitalaria y mayores tasas de rehospitalización.
En la fisiopatología de la enfermedad cardíaca aguda se producen dos tipos de daños: uno mediado hemodinámicamente y otro que es mediado humoralmente. El hemodinámico se relaciona principalmente a hipodébito, aunque también influye el aumento de la presión venosa con la consiguiente congestión visceral, llevando finalmente a isquemia renal. Los mediados humorales son el sistema renina-angiotensina-aldosterona, algunos factores natriuréticos, la activación simpática y el daño mediado por citoquinas.
Existen biomarcadores precoces de insuficiencia renal aguda que deben ser evaluados en este grupo de pacientes. Específicamente, los pacientes que presentan aumento en los niveles del biomarcador NGAL tienen un mayor riesgo de desarrollar insuficiencia renal aguda cuando sufren insuficiencia cardiaca5.
Hay un porcentaje de pacientes que tienen débito cardíaco normal, en quienes juega un rol importante la congestión renal, es decir, el aumento de las presiones venosas centrales6.
En el año 2009, un estudio con 2.500 pacientes que fueron sometidos a cateterización derecha por diferentes etiologías, mostró que la mayoría de los pacientes tienen presiones venosas centrales (PVC) dentro de rangos relativamente normales, pero un porcentaje de ellos tiene PVC mayor. Los que tienen PVC mayor son los pacientes con deterioro de la función renal. Existe una relación difícil de definir si es patogénica o no. En el seguimiento durante más de 10 años se evidenció una relación clara de la PVC con la sobrevida; los pacientes que presentaban PVC normal en el monitoreo hemodinámico inicial tuvieron una mayor sobrevida que los que tenían PVC elevada. Esto indica que si bien es importante tener en cuenta el débito, también se debe tener en cuenta la hipervolemia7.
Otro estudio del año 2009 demostró también que el riesgo de deterioro de la función renal va aumentando a medida que la PVC se va incrementando8. Los pacientes que tenían PVC baja presentaban mejor función renal basal. Con relación al índice cardíaco se puso en evidencia que el grupo de pacientes con índice cardíaco normal tenía mayor deterioro de la función renal, lo que significa que probablemente la congestión y la PVC siguen teniendo importancia en este tipo de pacientes. La curva ROC mostró que el índice cardíaco es mal predictor, mientras que la PVC tiene una mejor área bajo la curva para predecir el deterioro de la función renal.
Durante un episodio de insuficiencia cardíaca aguda descompensada, algunos pacientes presentan deterioro de la función renal. En algunos de ellos este deterioro es transitorio y por lo general a los 30 días han vuelto a la normalidad, pero hay un grupo de pacientes que persiste con disfunción renal y esto tiene implicaciones en el pronóstico. Es conocido que los pacientes con deterioro agudo de la función renal, pero que se recuperan al compensar la insuficiencia cardíaca, tienen una sobrevida equivalente a la de los pacientes que no presentaron falla renal. Mientras que en los pacientes que persisten con una disfunción renal existe una clara diferencia de sobrevida, es decir que los pacientes con síndrome cardio-renal agudo que desarrollan una falla renal con mejoría posterior, tienen mejor pronóstico que los pacientes en quienes la falla renal persiste9.
Tipo 2: síndrome cardio-renal crónico
El síndrome cardio-renal crónico es el que con mayor frecuencia atienden los nefrólogos y los cardiólogos que manejan pacientes con insuficiencia cardíaca, mientras que los cardiólogos de unidades coronarias atienden con mayor frecuencia pacientes con síndrome cardio-renal tipo 1.
El deterioro de la velocidad de filtración glomerular, definido como menos de 60 ml/min, es muy frecuente en la insuficiencia cardíaca (60% de los pacientes con insuficiencia cardíaca que se encuentran hospitalizados, y 45% de los pacientes ambulatorios con insuficiencia cardíaca crónica).
Estos pacientes desarrollan alteraciones estructurales mediadas por diferentes factores como el hipodébito, la inflamación, la ateroesclerosis y la hipoperfusión crónica. Esto lleva a que la injuria renal no sea solamente aguda, sino que puede producirse una enfermedad progresiva. Por otro lado, aparecen círculos viciosos con relación a la anemia, la retención de fosfatos, la retención de solutos urémicos y la hipertensión, evidenciándose un deterioro mayor en los pacientes que llegan a estadios avanzados de la enfermedad, necesitando en muchas ocasiones tratamiento dialítico4.
Un estudio que incluyó 118.000 pacientes con insuficiencia cardíaca aguda descompensada mostró que la mortalidad intrahospitalaria de los pacientes aumentó en la medida en que su disfunción renal era mayor. Los pacientes con enfermedad renal en estadios 4 ó 5, o sea filtración glomerular menor de 30 ml/minuto, tienen un riesgo relativo de muerte siete veces mayor10.
Tipo 3: síndrome reno-cardíaco agudo
La incidencia del síndrome reno-cardíaco agudo tipo 3 no está claramente definida, pues la insuficiencia renal aguda tiene múltiples etiologías y las definiciones modernas no se encuentran incorporadas en todos los estudios. En este momento existen dos definiciones que son la clasificación de RIFLE y la clasificación de AKIN, compartiendo ambas muchas similitudes. La mayoría de los estudios modernos utilizan estas clasificaciones; sin embargo, todavía existen clasificaciones antiguas, lo que dificulta conocer la real incidencia. En los estudios de insuficiencia renal aguda se busca analizar mortalidad total, necesidad de diálisis o recuperación de la función renal, pero por lo general no se evalúa ningún desenlace cardiovascular, lo que dificulta también conocer la incidencia de este síndrome.
No se conoce con exactitud el mecanismo patogénico de este síndrome. Se cree que los factores causales pueden ser la sobrecarga de volumen y la hipertensión; sin embargo, también se deben considerar los mediadores inflamatorios que se desarrollan en la insuficiencia renal aguda. Existen ciertos factores que no tienen relación con sobrecarga o hipertensión, ya que los pacientes no solamente se mueren de congestión, sino que un porcentaje presenta infartos de miocardio y otras causas de muerte cardiovascular.
El paciente con enfermedad renal crónica avanzada desarrolla frecuentemente una enfermedad vascular, generalmente ateroesclerosis y arterioesclerosis. Los pacientes presentan hipertensión sistólica, hipotensión diastólica y rigidez vascular. También pueden tener enfermedad coronaria, enfermedad vascular periférica, enfermedad vascular cerebral y mala distensibilidad6.
El 80% de los pacientes que ingresa a diálisis tiene ecocardiogramas alterados con alteraciones desde el punto de vista estructural.
La presencia de factores de riesgo tradicionales, factores nuevos y los específicos de la uremia generan un riesgo cardiovascular alto11. En el paciente con enfermedad renal crónica es evidente que no sólo la velocidad de filtración glomerular se asocia a morbimortalidad cardiovascular, sino que también el grado de proteinuria. En la actualidad la enfermedad renal crónica se clasifica de acuerdo a la velocidad estimada de filtración glomerular. Sin embargo, la proteinuria es un factor de riesgo frecuentemente ignorado. Por ejemplo, un paciente que tiene 40 ml/min pero sin proteinuria tiene mejor sobrevida que el que tiene 60 ml/min con proteinuria. Probablemente este elemento va a llevar a un cambio en las clasificaciones de la enfermedad renal crónica, dado que es un factor de mortalidad independiente. A medida que el estadio de la enfermedad renal progresa, el riesgo de enfermedad cardiovascular aumenta, pudiendo llegar a ser 1000 veces mayor en los pacientes en diálisis12.
La mortalidad cardiovascular en diálisis crónica es dada preferentemente por muerte súbita y no por infarto agudo al miocardio 13. Los factores que aumentan el riesgo de muerte súbita son: la enfermedad coronaria, hipertrofia ventricular, fibrosis miocárdica, sobreactividad simpática, alteraciones electrolíticas, hipervolemia, hiperfosfemia y apnea de sueño. Todos estos son blancos terapéuticos para disminuir la mortalidad cardiovascular en los dializados.
Cuando se estudia el riesgo de enfermedad coronaria oculta en pacientes con insuficiencia renal que ingresan a diálisis, se observa que la mitad de los pacientes que no presenta angina tiene enfermedad coronaria14.
Otro elemento importante en los pacientes con enfermedad renal, principalmente los dializados, es la evidencia de fibrosis cardíaca que lleva a una alteración de la capacitancia (compliance). El enfermo presenta hipervolemia y desarrolla un edema pulmonar, a veces hipervolemia discreta, o presenta hipovolemia en diálisis con hipotensión severa. La fibrosis también aumenta el riesgo de desarrollar arritmias.
La actividad simpática proviene del riñón en los pacientes con neuropatías crónicas. Existe evidencia experimental de ablación o nefrectomía con mejoría de la actividad simpática 15. Por esta razón es beneficioso utilizar beta bloqueadores en los pacientes dializados que los toleran adecuadamente. En los pacientes dializados que presentan niveles más elevados de noradrenalina circulante, aumenta la mortalidad total y la mortalidad cardiovascular16.
Una gran cantidad de los pacientes dializados o con enfermedad renal crónica grave, tienen insuficiencia cardíaca que puede ser de muy mal pronóstico. El paciente con insuficiencia cardíaca tiene una sobrevida menor al 20% a los tres años y su manejo es complejo.
Tipo 5: síndrome cardio-renal secundario
En el síndrome cardio-renal secundario o tipo 5, se encuentra compromiso simultáneo de ambos órganos y puede ser generado por múltiples etiologías. Ninguna de esas enfermedades causales, o muy pocas, comparten mecanismos patogénicos comunes, lo que lo convierte en un tipo de síndrome discutible.
A continuación se muestran diferentes etiologías del síndrome cardio-renal tipo 5 (Figura 2) 17.
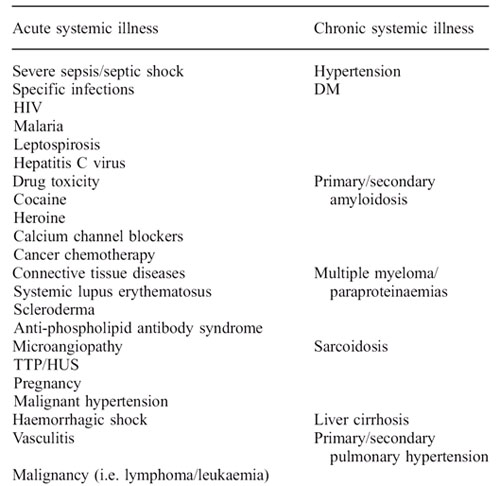 |
| Figura 2: Etiología del síndrome cardio-renal tipo 5. |
La enfermedad prototipo de este tipo de síndrome es la sepsis, que es una entidad muy frecuente. Alrededor de un 30% de los pacientes sépticos ingresa a una UCI general y 40% de éstos desarrolla una injuria renal aguda. Cuando un paciente desarrolla una injuria renal aguda su mortalidad aumenta, pero si ese paciente presenta además sepsis, su mortalidad es significativamente mayor (Figura 3) 18.
Figura 3: Mortalidad estratificada por subgrupos.
El aumento de la troponina también se relaciona con una mayor mortalidad en los pacientes que se encuentran en la UCI, así como el aumento del proBNP. Esto significa que probablemente parte de esta mortalidad se relaciona con alguna alteración cardíaca19.
Algunas unidades de cuidado crítico se caracterizan por reanimar agresivamente al paciente produciendo una excesiva expansión del volumen extracelular. La evidencia en la actualidad muestra que los pacientes con sobrecarga de volumen, definida ésta como más del 10% de aumento del peso, presentan también una mayor mortalidad 20. En estos pacientes no se conoce si la sobrecarga de volumen se relaciona con una enfermedad más grave y que requiere mayor reanimación con volumen. Sin embargo, cuando estos pacientes han sido ajustados por distintas escalas de severidad, la hipervolemia se mantiene como un factor independiente asociado a mortalidad. Por lo tanto, se puede considerar que una de las razones por las que fallecen los pacientes por hipervolemia es una alteración de la función cardíaca no pesquisada que se traduce en proBNP y troponina elevadas.
Utilidad del proBNP en pacientes con insuficiencia renal grave
Para evaluar insuficiencia cardíaca es posible medir el proBNP (péptido natriurético cerebral). El proBNP se produce en el ventrículo izquierdo, específicamente en los cardiomiocitos y se origina de la proteína preproBNP que se divide en proBNP y un péptido de señal. El proBNP se libera y se destruye en una forma equimolar entre el BNP o NT-proBNP. La vida media de estos es diferente; 120 minutos para el NT-proBNP y 20 minutos para el BNP, siendo los valores normales de BNP hasta 100 y los de proBNP hasta 500 pg/ml. Ambos presentan depuración renal y aumentan con la edad21. Los valores de corte utilizados no se conocen en los pacientes con insuficiencia renal, pero son superiores a los valores considerados tradicionalmente normales. Los pacientes en diálisis que no presentan disfunción ventricular presentan niveles de NT-proBNP que pueden llegar a 5.000 pg/ml. Los pacientes con insuficiencia cardíaca en diálisis pueden tener valores de 40.000 o mayores. David y cols. consideran el punto de corte en 7.000 pg/ml (especificidad de 90% y sensibilidad de 80%) o de 5.000 pg/ml (especificidad de 80% y sensibilidad de 90%) 22. Por lo tanto, menos de 5.000 pg/ml en un paciente en diálisis, podría considerarse normal.
Los ensayos clínicos hasta la fecha son insuficientes y de mala calidad, pues la mayoría de los estudios excluyen a los pacientes con enfermedades crónicas avanzadas, como son el cáncer, cirrosis hepática o enfermedad renal crónica avanzada. Los pacientes con nefropatías avanzadas se excluyen de los estudios por temor a los efectos adversos, como la hiperpotasemia y el deterioro de la función renal. Además, a estos pacientes por lo general se les ofrece menos procedimientos invasivos como la revascularización cardíaca, dado que tienen mayor mortalidad. En algunos lugares, cuando los pacientes dializados presentan un infarto, se les subtrata y no se les realiza coronariografía. Existe poca evidencia en estos pacientes, pero no existen razones para no tratarlos. Se deben utilizar las terapias que se encuentran probadas en pacientes coronarios o con otras cardiopatías.
Estos pacientes necesitan un manejo multidisciplinario con cardiólogo y nefrólogo, y eventualmente otros especialistas 37 39 40. Requieren una vigilancia estrecha, tanto clínica como de laboratorio, enfocada preferentemente en potasio, nitrógeno ureico, creatinina, hemoglobina, calcio, fósforo, ácido úrico y bicarbonato, con miras a pesquisar deterioro de la función renal potencialmente manejable.
Para pacientes con síndromes cardio-renal tipo 1 y tipo 2 inicialmente se debe optimizar la terapia de insuficiencia cardíaca y evaluar la estructura y función renal y cardíaca. Estos pacientes por lo general comparten mecanismos patogénicos comunes, son con frecuencia pacientes de edad avanzada, con ateromatosis, con cardiopatía isquémica o cardiopatía hipertensiva, y por lo tanto es importante evaluar las arterias renales con ecografía Doppler que es el método menos invasivo. Se debe optimizar la dosificación de diuréticos: aumentar la dosis de diuréticos es beneficioso desde el punto de vista cardiovascular, pero perjudicial desde el punto de vista renal y también desde el punto de vista pronóstico. Los pacientes que deterioran la función renal con los diuréticos presentan mayor mortalidad.
También se utilizan terapias específicas como la dopamina en dosis renal y el neseritide, aunque en el medio chileno no son empleados. Se utiliza la dobutamina, aunque no hay muchos estudios que la validen. En la actualidad existe evidencia de beneficio con otros inotrópicos como el levosimendan.
La ultrafiltración o hemodiálisis son también poco utilizadas en Chile al igual que otras terapias experimentales que se están empleando 23.
La terapia para la disfunción sistólica consiste en inhibidores de la enzima convertidora de angiotensina, que deben ser estrictamente controlados dado que es un medicamento que produce fallas renales reversibles; se debe realizar un seguimiento estricto y en caso de que se presente un deterioro significativo de la función renal o hiperpotasemia severa se debe suspender el medicamento.
También se utilizan los beta bloqueadores, los antagonistas de la aldosterona y los diuréticos; y se ha estudiado en estos pacientes la terapia no farmacológica como la resincronización y los desfibriladores implantables, no por muerte súbita, sino por miocardiopatía 24.
El carvedilol ha demostrado un aumento en la sobrevida de los pacientes dializados con miocardiopatía dilatada; es superior al placebo en diferentes estudios, razón por la cual se utiliza con frecuencia en nuestro medio25.
Los bloqueadores de angiotensina también han mostrado efectos sobre las tasas libres de eventos cardiovasculares. Takahasi y cols , mostraron que en el grupo control, 11 pacientes desarrollaron insuficiencia cardíaca, mientras que en el grupo tratado sólo 5. Con muerte súbita los pacientes fueron pocos, pero también se mostró una mayor presentación en el grupo control26.
Con fosinopril (inhibidor de la enzima convertidora de angiotensina) también se evidenció una tendencia a menos eventos cardiovasculares, aunque se encontró en el límite de la significancia (p=0,09) 27.
La espironolactona en pacientes dializados debe ser utilizada con cuidado dado que puede producir hiperpotasemias severas. Específicamente en un estudio de nuestro hospital la administración de espironolactona a dosis de 25 mg al día se asoció a hiperpotasemia en la mayoría de los pacientes (Dra. Miriam Alvo, Hospital Clínico U. de Chile, comunicación personal), lo que no ocurrió cuando se utilizó postdiálisis28. Un estudio publicado en Arabia Saudita mostró mejoría en la fracción de eyección, la hipertrofia y la hospitalización, aunque el tamaño de la muestra fue pequeño29. Si se utiliza debe existir precaución con los niveles de potasio plasmático.
Con respecto a la furosemida en insuficiencia cardíaca descompensada, su efecto parece ser mejor cuando se administra en infusión30. El problema principal de la furosemida es que el paciente elimina orina hipotónica; es decir que tiene tendencia hacia la hipernatremia. Además bloquea el co-transportador sodio-potasio-cloro en la mácula densa, lo que produce estimulación del sistema renina-angiotensina-aldosterona.
Otra opción de terapia es la ultrafiltración. Un estudio aleatorizado mostró que los pacientes que se ultrafiltraron bajaron más de peso y tuvieron menos hospitalizaciones al compararlo con la terapia diurética; es decir, hay evidencia de que la ultrafiltración lenta continua es beneficiosa31.
El neseritide, un péptido natriurético tipo B, también ha mostrado mejoría de la función renal en algunos estudios. El estudio NAPA, con pacientes en perioperatorio de cirugía cardíaca de diferentes etiologías, puso en evidencia que los pacientes que recibieron neseritide presentaron un menor deterioro de la función renal y una mejoría en la sobrevida a los 180 días32. Sin embargo, el trabajo más grande en pacientes ambulatorios no mostró beneficio en la sobrevida, ni en ningún endpoint cardiovascular, pero sí mostró menos disfunción renal en el grupo que recibió neseritide33.
Se debe tener precaución al utilizar eritropoyetina para el tratamiento de la anemia en este tipo de pacientes, pues un estudio reciente mostró que la hemoglobina mejora con los agentes estimulantes de la eritropoyesis; sin embargo, los desenlaces cardiovasculares no presentan diferencias significativas. No se evidenció diferencias en mortalidad, infarto, insuficiencia cardíaca e isquemia miocárdica y por el contrario se muestra un aumento del riesgo de accidente vascular encefálico en los pacientes que recibieron darbepoyetina34. Estos resultados están en concordancia con estudios previos que mostraban que al utilizar eritropoyetina alfa y beta en enfermos prediálisis, mejora el hematocrito y puede mejorar discretamente la calidad de vida, sin embargo no mejoran los desenlaces cardiovasculares y puede eventualmente deteriorarlos.
El levosimendan ha sido recientemente estudiado en estos pacientes y ha mostrado tener un efecto beneficioso en la función renal. Zemljic y cols. mostraron que los pacientes con insuficiencia cardíaca muy avanzada que recibieron levosimendan tuvieron mejoría discreta de la creatinina y caída del péptido natriurético cerebral, pero sin beneficios en sobrevida35.
A algunos pacientes con síndromes cardio-renales que a pesar del tratamiento no logran compensarse, se les puede ofrecer la opción de diálisis peritoneal crónica. Esto ha mostrado resultados favorables, al punto de mejorar la clase funcional en la mayoría de los pacientes, con mejoría de la fracción de eyección en varios de ellos, lo cual hemos corroborado en nuestro hospital. Un estudio español mostró una mejoría sintomática, mejoría de peso y la fracción de eyección en los pacientes tratados con diálisis peritoneal36. La sobrevida a los 2 años fue de 60%, transformando así a la diálisis peritoneal crónica en una buena opción de tratamiento para pacientes refractarios.
El trasplante renal se debe considerar en pacientes en diálisis con disfunción ventricular severa. Idealmente deberían recibir un trasplante combinado; cardíaco y renal, lo cual es difícil. Sin embargo, hay que tener presente que algunos pacientes sometidos exclusivamente a trasplante renal presentan una mejoría notable en su fracción de eyección y en la sobrevida41 42.

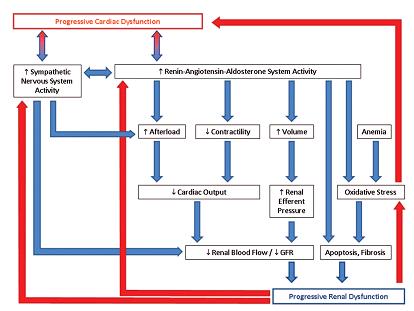 Figura 1: Mecanismos postulados para la interrelación bidireccional entre la insuficiencia cardiaca y la enfermedad renal crónica (3)
Figura 1: Mecanismos postulados para la interrelación bidireccional entre la insuficiencia cardiaca y la enfermedad renal crónica (3)

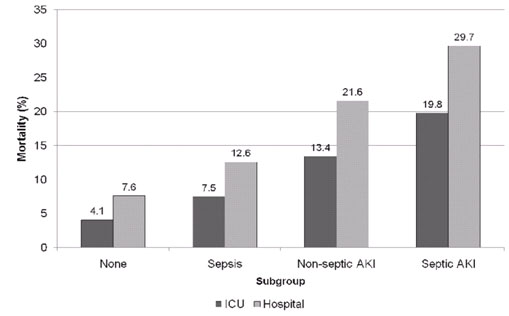 Figura 3: Mortalidad estratificada por subgrupos.
Figura 3: Mortalidad estratificada por subgrupos.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Heart and renal diseases frequently coexist. Both conditions share several pathogenic mechanisms, are difficult to manage and expensive to treat due to frequent hospitalizations and the requirement of uncommon procedures. They also entail significant morbidity and mortality. The Cardio-Renal Syndrome has been described, in which both organs are involved and their interaction is both ways. The article also covers the five-type classification and their different characteristics are described. Different possible therapies are looked into referring to studies and documented experiences, highlighting the risks and advantages of each one of them.
 Autor:
Erico Segovia[1]
Autor:
Erico Segovia[1]

Citación: Segovia E. Cardio-renal syndrome: diagnosis and treatment. Medwave 2011 May;11(05):e5028 doi: 10.5867/medwave.2011.05.5028
Fecha de envío: 7/4/2011
Fecha de aceptación: 9/4/2011
Fecha de publicación: 1/5/2011
Origen: solicitado
Tipo de revisión: sin revisión por pares

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 NHLBI Working Group. Cardio-Renal Connections in Heart Failure and Cardiovascular Disease. 2004. | Link |
NHLBI Working Group. Cardio-Renal Connections in Heart Failure and Cardiovascular Disease. 2004. | Link | Bock JS, Gottlieb SS. Cardiorenal syndrome: new perspectives. Circulation. 2010 Jun 15;121(23):2592-600. | CrossRef | PubMed |
Bock JS, Gottlieb SS. Cardiorenal syndrome: new perspectives. Circulation. 2010 Jun 15;121(23):2592-600. | CrossRef | PubMed | Ronco C, Haapio M, House AA, Anavekar N, Bellomo R. Cardiorenal syndrome. J Am Coll Cardiol. 2008 Nov 4;52(19):1527-39. | CrossRef | PubMed |
Ronco C, Haapio M, House AA, Anavekar N, Bellomo R. Cardiorenal syndrome. J Am Coll Cardiol. 2008 Nov 4;52(19):1527-39. | CrossRef | PubMed | Aghel A, Shrestha K, Mullens W, Borowski A, Tang WH. Serum neutrophil gelatinase-associated lipocalin (NGAL) in predicting worsening renal function in acute decompensated heart failure. J Card Fail. 2010 Jan;16(1):49-54. Epub 2009 Aug 21. | CrossRef | PubMed | PMC |
Aghel A, Shrestha K, Mullens W, Borowski A, Tang WH. Serum neutrophil gelatinase-associated lipocalin (NGAL) in predicting worsening renal function in acute decompensated heart failure. J Card Fail. 2010 Jan;16(1):49-54. Epub 2009 Aug 21. | CrossRef | PubMed | PMC | Shamseddin MK, Parfrey PS. Mechanisms of the cardiorenal syndromes. Nat Rev Nephrol. 2009 Nov;5(11):641-9. Epub 2009 Sep 29. | CrossRef | PubMed |
Shamseddin MK, Parfrey PS. Mechanisms of the cardiorenal syndromes. Nat Rev Nephrol. 2009 Nov;5(11):641-9. Epub 2009 Sep 29. | CrossRef | PubMed | Damman K, van Deursen VM, Navis G, Voors AA, van Veldhuisen DJ, Hillege HL. Increased central venous pressure is associated with impaired renal function and mortality in a broad spectrum of patients with cardiovascular disease. J Am Coll Cardiol. 2009 Feb 17;53(7):582-8. | CrossRef | PubMed |
Damman K, van Deursen VM, Navis G, Voors AA, van Veldhuisen DJ, Hillege HL. Increased central venous pressure is associated with impaired renal function and mortality in a broad spectrum of patients with cardiovascular disease. J Am Coll Cardiol. 2009 Feb 17;53(7):582-8. | CrossRef | PubMed | Mullens W, Abrahams Z, Francis GS, Sokos G, Taylor DO, Starling RC, Young JB, Tang WH. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. J Am Coll Cardiol. 2009 Feb 17;53(7):589-96. | CrossRef | PubMed | PMC |
Mullens W, Abrahams Z, Francis GS, Sokos G, Taylor DO, Starling RC, Young JB, Tang WH. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. J Am Coll Cardiol. 2009 Feb 17;53(7):589-96. | CrossRef | PubMed | PMC | Aronson D, Burger AJ. The relationship between transient and persistent worsening renal function and mortality in patients with acute decompensated heart failure. J Card Fail. 2010 Jul;16(7):541-7. Epub 2010 Mar 19. | CrossRef | PubMed |
Aronson D, Burger AJ. The relationship between transient and persistent worsening renal function and mortality in patients with acute decompensated heart failure. J Card Fail. 2010 Jul;16(7):541-7. Epub 2010 Mar 19. | CrossRef | PubMed | Heywood JT, Fonarow GC, Costanzo MR, Mathur VS, Wigneswaran JR, Wynne J; ADHERE Scientific Advisory Committee and Investigators. High prevalence of renal dysfunction and its impact on outcome in 118,465 patients hospitalized with acute decompensated heart failure: a report from the ADHERE database. J Card Fail. 2007 Aug;13(6):422-30. | CrossRef | PubMed |
Heywood JT, Fonarow GC, Costanzo MR, Mathur VS, Wigneswaran JR, Wynne J; ADHERE Scientific Advisory Committee and Investigators. High prevalence of renal dysfunction and its impact on outcome in 118,465 patients hospitalized with acute decompensated heart failure: a report from the ADHERE database. J Card Fail. 2007 Aug;13(6):422-30. | CrossRef | PubMed | Alonso Gómez AM. ¿Que debe conocer el nefrólogo de la afectación cardiaca en diálisis peritoneal? Nefrologia. 2008;28 Suppl 6:105-12. | PubMed |
Alonso Gómez AM. ¿Que debe conocer el nefrólogo de la afectación cardiaca en diálisis peritoneal? Nefrologia. 2008;28 Suppl 6:105-12. | PubMed | Schiffrin EL, Lipman ML, Mann JF. Chronic kidney disease: effects on the cardiovascular system. Circulation. 2007 Jul 3;116(1):85-97. | CrossRef | PubMed |
Schiffrin EL, Lipman ML, Mann JF. Chronic kidney disease: effects on the cardiovascular system. Circulation. 2007 Jul 3;116(1):85-97. | CrossRef | PubMed | Wanner C, Krane V, März W, Olschewski M, Mann JF, Ruf G, Ritz E; German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med. 2005 Jul 21;353(3):238-48. | CrossRef | PubMed |
Wanner C, Krane V, März W, Olschewski M, Mann JF, Ruf G, Ritz E; German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med. 2005 Jul 21;353(3):238-48. | CrossRef | PubMed | Ohtake T, Kobayashi S, Moriya H, Negishi K, Okamoto K, Maesato K, Saito S. High prevalence of occult coronary artery stenosis in patients with chronic kidney disease at the initiation of renal replacement therapy: an angiographic examination. J Am Soc Nephrol. 2005 Apr;16(4):1141-8. Epub 2005 Mar 2. | CrossRef | PubMed |
Ohtake T, Kobayashi S, Moriya H, Negishi K, Okamoto K, Maesato K, Saito S. High prevalence of occult coronary artery stenosis in patients with chronic kidney disease at the initiation of renal replacement therapy: an angiographic examination. J Am Soc Nephrol. 2005 Apr;16(4):1141-8. Epub 2005 Mar 2. | CrossRef | PubMed | Schlaich MP, Socratous F, Hennebry S, Eikelis N, Lambert EA, Straznicky N, Esler MD, Lambert GW. Sympathetic activation in chronic renal failure. J Am Soc Nephrol. 2009 May;20(5):933-9. Epub 2008 Sep 17. | CrossRef | PubMed |
Schlaich MP, Socratous F, Hennebry S, Eikelis N, Lambert EA, Straznicky N, Esler MD, Lambert GW. Sympathetic activation in chronic renal failure. J Am Soc Nephrol. 2009 May;20(5):933-9. Epub 2008 Sep 17. | CrossRef | PubMed | Zoccali C, Mallamaci F, Parlongo S, Cutrupi S, Benedetto FA, Tripepi G, Bonanno G, Rapisarda F, Fatuzzo P, Seminara G, Cataliotti A, Stancanelli B, Malatino LS. Plasma norepinephrine predicts survival and incident cardiovascular events in patients with end-stage renal disease. Circulation. 2002 Mar 19;105(11):1354-9. | CrossRef | PubMed |
Zoccali C, Mallamaci F, Parlongo S, Cutrupi S, Benedetto FA, Tripepi G, Bonanno G, Rapisarda F, Fatuzzo P, Seminara G, Cataliotti A, Stancanelli B, Malatino LS. Plasma norepinephrine predicts survival and incident cardiovascular events in patients with end-stage renal disease. Circulation. 2002 Mar 19;105(11):1354-9. | CrossRef | PubMed | Bagshaw SM, Cruz DN, Aspromonte N, Daliento L, Ronco F, Sheinfeld G, Anker SD, Anand I, Bellomo R, Berl T, Bobek I, Davenport A, Haapio M, Hillege H, House A, Katz N, Maisel A, Mankad S, McCullough P, Mebazaa A, Palazzuoli A, Ponikowski P, Shaw A, Soni S, Vescovo G, Zamperetti N, Zanco P, Ronco C; Acute Dialysis Quality Initiative Consensus Group. Epidemiology of cardio-renal syndromes: workgroup statements from the 7th ADQI Consensus Conference. Nephrol Dial Transplant. 2010 May;25(5):1406-16. Epub 2010 Feb 25. | CrossRef | PubMed |
Bagshaw SM, Cruz DN, Aspromonte N, Daliento L, Ronco F, Sheinfeld G, Anker SD, Anand I, Bellomo R, Berl T, Bobek I, Davenport A, Haapio M, Hillege H, House A, Katz N, Maisel A, Mankad S, McCullough P, Mebazaa A, Palazzuoli A, Ponikowski P, Shaw A, Soni S, Vescovo G, Zamperetti N, Zanco P, Ronco C; Acute Dialysis Quality Initiative Consensus Group. Epidemiology of cardio-renal syndromes: workgroup statements from the 7th ADQI Consensus Conference. Nephrol Dial Transplant. 2010 May;25(5):1406-16. Epub 2010 Feb 25. | CrossRef | PubMed | Bagshaw SM, George C, Bellomo R; ANZICS Database Management Committee. Early acute kidney injury and sepsis: a multicentre evaluation. Crit Care. 2008;12(2):R47. Epub 2008 Apr 10. | PubMed | PMC |
Bagshaw SM, George C, Bellomo R; ANZICS Database Management Committee. Early acute kidney injury and sepsis: a multicentre evaluation. Crit Care. 2008;12(2):R47. Epub 2008 Apr 10. | PubMed | PMC | Brueckmann M, Huhle G, Lang S, Haase KK, Bertsch T, Weiss C, Kaden JJ, Putensen C, Borggrefe M, Hoffmann U. Prognostic value of plasma N-terminal pro-brain natriuretic peptide in patients with severe sepsis. Circulation. 2005 Jul 26;112(4):527-34. Epub 2005 Jul 18. | CrossRef | PubMed |
Brueckmann M, Huhle G, Lang S, Haase KK, Bertsch T, Weiss C, Kaden JJ, Putensen C, Borggrefe M, Hoffmann U. Prognostic value of plasma N-terminal pro-brain natriuretic peptide in patients with severe sepsis. Circulation. 2005 Jul 26;112(4):527-34. Epub 2005 Jul 18. | CrossRef | PubMed | Bouchard J, Soroko SB, Chertow GM, Himmelfarb J, Ikizler TA, Paganini EP, Mehta RL; Program to Improve Care in Acute Renal Disease (PICARD) Study Group. Fluid accumulation, survival and recovery of kidney function in critically ill patients with acute kidney injury. Kidney Int. 2009 Aug;76(4):422-7. Epub 2009 May 13. | CrossRef | PubMed |
Bouchard J, Soroko SB, Chertow GM, Himmelfarb J, Ikizler TA, Paganini EP, Mehta RL; Program to Improve Care in Acute Renal Disease (PICARD) Study Group. Fluid accumulation, survival and recovery of kidney function in critically ill patients with acute kidney injury. Kidney Int. 2009 Aug;76(4):422-7. Epub 2009 May 13. | CrossRef | PubMed | Rosner MH. Measuring risk in end-stage renal disease: is N-terminal pro brain natriuretic peptide a useful marker? Kidney Int. 2007 Mar;71(6):481-3. | CrossRef | PubMed |
Rosner MH. Measuring risk in end-stage renal disease: is N-terminal pro brain natriuretic peptide a useful marker? Kidney Int. 2007 Mar;71(6):481-3. | CrossRef | PubMed | David S, Kümpers P, Seidler V, Biertz F, Haller H, Fliser D. Diagnostic value of N-terminal pro-B-type natriuretic peptide (NT-proBNP) for left ventricular dysfunction in patients with chronic kidney disease stage 5 on haemodialysis. Nephrol Dial Transplant. 2008 Apr;23(4):1370-7. Epub 2007 Dec 18. | CrossRef | PubMed |
David S, Kümpers P, Seidler V, Biertz F, Haller H, Fliser D. Diagnostic value of N-terminal pro-B-type natriuretic peptide (NT-proBNP) for left ventricular dysfunction in patients with chronic kidney disease stage 5 on haemodialysis. Nephrol Dial Transplant. 2008 Apr;23(4):1370-7. Epub 2007 Dec 18. | CrossRef | PubMed | Liang KV, Williams AW, Greene EL, Redfield MM. Acute decompensated heart failure and the cardiorenal syndrome. Crit Care Med. 2008 Jan;36(1 Suppl):S75-88. | PubMed |
Liang KV, Williams AW, Greene EL, Redfield MM. Acute decompensated heart failure and the cardiorenal syndrome. Crit Care Med. 2008 Jan;36(1 Suppl):S75-88. | PubMed | Chatterjee K, Rame JE. Systolic heart failure: chronic and acute syndromes. Crit Care Med. 2008 Jan;36(1 Suppl):S44-51. | PubMed |
Chatterjee K, Rame JE. Systolic heart failure: chronic and acute syndromes. Crit Care Med. 2008 Jan;36(1 Suppl):S44-51. | PubMed | Cice G, Ferrara L, D'Andrea A, D'Isa S, Di Benedetto A, Cittadini A, Russo PE, Golino P, Calabrò R. Carvedilol increases two-year survivalin dialysis patients with dilated cardiomyopathy: a prospective, placebo-controlled trial. J Am Coll Cardiol. 2003 May 7;41(9):1438-44. | CrossRef | PubMed |
Cice G, Ferrara L, D'Andrea A, D'Isa S, Di Benedetto A, Cittadini A, Russo PE, Golino P, Calabrò R. Carvedilol increases two-year survivalin dialysis patients with dilated cardiomyopathy: a prospective, placebo-controlled trial. J Am Coll Cardiol. 2003 May 7;41(9):1438-44. | CrossRef | PubMed | Takahashi A, Takase H, Toriyama T, Sugiura T, Kurita Y, Ueda R, Dohi Y. Candesartan, an angiotensin II type-1 receptor blocker, reduces cardiovascular events in patients on chronic haemodialysis--a randomized study. Nephrol Dial Transplant. 2006 Sep;21(9):2507-12. Epub 2006 Jun 9. | CrossRef | PubMed |
Takahashi A, Takase H, Toriyama T, Sugiura T, Kurita Y, Ueda R, Dohi Y. Candesartan, an angiotensin II type-1 receptor blocker, reduces cardiovascular events in patients on chronic haemodialysis--a randomized study. Nephrol Dial Transplant. 2006 Sep;21(9):2507-12. Epub 2006 Jun 9. | CrossRef | PubMed | Zannad F, Kessler M, Lehert P, Grünfeld JP, Thuilliez C, Leizorovicz A, Lechat P. Prevention of cardiovascular events in end-stage renal disease: results of a randomized trial of fosinopril and implications for future studies. Kidney Int. 2006 Oct;70(7):1318-24. Epub 2006 Jul 19. | CrossRef | PubMed |
Zannad F, Kessler M, Lehert P, Grünfeld JP, Thuilliez C, Leizorovicz A, Lechat P. Prevention of cardiovascular events in end-stage renal disease: results of a randomized trial of fosinopril and implications for future studies. Kidney Int. 2006 Oct;70(7):1318-24. Epub 2006 Jul 19. | CrossRef | PubMed | Michea L, Vukusich A, González M, Zehnder C, Marusic ET. Effect of spironolactone on K(+) homeostasis and ENaC expression in lymphocytes from chronic hemodialysis patients. Kidney Int. 2004 Oct;66(4):1647-53. | CrossRef | PubMed |
Michea L, Vukusich A, González M, Zehnder C, Marusic ET. Effect of spironolactone on K(+) homeostasis and ENaC expression in lymphocytes from chronic hemodialysis patients. Kidney Int. 2004 Oct;66(4):1647-53. | CrossRef | PubMed | Taheri S, Mortazavi M, Shahidi S, Pourmoghadas A, Garakyaraghi M, Seirafian S, Eshaghian A, Ghassami M. Spironolactone in chronic hemodialysis patients improves cardiac function. Saudi J Kidney Dis Transpl. 2009 May;20(3):392-7. | PubMed |
Taheri S, Mortazavi M, Shahidi S, Pourmoghadas A, Garakyaraghi M, Seirafian S, Eshaghian A, Ghassami M. Spironolactone in chronic hemodialysis patients improves cardiac function. Saudi J Kidney Dis Transpl. 2009 May;20(3):392-7. | PubMed | Thomson MR, Nappi JM, Dunn SP, Hollis IB, Rodgers JE, Van Bakel AB. Continuous versus intermittent infusion of furosemide in acute decompensated heart failure. J Card Fail. 2010 Mar;16(3):188-93. Epub 2010 Jan 6. | CrossRef | PubMed |
Thomson MR, Nappi JM, Dunn SP, Hollis IB, Rodgers JE, Van Bakel AB. Continuous versus intermittent infusion of furosemide in acute decompensated heart failure. J Card Fail. 2010 Mar;16(3):188-93. Epub 2010 Jan 6. | CrossRef | PubMed | Costanzo MR, Guglin ME, Saltzberg MT, Jessup ML, Bart BA, Teerlink JR, Jaski BE, Fang JC, Feller ED, Haas GJ, Anderson AS, Schollmeyer MP, Sobotka PA; UNLOAD Trial Investigators. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol. 2007 Feb 13;49(6):675-83. Epub 2007 Jan 26. | CrossRef | PubMed |
Costanzo MR, Guglin ME, Saltzberg MT, Jessup ML, Bart BA, Teerlink JR, Jaski BE, Fang JC, Feller ED, Haas GJ, Anderson AS, Schollmeyer MP, Sobotka PA; UNLOAD Trial Investigators. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol. 2007 Feb 13;49(6):675-83. Epub 2007 Jan 26. | CrossRef | PubMed | Mentzer RM Jr, Oz MC, Sladen RN, Graeve AH, Hebeler RF Jr, Luber JM Jr, Smedira NG; NAPA Investigators. Effects of perioperative nesiritide in patients with left ventricular dysfunction undergoing cardiac surgery:the NAPA Trial. J Am Coll Cardiol. 2007 Feb 13;49(6):716-26. Epub 2006 Dec 11. | CrossRef | PubMed |
Mentzer RM Jr, Oz MC, Sladen RN, Graeve AH, Hebeler RF Jr, Luber JM Jr, Smedira NG; NAPA Investigators. Effects of perioperative nesiritide in patients with left ventricular dysfunction undergoing cardiac surgery:the NAPA Trial. J Am Coll Cardiol. 2007 Feb 13;49(6):716-26. Epub 2006 Dec 11. | CrossRef | PubMed | Yancy CW, Krum H, Massie BM, Silver MA, Stevenson LW, Cheng M, Kim SS, Evans R; FUSION II Investigators. Safety and efficacy of outpatient nesiritide in patients with advanced heart failure: results of the Second Follow-Up Serial Infusions of Nesiritide (FUSION II) trial. Circ Heart Fail. 2008 May;1(1):9-16. | CrossRef | PubMed |
Yancy CW, Krum H, Massie BM, Silver MA, Stevenson LW, Cheng M, Kim SS, Evans R; FUSION II Investigators. Safety and efficacy of outpatient nesiritide in patients with advanced heart failure: results of the Second Follow-Up Serial Infusions of Nesiritide (FUSION II) trial. Circ Heart Fail. 2008 May;1(1):9-16. | CrossRef | PubMed | Pfeffer MA, Burdmann EA, Chen CY, Cooper ME, de Zeeuw D, Eckardt KU, Feyzi JM, Ivanovich P, Kewalramani R, Levey AS, Lewis EF, McGill JB, McMurray JJ, Parfrey P, Parving HH, Remuzzi G, Singh AK, Solomon SD, Toto R; TREAT Investigators. A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease. N Engl J Med. 2009 Nov 19;361(21):2019-32. Epub 2009 Oct 30. | CrossRef | PubMed |
Pfeffer MA, Burdmann EA, Chen CY, Cooper ME, de Zeeuw D, Eckardt KU, Feyzi JM, Ivanovich P, Kewalramani R, Levey AS, Lewis EF, McGill JB, McMurray JJ, Parfrey P, Parving HH, Remuzzi G, Singh AK, Solomon SD, Toto R; TREAT Investigators. A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease. N Engl J Med. 2009 Nov 19;361(21):2019-32. Epub 2009 Oct 30. | CrossRef | PubMed | Zemljic G, Bunc M, Yazdanbakhsh AP, Vrtovec B. Levosimendan improves renal function in patients with advanced chronic heart failure awaiting cardiac transplantation. J Card Fail. 2007 Aug;13(6):417-21. | CrossRef | PubMed |
Zemljic G, Bunc M, Yazdanbakhsh AP, Vrtovec B. Levosimendan improves renal function in patients with advanced chronic heart failure awaiting cardiac transplantation. J Card Fail. 2007 Aug;13(6):417-21. | CrossRef | PubMed | Sánchez JE, Ortega T, Rodríguez C, Díaz-Molina B, Martín M, Garcia-Cueto C, Vidau P, Gago E, Ortega F. Efficacy of peritoneal ultrafiltration in the treatment of refractory congestive heart failure. Nephrol Dial Transplant. 2010 Feb;25(2):605-10. Epub 2009 Sep 25. | PubMed |
Sánchez JE, Ortega T, Rodríguez C, Díaz-Molina B, Martín M, Garcia-Cueto C, Vidau P, Gago E, Ortega F. Efficacy of peritoneal ultrafiltration in the treatment of refractory congestive heart failure. Nephrol Dial Transplant. 2010 Feb;25(2):605-10. Epub 2009 Sep 25. | PubMed | Ronco C, Chionh CY, Haapio M, Anavekar NS, House A, Bellomo R. The cardiorenal syndrome. Blood Purif. 2009;27(1):114-26. Epub 2009 Jan 23. | CrossRef | PubMed |
Ronco C, Chionh CY, Haapio M, Anavekar NS, House A, Bellomo R. The cardiorenal syndrome. Blood Purif. 2009;27(1):114-26. Epub 2009 Jan 23. | CrossRef | PubMed | House AA, Anand I, Bellomo R, Cruz D, Bobek I, Anker SD, Aspromonte N, Bagshaw S, Berl T, Daliento L, Davenport A, Haapio M, Hillege H, McCullough P, Katz N, Maisel A, Mankad S, Zanco P, Mebazaa A, Palazzuoli A, Ronco F, Shaw A, Sheinfeld G, Soni S, Vescovo G, Zamperetti N, Ponikowski P, Ronco C; Acute Dialysis Quality Initiative Consensus Group. Definition and classification of Cardio-Renal Syndromes: workgroup statements from the 7th ADQI Consensus Conference. Nephrol Dial Transplant. 2010 May;25(5):1416-20. Epub 2010 Mar 12. | CrossRef | PubMed |
House AA, Anand I, Bellomo R, Cruz D, Bobek I, Anker SD, Aspromonte N, Bagshaw S, Berl T, Daliento L, Davenport A, Haapio M, Hillege H, McCullough P, Katz N, Maisel A, Mankad S, Zanco P, Mebazaa A, Palazzuoli A, Ronco F, Shaw A, Sheinfeld G, Soni S, Vescovo G, Zamperetti N, Ponikowski P, Ronco C; Acute Dialysis Quality Initiative Consensus Group. Definition and classification of Cardio-Renal Syndromes: workgroup statements from the 7th ADQI Consensus Conference. Nephrol Dial Transplant. 2010 May;25(5):1416-20. Epub 2010 Mar 12. | CrossRef | PubMed | McCullough PA, Haapio M, Mankad S, Zamperetti N, Massie B, Bellomo R, Berl T, Anker SD, Anand I, Aspromonte N, Bagshaw SM, Bobek I, Cruz DN, Daliento L, Davenport A, Hillege H, House AA, Katz N, Maisel A, Mebazaa A, Palazzuoli A, Ponikowski P, Ronco F, Shaw A, Sheinfeld G, Soni S, Vescovo G, Zanco P, Ronco C, Berl T; Acute Dialysis Quality Initiative (ADQI) Consensus Group. Prevention of cardio-renal syndromes: workgroup statements from the 7th ADQI Consensus Conference. Nephrol Dial Transplant. 2010 Jun;25(6):1777-84. Epub 2010 Apr 6. | CrossRef | PubMed |
McCullough PA, Haapio M, Mankad S, Zamperetti N, Massie B, Bellomo R, Berl T, Anker SD, Anand I, Aspromonte N, Bagshaw SM, Bobek I, Cruz DN, Daliento L, Davenport A, Hillege H, House AA, Katz N, Maisel A, Mebazaa A, Palazzuoli A, Ponikowski P, Ronco F, Shaw A, Sheinfeld G, Soni S, Vescovo G, Zanco P, Ronco C, Berl T; Acute Dialysis Quality Initiative (ADQI) Consensus Group. Prevention of cardio-renal syndromes: workgroup statements from the 7th ADQI Consensus Conference. Nephrol Dial Transplant. 2010 Jun;25(6):1777-84. Epub 2010 Apr 6. | CrossRef | PubMed | Longhini C, Molino C, Fabbian F. Cardiorenal syndrome: still not a defined entity. Clin Exp Nephrol. 2010 Feb;14(1):12-21. Epub 2010 Feb 20. | CrossRef | PubMed |
Longhini C, Molino C, Fabbian F. Cardiorenal syndrome: still not a defined entity. Clin Exp Nephrol. 2010 Feb;14(1):12-21. Epub 2010 Feb 20. | CrossRef | PubMed | Wali RK, Wang GS, Gottlieb SS, Bellumkonda L, Hansalia R, Ramos E, Drachenberg C, Papadimitriou J, Brisco MA, Blahut S, Fink JC, Fisher ML, Bartlett ST, Weir MR. Effect of kidney transplantation on left ventricular systolic dysfunction and congestive heart failure in patients with end-stage renal disease. J Am Coll Cardiol. 2005 Apr 5;45(7):1051-60. | CrossRef | PubMed |
Wali RK, Wang GS, Gottlieb SS, Bellumkonda L, Hansalia R, Ramos E, Drachenberg C, Papadimitriou J, Brisco MA, Blahut S, Fink JC, Fisher ML, Bartlett ST, Weir MR. Effect of kidney transplantation on left ventricular systolic dysfunction and congestive heart failure in patients with end-stage renal disease. J Am Coll Cardiol. 2005 Apr 5;45(7):1051-60. | CrossRef | PubMed |