 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: biopsia transtorácica, tomografía axial computarizada
La biopsia transtorácica con aguja fina es un procedimiento de estudio de lesiones intratorácicas detectadas por imágenes, cuyo uso se remonta a la segunda mitad del siglo XIX. En el presente trabajo se realiza una revisión de los aspectos novedosos de la biopsia transtorácica guiada por imágenes, haciendo énfasis en la vigencia actual de la utilidad diagnóstica del procedimiento, su sensibilidad, especificidad, valor predictivo negativo y positivo. Igualmente se revisan aspectos formales de la realización del procedimiento, empleo de las imágenes, complicaciones y cuidados posteriores a la punción.
La obtención de muestras citológicas e histopatológicas a través de punción percutánea del tórax es el procedimiento de elección para el diagnóstico definitivo de la mayoría de las lesiones torácicas, lo mismo si están localizadas en pleura, parénquima pulmonar o mediastino. Las lesiones difusas y el nódulo pulmonar solitario también pueden ser estudiados por esta vía y tiene la ventaja de que en la mayoría de los pacientes puede realizarse de forma ambulatoria (1, 2).
Aplicado por primera vez por Leyden en 1883 con el objetivo de diagnosticar el germen causal en una neumonía (3, 4), tres años más tarde es utilizado por Menetrier para el diagnóstico positivo de un tumor pulmonar (4, 5), siendo ésta la indicación más frecuente de este procedimiento hasta nuestros días (1, 2, 4).
A pesar del conocimiento de la técnica, tienen que pasar casi 100 años antes de que su uso se generalizara en el ámbito clínico, gracias a la radiología intervencionista, siendo Haaga y Alfidi quienes usaron por primera vez en 1976 imágenes de tomografía axial computarizada como guía para la punción percutánea del pulmón (4, 6).
En el presente artículo se actualiza sobre las indicaciones, contraindicaciones, valor diagnóstico, técnicas utilizadas y complicaciones más frecuentes.
Se realizó una revisión de la bibliografía actualizada sobre el tema, haciendo énfasis en las indicaciones, contraindicaciones y complicaciones del proceder, así como el empleo de imágenes y detalles de la técnica.
La obtención de muestras celulares y tisulares del tórax por vía de punción percutánea tiene la finalidad de realizar el diagnóstico definitivo en cualquier lesión de pleura, pulmón y mediastino detectada por técnicas de imágenes (1, 2). En la mayoría de las series publicadas el carcinoma epidermoide (1, 2, 7) es el hallazgo más frecuente, aunque también ha sido señalado el adenocarcinoma (8), seguidos ambos por otras variedades histológicas de malignidades pulmonares (1, 2, 7, 8), siendo un hecho probado que la sensibilidad de las técnicas citológicas se reduce sensiblemente cuando se trata de lesiones benignas (1, 2, 7, 8).
Resulta de vital importancia el juicio clínico acerca del diagnóstico previo a la obtención de la muestra, pues ello permitiría escoger la mejor técnica a utilizar y alertar al citopatólogo sobre la validez del resultado que esperamos. Por ejemplo, si existe alta sospecha de malignidad lo ideal sería obtener un subtipo histológico preciso, pero como quiera que esto a veces resulta difícil y la concordancia entre tipo celular encontrado en citología y muestras de tejidos pulmonares resecados es de sólo el 73,6 % (1), la diferenciación entre tumores de células pequeñas de los de células no pequeñas puede bastar para definir la conducta a seguir con el enfermo (1, 2). Si, por el contrario, se sospecha tumor benigno, debe tenerse en consideración que una muestra de tejido con trócar de biopsia (trucut o similar) ofrecerá mayores posibilidades diagnósticas en linfomas (1), timomas (1), sarcoidosis (1, 9, 10) hamartomas, teratomas y otros tumores benignos sólidos (1, 7). La mayoría de los estudios coinciden en señalar el poco valor de la citología para precisar lesiones benignas (1, 7, 8, 11, 12), con la que solamente se logra diagnóstico específico en alrededor de un 34 % (1, 2). No obstante, su sensibilidad se ha venido incrementando con el tiempo y el refinamiento de los estudios de imágenes del tórax y se puede diagnosticar por esta vía absceso pulmonar, tejido fibroso o epitelial benigno, fibrosis quística, neumoconiosis, empiema loculado, tumores embrionarios benignos (1), tuberculosis (1, 7) y neumonías (1, 13). En el estudio del síndrome mediastinal se han reportado con citología diagnósticos tan poco frecuentes como hemangioendotelioma epitelioide (14), pero los resultados más consistentes se obtienen tomando cilindros de tejidos para biopsias (15).
Algunos autores han reportado que la biopsia transtorácica es un procedimiento seguro y eficaz para el diagnóstico de enfermedades hematológicas, sobre todo linfomas No Hodgkin (1, 16).
Las técnicas de toma de muestras por vía percutánea en el tórax van a estar siempre indicadas cuando no se tiene diagnóstico por broncoscopia (biopsia endobronquial, cepillado de lesiones visibles, lavado bronquioalveolar) o citologías de esputos y se presume que su resultado va a influir decisivamente en la terapéutica del paciente; también en todo nódulo pulmonar sospechoso de malignidad o que no parezca benigno en la tomografía y en pacientes con nódulos pulmonares y tumor extrapulmonar conocido (1, 8).
La indicación más controversial de la biopsia transtorácica con aguja es el estudio del nódulo pulmonar solitario. Esto se debe a que el porcentaje de muestras útiles disminuye proporcionalmente al tamaño del nódulo, reportándose una efectividad del 77,2 % en nódulos menores de 20 mm y mucho menor aún en lesiones menores de un centímetro (17). Como quiera que un nódulo maligno debe operarse y un resultado negativo de biopsia con aguja no excluye malignidad y requiere, por tanto, intervención quirúrgica, se ha planteado que es innecesario realizar la biopsia por punción percutánea a estos pacientes (1). Consideramos que en estos casos la indicación debe ajustarse a las condiciones específicas del centro médico y del paciente. Contar con un citopatólogo experto y pacientes cuya función ventilatoria pudiera verse deteriorada por la cirugía, serían indicaciones precisas para intentar una biopsia con aguja.
La efectividad del procedimiento calculada en base al porciento de estudios útiles entre el total de muestras tomadas varía entre el 67,6 % y el 93,2 % (1, 2, 7, 8, 11, 12, 18, 19). Numerosos factores han demostrado su influencia en la utilidad de las muestras tomadas. A pesar de la exactitud en la colocación de la aguja que facilitan las modernas técnicas de imágenes, el tamaño del tumor resulta crítico (17, 20). Sin embargo, no parece ser éste el obstáculo mayor para una buena muestra. La distancia entre el tumor y la superficie pleural, es decir, el trayecto intrapulmonar de la aguja, afecta inversamente la calidad de la muestra más que el propio tamaño del tumor (7, 8, 18), reportándose que distancias mayores de 40 mm se asocian a menor tasa de éxitos (17). Aunque al parecer con menor peso específico en las series de pacientes que han estudiado los factores que influyen en la calidad de la muestra, la necrosis, fibrosis, neumonías secundarias y reacciones inflamatorias peri-tumorales son causas frecuentes de que se tomen muestras escasas, no útiles o falsos negativos (1). Las muestras constituidas por cilindros de tejido pulmonar tienen generalmente mayor rentabilidad diagnóstica que la citología. En un estudio comparativo que incluyó 107 pacientes a los que se practicaron ambos procedimientos, se obtuvieron diagnósticos correctos confirmados por biopsias trans-operatorias o curso clínico en el 75,8 % de las biopsias vs 71,7 % de las citologías, mientras que el neumotórax como complicación mayor ocurrió en 24,3 % del primer grupo y en 40 % del grupo de las citologías (21). Actualmente, el uso del trócar coaxial incrementa la positividad de las muestras tomadas al permitir en un solo pase de la aguja tomar un cilindro de tejido para biopsia y extendidos para citología. Otras ventajas de esta técnica incluyen mejores posibilidades de estudios microbiológicos al obtenerse mayor volumen de material, mayor sensibilidad para diagnóstico de lesiones benignas, mayor accesibilidad al mediastino si se usa la vía trans-esternal y posibilidad de inyectar sustancias dentro del tumor después de la biopsia. Está especialmente indicada en pacientes con mayor sospecha de tumores benignos o infecciones que de tumores malignos, cuando ha fracasado una primera tentativa de biopsia con aguja fina, si la intención es administrar tratamiento intra-tumoral, en lesiones mediastínicas poco accesibles y cuando se prevé que la inserción de la aguja guiada por imágenes pueda ser trabajosa o incremente el riesgo de exposición a radiaciones del paciente (1). Al crearse un mayor defecto pleural tras la colocación del trócar existe el riesgo teórico de incremento en la incidencia de neumotórax pos biopsia (1), sin embargo los reportes del empleo de esta técnica más bien señalan una disminución de esta complicación, lo que se explicaría porque al poder tomarse todas las muestras necesarias con un solo pase, se disminuye el número de punturas pleurales (8).
La sensibilidad para el diagnóstico de lesiones malignas varía entre un 83 y 92,6 %, mientras que la especificidad es cercana al 100 % (1, 11, 12, 19), lo que supone un valor predictivo positivo de 100 % y un valor predictivo negativo entre 53 y 63 % (2, 12). Se ha reportado un ligero incremento de la sensibilidad en lesiones periféricas (12), pero existe consenso en que el mayor factor limitante de la sensibilidad de la técnica es la experiencia del citopatólogo (1, 2, 8, 20). No obstante, un estudio diseñado especialmente para evaluar el papel del citopatólogo (22) no encontró diferencias en la sensibilidad del procedimiento cuando la muestra fue evaluada por especialistas con distinto nivel de experiencia ni que la presencia del citopatólogo en el momento de la toma de la muestra influyera en el resultado final. Otros autores han señalado que la experiencia de quien toma la muestra también puede ser un factor limitante en la calidad de la misma, considerándose que la biopsia transtorácica con aguja es un proceder con curva de aprendizaje (2, 20).
Existen en la práctica muy pocas contraindicaciones, considerándose como absolutas la presencia de un trastorno de la coagulación no corregido y la incapacidad del paciente para cooperar con el procedimiento (1, 2, 8). La enfermedad pulmonar obstructiva crónica y las lesiones profundas, aún cuando pueden incrementar el riesgo de neumotórax, no contraindican la punción torácica (1, 8), ya que la incidencia de neumotórax grave, que requiera inserción de tubo de pleurotomía es en realidad baja (1). Otras entidades que pueden constituirse en contraindicaciones relativas son el enfisema buloso (2), hipertensión pulmonar (2, 8), alta sospecha de tumores vasculares (2, 8), hipertensión arterial pulmonar, insuficiencia cardíaca, ventilación mecánica y evento coronario reciente (8).
Para la mejor comprensión de la técnica de realización de la biopsia pulmonar percutánea la hemos dividido en tres etapas: planificación, toma de muestra y cuidados posteriores.
Etapa 1: Planificación:
Cuando el médico de asistencia del paciente con indicación de biopsia pulmonar con aguja solicita la presencia del radiólogo intervencionista, cirujano, oncólogo u otro especialista dedicado al proceder, deben revisarse algunos aspectos básicos antes de la toma de muestra. Estos son:
Etapa 2: Toma de muestra:
Etapa 3: Cuidados posteriores:
A partir de 1976, cuando Haaga y Alfidi dan a conocer la realización de biopsia transtorácica con aguja utilizando tomografía axial computarizada, la técnica se generaliza y se incrementa notablemente su sensibilidad, indicaciones y tipos de enfermedades que pueden ser diagnosticadas (1, 4, 6). Antes de esta época la fluoroscopia era el método de elección y aunque ha sido desplazado por la tomografía, probablemente no signifique que sea inferior, sino que la tomografía está ampliamente disponible. De hecho, muchos afirman que la fluoroscopia garantiza mayores posibilidades de obtener material útil y la prefieren sobre la tomografía (1, 23). Entre las ventajas que se han atribuido a la fluoroscopia están el ser un estudio dinámico, que permite una imagen del procedimiento en tiempo real, pudiendo tomar en cuenta la influencia de los movimientos respiratorios; permite seleccionar fácilmente la ruta que evite las costillas y los procesos transversos; si el paciente tiene neumotórax y necesita aspirarse nuevamente, la fluoroscopia permite ajustar nuevamente la ruta a usar en la inserción de la aguja, lo cual tomaría más tiempo con la tomografía (1). La tomografía, en cambio, sería superior en tumores mediastinales e hiliares, lesiones de la pared torácica y nódulos de difícil visualización con la fluoroscopia, además de que expone menos al que realiza la técnica (1, 15). Una opción razonable en los centros que disponen de ambos métodos es combinarlos, usando la tomografía para la planificación de la punción y la fluoroscopia para la toma de biopsia (1). La ultrasonografía, por su parte, es un método seguro para lesiones periféricas, que no expone a radiaciones y puede representar una alternativa eficaz en entornos de recursos limitados (1, 24). En lesiones profundas del parénquima pulmonar carece prácticamente de valor (1, 19), pero se ha usado con éxito en el estudio de pacientes con síndrome de la vena cava superior (25). Otra técnica de imágenes de reciente introducción y cuya principal utilidad parece ser el estudio del nódulo pulmonar solitario (20) y detección temprana de metástasis (18), es la tomografía por emisión de positrones. La posibilidad de detectar actividad metabólica en el interior de las lesiones permite escoger el mejor sitio a puncionar, especialmente en recurrencias de neoplasias tratadas y grandes lesiones con necrosis asociada. Los nódulos pequeños o que morfológicamente parecen benignos se evaluarían con biopsia si presentan actividad metabólica incrementada (1).
Las figuras # 1, 2 y 3 ejemplifican el empleo de imágenes tomográficas como guía para biopsia transtorácica con aguja.
Las principales complicaciones que se presentan son: neumotórax, hemorragia, dolor pos-punción, infección, embolismo aéreo y siembra tumoral en el trayecto de la aguja.
El dolor en el sitio de punción dependerá de la sensibilidad del paciente y se previene con sedación ligera previa (1, 2, 8), infiltración del sitio a puncionar con anestésico local e introduciendo la aguja por sobre el borde superior de la costilla, para evitar el paquete vasculo-nervioso (1). Por lo general es de corta duración, a menos que se presente neumotórax y puede tratarse con analgésicos suaves (1, 19).
La infección es otra complicación reportada (8), cuya incidencia es en extremo rara y se previene con las normas habituales de asepsia y antisepsia.
El embolismo aéreo es raro, pero potencialmente fatal y se debe a entrada de aire en el circuito arterial sistémico del pulmón cuando se crea una fístula entre una vena pulmonar y una vía aérea. Las burbujas de aire alcanzan la aurícula izquierda a través de las venas pulmonares y desde allí pueden embolizar arterias coronarias e intra-craneales provocando infartos del territorio afecto. El riesgo se incrementa en lesiones centrales. Una terapéutica posible es la cámara hiperbárica (1, 8).
Se ha descrito la siembra de células tumorales malignas en el surco creado por el trayecto de la aguja, lo cual es raro, pero se ha usado como argumento en contra del procedimiento en pacientes con lesiones operables con signos imagenológicos de malignidad (1, 2). Un estudio realizado para cuantificar el posible efecto que pudiera tener esta complicación en la supervivencia de los pacientes no mostró diferencias significativas que pudieran ser atribuibles a la siembra tumoral (25).
El sangrado en forma de hemoptisis es la segunda complicación en importancia, reportada en casi todas las series, que sólo muy raramente llega a ser clínicamente significativa y suele ser auto-limitada. Se indica reposo, evitar maniobras de puño – percusión en el tórax o empleo de aerosoles (1, 7, 8, 12, 19, 21).
El neumotórax es la complicación más frecuente de la biopsia transtorácica con aguja, al punto que se ha afirmado que forma parte del proceder y que lo raro es que no ocurra con mayor frecuencia, dado que la aguja atraviesa la pleura hasta el pulmón (1). Su frecuencia varía entre distintas series entre un 8,2 % y un 42,3 %, lo que está en dependencia de la localización de las lesiones que se hayan puncionado y los criterios de selección para la prueba que hayan empleado los diferentes autores (1, 2, 7, 8, 10 - 12, 17 - 19, 21 – 23). En casi un 20 % el neumotórax es inestable o sintomático, aunque la evolución es lenta y casi nunca llega a constituir una emergencia médica, salvo en pacientes con enfermedad pulmonar obstructiva crónica grave, con reserva respiratoria disminuida (1). La mayoría de las publicaciones coinciden en señalar que muy pocos pacientes necesitan pleurotomía (1, 2, 7, 8, 10, 12, 17, 18, 22, 23) e incluso ninguno (19). La técnica coaxial ha demostrado reducción del riesgo de neumotórax a pesar de crear un defecto pleural mayor (8). Se han reportado casos muy raros de neumotórax bilateral si existe comunicación entre ambas pleuras, como puede ocurrir después de cirugía cardiovascular, trasplante de corazón o corazón pulmones, timectomía o resección esofágica transtorácica (27). Entre los factores de riesgo se ha señalado el enfisema pulmonar, sobre todo enfermedad bullosa (1), lesiones centrales (1, 11), tamaño del tumor y fisuras pleurales (1). No obstante, se ha publicado un estudio que no demuestra correlación entre el tamaño de la lesión y la incidencia de complicaciones (18), tampoco se ha observado un incremento de la incidencia de neumotórax y pleurotomías cuando se puncionan lesiones menores de 20 mm (17). Otro estudio no demostró que se incrementara realmente el riesgo de neumotórax al atravesar fisuras pleurales (28).
La biopsia transtorácica con aguja es un procedimiento seguro y sensible para el estudio de lesiones en pulmón, pleura o mediastino detectadas por estudios de imágenes. Las contraindicaciones absolutas se limitan a pacientes que no puedan cooperar con la técnica y diátesis hemorrágica no controlada. La tomografía axial computarizada y la fluoroscopia son los medios más usados como guía para el proceder y nos permiten acceder a cualquier lesión independientemente de su localización. El neumotórax es su principal complicación, seguido de hemorragias, dolor en el sitio de punción y más raramente embolismo aéreo, siembra tumoral en el trayecto de la aguja e infección.
Imagen 1: Medición del diámetro mayor del tumor.
Imagen 2: Cálculo del trayecto de la aguja y vía de acceso a través de la pared del tórax.

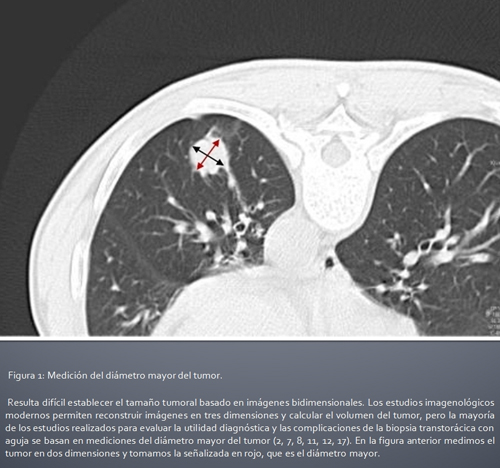 Imagen 1: Medición del diámetro mayor del tumor.
Imagen 1: Medición del diámetro mayor del tumor.

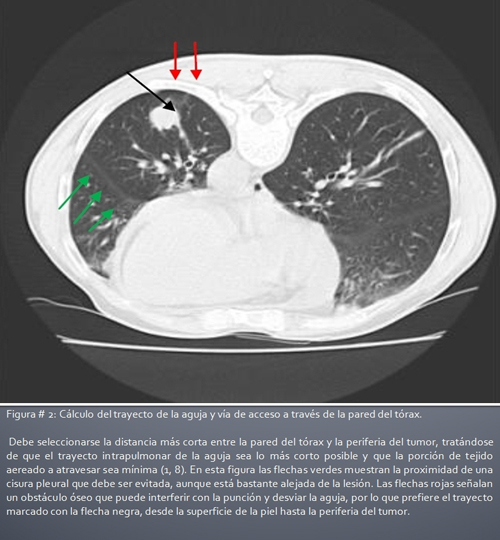 Imagen 2: Cálculo del trayecto de la aguja y vía de acceso a través de la pared del tórax.
Imagen 2: Cálculo del trayecto de la aguja y vía de acceso a través de la pared del tórax.

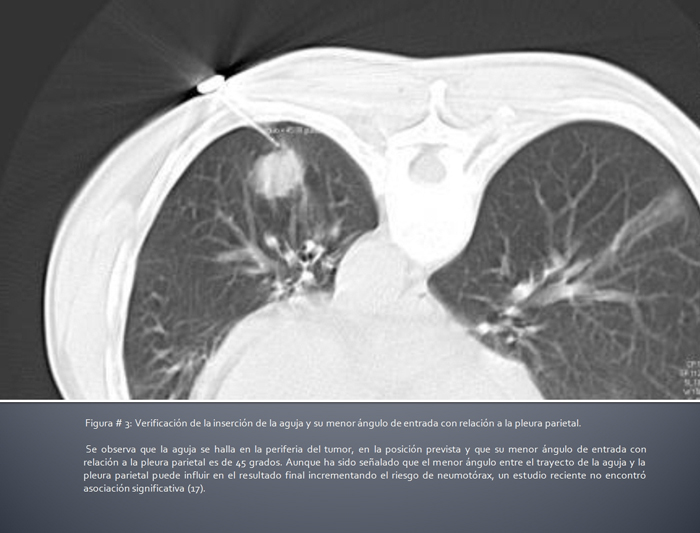 Imagen 3: Verificación de la inserción de la aguja y su menor ángulo de entrada con relación a la pleura parietal.
Imagen 3: Verificación de la inserción de la aguja y su menor ángulo de entrada con relación a la pleura parietal.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La biopsia transtorácica con aguja fina es un procedimiento de estudio de lesiones intratorácicas detectadas por imágenes, cuyo uso se remonta a la segunda mitad del siglo XIX. En el presente trabajo se realiza una revisión de los aspectos novedosos de la biopsia transtorácica guiada por imágenes, haciendo énfasis en la vigencia actual de la utilidad diagnóstica del procedimiento, su sensibilidad, especificidad, valor predictivo negativo y positivo. Igualmente se revisan aspectos formales de la realización del procedimiento, empleo de las imágenes, complicaciones y cuidados posteriores a la punción.
 Autores:
Carlos López Costa[1], Yoannys González Moreno[1], Adonis Frómeta Guerra[1], Eric Miller Dixon[1]
Autores:
Carlos López Costa[1], Yoannys González Moreno[1], Adonis Frómeta Guerra[1], Eric Miller Dixon[1]

Citación: López C, González Y, Frómeta A, Miller E. Image-guided percutaneous transthoracic needle biopsy. Medwave. 2011 Ene;11(04):e4831 doi: 10.5867/medwave.2011.01.4831
Fecha de envío: 21/10/2010
Fecha de aceptación: 4/12/2010
Fecha de publicación: 1/1/2011
Origen: no solicitado, ingresado por FTS
Tipo de revisión: con revisión externa por un revisor, autor ciego al revisor

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Thomas JW, Meziane MA, Vasquez RE. Transthoracic Needle Biopsy. [monografía en internet]. Medscape’s continually updated clinical reference; Actualizado 10 Nov. 2009 [citado 30 jun 2010]. | Link |
Thomas JW, Meziane MA, Vasquez RE. Transthoracic Needle Biopsy. [monografía en internet]. Medscape’s continually updated clinical reference; Actualizado 10 Nov. 2009 [citado 30 jun 2010]. | Link | Solak H, Östaz S, Aganoglu S, Tümer O, Hazar A, Kurutepe M. Diagnostic Value of Transthoracic Fine Needle Aspiration Biopsy in Thoracic Lesions. Turkish Respiratory Journal 2001;2 (2):11-15. | Link |
Solak H, Östaz S, Aganoglu S, Tümer O, Hazar A, Kurutepe M. Diagnostic Value of Transthoracic Fine Needle Aspiration Biopsy in Thoracic Lesions. Turkish Respiratory Journal 2001;2 (2):11-15. | Link | Leyden H. On infectious pneumonia. Dtsch Med Wochenschr 1883; 9:52-54.
Leyden H. On infectious pneumonia. Dtsch Med Wochenschr 1883; 9:52-54.  Hopper KD. Percutaneous, radiographically guided biopsy: a history. Radiology. 1995 Aug;196(2):329-33. | PubMed |
Hopper KD. Percutaneous, radiographically guided biopsy: a history. Radiology. 1995 Aug;196(2):329-33. | PubMed | Menetrier P. Cancer primitif du poumon. Bull Soc Anat 1886; 11:643-647.
Menetrier P. Cancer primitif du poumon. Bull Soc Anat 1886; 11:643-647.  Haaga JR, Alfidi RJ. Precise biopsy localization by computer tomography. Radiology. 1976 Mar;118(3):603-7. | PubMed |
Haaga JR, Alfidi RJ. Precise biopsy localization by computer tomography. Radiology. 1976 Mar;118(3):603-7. | PubMed | Yanardağ H, Caner M, Akman C, Melikoğlu Ů, Uygun S, Demirci S, Karayel T. Diagnostic value of transthoracic needle biopsy in 121 cases with peripheral pulmonary mass . The Internet Journal of Internal Medicine. 2004;4(2). | Link |
Yanardağ H, Caner M, Akman C, Melikoğlu Ů, Uygun S, Demirci S, Karayel T. Diagnostic value of transthoracic needle biopsy in 121 cases with peripheral pulmonary mass . The Internet Journal of Internal Medicine. 2004;4(2). | Link | Kocijanèiè I, Kocijanèiè K. CT-guided percutaneous transthoracic needle biopsy of lung lesions – 2-year experience at the Institute of Radiology in Ljubljana. Radiol Oncol 2007; 41(3): 99-106. | CrossRef |
Kocijanèiè I, Kocijanèiè K. CT-guided percutaneous transthoracic needle biopsy of lung lesions – 2-year experience at the Institute of Radiology in Ljubljana. Radiol Oncol 2007; 41(3): 99-106. | CrossRef | Sidiropoulou N, Filippousis P, Apostolopoulou S, Tsangaridou I, Thanos L. Tumor-like pulmonary sarcoidosis diagnosed by CT-guided transthoracic lung biopsy. Cases J. 2009 May 15;2:6607. | CrossRef | PubMed | PMC |
Sidiropoulou N, Filippousis P, Apostolopoulou S, Tsangaridou I, Thanos L. Tumor-like pulmonary sarcoidosis diagnosed by CT-guided transthoracic lung biopsy. Cases J. 2009 May 15;2:6607. | CrossRef | PubMed | PMC | Klein JS, Johnson A, Watson E, Mount S. CT-guided transthoracic needle biopsy in the diagnosis of sarcoidosis. J Thorac Imaging. 2009 Feb;24(1):23-30. | CrossRef | PubMed |
Klein JS, Johnson A, Watson E, Mount S. CT-guided transthoracic needle biopsy in the diagnosis of sarcoidosis. J Thorac Imaging. 2009 Feb;24(1):23-30. | CrossRef | PubMed | Uskül BT, Türker H, Gökçe M, Kant A, Arslan S, Turan FE. CT-guided transthoracic fine needle aspiration of pulmonary lesions: accuracy and complications in 134 cases. Tuberk Toraks. 2009;57(2):177-85. | PubMed |
Uskül BT, Türker H, Gökçe M, Kant A, Arslan S, Turan FE. CT-guided transthoracic fine needle aspiration of pulmonary lesions: accuracy and complications in 134 cases. Tuberk Toraks. 2009;57(2):177-85. | PubMed | Arslan S, Yilmaz A, Bayramgürler B, Uzman O, Nver E, Akkaya E. CT- guided transthoracic fine needle aspiration of pulmonary lesions: accuracy and complications in 294 patients. Med Sci Monit. 2002 Jul;8(7):CR493-7. | PubMed |
Arslan S, Yilmaz A, Bayramgürler B, Uzman O, Nver E, Akkaya E. CT- guided transthoracic fine needle aspiration of pulmonary lesions: accuracy and complications in 294 patients. Med Sci Monit. 2002 Jul;8(7):CR493-7. | PubMed | Hernes SS, Hagen E, Tofteland S, Finsen NT, Christensen A, Giske CG, Spindler C, Bakke PS, Bjorvatn B. Transthoracic fine-needle aspiration in the aetiological diagnosis of community-acquired pneumonia. Clin Microbiol Infect. 2010 Jul;16(7):909-11. Epub 2009 Jul 21. | PubMed |
Hernes SS, Hagen E, Tofteland S, Finsen NT, Christensen A, Giske CG, Spindler C, Bakke PS, Bjorvatn B. Transthoracic fine-needle aspiration in the aetiological diagnosis of community-acquired pneumonia. Clin Microbiol Infect. 2010 Jul;16(7):909-11. Epub 2009 Jul 21. | PubMed | Pila Pérez R, Pila Peláez R, Rosales Torres P, Alzate Giraldo LF, Holguín Prieto V. Hemangioendotelioma epiteloide del mediastino: síndrome de la vena cava superior y síndrome de Kasabach-Merritt: a propósito de un caso. Mapfre Medicina 2007;18(2):147-152.
Pila Pérez R, Pila Peláez R, Rosales Torres P, Alzate Giraldo LF, Holguín Prieto V. Hemangioendotelioma epiteloide del mediastino: síndrome de la vena cava superior y síndrome de Kasabach-Merritt: a propósito de un caso. Mapfre Medicina 2007;18(2):147-152.  Kulkarni S, Kulkarni A, Roy D, Thakur MH. Percutaneous computed tomography-guided core biopsy for the diagnosis of mediastinal masses. Ann Thorac Med. 2008 Jan;3(1):13-7. | CrossRef | PubMed | PMC |
Kulkarni S, Kulkarni A, Roy D, Thakur MH. Percutaneous computed tomography-guided core biopsy for the diagnosis of mediastinal masses. Ann Thorac Med. 2008 Jan;3(1):13-7. | CrossRef | PubMed | PMC | Kallenberg MH, Gill RR, Factor RE, Bryar JM, Rubin RH, Jacobson FL, Marty FM. Diagnostic efficacy and safety of computed tomography-guided transthoracic needle biopsy in patients with hematologic malignancies. Acad Radiol. 2009 Nov;16(11):1408-15. Epub 2009 Aug 15. | CrossRef | PubMed |
Kallenberg MH, Gill RR, Factor RE, Bryar JM, Rubin RH, Jacobson FL, Marty FM. Diagnostic efficacy and safety of computed tomography-guided transthoracic needle biopsy in patients with hematologic malignancies. Acad Radiol. 2009 Nov;16(11):1408-15. Epub 2009 Aug 15. | CrossRef | PubMed | Ohno Y, Hatabu H, Takenaka D, Higashino T, Watanabe H, Ohbayashi C, Sugimura K. CT-guided transthoracic needle aspiration biopsy of small (< or = 20 mm) solitary pulmonary nodules. AJR Am J Roentgenol. 2003 Jun;180(6):1665-9. | PubMed |
Ohno Y, Hatabu H, Takenaka D, Higashino T, Watanabe H, Ohbayashi C, Sugimura K. CT-guided transthoracic needle aspiration biopsy of small (< or = 20 mm) solitary pulmonary nodules. AJR Am J Roentgenol. 2003 Jun;180(6):1665-9. | PubMed | Kothary N, Lock L, Sze DY, Hofmann LV. Computed tomography-guided percutaneous needle biopsy of pulmonary nodules: impact of nodule size on diagnostic accuracy. Clin Lung Cancer. 2009 Sep;10(5):360-3. | CrossRef | PubMed |
Kothary N, Lock L, Sze DY, Hofmann LV. Computed tomography-guided percutaneous needle biopsy of pulmonary nodules: impact of nodule size on diagnostic accuracy. Clin Lung Cancer. 2009 Sep;10(5):360-3. | CrossRef | PubMed | Singh JP, Garg L, Setia V. Computed Tomography (CT) Guided Transthoracic Needle Aspiration Cytology in difficult thoracic mass lesions not approachable by USG. Ind J Radiol Imag 2004;14:4:395-400. | Link |
Singh JP, Garg L, Setia V. Computed Tomography (CT) Guided Transthoracic Needle Aspiration Cytology in difficult thoracic mass lesions not approachable by USG. Ind J Radiol Imag 2004;14:4:395-400. | Link | Lucena J, Coronel P, Orellana Y. Incidencia de lesiones benignas en pacientes sometidos a resecciones pulmonares por sospecha de neoplasias maligna. Revista Chilena de Cirugía. 2009;61(1):27-32. | CrossRef |
Lucena J, Coronel P, Orellana Y. Incidencia de lesiones benignas en pacientes sometidos a resecciones pulmonares por sospecha de neoplasias maligna. Revista Chilena de Cirugía. 2009;61(1):27-32. | CrossRef | Arakawa H, Nakajima Y, Kurihara Y, Niimi H, Ishikawa T. CT-guided transthoracic needle biopsy: a comparison between automated biopsy gun and fine needle aspiration. Clin Radiol. 1996 Jul;51(7):503-6. | CrossRef | PubMed |
Arakawa H, Nakajima Y, Kurihara Y, Niimi H, Ishikawa T. CT-guided transthoracic needle biopsy: a comparison between automated biopsy gun and fine needle aspiration. Clin Radiol. 1996 Jul;51(7):503-6. | CrossRef | PubMed | Priola AM, Priola SM, Cataldi A, Di Franco M, Pazè F, Marci V, Berruti A. Diagnostic accuracy and complication rate of CT-guided fine needle aspiration biopsy of lung lesions: a study based on the experience of the cytopathologist. Acta Radiol. 2010 Jun;51(5):527-33. | CrossRef | PubMed |
Priola AM, Priola SM, Cataldi A, Di Franco M, Pazè F, Marci V, Berruti A. Diagnostic accuracy and complication rate of CT-guided fine needle aspiration biopsy of lung lesions: a study based on the experience of the cytopathologist. Acta Radiol. 2010 Jun;51(5):527-33. | CrossRef | PubMed | Hiraki T, Mimura H, Gobara H, Shibamoto K, Inoue D, Matsui Y, Kanazawa S. Incidence of and risk factors for pneumothorax and chest tube placement after CT fluoroscopy-guided percutaneous lung biopsy: retrospective analysis of the procedures conducted over a 9-year period. AJR Am J Roentgenol. 2010 Mar;194(3):809-14. | CrossRef | PubMed |
Hiraki T, Mimura H, Gobara H, Shibamoto K, Inoue D, Matsui Y, Kanazawa S. Incidence of and risk factors for pneumothorax and chest tube placement after CT fluoroscopy-guided percutaneous lung biopsy: retrospective analysis of the procedures conducted over a 9-year period. AJR Am J Roentgenol. 2010 Mar;194(3):809-14. | CrossRef | PubMed | Diacon AH, Theron J, Schubert P, Brundyn K, Louw M, Wright CA, Bolliger CT. Ultrasound-assisted transthoracic biopsy: fine-needle aspiration or cutting-needle biopsy? Eur Respir J. 2007 Feb;29(2):357-62. Epub 2006 Nov 1. | CrossRef | PubMed |
Diacon AH, Theron J, Schubert P, Brundyn K, Louw M, Wright CA, Bolliger CT. Ultrasound-assisted transthoracic biopsy: fine-needle aspiration or cutting-needle biopsy? Eur Respir J. 2007 Feb;29(2):357-62. Epub 2006 Nov 1. | CrossRef | PubMed | Koegelenberg CF, Bolliger CT, Plekker D, Wright CA, Brundyn K, Louw M, Schubert P, van den Heuvel MM, Diacon AH. Diagnostic yield and safety of ultrasound-assisted biopsies in superior vena cava syndrome. Eur Respir J. 2009 Jun;33(6):1389-95. Epub 2009 Feb 12. | CrossRef | PubMed |
Koegelenberg CF, Bolliger CT, Plekker D, Wright CA, Brundyn K, Louw M, Schubert P, van den Heuvel MM, Diacon AH. Diagnostic yield and safety of ultrasound-assisted biopsies in superior vena cava syndrome. Eur Respir J. 2009 Jun;33(6):1389-95. Epub 2009 Feb 12. | CrossRef | PubMed | Wisnivesky JP, Henschke CI, Yankelevitz DF. Diagnostic percutaneous transthoracic needle biopsy does not affect survival in stage I lung cancer. Am J Respir Crit Care Med. 2006 Sep 15;174(6):684-8. Epub 2006 Jun 23. | CrossRef | PubMed |
Wisnivesky JP, Henschke CI, Yankelevitz DF. Diagnostic percutaneous transthoracic needle biopsy does not affect survival in stage I lung cancer. Am J Respir Crit Care Med. 2006 Sep 15;174(6):684-8. Epub 2006 Jun 23. | CrossRef | PubMed | Simonett-Luthy D, Strobel W, Chhajed PN. Recurrent bilateral pneumothorax. J Assoc Physicians India. 2009 May;57:405-6. | PubMed |
Simonett-Luthy D, Strobel W, Chhajed PN. Recurrent bilateral pneumothorax. J Assoc Physicians India. 2009 May;57:405-6. | PubMed |