 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La matriz ósea esta compuesta por dos fases principales a escala nanométrica: La orgánica que representa aproximadamente el 35% del peso seco del hueso. Formada fundamentalmente por proteínas, entre las que destaca el colágeno (90%), tipo I (>95%) y tipo V (<5%). También se ha comprobado la presencia, en pequeñas proporciones, de colágeno tipo III, relacionado con las fibras de Sharpey y tipo XII, constituido bajo estrés mecánico.
La molécula de colágeno contiene a los aminoácidos hidroxilisina e hidroxiprolina, este último un marcador específico de todos los fenotipos de colágeno (Tabla I). El 10% restante lo forman proteínas no colagénicas (proteoglicanos o glicoproteínas).
Tabla 1. Proteínas en la matriz ósea
En la matriz osteoide hay cuatro tipos de proteoglicanos: hialuronano y condroitín sulfato: de molécula grande, intervienen en las etapas iniciales de la morfogénesis ósea. Biglicano y decorina: de molécula más pequeña, aparecen en las fases siguientes de la formación ósea. Estas proteínas no colagénicas pueden modular la adherencia celular y median en la calcificación de la matriz orgánica.
Las proteínas con ácido gamma-carboxi-glutámico son la osteocalcina y la proteína de la matriz con ácido gamma-carboxiglutámico. Este ácido es un aminoácido que liga calcio y necesita vitamina K para su síntesis.
La osteocalcina es una pequeña proteína de la matriz sintetizada por los osteoblastos y plaquetas, dependiente de las vitaminas D y K. Representa el 15% de las proteínas no colágenas de la matriz y sus niveles plasmáticos se han considerado como uno de los marcadores bioquímicos de la osteogénesis, relacionándose con el número y actividad de los osteoblastos.
Las glicoproteínas son la osteonectina, la fosfatasa alcalina y las proteínas con el tripéptido RGD (Arg-Gly-Asp).
La osteonectina es una glicoproteína con gran afinidad por el colágeno tipo I, por el calcio y por la hidroxiapatita. Representa el 25% de las proteínas no colágenas. Se cree que interviene en la regulación de la adhesión celular entre la matriz y las células. En el hueso es necesaria para la mineralización normal.
La fosfatasa alcalina es una enzima que libera fosfato inorgánico a partir de ésteres fosfóricos, necesario para la mineralización. Existen varias isoenzimas y, entre ellas la ósea, que se han considerado un buen marcador de la actividad osteoblástica.
Proteínas con el tripéptido RGD, también llamadas SIBLINGS (Small Integrin-Binding Ligand, N-linked Glycoprotein) son fundamentalmente cinco: osteopontina, sialoproteínas óseas, fibronectina, trombospondina y vitronectina. Son glicoproteínas fundamentales en los procesos de remodelado y regeneración óseos, con una secuencia Arg-Gly-Asp (RGD) que es reconocida por las integrinas de los osteoblastos y los osteoclastos (avbeta3, entre otras). También actúan como receptores de superficie de las células óseas permitiendo la adhesión de las células a la matriz extracelular y activando señales. Otras proteínas procedentes del plasma se encuentran en la matriz orgánica ósea en mayor proporción. Son la albúmina y la a2-SH-glicoproteína, probablemente relacionadas con la incorporación del calcio a la matriz osteoide.
Por último los factores de crecimiento, polipéptidos sintetizados en el propio hueso o procedentes de otros lugares (hígado, plaquetas, etc.), que intervienen en la diferenciación, crecimiento y proliferación de las células de forma autocrina o paracrina (1) .
La matriz inorgánica representa 60 a 70% del peso en seco del hueso. El 99% del calcio, el 85% del fósforo, y cerca del 40-60% del sodio y magnesio del organismo residen en el esqueleto. El colágeno tipo I del osteoide, con una estructura fibrosa típica cuyo diámetro varia entre 100 y 200 nm es el sustrato en el que, por mineralización, se deposita el fosfato cálcico. Un proceso ordenado, tiempo-dependiente, modulado por las células, se realiza a razón de 1-2 um al día (2).
La regulación de esta homeostasis mineral del hueso se lleva a cabo por los iones: calcio, fosfato y magnesio que responden a la acción de la vitamina D3, la hormona paratiroidea (HPT) y la calcitonina. La vitamina D3 aumenta la reabsorción de calcio a nivel intestinal, la HPT la reabsorción a nivel renal, además activa los osteoclastos y la calcitonina, y desactiva los osteoblastos, facilitando la restauración del nivel basal de calcio.
Los minerales no están directamente ligados al colágeno sino a las proteínas no colágenas. Estas suponen de 3 a 5% de la composición del hueso y proveen emplazamientos activos para la biomineralización y unión celular.
Urist (3), en 1965, descubrió factores de diferenciación que facilitaban el reclutamiento y diferenciación de células mesenquimales, específicamente las que inducen la formación de osteoblastos, capaces de provocar formación ósea en lugares ectópicos. Sampath y Reddi (4) observaron que la matriz ósea carecía de actividad osteoinductora tras la extracción de las proteínas que contenía, pero que esta actividad era restablecida al reconstituir dicha matriz de nuevo con el extracto proteico, demostrando que las moléculas responsables de la osteoinducción se encontraban en la fracción soluble de la matriz ósea. Hecho clave para su posterior aislamiento e identificación.
A estos factores de diferenciación se les denomino Proteínas Morfogenéticas Humanas (PMH), un grupo de morfogenes que dirigen el desarrollo embriológico de las células y juegan un papel importante en la fisiología postfetal. Friedenstein (5) describió que pueden dar origen a cinco estirpes celulares distintas: fibroblastos, osteoblastos, condroblastos, adipocitos y mioblastos, en respuesta a diferentes señales moleculares que inician la cascada de activación de genes. Wozney (6) las identificó como proteínas morfogenéticas óseas, parte de la superfamilia de proteínas del factor de crecimiento transformador de proteínas beta.
Las funciones de las PMH son contradictorias ya que presentan propiedades eclécticas, una característica única de los morfogenes, por lo que se les ha denominado pleiotrópicas. Los receptores para las PMH son moléculas transmembrana que contienen el dominio serina/treonina/kinasa, de manera que un mismo receptor puede unirse a diferentes PMH (7). La regulación de sus efectos se debe a que depende de la combinación de diferentes receptores para desarrollar una acción u otra.
Tienen diferentes orígenes. Pueden ser producidos por el sistema inmunitario, por las plaquetas o también por células de la línea osteogénica. Pueden tener su efecto en células cercanas a las que producen el factor (acción paracrina), sobre las mismas células (acción autocrina), o pueden ser almacenadas en la matriz ósea y ser liberados posteriormente en la resorción ósea (acción paracrina tardía). Algunas de estas sustancias deben actuar en asociación con hormonas como la HPT, la calcitonina o la vitamina D3. A continuación los enumeramos:
Las células mesenquimáticas pluripotenciales se diferencian directamente en el seno del tejido conjuntivo en células formadoras óseas (osteoblastos) en respuesta a las moléculas de adhesión y los factores solubles de señal. Este tipo de formación ósea directa es lo que caracteriza el desarrollo del hueso intramembranoso (8).
Las proteínas morfogenéticas óseas (PMH) promueven la diferenciación osteoblástica de las células pluripotenciales, posiblemente porque exista un gradiente de concentración de PMH (9). En la secuencia de formación de hueso endocondral, al que pertenecen la base del cráneo, columna vertebral, pelvis y extremidades, las células mesenquimáticas siguen un camino hacia la estirpe celular condrogénica en lugar de hacia la osteogénica, el motivo tampoco está bien identificado, pero se especula si las PMH y la síntesis local de factores angiogénicos o angiogenéticos como el Factor básico de crecimiento fibroblástico (FBCF), actúan en esas localizaciones modulando la expresión del fenotipo celular hacia esta línea condrogénica (10).
Donde se hace más evidente este proceso es en los centros de osificación primaria de los huesos largos, entre la epífisis y la metáfisis. En la metáfisis los condrocitos en diferentes estadios de evolución se disponen ordenadamente en forma de columnas longitudinales, lo que permite el crecimiento del hueso en longitud, a través de los centros de osificación secundaria, cuando los osteoblastos provenientes del pericondrio invaden los espacios dejados por los condrocitos degenerados e inician la formación ósea.
Independientemente de la ruta de la histogénesis ósea, no existe ninguna diferencia bioquímica, morfológica o funcional entre el hueso endocondral y el intramembranoso, y durante la reparación ósea del esqueleto en el adulto también responden a los mismos factores (11). Las diferencias entre estos huesos de distinto origen se encuentran en la carga funcional y la vascularización. Por ejemplo, el hueso intramembranoso tiene una vascularización mayor que el de las extremidades, lo que puede ser un factor determinante en cuanto a permitir una mayor concentración de PMH a nivel local (12).
Cuando se produce una fractura ósea, las células y las moléculas de señal aparecen en el lugar a reparar de la misma manera que en el proceso embriogénico. En el momento inicial se desencadena una respuesta inflamatoria, con activación del complemento y rotura de vasos. La degradación proteolítica de la matriz extracelular aporta factores quimiotácticos para los monocitos y los macrófagos.
Una vez que se activan los macrófagos liberan el FBCF que estimula a las células endoteliales a expresar el activador del plasminógeno y la procolagenasa. La sangre extravasada forma un coágulo, y las plaquetas que lo integran tienen una función dual: la de hemostasia y la de liberar factores como el FCDP y FCT beta. La zona dañada presenta una hipoxia debido a la rotura de los vasos sanguíneos. Como consecuencia se produce una disminución del pH, y los macrófagos y leucocitos polimorfonucleares actúan eliminando los detritus celulares a la vez que secretan factores que promueven la quimiotaxis y la mitogénesis (13).
A los 3-5 días se constituye un tejido de granulación, consistente en vasos, colágeno y células. El colágeno será el substrato que contenga los factores a los que serán sensibles las células y el lugar donde ellas se anclarán cuando lleguen a través de los vasos, periostio, endostio y médula ósea, diferenciándose posteriormente en osteoblastos y condroblastos.
La maduración del tejido de granulación se produce en varias semanas hasta que se forma el callo óseo, más tarde sustituido por hueso fibroso inmaduro y posteriormente por hueso lamelar. El papel del callo óseo es estabilizar los fragmentos de la fractura ya que si existe movilidad este proceso no puede llevarse a cabo, con lo que el tejido que predominará será de tipo cartilaginoso.
El último evento que ocurre en la cascada de fenómenos de reparación ósea es el remodelado. Un proceso de activación- reabsorción- formación, donde los osteoclastos se activan produciendo las lagunas de Howship, que serán repobladas por osteoblastos que expresan osteoide y cuando éste se calcifica se restaura la morfología ósea (14). Este equipo de células se denomina unidad básica multicelular.
El proceso de remodelado en el hueso cortical será llevado a cabo por los osteoclastos que labran un túnel que posteriormente se repuebla de osteoblastos. A esta unidad funcional que constituyen ambas células se le denomina cono de corte y actúa en la matriz como una especie de taladro acompañado por las estructuras vasculares que crecen a medida que avanza su actividad erosiva. A cierta distancia del frente de erosión se alinean los osteoblastos, bordeando las paredes de la matriz, que se disponen, en forma progresiva para cerrar el túnel creado por los osteoblastos pero sin llegar a obliterarlo. El resultado final de todo este proceso será un conducto de Havers.
El hematoma fracturario y la hipoxia local son los desencadenantes del proceso de consolidación al que dividiremos en dos fases. La primera caracterizada por la homeostasis y la liberación de mediadores como el FCDP y FCT beta que promueven la quimiotaxis y la mitogénesis. En la segunda el colágeno servirá de sustrato para todos aquellos elementos involucrados en el proceso de cicatrización y que llegan a través del aporte vascular para diferenciarse en osteoblastos y condroblastos.
Durante esta fase las BMP difunden a partir de esta matriz ósea, pasando en una fase posterior a ser sintetizadas por las células osteogénicas que han sido reclutadas por las propias BMP y que son sometidas a un proceso de diferenciación osteoblástica (Fig. 1). Con ello se consigue el mantenimiento de la acción reparadora sobre el tejido dañado a lo largo del tiempo necesario para su reparación (15).
Figura 1. Cascada de formación del tejido óseo.
Las proteínas óseas morfogenéticas regulan la quimiotaxis, la mitosis, y la diferenciación. Los factores de transformación del crecimiento están 100 veces más concentrados en el hueso que en otros tejidos. Los osteoblastos tienen una concentración alta de receptores para él. Las proteínas óseas morfogenéticas y los factores de transformación del crecimiento refuerzan la curación de la fractura y pueden minimizar la proporciones de no unión (16). Estas proteínas tienen una corta vida media biológica y debe mantenerse a concentraciones terapéuticas en el foco de fractura para ser eficaces.

 Tabla 1. Proteínas en la matriz ósea
Tabla 1. Proteínas en la matriz ósea

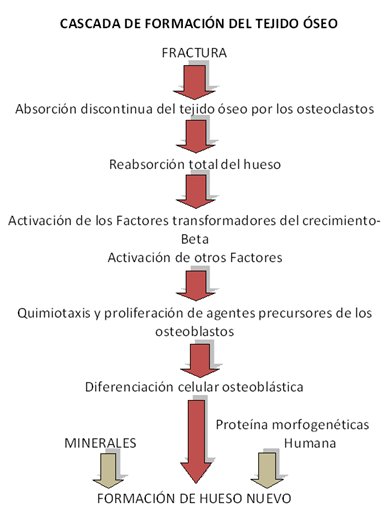 Figura 1. Cascada de formación del tejido óseo.
Figura 1. Cascada de formación del tejido óseo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Autor:
Yovanny Ferrer Lozano[1]
Autor:
Yovanny Ferrer Lozano[1]

Citación: Ferrer Y. Bone matrix and healing. Medwave 2009 Sep;9(9):4155 doi: 10.5867/medwave.2009.09.4155
Fecha de publicación: 1/9/2009
Origen: no solicitado
Tipo de revisión: sin revisión por pares

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Canalis E, Economides AN, Gazzerro E. Bone morphogenetic proteins, their antagonists, and the skeleton. Endocr Rev. 2003 Apr;24(2):218-35. | CrossRef | PubMed |
Canalis E, Economides AN, Gazzerro E. Bone morphogenetic proteins, their antagonists, and the skeleton. Endocr Rev. 2003 Apr;24(2):218-35. | CrossRef | PubMed | Simões R, Carolina C, Verna C, Teixeira R. Cellular and molecular aspects of bone remodelation. Femina 2006; 35(5):279-283.
Simões R, Carolina C, Verna C, Teixeira R. Cellular and molecular aspects of bone remodelation. Femina 2006; 35(5):279-283.  Urist MR. Bone: formation by autoinduction. Science. 1965 Nov 12;150(3698):893-9. | CrossRef | PubMed |
Urist MR. Bone: formation by autoinduction. Science. 1965 Nov 12;150(3698):893-9. | CrossRef | PubMed | Sampath TK, Reddi AH. Dissociative extraction and reconstitution of extracellular matrix components involved in local bone differentiation. Proc Natl Acad Sci U S A. 1981 Dec;78(12):7599-603. | CrossRef | PubMed | PMC |
Sampath TK, Reddi AH. Dissociative extraction and reconstitution of extracellular matrix components involved in local bone differentiation. Proc Natl Acad Sci U S A. 1981 Dec;78(12):7599-603. | CrossRef | PubMed | PMC | Friedenstein AJ. Precursor cells of mechanocytes. Int Rev Cytol. 1976;47:327-59. | CrossRef | PubMed |
Friedenstein AJ. Precursor cells of mechanocytes. Int Rev Cytol. 1976;47:327-59. | CrossRef | PubMed | Wozney JM, Rosen V, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, et al. Novel regulators of bone formation: molecular clones and activities. Science. 1988 Dec 16;242(4885):1528-34. | CrossRef | PubMed |
Wozney JM, Rosen V, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, et al. Novel regulators of bone formation: molecular clones and activities. Science. 1988 Dec 16;242(4885):1528-34. | CrossRef | PubMed | Nunes FD, Valenzuela Mda G, Rodini CO, Massironi SM, Ko GM. Localization of Bmp-4, Shh and Wnt-5a transcripts during early mice tooth development by in situ hybridization. Braz Oral Res. 2007 Apr-Jun;21(2):127-33. | CrossRef | PubMed |
Nunes FD, Valenzuela Mda G, Rodini CO, Massironi SM, Ko GM. Localization of Bmp-4, Shh and Wnt-5a transcripts during early mice tooth development by in situ hybridization. Braz Oral Res. 2007 Apr-Jun;21(2):127-33. | CrossRef | PubMed | De Biase P, Capanna R. Clinical applications of BMPs. Injury. 2005 Nov;36 Suppl 3:S43-6. | CrossRef | PubMed |
De Biase P, Capanna R. Clinical applications of BMPs. Injury. 2005 Nov;36 Suppl 3:S43-6. | CrossRef | PubMed | Ferrigno C, Della N, Fantoni D. A comparative study of osteosynthesis with plates and plates associated with grafts of bone morphogenic proteins (Gen-Tech®) in distal radio-ulna fractures in dogs with less than 6 quilograms. Pesq. Braz j vet res 2007 ;27(2):65-69.
Ferrigno C, Della N, Fantoni D. A comparative study of osteosynthesis with plates and plates associated with grafts of bone morphogenic proteins (Gen-Tech®) in distal radio-ulna fractures in dogs with less than 6 quilograms. Pesq. Braz j vet res 2007 ;27(2):65-69.  Hutmacher DW, Garcia AJ. Scaffold-based bone engineering by using genetically modified cells. Gene. 2005 Feb 28;347(1):1-10. | CrossRef | PubMed |
Hutmacher DW, Garcia AJ. Scaffold-based bone engineering by using genetically modified cells. Gene. 2005 Feb 28;347(1):1-10. | CrossRef | PubMed | Murugan R, Ramakrishna A. Development of nanocomposites for bone grafting. Composites Science and technology 2005; 65: 2385-406. | CrossRef |
Murugan R, Ramakrishna A. Development of nanocomposites for bone grafting. Composites Science and technology 2005; 65: 2385-406. | CrossRef | Khan SN, Cammisa FP Jr, Sandhu HS, Diwan AD, Girardi FP, Lane JM. The biology of bone grafting. J Am Acad Orthop Surg. 2005 Jan-Feb;13(1):77-86. | PubMed |
Khan SN, Cammisa FP Jr, Sandhu HS, Diwan AD, Girardi FP, Lane JM. The biology of bone grafting. J Am Acad Orthop Surg. 2005 Jan-Feb;13(1):77-86. | PubMed | Selvamurugan N, Jefcoat SC, Kwok S, Kowalewski R, Tamasi JA, Partridge NC. Overexpression of Runx2 directed by the matrix metalloproteinase-13 promoter containing the AP-1 and Runx/RD/Cbfa sites alters bone remodeling in vivo. J Cell Biochem. 2006 Oct 1;99(2):545-57. | CrossRef | PubMed |
Selvamurugan N, Jefcoat SC, Kwok S, Kowalewski R, Tamasi JA, Partridge NC. Overexpression of Runx2 directed by the matrix metalloproteinase-13 promoter containing the AP-1 and Runx/RD/Cbfa sites alters bone remodeling in vivo. J Cell Biochem. 2006 Oct 1;99(2):545-57. | CrossRef | PubMed | Gil J, Garrido R, Gil R, Melgosa M. Materiales para la reparación y sustitución ósea. Factores de crecimiento y terapia genética en Cirugía Ortopédica y Traumatología. Mapfre Medicina 2003;14: 51-65. | Link |
Gil J, Garrido R, Gil R, Melgosa M. Materiales para la reparación y sustitución ósea. Factores de crecimiento y terapia genética en Cirugía Ortopédica y Traumatología. Mapfre Medicina 2003;14: 51-65. | Link | Bostrom MP. Expression of bone morphogenetic proteins in fracture healing. Clin Orthop Relat Res. 1998 Oct;(355 Suppl):S116-23. | CrossRef | PubMed |
Bostrom MP. Expression of bone morphogenetic proteins in fracture healing. Clin Orthop Relat Res. 1998 Oct;(355 Suppl):S116-23. | CrossRef | PubMed | Zambuzzi W, Oliveira RC, Piozzi R, Cestari T, Taga R. Histological evaluation of acellular and demineralized fetal bovine bone in the subcutaneous of rats. Rev Bra ortop 2006;41(6): 227-232.
Zambuzzi W, Oliveira RC, Piozzi R, Cestari T, Taga R. Histological evaluation of acellular and demineralized fetal bovine bone in the subcutaneous of rats. Rev Bra ortop 2006;41(6): 227-232.