 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: network meta-analysis, systematic reviews as topic
Este artículo forma parte de una serie metodológica colaborativa de revisiones narrativas sobre bioestadística y epidemiología clínica. El objetivo de este trabajo es presentar conceptos básicos respecto de las revisiones sistemáticas de intervenciones múltiples con metanálisis en red. Para las preguntas clínicas en las que hay muchas alternativas terapéuticas que compiten (o se comparan) entre sí. La pregunta central es cómo clasificar u ordenar jerárquicamente su efecto (beneficio y/o daño) para escoger la mejor opción. Los metanálisis en red buscan responder a preguntas relacionadas con la efectividad o seguridad de múltiples tratamientos comparados entre sí, mediante el análisis simultáneo de resultados surgidos tanto de comparaciones directas como de comparaciones indirectas. La geometría de la red (network geometry) es la representación gráfica general de los metanálisis en red y permite comprender e incluso evaluar la fuerza de las comparaciones. Para que un metanálisis de comparaciones múltiples sea válido debe cumplir una serie de supuestos, destacándose el supuesto de transitividad que permite asumir que no hay diferencias sistemáticas entre las comparaciones disponibles, a excepción de las intervenciones comparadas. Así, es posible conocer la efectividad terapéutica relativa entre cualquier par de intervenciones del metanálisis en red y el orden de las intervenciones en términos de su categorización. Se ha propuesto utilizar el modelo Grading of Recommendation, Assessment, Development, and Evaluation (GRADE) modificado en cuanto a las particularidades de los metanálisis en red para valorar la certeza de la evidencia, tanto para cada comparación como para la jerarquización de intervenciones.
|
Ideas clave
|
Frente al rápido aumento de estudios y reportes han surgido distintos diseños metodológicos para sintetizar y analizar dicha información. Este es el caso de las revisiones sistemáticas. Las revisiones sistemáticas han sido consideradas por mucho tiempo como el nivel más alto en la jerarquía de la evidencia, pues el uso de metodologías explícitas y claras en su elaboración y análisis, han aumentado la confianza en ellas para la toma de decisiones en la práctica clínica a pequeña y gran escala. Recientemente se ha propuesto que las revisiones sistemáticas pueden ser vistas como el lente a través del cual se observa y aplica la evidencia existente, más que por un nivel de evidencia en sí misma, por sus características metodológicas [1].
Para las preguntas clínicas en las que hay muchos regímenes o alternativas terapéuticas que compiten (o se comparan) entre sí, la pregunta central es cómo clasificar o jerarquizar su efecto (por ejemplo, beneficio y/o daño), a fin de escoger la mejor opción [2]. Desde el punto de vista de los tomadores de decisiones, puede ser muy difícil valorar los beneficios relativos de cada tratamiento versus otra opción disponible. Esto es de especial relevancia cuando hay múltiples alternativas terapéuticas que no han sido comparadas directamente mediante un ensayo clínico aleatorizado. Además, no siempre la mejor opción en términos terapéuticos es accesible o aplicable, por lo que conocer la segunda o tercera mejor opción puede ser útil. En este sentido cobra especial interés ordenar mediante un ranking las múltiples alternativas terapéuticas.
Frente a esta inquietud, en 2002 se propuso el metanálisis en red como un procedimiento estadístico de síntesis de evidencia capaz de comparar diferentes alternativas terapéuticas a través de comparaciones directas e indirectas [3]. Anteriormente, ya se han revisado algunas generalidades respecto a los metanálisis en red y su metodología [4],[5],[6],[7]. No obstante, con el paso del tiempo y la difusión de las técnicas de análisis, sumado a las ventajas que ofrecen los metanálisis en red gracias a su capacidad de síntesis de evidencia mixta (evidencia surgida mediante la síntesis de evidencia directa e indirecta), ha habido un aumento en el número de publicaciones que utilizan dicho método. Con ello se genera una mayor ponderación de estos metanálisis a la hora de informar decisiones en salud. De hecho, realizando una búsqueda rápida en la base de datos de PubMed de trabajos indexados bajo el término MeSH “Network Meta-Analysis” es posible ver un incremento de publicaciones de más de 15 veces entre el año 2010 (155 trabajos) y el año 2021 (2583 trabajos). También existen iniciativas como Cochrane Training en donde se enseñan los fundamentos y las herramientas necesarias para ejecutar un metanálisis en red. Sin embargo, previo a cuestiones relativas a la ejecución, se hace necesario acercar a los clínicos a esta metodología, discutir algunos conceptos importantes para la comprensión de los metanálisis en red y comentar cuál es el aporte de estos a la certeza de la evidencia en torno a una pregunta clínica dada.
Este artículo corresponde al décimo de una serie metodológica de revisiones narrativas acerca de tópicos generales en bioestadística y epidemiología clínica, las que exploran y resumen en un lenguaje amigable, artículos publicados disponibles en las principales bases de datos y textos de consulta especializados. La serie está orientada a la formación de estudiantes de pre y posgrado. Es realizada por la Cátedra de Medicina Basada en la Evidencia de la Escuela de Medicina de la Universidad de Valparaíso de Chile, en colaboración con el Instituto Universitario Hospital Italiano de Buenos Aires, Argentina, y el Centro Evidencia UC, de la Universidad Católica de Chile.
El objetivo de este manuscrito es presentar conceptos básicos sobre los metanálisis en red, sus supuestos metodológicos, sus particularidades para la interpretación de los análisis y resultados, y sus ventajas para la síntesis de evidencia y la toma de decisiones informadas en salud.
Los metanálisis en red (del inglés network meta-analysis) corresponden a un procedimiento estadístico para las revisiones sistemáticas, capaz de responder a preguntas clínicas relacionadas con la efectividad o seguridad de múltiples tratamientos existentes para una condición dada. Estos amplían el alcance de una revisión sistemática común, pues analizan simultáneamente la evidencia surgida tanto de comparaciones directas (de ensayos clínicos aleatorizados) como de comparaciones indirectas (basadas en un comparador común, lo que se explicará en mayor detalle más adelante en” geometría de la red”), con el objetivo de comparar múltiples tratamientos entre sí [3]. Gracias a esto, los metanálisis en red pueden entregar información de comparaciones que no han sido previamente evaluadas en un ensayo clínico [8]. Otros términos para referirse a este tipo de metanálisis son metanálisis con comparaciones múltiples (multiple-treatments meta-analysis) o metanálisis con comparaciones mixtas (mixed-treatments comparisons meta-analysis) [3]. De ahora en adelante, cada vez que se hable de metanálisis en red, en realidad se estará haciendo referencia a las revisiones sistemáticas de intervenciones múltiples con metanálisis en red.
A diferencia de los metanálisis estándar de comparaciones únicas (o pairwise), los metanálisis en red evalúan en un mismo análisis distintas intervenciones para una condición dada [9]. Ello permite establecer la estimación de una jerarquización relativa en relación con el desenlace estudiado. Esto último los convierte en una herramienta prometedora a la hora de valorar la efectividad relativa comparada entre distintas intervenciones y, en cierto sentido, necesaria como método para sintetizar la cantidad creciente de información que los clínicos disponen para la toma de decisiones [3],[10].
Como se mencionaba anteriormente, el producto final de los metanálisis en red puede resultar de comparaciones directas o indirectas, según la disponibilidad de ensayos clínicos aleatorizados para una misma pregunta clínica que comparan las mismas intervenciones (por ejemplo, comparación directa), o de ensayos clínicos con comparaciones divergentes con al menos una intervención en común (por ejemplo, comparación indirecta) [11]. Así, la evidencia directa es aquella obtenida desde ensayos clínicos aleatorizados que comparan dos intervenciones a fin de estimar la efectividad relativa para una condición dada. En tanto, la evidencia indirecta es aquella obtenida mediante la comparación de dos intervenciones y un comparador común que permite relacionarlas. Por ejemplo, si tenemos un ensayo que compare una intervención A con una intervención C y otro ensayo clínico que evalúe el efecto de la intervención B en relación con la misma intervención C, es posible comparar indirectamente la intervención A versus la B mediante el metanálisis en red utilizando un comparador transitivo, en este caso la intervención C (Figura 1). La combinación de evidencia directa e indirecta se ha denominado evidencia mixta [12]. Más adelante se ahondará en ciertas particularidades de la evidencia mixta y de su análisis.
Figura 1. Esquema representativo del comparador transitivo.
Una herramienta distintiva de los metanálisis en red es el diagrama de red, el cual grafica las intervenciones comparadas. La geometría de la red (network geometry) es la representación gráfica de los metanálisis en red que muestra visualmente las intervenciones que han sido comparadas directa e indirectamente [3]. Además, permite aproximarse al número de estudios incluidos para cada intervención y al número de participantes para cada comparación [13]. La geometría de la red facilita la comprensión del metanálisis en red y sus estimadores de efecto, a la vez que puede emplear un código de colores que explicita el grado de la certeza de evidencia para cada comparación [13].
En estas figuras cada nodo de la red (treatment nodes) representa una intervención distinta. Su tamaño indica proporcionalmente el número total de pacientes aleatorizados para esa intervención. Las líneas de unión entre los nodos representan comparaciones directas rescatadas de ensayos clínicos aleatorizados. Por el contrario, cuando no hay líneas de unión entre dos nodos quiere decir que no se identificaron ensayos clínicos que comparen ambas intervenciones. Del mismo modo, el ancho de las líneas es proporcional al número de estudios incluidos para cada par de intervenciones [12].
A modo de ejemplificar los tipos de geometrías de la red [9], la Figura 2a muestra una “red estrella” (star network), donde las intervenciones a comparar (B-C-D-E-F-G-H) no se unen, lo que muestra la carencia de evidencia directa que las relacione. Sin embargo, todas las intervenciones se unen a un único comparador común (A), lo que permite estimar una medida de efecto en ausencia de comparaciones directas. De manera concreta, el nodo A podría representar al placebo y los otros nodos a intervenciones activas. La Figura 2b muestra una “red bien conectada” (well-connected network), donde cada nodo se une a las demás intervenciones formando una geometría de red muy interconectada y compleja. Esto traduce la existencia de evidencia directa para cada comparación de intervenciones unidas [9].
Figura 2. Ejemplos de tipos de geometrías de la red.
1. Supuesto de homogeneidad
En primer lugar, al igual que en las revisiones sistemáticas con metanálisis de comparaciones únicas, es necesario evaluar la heterogeneidad tanto clínica como metodológica [12]. Esto debido a que los insumos para realizar el metanálisis provienen de diferentes estudios primarios cuyos resultados pueden afectarse por otras variables y no solo por las intervenciones estudiadas. En efecto, es posible evaluar la heterogeneidad de las distintas comparaciones directas de la red mediante los mismos métodos que se emplean en los metanálisis pareados (o estándar) [8]. No obstante, un supuesto fundamental para la validez de los metanálisis en red es que no hay otras diferencias entre los ensayos clínicos incluidos, fuera de las intervenciones a comparar [9].
Existen efectos modificadores que se oponen a este primer supuesto y pueden alterar los efectos reportados en los metanálisis en red [11]:
2. Supuesto de transitividad
En los metanálisis en red existe además otra fuente de variabilidad diferente a la heterogeneidad debido a la inclusión de estudios que evalúan diferentes intervenciones [3].
En este sentido, un supuesto crítico para la validez de los metanálisis en red es el supuesto de transitividad, que asume que no hay diferencias sistemáticas entre los estudios incluidos, a excepción de las intervenciones [13].
Según se observa en la Figura 1, este supuesto da pie a la comparación de una intervención A versus una intervención B, utilizando a la intervención C como comparador transitivo. Para evaluar esto es necesario que los nodos de la geometría de la red estén bien definidos. Un punto importante para considerar es que se viola el supuesto de transitividad cuando la intervención C difiere sistemáticamente en las distintas comparaciones. Esto puede ocurrir cuando en las distintas comparaciones o ensayos clínicos, el comparador transitivo se utiliza en distintas dosis, por diferentes vías de administración, en diferentes frecuencias o en diferentes grados de severidad de la condición estudiada, entre otros [13]. Es importante destacar que la evaluación de la transitividad no es de carácter estadístico, sino de carácter cualitativo [13].
3. Supuesto de consistencia
Otro supuesto para el análisis de información mixta es la consistencia, que es el grado de concordancia entre la información obtenida de las comparaciones directas e indirectas [13]. Si para una comparación solo se cuenta con evidencia indirecta, el supuesto de consistencia se reduce solo a la evaluación del supuesto de transitividad. Es por esta característica que se ha considerado a la consistencia como una extensión del supuesto de transitividad [13].
La consistencia se puede evaluar estadísticamente. El calcularla es un requisito a fin de obtener un estimador mixto válido de cada una de las intervenciones comparadas del metanálisis en red [13].
Si se identifica una inconsistencia es aconsejable revisar que no haya errores en la extracción de datos. Luego se debe examinar con mayor detalle los posibles efectos modificadores en los estudios entre los que hay inconsistencia [12]. Si la inconsistencia resulta sustantiva y su fuente no es identificable, se desaconseja sintetizar la información mediante un metanálisis en red [12].
Un punto novedoso en el análisis de evidencia que se realiza en los metanálisis en red es la síntesis de evidencia indirecta, la que al ser relacionada con evidencia directa permite la obtención de un único estimador de efecto para un par de intervenciones dadas. Esto se denomina “estimación combinada o mixta” [10]. Para que esto sea posible, todo metanálisis en red debe evaluar y cumplir los supuestos que ya han sido revisados. Sin embargo, el principal requerimiento para el análisis estadístico de los metanálisis en red es que las intervenciones incluidas en el análisis se relacionan formando una red conectada [8].
En el caso de una red con tres intervenciones A, B y C, que no incluya a un ensayo que compare A versus B, se analizan los resultados de los subgrupos A versus C y B versus C. Luego se estima el efecto para cada par de intervenciones. Finalmente se comparan y contrastan estadísticamente. Como resultado, el coeficiente de efecto estimado para A versus B resume toda la evidencia indirecta disponible que relaciona dichas intervenciones [8], en este caso A versus C y B versus C. Así, en una red de metanálisis con más intervenciones, el coeficiente de efecto estimado se obtiene a partir de la relación con cada una de las otras intervenciones de la red. Estas otras intervenciones entregan información de una de las intervenciones incluidas en la red a partir de un comparador común.
Si no existen comparaciones directas para un par de intervenciones determinadas, estaremos frente a una red que sólo proporciona evidencia indirecta. Sin embargo, si se cuenta tanto con comparaciones directas como indirectas para el mismo par de intervenciones, se habla de evidencia mixta [15].
El análisis de la evidencia mixta en los metanálisis en red se lleva a cabo mediante técnicas estadísticas complejas de metaregresión [16]. Dichas técnicas otorgan estimaciones de efectos en términos de probabilidades, para cada una de las intervenciones incluidas en el metanálisis.
Mediante las comparaciones que realizan los metanálisis en red, es posible obtener la efectividad terapéutica relativa entre cualquier par de intervenciones de esa red. La presentación de los resultados del análisis de evidencia mixta es generalmente mediante tablas o matrices que ordenan toda la información obtenida (evidencia directa, indirecta o mixta) [12], con sus respectivos estimadores de efecto (habitualmente en Odds ratio o Relative risk) y de incertidumbre [13]. Para presentar los resultados de cada par de comparaciones pueden utilizarse gráficos tipo Forest plot (Figura 3) que resuman los estimadores de efecto y sus intervalos de confianza.
Figura 3. Ejemplo de gráfico tipo Forest plot para metanálisis en red.
Debido a que las intervenciones que se analizan entre sí suelen ser numerosas, la disposición de los resultados en tablas facilita la interpretación del metanálisis en red. Mediante las tablas de clasificación (league table), se puede extraer la información de todas las comparaciones posibles entre las intervenciones del metanálisis. La Tabla 1 muestra un ejemplo de tabla de clasificación, donde cada celda verde o amarilla corresponde al estimador de efecto de la comparación entre dos intervenciones según desenlace. De esta manera la primera columna muestra los estimadores de efecto de todas las intervenciones (Q, R, S y T) comparadas con placebo.
Este tipo de tabla permite mostrar todos los estimadores de efecto entre los distintos pares de intervenciones para un máximo de dos desenlaces (desenlace 1 y 2 en Tabla 1) [12],[16],[17].
Tabla 1. Ejemplo de tabla de clasificación.
La mayoría de las veces la toma de decisiones clínicas se basa en un análisis de probabilidades. Los metanálisis en red entregan una gran cantidad de efectos estimados, lo que puede complicar la decisión de preferir una u otra de las intervenciones incluidas en la red. Por este motivo es necesario que los resultados de los metanálisis en red se entreguen de una manera organizada y jerarquizada [16]. Con ello se facilita la identificación de la mejor opción terapéutica entre las intervenciones comparadas, mediante la disposición gráfica y ordinal de las intervenciones evaluadas en relación con su efectividad.
En este sentido, los metanálisis entregan una jerarquización de las intervenciones evaluadas en términos de probabilidad. Esto quiere decir que es una categorización de probabilidades, por lo tanto, se informa en términos de probabilidad por cada número de orden y por cada intervención. Algunas de las formas en las que se suele informar esta jerarquización de probabilidades son los “rankogramas”, las curvas surface under the cumulative ranking curves (SUCRA) y tablas de probabilidades. No obstante, no siempre se presenta esta información en el metanálisis en red [18].
Rankogramas
Los rankogramas son gráficos que muestran la probabilidad que tiene cada tratamiento de alcanzar una determinada jerarquización. En el eje X muestran los ranking posibles (1, 2, 3, entre otros) y en el eje Y la probabilidad que tiene cada tratamiento de alcanzarlo [16]. A modo de ejemplo, presentamos los resultados en forma de rankograma de un metanálisis en red de tres intervenciones, que compara distintas opciones de higiene oral en pacientes con ventilación mecánica para prevenir neumonía asociada a uso de ventilación mecánica (Figura 4) [19].
Figura 4. Ejemplo de rankogramas en metanálisis en red de tres intervenciones.
A partir de los rankogramas es posible obtener el valor SUCRA. Este valor sintetiza las probabilidades acumuladas de cada tratamiento de alcanzar un número de jerarquización dada. Se obtiene calculando el área bajo la curva de las probabilidades acumuladas (ranking acumulado). Al integrar todas las categorizaciones probables para un tratamiento, el valor SUCRA permite aproximarse a la noción sobre qué tratamiento tenga las mayores probabilidades de ser el mejor (valores SUCRA cercanos a 1). Del mismo modo, valores SUCRA cercanos a 0 señalan a las intervenciones que serían las menos efectivas [12],[16],[20].
Tablas de probabilidades
La disposición de los resultados del ranking de probabilidades en formato de tablas de probabilidades puede ser difícil de leer e interpretar. Por lo que se prefieren las presentaciones gráficas ya explicadas [16]. Las tablas de probabilidades contienen en cada columna las intervenciones contenidas en el metanálisis en red (por ejemplo, W, X, Y y Z) y en cada fila, la probabilidad de alcanzar uno u otro número de orden de ranking (por ejemplo, 1, 2, 3, 4). De este modo en el ejemplo de la Tabla 2, la probabilidad de que la intervención X sea la segunda mejor opción entre las intervenciones comparadas es de 0,25. Las tablas también pueden mostrar entre paréntesis la probabilidad acumulada de cada intervención. Siguiendo el ejemplo anterior, la probabilidad acumulada de que X esté entre el puesto 1 y 2 es de 0,75 (75%). Por último, las tablas incluyen el valor SUCRA de cada intervención.
Tabla 2. Ejemplo de tabla de presentación de ranking de probabilidades en un metanálisis en red.
La aproximación Grading of Recommendation, Assessment, Development, and Evaluation (GRADE) es un sistema ampliamente utilizado para determinar el grado de certeza de la evidencia en revisiones sistemáticas, mediante el análisis de cinco componentes. Para más detalle, en la presente serie metodológica existe un artículo que aborda este tema en profundidad[21].
Para valorar el grado de certeza de la evidencia de los metanálisis en red, se ha propuesto utilizar el modelo GRADE con algunas modificaciones [15],[22] derivadas principalmente del uso de evidencia indirecta, de la contribución diferencial que otorgan las distintas fuentes de evidencia directa para el efecto final, del supuesto de transitividad para la valoración de la evidencia mixta y de la posibilidad de grados de inconsistencia entre la evidencia directa e indirecta.
El cálculo del ranking de tratamientos se hace a partir de toda la red de evidencia, mientras que el cálculo del tamaño de efectos entre las comparaciones pareadas se hace incorporando resultados de fuentes directas e indirectas. En este caso la evidencia directa es la que más pesa sobre el efecto estimado final [15]. Debido a la naturaleza de los resultados que ofrecen los metanálisis en red, es que se ha propuesto evaluar la certeza de la evidencia tanto para los hallazgos relacionados con el tamaño del efecto entre cada comparación de la red como para el ranking de tratamientos.
Si bien, es posible analizar los cinco dominios de GRADE [15] para cada estimador de efecto, esto puede tornarse engorroso a la hora de evaluar cada una de las comparaciones pareadas presentes en un metanálisis en red. Lo mismo ocurre en la evaluación de la certeza en la jerarquización, guiándose por los dominios de la herramienta GRADE. Además, existe cierto grado de subjetividad, como por ejemplo en la evaluación de la imprecisión que es a partir de la observación de los rankogramas.
No obstante, han surgido propuestas basadas en el enfoque GRADE que centran el análisis en dos elementos:
Como es posible observar en la Figura 5, el grupo de trabajo GRADE actualmente no incluye la evaluación de la imprecisión de las estimaciones directas [22], a diferencia de otros grupos de trabajo que sí lo incluyen basándose en el marco común de evaluación GRADE [15].
El análisis de la calidad de la evidencia surgida de los metanálisis en red es en sí mismo un tema complejo, del que depende finalmente la utilidad práctica de los resultados del metanálisis. Por esto hay numerosos grupos de trabajo que buscan perfeccionar y desarrollar herramientas para la evaluación de la calidad de la evidencia de los metanálisis en red [23],[24] y la disposición de sus resultados en la actualidad [25].
Los metanálisis en red o metanálisis de múltiples intervenciones son una forma de síntesis de la evidencia que permite maximizar el uso de la información disponible, especialmente cuando para una condición existen múltiples intervenciones disponibles. Este tipo de metanálisis permite combinar evidencia directa (surgida de comparaciones directas) y evidencia indirecta de las comparaciones incluidas en la red, lo cual en su conjunto es denominado evidencia mixta.
Debido a estas particularidades los metanálisis en red proporcionan una vía de análisis con “mayores antecedentes”, para quienes necesiten decidir entre múltiples intervenciones. Además, buscan maximizar la extracción de información de la evidencia actualmente disponible. No obstante, para que sus estimaciones sean válidas y consistentes, es imprescindible evaluar el grado de homogeneidad clínica y metodológica de los estudios incluidos. Por último, también es necesario evaluar la presencia de diferencias sistemáticas a la hora extraer evidencia indirecta.
Roles de autoría
CGGX: conceptualización, investigación, recursos, escritura (preparación de borrador original), escritura (revisión y edición), visualización, administración de proyecto. LVM: conceptualización, investigación, recursos, escritura (revisión y edición), visualización. NM: conceptualización, investigación, recursos, escritura (revisión y edición), visualización, supervisión. LG: conceptualización, escritura (revisión y edición), visualización. LO: Conceptualización, recursos, visualización.
Agradecimientos
Agradecemos a la Cátedra de Medicina Basada en Evidencia de la Escuela de Medicina de la Universidad de Valparaíso, Chile por impulsar esta serie y la colaboración del Departamento de Investigación del Instituto Universitario del Hospital Italiano de Buenos Aires, Argentina.
Conflictos de intereses
Los autores completaron la declaración de conflictos de interés de ICMJE y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo. Los formularios se pueden solicitar contactando al autor responsable o a la revista.
Financiamiento
Los autores declaran que no poseen fuentes de financiamiento externas asociadas a la realización de este artículo.
Consideraciones éticas
Dados los atributos del estudio, no se requirió de comité de ética.
Disponibilidad de datos
Los datos utilizados para el presente estudio se encuentran disponibles previa solicitud al autor corresponsal.
Idioma de la versión original
Español.

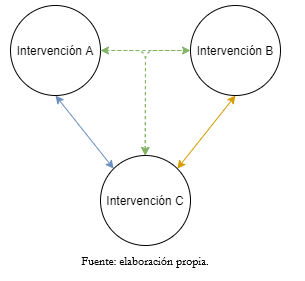 Figura 1. Esquema representativo del comparador transitivo.
Figura 1. Esquema representativo del comparador transitivo.

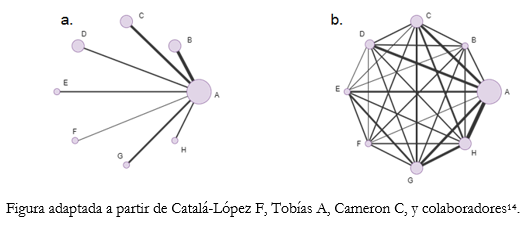 Figura 2. Ejemplos de tipos de geometrías de la red.
Figura 2. Ejemplos de tipos de geometrías de la red.

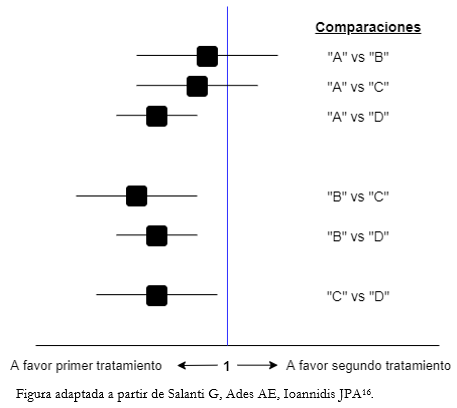 Figura 3. Ejemplo de gráfico tipo Forest plot para metanálisis en red.
Figura 3. Ejemplo de gráfico tipo Forest plot para metanálisis en red.

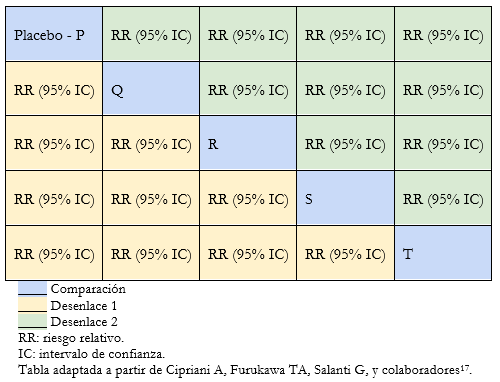 Tabla 1. Ejemplo de tabla de clasificación.
Tabla 1. Ejemplo de tabla de clasificación.

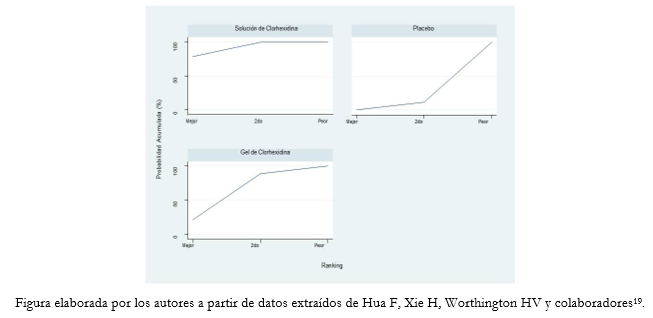 Figura 4. Ejemplo de rankogramas en metanálisis en red de tres intervenciones.
Figura 4. Ejemplo de rankogramas en metanálisis en red de tres intervenciones.

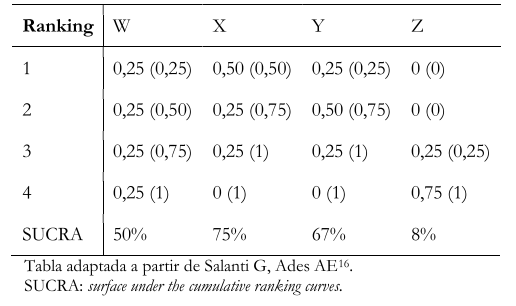 Tabla 2. Ejemplo de tabla de presentación de ranking de probabilidades en un metanálisis en red.
Tabla 2. Ejemplo de tabla de presentación de ranking de probabilidades en un metanálisis en red.

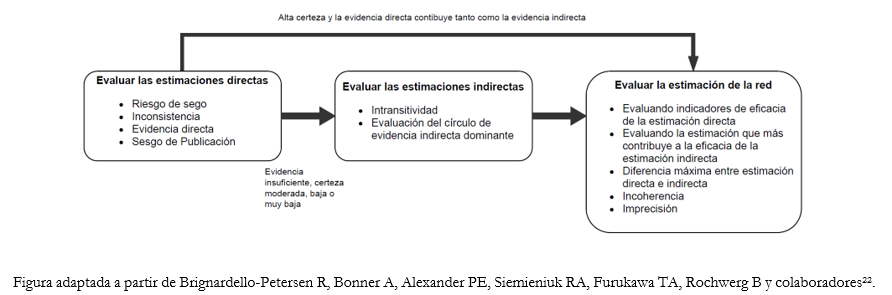 Figura 5. Esquema del proceso de análisis del grado de certeza de la evidencia de un metanálisis en red.
Figura 5. Esquema del proceso de análisis del grado de certeza de la evidencia de un metanálisis en red.

This article belongs to a collaborative methodological series of narrative reviews about biostatistics and clinical epidemiology. The goal is to present basics concepts concerning the systematics reviews of multiple treatments comparisons with network meta-analysis. For clinical ques-tions with several therapeutic alternatives to be compared, the central question is how to classify or rank their effectiveness (benefit and harm) to choose the best option. The network meta-analysis aims to answer questions related to the effectiveness and safety of comparing multiple treatments by the simultaneous analysis of results raised from direct and indirect comparisons. The network geometry is the general graphical representation of the network meta-analysis and allows to understand and assess the strength of comparisons. The network meta-analysis should check several assumptions to be valid, especially the transitivity assumption, which allows assuming that there are no systematic differences among the included comparisons, except their compared interventions. Thus, it is possible to know the relative therapeutic effectiveness of each pair of interventions included in the network meta-analysis and their ranking in terms of categorization. It has been proposed to use a modified Grading of Recommendation, Assessment, Development, and Evaluation (GRADE) approach considering the distinctive features of network meta-analysis to assess the certainty of the evidence for each comparison and the ranking of interventions.
 Autores:
Catalina Gracia González-Xuriguera[1], Laura Vergara-Merino[2,3], Luis Garegnani[4], Luis Ortiz-Muñoz[5,6], Nicolás Meza[2,3]
Autores:
Catalina Gracia González-Xuriguera[1], Laura Vergara-Merino[2,3], Luis Garegnani[4], Luis Ortiz-Muñoz[5,6], Nicolás Meza[2,3]

Citación: González-Xuriguera CG, Vergara-Merino L, Garegnani L, Ortiz-Muñoz L, Meza N. Introduction to network meta-analysis for evidence synthesis. Medwave 2021;21(6):e8315 doi: 10.5867/medwave.2021.06.8315
Fecha de envío: 16/3/2021
Fecha de aceptación: 7/6/2021
Fecha de publicación: 15/7/2021
Origen: No solicitado
Tipo de revisión: Con revisión por pares externa, por tres árbitros a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Murad MH, Asi N, Alsawas M, Alahdab F. New evidence pyramid. Evid Based Med. 2016 Aug;21(4):125-7. | CrossRef | PubMed |
Murad MH, Asi N, Alsawas M, Alahdab F. New evidence pyramid. Evid Based Med. 2016 Aug;21(4):125-7. | CrossRef | PubMed | Salanti G, Higgins JP, Ades AE, Ioannidis JP. Evaluation of networks of randomized trials. Stat Methods Med Res. 2008 Jun;17(3):279-301. | CrossRef | PubMed |
Salanti G, Higgins JP, Ades AE, Ioannidis JP. Evaluation of networks of randomized trials. Stat Methods Med Res. 2008 Jun;17(3):279-301. | CrossRef | PubMed | Lumley T. Network meta-analysis for indirect treatment comparisons. Stat Med. 2002 Aug 30;21(16):2313-24. | CrossRef | PubMed |
Lumley T. Network meta-analysis for indirect treatment comparisons. Stat Med. 2002 Aug 30;21(16):2313-24. | CrossRef | PubMed | Catalá-López F, Tobías A, Roqué M. Conceptos básicos del metaanálisis en red [Basic concepts for network meta-analysis]. Aten Primaria. 2014
Dec;46(10):573-81. Spanish. | CrossRef | PubMed |
Catalá-López F, Tobías A, Roqué M. Conceptos básicos del metaanálisis en red [Basic concepts for network meta-analysis]. Aten Primaria. 2014
Dec;46(10):573-81. Spanish. | CrossRef | PubMed | Ferreira González I, Urrútia G, Alonso-Coello P. Systematic reviews and meta-analysis: scientific rationale and interpretation. Rev Esp Cardiol. 2011
Aug;64(8):688-96. English, Spanish. | CrossRef | PubMed |
Ferreira González I, Urrútia G, Alonso-Coello P. Systematic reviews and meta-analysis: scientific rationale and interpretation. Rev Esp Cardiol. 2011
Aug;64(8):688-96. English, Spanish. | CrossRef | PubMed | Arias MM. El metaanálisis en red. Pediatría Aten Primaria 2016;XVIII:279–82.
Arias MM. El metaanálisis en red. Pediatría Aten Primaria 2016;XVIII:279–82.  Labarca G, Uribe JP, Majid A, Folch E, Fernandez-Bussy S. Como interpretar una revisión sistemática con comparaciones múltiples o network metaanálisis [How to interpret systematic reviews with multiple comparisons or network meta-analysis]. Rev Med Chil. 2020 Jan;148(1):109-117. Spanish. | CrossRef | PubMed |
Labarca G, Uribe JP, Majid A, Folch E, Fernandez-Bussy S. Como interpretar una revisión sistemática con comparaciones múltiples o network metaanálisis [How to interpret systematic reviews with multiple comparisons or network meta-analysis]. Rev Med Chil. 2020 Jan;148(1):109-117. Spanish. | CrossRef | PubMed | Chaimani A, Caldwell DM, Li T, Higgins JPT, Salanti G. Chapter 11: Undertaking network meta-analyses. In: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions version 6.2 (updated February 2021). Cochrane, 2021. | Link |
Chaimani A, Caldwell DM, Li T, Higgins JPT, Salanti G. Chapter 11: Undertaking network meta-analyses. In: Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions version 6.2 (updated February 2021). Cochrane, 2021. | Link | Cipriani A, Higgins JP, Geddes JR, Salanti G. Conceptual and technical challenges in network meta-analysis. Ann Intern Med. 2013 Jul 16;159(2):130-7. | CrossRef | PubMed |
Cipriani A, Higgins JP, Geddes JR, Salanti G. Conceptual and technical challenges in network meta-analysis. Ann Intern Med. 2013 Jul 16;159(2):130-7. | CrossRef | PubMed | Caldwell DM, Ades AE, Higgins JP. Simultaneous comparison of multiple treatments: combining direct and indirect evidence. BMJ. 2005 Oct
15;331(7521):897-900. | CrossRef | PubMed |
Caldwell DM, Ades AE, Higgins JP. Simultaneous comparison of multiple treatments: combining direct and indirect evidence. BMJ. 2005 Oct
15;331(7521):897-900. | CrossRef | PubMed | Jansen JP, Naci H. Is network meta-analysis as valid as standard pairwise meta-analysis? It all depends on the distribution of effect modifiers. BMC Med. 2013 Jul 4;11:159. | CrossRef | PubMed |
Jansen JP, Naci H. Is network meta-analysis as valid as standard pairwise meta-analysis? It all depends on the distribution of effect modifiers. BMC Med. 2013 Jul 4;11:159. | CrossRef | PubMed | Rouse B, Chaimani A, Li T. Network meta-analysis: an introduction for clinicians. Intern Emerg Med. 2017 Feb;12(1):103-111. | CrossRef | PubMed |
Rouse B, Chaimani A, Li T. Network meta-analysis: an introduction for clinicians. Intern Emerg Med. 2017 Feb;12(1):103-111. | CrossRef | PubMed | Salanti G. Indirect and mixed-treatment comparison, network, or multiple-treatments meta-analysis: many names, many benefits, many concerns for the next generation evidence synthesis tool. Res Synth Methods. 2012 Jun;3(2):80-97. | CrossRef | PubMed |
Salanti G. Indirect and mixed-treatment comparison, network, or multiple-treatments meta-analysis: many names, many benefits, many concerns for the next generation evidence synthesis tool. Res Synth Methods. 2012 Jun;3(2):80-97. | CrossRef | PubMed | Catalá-López F, Tobías A, Cameron C, Moher D, Hutton B. Network meta-analysis for comparing treatment effects of multiple interventions: an
introduction. Rheumatol Int. 2014 Nov;34(11):1489-96. | CrossRef | PubMed |
Catalá-López F, Tobías A, Cameron C, Moher D, Hutton B. Network meta-analysis for comparing treatment effects of multiple interventions: an
introduction. Rheumatol Int. 2014 Nov;34(11):1489-96. | CrossRef | PubMed | Salanti G, Del Giovane C, Chaimani A, Caldwell DM, Higgins JP. Evaluating the quality of evidence from a network meta-analysis. PLoS One. 2014 Jul 3;9(7):e99682. | CrossRef | PubMed |
Salanti G, Del Giovane C, Chaimani A, Caldwell DM, Higgins JP. Evaluating the quality of evidence from a network meta-analysis. PLoS One. 2014 Jul 3;9(7):e99682. | CrossRef | PubMed | Salanti G, Ades AE, Ioannidis JP. Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis: an overview and tutorial. J Clin Epidemiol. 2011 Feb;64(2):163-71. | CrossRef | PubMed |
Salanti G, Ades AE, Ioannidis JP. Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis: an overview and tutorial. J Clin Epidemiol. 2011 Feb;64(2):163-71. | CrossRef | PubMed | Cipriani A, Furukawa TA, Salanti G, Geddes JR, Higgins JP, Churchill R, et al. Comparative
efficacy and acceptability of 12 new-generation antidepressants: a multiple-treatments meta-analysis. Lancet. 2009 Feb 28;373(9665):746-58. | CrossRef | PubMed |
Cipriani A, Furukawa TA, Salanti G, Geddes JR, Higgins JP, Churchill R, et al. Comparative
efficacy and acceptability of 12 new-generation antidepressants: a multiple-treatments meta-analysis. Lancet. 2009 Feb 28;373(9665):746-58. | CrossRef | PubMed | Petropoulou M, Nikolakopoulou A, Veroniki AA, Rios P, Vafaei A, Zarin W, et al. Bibliographic study showed improving statistical methodology of network meta-analyses published between 1999 and 2015. J Clin Epidemiol. 2017 Feb;82:20-28. | CrossRef | PubMed |
Petropoulou M, Nikolakopoulou A, Veroniki AA, Rios P, Vafaei A, Zarin W, et al. Bibliographic study showed improving statistical methodology of network meta-analyses published between 1999 and 2015. J Clin Epidemiol. 2017 Feb;82:20-28. | CrossRef | PubMed | Hua F, Xie H, Worthington HV, Furness S, Zhang Q, Li C. Oral hygiene care for critically ill patients to prevent ventilator-associated pneumonia. Cochrane Database Syst Rev. 2016 Oct 25;10(10):CD008367. | CrossRef | PubMed |
Hua F, Xie H, Worthington HV, Furness S, Zhang Q, Li C. Oral hygiene care for critically ill patients to prevent ventilator-associated pneumonia. Cochrane Database Syst Rev. 2016 Oct 25;10(10):CD008367. | CrossRef | PubMed | Li T, Lindsley K, Rouse B, Hong H, Shi Q, Friedman DS, et al. Comparative Effectiveness of First-Line Medications for Primary Open-Angle
Glaucoma: A Systematic Review and Network Meta-analysis. Ophthalmology. 2016 Jan;123(1):129-40. | CrossRef | PubMed |
Li T, Lindsley K, Rouse B, Hong H, Shi Q, Friedman DS, et al. Comparative Effectiveness of First-Line Medications for Primary Open-Angle
Glaucoma: A Systematic Review and Network Meta-analysis. Ophthalmology. 2016 Jan;123(1):129-40. | CrossRef | PubMed | Kirmayr M, Quilodrán C, Valente B, Loezar C, Garegnani L, Franco JVA. The GRADE approach, Part 1: how to assess the certainty of the evidence. Medwave. 2021 Mar 17;21(2):e8109. Spanish, English. | CrossRef | PubMed |
Kirmayr M, Quilodrán C, Valente B, Loezar C, Garegnani L, Franco JVA. The GRADE approach, Part 1: how to assess the certainty of the evidence. Medwave. 2021 Mar 17;21(2):e8109. Spanish, English. | CrossRef | PubMed | Brignardello-Petersen R, Bonner A, Alexander PE, Siemieniuk RA, Furukawa TA, Rochwerg B, et al. Advances in the GRADE approach to
rate the certainty in estimates from a network meta-analysis. J Clin Epidemiol. 2018 Jan;93:36-44. | CrossRef | PubMed |
Brignardello-Petersen R, Bonner A, Alexander PE, Siemieniuk RA, Furukawa TA, Rochwerg B, et al. Advances in the GRADE approach to
rate the certainty in estimates from a network meta-analysis. J Clin Epidemiol. 2018 Jan;93:36-44. | CrossRef | PubMed | Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, et al. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. | CrossRef | PubMed |
Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, et al. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. | CrossRef | PubMed |