 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: randomized controlled trial, bias, systematic review, meta-analysis, epidemiology
El análisis secuencial de ensayos clínicos permite el monitoreo continuo de los datos emergentes para el investigador, así como una mayor seguridad para evitar someter a los participantes a una terapia inferior o fútil en términos de eficacia o seguridad, antes que esta sea evidente, mientras se controla la tasa de error general. Si bien ha sido extensamente empleado desde su desarrollo, no está exento de problemas. Entre ellos se puede mencionar el balance entre seguridad y eficacia, el sesgo condicional y la sobrestimación del tamaño del efecto de las intervenciones. En esta revisión se desarrollan distintos aspectos de esta metodología y el impacto que tiene la inclusión de ensayos clínicos precozmente interrumpidos en las revisiones sistemáticas con metanálisis.
|
Ideas clave
|
En la investigación con seres humanos, el ensayo clínico es el principal diseño metodológico experimental. Se trata de un experimento controlado utilizado para evaluar la seguridad y la eficacia de las intervenciones para cualquier tipo de problema de salud, así como para determinar otros efectos de estas intervenciones, incluyendo el análisis de eventos adversos. Son considerados el paradigma de la investigación epidemiológica para el establecimiento de relaciones causales entre las intervenciones y sus efectos[1],[2],[3]. Los ensayos clínicos son los estudios primarios que nutren a las revisiones sistemáticas de intervenciones, las que aportarán un nivel de evidencia incluso mayor. Por lo tanto, las características del ensayo clínico impactarán directamente en el resultado de una revisión sistemática y eventualmente de su metanálisis.
Los ensayos clínicos suelen tener una temporalidad planificada, concluyendo una vez que ocurren los eventos esperados en los participantes. Tanto la temporalidad como la cantidad mínima de participantes que deben incorporarse a los grupos de comparación para demostrar diferencias significativas en desenlaces clínicamente relevantes, son definidas a priori. No obstante, puede ocurrir que, por condiciones éticas, el estudio deba ser finalizado precozmente. Esto puede asociarse a razones de eficacia (por ejemplo, se observa una clara eficacia en una intervención por sobre otra), de seguridad (por ejemplo, múltiples eventos adversos en una intervención) o científicas (por ejemplo, emergencia de nueva información que invalide la realización del ensayo)[4]. Un ejemplo podría ser lo sucedido con la utilización de la proteína C activada recombinante humana en pacientes críticamente enfermos con sepsis: el ensayo clínico original, publicado en 2001, fue interrumpido precozmente luego de un análisis interino debido a aparentes diferencias en la mortalidad[5], lo que llevó a la recomendación de su uso en las guías de la campaña Surviving sepsis[6]. Algunos ensayos posteriores generaron preocupación debido al aumento en el riesgo de sangrado serio[7], cuestionando la reducción en la mortalidad hallada en el estudio original, hasta que la droga fue finalmente retirada del mercado en 2011 y eliminada de las guías de práctica clínica[6]. Como se observa, la interrupción precoz no está exenta de imprevistos y controversias; aunque puede establecerse durante el protocolo de algunos tipos de ensayo clínicos: los ensayos clínicos secuenciales[8].
En esta revisión narrativa se desarrollan los principales aspectos teóricos y las controversias en cuanto a la ejecución de ensayos clínicos con diseño secuencial que llevan a la interrupción precoz positiva, así como su impacto en las revisiones sistemáticas con metanálisis, con el objetivo de clarificar algunos conceptos que han sido escasamente tratados en la literatura. Existen distintos análisis secuenciales: clásicos o fijos, flexibles y por grupos[9]. En esta revisión abarcaremos estos últimos, los más utilizados en los ensayos clínicos.
Los ensayos clínicos secuenciales estipulan en su diseño metodológico análisis intermedios repetidos a razón de pesquisar diferencias intergrupales a tiempo, lo que conlleva diversas ventajas. Los análisis intermedios pueden devenir en:
Los ensayos clínicos secuenciales deben contar con un tamaño de muestra elevado, debido a que los análisis intermedios implican fraccionar y comparar bloques de la muestra. Asimismo, su duración debe prolongarse por al menos dos años. Además, los análisis intermedios deben llevarse a cabo por un comité independiente de monitoreo de datos para cuidar el enmascaramiento[4]. De este modo, si una regla estadística indica la necesidad de detener el estudio, se puede realizar un análisis interino con los datos recolectados para evaluar la evidencia emergente sobre la eficacia de un tratamiento hasta el momento de la detención[11]. Debido a su naturaleza dinámica, los ensayos clínicos que siguen esta metodología deben evaluar desenlaces que puedan producirse en el lapso estipulado, como así también deben garantizar la rápida disponibilidad de datos para su análisis interino.
El análisis secuencial es una metodología que permite el monitoreo continuo de los datos emergentes para llegar a una conclusión lo antes posible, mientras se controla la tasa de error general[12]. Desarrollada por Wald a fines de la década de 1940 y adaptada para las ciencias médicas años más tarde, ha sido extensamente empleada desde entonces. También ha abierto un nuevo capítulo en estudios a gran escala mediante la creación y utilización de comités de monitoreo estadístico y de datos[12],[13]. La existencia de estos comités se justifica en función de algunas desventajas de este tipo de estudios, las que serán abordadas más adelante. Es importante señalar que la decisión de interrumpir un ensayo clínico es más compleja y no está supeditada únicamente a un análisis interino, ajustado por un método estadístico.
Los diseños secuenciales proporcionan un marco de prueba de hipótesis para tomar decisiones respecto a la terminación temprana de un estudio, posibilitando algunas veces no continuar destinando recursos de todo tipo en un ensayo más allá del punto en el que la evidencia es convincente sobre la superioridad de una terapia frente a otra. Ello permite minimizar el número de pacientes que recibirían una terapia inferior y divulgar esta nueva información a pacientes, personal de salud, proveedores y tomadores de decisión tan pronto como sea posible[11].
Los análisis intermedios que buscan probar un beneficio de la intervención elevan la probabilidad de un “falso positivo” o error tipo I. Este error se comete cuando el investigador rechaza la hipótesis nula siendo esta verdadera en la población. Esto sería equivalente a llegar a la conclusión de que existe una asociación estadística entre ambas ramas cuando en realidad no existe. En consecuencia, deben considerarse algunos ajustes estadísticos dado que mientras más comparaciones entre intervenciones se realicen, mayor será la probabilidad de cometer un error tipo I[14].
Entre los métodos existentes para realizar estos ajustes se incluyen reglas de detención secuencial como los límites de O’Brien y Fleming o Haybittle y Peto (reglas también conocidas como métodos de análisis secuencial por grupos con regla de finalización), así como las generalizaciones de gasto de α de Lan-DeMets[15],[16]. En estas últimas reglas es posible efectuar los análisis intermedios que se deseen sin que hayan sido establecidos previamente, puesto que existe una disminución del valor de significancia estadística en virtud de evitar cometer un error asociado a las comparaciones múltiples[4]. Estos métodos son de difícil implementación y requieren conocimientos estadísticos avanzados[17].
Si bien existen metodologías de reciente origen en la evaluación de diseños secuenciales[18], los métodos clásicos han sido ampliamente aceptados e implementados en la práctica[19]. Sin embargo, pueden surgir múltiples problemas cuando los investigadores terminan un ensayo antes de lo planificado, especialmente cuando la decisión de terminar el ensayo se basa en el hallazgo de un efecto de tratamiento aparentemente beneficioso[20].
El problema de equilibrar la información sobre seguridad y eficacia, posiblemente sea el más difícil de resolver. Es bastante común que los resultados asociados a la seguridad se produzcan más tarde, y más infrecuentemente que los relacionados con la eficacia. Un ensayo detenido precozmente por su eficacia podría promover la adopción de una terapia sin comprender totalmente sus consecuencias, ya sea porque el ensayo fue demasiado pequeño o la duración fue demasiado breve como para acumular criterios de seguridad suficientes. Ello constituye un potencial problema, incluso si el ensayo continúa hasta el término planificado[12]. Esto sucede debido a que el análisis secuencial se basa en la eficacia de las intervenciones, por lo que tiene menor poder para evaluar su seguridad, como ilustra el ejemplo anteriormente citado sobre la proteína C activada recombinante humana.
A) Sesgo condicional
Otro problema asociado al análisis secuencial es que, cuando se detiene el ensayo debido a un tamaño del efecto pequeño o grande, existe una mayor probabilidad de que el ensayo se encuentre en un nivel “alto” o “bajo” con respecto a la estimación de la magnitud del efecto. Este problema se conoce como “sesgo condicional”[12]. El sesgo puede surgir debido a grandes fluctuaciones aleatorias del efecto estimado del tratamiento, particularmente al comienzo del progreso de un ensayo.
La Figura 1 muestra la variabilidad en la estimación del efecto según el tiempo en tres escenarios posibles teóricos. La línea roja superior muestra un ensayo cuyo efecto fluctúa hacia un beneficio exagerado. La línea roja inferior muestra un ensayo cuyo efecto fluctúa hacia un daño exagerado. La línea azul muestra un ensayo cuyo efecto oscila alrededor del verdadero efecto. Los límites de interrupción en cada escenario podrían determinar efectos muy disímiles respecto al verdadero efecto, según se utilice un umbral tradicional o reglas de interrupción.
Figura 1. Fluctuación de la medición del efecto y posibles umbrales de interrupción.
Por lo tanto, cuando los investigadores detienen un ensayo basado en un efecto de tratamiento aparentemente beneficioso, sus resultados pueden proporcionar resultados erróneos[20]. Se ha argumentado, sobre la base del examen empírico de los estudios detenidos tempranamente, que el sesgo condicional es sustancial y conlleva el potencial de distorsionar las estimaciones del balance riesgo-beneficio y del efecto metanalítico. Por otra parte, también se ha aseverado que la interrupción temprana de un estudio a veces se describe de manera dramática, lo que dificulta la planificación y ejecución de estudios posteriores sobre el mismo tema debido a la creencia infundada de que el efecto es mucho mayor o más seguro de lo que realmente es[12].
La probabilidad de este sesgo condicional ha sido reconocida desde hace décadas. Se han propuesto varios métodos de análisis para controlarlo luego de la finalización de un ensayo secuencial. No obstante, tales métodos generalmente son menos conocidos que los métodos para controlar el error tipo I, y rara vez se utilizan en la práctica al informar los resultados de los ensayos detenidos precozmente[19],[21].
B) Sobrestimación del efecto del tratamiento
Los modelos estadísticos sugieren que los ensayos clínicos aleatorizados que se suspenden anticipadamente por demostrar algún beneficio sobrestiman sistemáticamente los efectos del tratamiento[20]. Del mismo modo, al detenerse precozmente el efecto del error aleatorio será mayor, ya que la cantidad de observaciones será menor[8],[10]. Al analizar repetidamente los resultados de un ensayo, serán las fluctuaciones aleatorias que tiendan a exagerar el efecto las que llevarán a determinar su finalización. Si se interrumpe un ensayo tras obtener un valor p particularmente bajo es probable que, de haber continuado con el estudio, los futuros valores p hubiesen sido mayores, lo que se asocia al fenómeno de regresión a la media[14],[22].
Bassler y colaboradores[20] compararon el efecto del tratamiento de los ensayos clínicos aleatorizados truncados con el de los metanálisis de los ensayos clínicos aleatorizados que abordaron la misma pregunta de investigación, pero que no se detuvieron precozmente, y exploraron los factores asociados con la sobrestimación del efecto. Encontraron grandes diferencias en el tamaño del efecto del tratamiento entre ensayos clínicos aleatorizados truncados y no truncados (con un cociente de riesgos relativos entre truncados versus no truncados de 0,71), con ensayos clínicos aleatorizados truncados que tuvieron menos de 500 eventos, independientemente de la presencia de una regla de detención estadística y de la calidad metodológica de los estudios, evaluada mediante el ocultamiento de la asignación y del cegamiento. Las sobrestimaciones grandes fueron comunes cuando el número total de eventos fue inferior a 200; ocurrieron sobrestimaciones más pequeñas pero importantes con 200 a 500 eventos, mientras que pruebas con más de 500 eventos mostraron pequeñas sobrestimaciones.
Esta sobrestimación del efecto del tratamiento que surge de la interrupción precoz debe diferenciarse de otro tipo de sobrestimación debida al reporte selectivo de resultados de investigaciones. Por ejemplo, en que los investigadores pueden elegir reportar algunos de los múltiples desenlaces analizados durante la investigación, basados en la naturaleza y dirección de los mismos[23]. La tendencia de los ensayos truncados a sobrestimar los efectos del tratamiento es particularmente peligrosa, porque permitiría la introducción de sesgos de publicación, ya que sus resultados aparentemente convincentes a menudo se publican rápidamente en revistas destacadas, se difunden en los medios de comunicación con premura y se toman decisiones basados en ellos, como la incorporación a guías de práctica clínica, políticas públicas e iniciativas de garantía de calidad[24].
Dada esta rápida divulgación de ensayos truncados en revistas de corriente principal[25],[26],[27] y su amplia incorporación a la práctica clínica, es muy probable que, durante las búsquedas de estudios primarios para revisiones sistemáticas, estos estudios sean identificados e incluidos. En ese caso, los aspectos que deben ser adecuadamente reportados en los estudios primarios son la estimación del tamaño muestral, el análisis intermedio que dio paso a la interrupción y la regla que se ha usado para determinarla. Si los autores de la revisión sistemática no notan el truncamiento y no consideran la interrupción precoz de los ensayos como fuente de una posible sobrestimación de los efectos del tratamiento, los metanálisis pueden sobrestimar muchos de los efectos del tratamiento[28]. De hecho, la inclusión de ensayos clínicos aleatorizados truncados puede introducir una heterogeneidad artificial entre los estudios, lo que conduce a un mayor uso de la técnica metanalítica de efectos aleatorios, por lo que se vuelve importante examinar el potencial de sesgo tanto en los modelos de efectos fijos como aleatorios[19].
Como respuesta a este riesgo, se ha planteado la exclusión de estudios truncados en los metanálisis. Sin embargo, esto genera una subestimación del efecto de la intervención que aumenta de acuerdo con el número de análisis interinos, lo que ha sido demostrado a través de simulaciones[19]. Esta subestimación se nutre de la combinación de dos tipos de sesgos: el sesgo de estimación, relacionado a cómo se calcula la medida de efecto, y el sesgo de información, relacionado al modo de ponderación de cada estudio en el metanálisis. Cuando la proporción de estudios secuenciales es baja, el sesgo de excluir los estudios truncados es bajo. Cuando al menos la mitad de los estudios están sujetos a análisis secuencial, el sesgo de subestimación es del orden del cinco al 15%, independientemente de si se utilizó el enfoque de efectos fijos o aleatorios. Cuando todos los estudios están sujetos a monitoreo interino, el sesgo puede ser sustancialmente mayor que ese rango. En general, estos resultados de simulación muestran que una estrategia que excluya los estudios truncados de los metanálisis introduce un sesgo en la estimación de los efectos del tratamiento[19].
Por otra parte, y aunque los estudios que se detienen tempranamente por demostrar un beneficio del tratamiento tienden a sobrestimar su verdadero efecto, no debería ser demasiado sorprendente que su inclusión en los metanálisis conduzca a una estimación válida. Si bien es cierto que al incluir ensayos truncados al metanálisis, la diferencia observada en el tratamiento sobrestima el efecto verdadero y que condicional al no truncamiento, la diferencia observada en el tratamiento subestima el verdadero efecto; en conjunto, los efectos del truncamiento y el no truncamiento se equilibrarían entre sí para permitir una estimación intermedia. No obstante, estas simulaciones suponen que los resultados de un ensayo no influyen en cómo se realiza otro ensayo o directamente si ese ensayo llega a realizarse[19]. Es poco probable que esto refleje la realidad, ya que si un ensayo por casualidad sobrestima los efectos del tratamiento y por lo tanto se detiene tempranamente, será uno de los primeros en realizarse y publicarse; los ensayos de corrección que aportarían a la estimación combinada de un metanálisis nunca se llevarían a cabo[24],[29].
Finalmente, la inclusión de ensayos interrumpidos precozmente podría tener implicancias en la certeza de la evidencia. Como el número de eventos de estos ensayos suele ser menor (justamente por detenerse antes de alcanzar el tamaño requerido), los intervalos de confianza del estimador son usualmente amplios, lo que aporta imprecisión en los resultados de las revisiones sistemáticas, haciendo muy probable que investigaciones adicionales tengan un impacto importante en la confianza sobre las estimaciones del efecto[30].
El análisis secuencial de ensayos clínicos puede ser una herramienta útil e interesante en términos de tiempo y recursos, pero no está exenta de problemas como el sesgo condicional y la sobrestimación del tamaño del efecto.
Sin embargo, parece ser que los efectos combinados obtenidos mediante metanálisis que incluyen ensayos clínicos aleatorizados truncados no muestran un problema de sesgo, incluso si el estudio truncado impide los experimentos futuros. Por lo tanto, los ensayos clínicos aleatorizados truncados no deberían omitirse en los metanálisis que evalúan los efectos del tratamiento.
La superioridad de un tratamiento sobre otro (demostrada en un análisis intermedio de un ensayo clínico aleatorizado diseñado con reglas de interrupción apropiadas, señaladas en el protocolo del estudio y debidamente ejecutadas), constituye probablemente una inferencia válida, incluso si el efecto es ligeramente mayor al verdadero, aunque la estimación derivada del mismo pueda ser imprecisa.
Roles y contribuciones de los autores
LIG y JVAF conceptualizaron el manuscrito inicial. Todos los autores colaboraron en la redacción de todas sus secciones, en la edición y revisión del manuscrito final.
Financiamiento
Los autores declaran que no hubo fuentes externas de financiamiento.
Conflictos de interés
Los autores completaron la declaración de conflictos de interés de ICMJE y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo. Los formularios se pueden solicitar contactando al autor responsable o al Comité Editorial de la Revista.
Aspectos éticos
Este estudio no requirió la evaluación por parte de un comité de ética-científica, debido a que trabajó sobre fuentes secundarias.

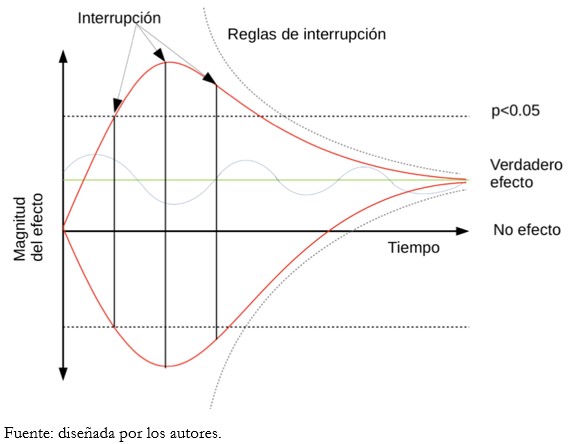 Figura 1. Fluctuación de la medición del efecto y posibles umbrales de interrupción.
Figura 1. Fluctuación de la medición del efecto y posibles umbrales de interrupción.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Sequential analysis of clinical trials allows researchers a continuous monitoring of emerging data and greater security to avoid subjecting the trial participants to a less effective therapy before the inferiority is evident, while controlling the overall error rate. Although it has been widely used since its development, sequential analysis is not problem-free. Among them main issues to be mentioned are the balance between safety and efficacy, overestimation of the effect size of interventions and conditional bias. In this review, we develop different aspects of this methodology and the impact of including early-stopped clinical trials in systematic reviews with meta-analysis.
 Autores:
Luis Ignacio Garegnani[1], Marcelo Arancibia[2], Eva Madrid[2], Juan Víctor Ariel Franco[1]
Autores:
Luis Ignacio Garegnani[1], Marcelo Arancibia[2], Eva Madrid[2], Juan Víctor Ariel Franco[1]

Citación: Garegnani LI, Arancibia M, Madrid E, Franco JVA. How to interpret clinical trials with sequential analysis that were stopped early. Medwave 2020;20(5):e7930 doi: 10.5867/medwave.2020.05.7930
Fecha de envío: 29/11/2019
Fecha de aceptación: 18/5/2020
Fecha de publicación: 5/6/2020
Origen: No solicitado
Tipo de revisión: Con revisión por pares externa, por tres árbitros a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Höfler M. The Bradford Hill considerations on causality: a counterfactual perspective. Emerg Themes Epidemiol. 2005 Nov 3;2:11. | CrossRef | PubMed |
Höfler M. The Bradford Hill considerations on causality: a counterfactual perspective. Emerg Themes Epidemiol. 2005 Nov 3;2:11. | CrossRef | PubMed | Fedak KM, Bernal A, Capshaw ZA, Gross S. Applying the Bradford Hill criteria in the 21st century: how data integration has changed causal inference in molecular epidemiology. Emerg Themes Epidemiol. 2015 Sep 30;12:14. | CrossRef | PubMed |
Fedak KM, Bernal A, Capshaw ZA, Gross S. Applying the Bradford Hill criteria in the 21st century: how data integration has changed causal inference in molecular epidemiology. Emerg Themes Epidemiol. 2015 Sep 30;12:14. | CrossRef | PubMed | Lazcano-Ponce E, Salazar-Martínez E, Gutiérrez-Castrellón P, Angeles-Llerenas A, Hernández-Garduño A, Viramontes JL. Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación [Randomized clinical trials: variants, randomization methods, analysis, ethical issues and regulations]. Salud Publica Mex. 2004 Nov-Dec;46(6):559-84. | CrossRef | PubMed |
Lazcano-Ponce E, Salazar-Martínez E, Gutiérrez-Castrellón P, Angeles-Llerenas A, Hernández-Garduño A, Viramontes JL. Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación [Randomized clinical trials: variants, randomization methods, analysis, ethical issues and regulations]. Salud Publica Mex. 2004 Nov-Dec;46(6):559-84. | CrossRef | PubMed | Monleón-Getino T, Barnadas-Molins A, Roset-Gamisans M. Diseños secuenciales y análisis intermedio en la investigación clínica: tamaño frente a dificultad [Sequential designs and intermediate analysis in clinical research: size vs difficulty]. Med Clin (Barc). 2009 Mar 28;132(11):437-42. | CrossRef | PubMed |
Monleón-Getino T, Barnadas-Molins A, Roset-Gamisans M. Diseños secuenciales y análisis intermedio en la investigación clínica: tamaño frente a dificultad [Sequential designs and intermediate analysis in clinical research: size vs difficulty]. Med Clin (Barc). 2009 Mar 28;132(11):437-42. | CrossRef | PubMed | Bernard GR, Vincent JL, Laterre PF, LaRosa SP, Dhainaut JF, Lopez-Rodriguez A, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001 Mar 8;344(10):699-709. | CrossRef | PubMed |
Bernard GR, Vincent JL, Laterre PF, LaRosa SP, Dhainaut JF, Lopez-Rodriguez A, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001 Mar 8;344(10):699-709. | CrossRef | PubMed | Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 2013 Feb;39(2):165-228. | CrossRef | PubMed |
Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 2013 Feb;39(2):165-228. | CrossRef | PubMed | Abraham E, Laterre PF, Garg R, Levy H, Talwar D, Trzaskoma BL, et al. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med. 2005 Sep 29;353(13):1332-41. | CrossRef | PubMed |
Abraham E, Laterre PF, Garg R, Levy H, Talwar D, Trzaskoma BL, et al. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med. 2005 Sep 29;353(13):1332-41. | CrossRef | PubMed | Molina-Arias M. Diseños secuenciales: interrupción precoz del ensayo clínico. Rev Pediatr Aten Primaria. 2017;19(73):87–90. [On line]. | Link |
Molina-Arias M. Diseños secuenciales: interrupción precoz del ensayo clínico. Rev Pediatr Aten Primaria. 2017;19(73):87–90. [On line]. | Link | DeMets DL. Sequential designs in clinical trials. Card Electrophysiol Rev. 1998;2(1):57–60. | CrossRef |
DeMets DL. Sequential designs in clinical trials. Card Electrophysiol Rev. 1998;2(1):57–60. | CrossRef | Muñoz Navarro SR, Bangdiwala SI. Análisis interino en ensayos clínicos: una guía metodológica [Interim analysis in clinical trials: a methodological guide]. Rev Med Chil. 2000 Aug;128(8):935-41. | PubMed |
Muñoz Navarro SR, Bangdiwala SI. Análisis interino en ensayos clínicos: una guía metodológica [Interim analysis in clinical trials: a methodological guide]. Rev Med Chil. 2000 Aug;128(8):935-41. | PubMed | Wang H, Rosner GL, Goodman SN. Quantifying over-estimation in early stopped clinical trials and the "freezing effect" on subsequent research. Clin Trials. 2016 Dec;13(6):621-631. | CrossRef | PubMed |
Wang H, Rosner GL, Goodman SN. Quantifying over-estimation in early stopped clinical trials and the "freezing effect" on subsequent research. Clin Trials. 2016 Dec;13(6):621-631. | CrossRef | PubMed | Goodman SN. Stopping trials for efficacy: an almost unbiased view. Clin Trials. 2009 Apr;6(2):133-5. | CrossRef | PubMed |
Goodman SN. Stopping trials for efficacy: an almost unbiased view. Clin Trials. 2009 Apr;6(2):133-5. | CrossRef | PubMed | Eckstein L. Assessing the legal duty to use or disclose interim data for ongoing clinical trials. J Law Biosci. 2019 Aug 13;6(1):51-84. | CrossRef | PubMed |
Eckstein L. Assessing the legal duty to use or disclose interim data for ongoing clinical trials. J Law Biosci. 2019 Aug 13;6(1):51-84. | CrossRef | PubMed | Latour-Pérez J, Cabello-López JB. Interrupción precoz de los ensayos clínicos. Demasiado bueno para ser cierto? [Early interruption of clinical trials: too good to be true?]. Med Intensiva. 2007 Dec;31(9):518-20. | CrossRef | PubMed |
Latour-Pérez J, Cabello-López JB. Interrupción precoz de los ensayos clínicos. Demasiado bueno para ser cierto? [Early interruption of clinical trials: too good to be true?]. Med Intensiva. 2007 Dec;31(9):518-20. | CrossRef | PubMed | Lan KK, DeMets DL. Discrete sequential boundaries for clinical trials. Biometrika. 1983;70(3):659–63. | CrossRef |
Lan KK, DeMets DL. Discrete sequential boundaries for clinical trials. Biometrika. 1983;70(3):659–63. | CrossRef | DeMets DL, Lan KK. Interim analysis: the alpha spending function approach. Stat Med. 1994 Jul 15-30;13(13-14):1341-52; discussion 1353-6. | CrossRef | PubMed |
DeMets DL, Lan KK. Interim analysis: the alpha spending function approach. Stat Med. 1994 Jul 15-30;13(13-14):1341-52; discussion 1353-6. | CrossRef | PubMed | Hunt L. Sequential clinical trials—but not for beginners. Lancet. 1998 Mar 21;351(9106):919. | CrossRef |
Hunt L. Sequential clinical trials—but not for beginners. Lancet. 1998 Mar 21;351(9106):919. | CrossRef | Chen DT, Schell MJ, Fulp WJ, Pettersson F, Kim S, Gray JE, et al. Application of Bayesian predictive probability for interim futility analysis in single-arm phase II trial. Transl Cancer Res. 2019 Jul;8(Suppl 4):S404-S420. | CrossRef | PubMed |
Chen DT, Schell MJ, Fulp WJ, Pettersson F, Kim S, Gray JE, et al. Application of Bayesian predictive probability for interim futility analysis in single-arm phase II trial. Transl Cancer Res. 2019 Jul;8(Suppl 4):S404-S420. | CrossRef | PubMed | Schou IM, Marschner IC. Meta-analysis of clinical trials with early stopping: an investigation of potential bias. Stat Med. 2013 Dec 10;32(28):4859-74. | CrossRef | PubMed |
Schou IM, Marschner IC. Meta-analysis of clinical trials with early stopping: an investigation of potential bias. Stat Med. 2013 Dec 10;32(28):4859-74. | CrossRef | PubMed | Bassler D, Briel M, Montori VM, Lane M, Glasziou P, Zhou Q, et al. Stopping randomized trials early for benefit and estimation of treatment effects: systematic review and meta-regression analysis. JAMA. 2010 Mar 24;303(12):1180-7. | CrossRef | PubMed |
Bassler D, Briel M, Montori VM, Lane M, Glasziou P, Zhou Q, et al. Stopping randomized trials early for benefit and estimation of treatment effects: systematic review and meta-regression analysis. JAMA. 2010 Mar 24;303(12):1180-7. | CrossRef | PubMed | Kumar A, Chakraborty BS. Interim analysis: A rational approach of decision making in clinical trial. J Adv Pharm Technol Res. 2016 Oct-Dec;7(4):118-122. | CrossRef | PubMed |
Kumar A, Chakraborty BS. Interim analysis: A rational approach of decision making in clinical trial. J Adv Pharm Technol Res. 2016 Oct-Dec;7(4):118-122. | CrossRef | PubMed | Pocock SJ. When (not) to stop a clinical trial for benefit. JAMA. 2005 Nov 2;294(17):2228-30. | CrossRef | PubMed |
Pocock SJ. When (not) to stop a clinical trial for benefit. JAMA. 2005 Nov 2;294(17):2228-30. | CrossRef | PubMed | Higgins J, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, et al. Cochrane Handbook for Systematic Reviews of Interventions: version 6.0. Cochrane; 2019. [On line]. | Link |
Higgins J, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, et al. Cochrane Handbook for Systematic Reviews of Interventions: version 6.0. Cochrane; 2019. [On line]. | Link | Briel M, Bassler D, Wang AT, Guyatt GH, Montori VM. The dangers of stopping a trial too early. J Bone Joint Surg Am. 2012 Jul 18;94 Suppl 1:56-60. | CrossRef | PubMed |
Briel M, Bassler D, Wang AT, Guyatt GH, Montori VM. The dangers of stopping a trial too early. J Bone Joint Surg Am. 2012 Jul 18;94 Suppl 1:56-60. | CrossRef | PubMed | Bothwell LE, Avorn J, Khan NF, Kesselheim AS. Adaptive design clinical trials: a review of the literature and ClinicalTrials.gov. BMJ Open. 2018 Feb 10;8(2):e018320. | CrossRef | PubMed |
Bothwell LE, Avorn J, Khan NF, Kesselheim AS. Adaptive design clinical trials: a review of the literature and ClinicalTrials.gov. BMJ Open. 2018 Feb 10;8(2):e018320. | CrossRef | PubMed | Cerqueira FP, Jesus AMC, Cotrim MD. Adaptive Design: A Review of the Technical, Statistical, and Regulatory Aspects of Implementation in a Clinical Trial. Ther Innov Regul Sci. 2020 Jan;54(1):246-258. | CrossRef | PubMed |
Cerqueira FP, Jesus AMC, Cotrim MD. Adaptive Design: A Review of the Technical, Statistical, and Regulatory Aspects of Implementation in a Clinical Trial. Ther Innov Regul Sci. 2020 Jan;54(1):246-258. | CrossRef | PubMed | Wayant C, Vassar M. A comparison of matched interim analysis publications and final analysis publications in oncology clinical trials. Ann Oncol. 2018 Dec 1;29(12):2384-2390. | CrossRef | PubMed |
Wayant C, Vassar M. A comparison of matched interim analysis publications and final analysis publications in oncology clinical trials. Ann Oncol. 2018 Dec 1;29(12):2384-2390. | CrossRef | PubMed | Bassler D, Ferreira-Gonzalez I, Briel M, Cook DJ, Devereaux PJ, Heels-Ansdell D, et al. Systematic reviewers neglect bias that results from trials stopped early for benefit. J Clin Epidemiol. 2007 Sep;60(9):869-73. | CrossRef | PubMed |
Bassler D, Ferreira-Gonzalez I, Briel M, Cook DJ, Devereaux PJ, Heels-Ansdell D, et al. Systematic reviewers neglect bias that results from trials stopped early for benefit. J Clin Epidemiol. 2007 Sep;60(9):869-73. | CrossRef | PubMed | Guyatt GH, Briel M, Glasziou P, Bassler D, Montori VM. Problems of stopping trials early. BMJ. 2012 Jun 15;344:e3863. | CrossRef | PubMed |
Guyatt GH, Briel M, Glasziou P, Bassler D, Montori VM. Problems of stopping trials early. BMJ. 2012 Jun 15;344:e3863. | CrossRef | PubMed | Schünemann H, Brożek J, Guyatt G, Oxman A. Handbook for grading the quality of evidence and the strength of recommendations using the GRADE approach. GRADE Work Gr. 2013. [On line]. | Link |
Schünemann H, Brożek J, Guyatt G, Oxman A. Handbook for grading the quality of evidence and the strength of recommendations using the GRADE approach. GRADE Work Gr. 2013. [On line]. | Link |