 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: radiotherapy, COVID-19, coronavirus, hypofractionated, pandemic, cancer
Objetivo
Establecer recomendaciones para la toma de decisiones de manejo en radioterapia durante la pandemia de COVID-19, adaptadas a un país con recursos de salud limitados.
Métodos
A través de una revisión rápida de la literatura se buscaron publicaciones que describieran medidas para reducir el riesgo de infección por COVID-19, así como también pautas de manejo para reducir la carga de trabajo en las unidades de radioterapia. Se incluyeron en el alcance de esta revisión las siguientes patologías: tumores ginecológicos, cáncer de mama, tumores gastrointestinales, tumores genitourinarios, tumores de cabeza y cuello, cáncer de piel, tumores del sistema nervioso central y linfomas. Un grupo de expertos discutió en línea los datos extraídos y redactó las recomendaciones. Mediante un método Delphi modificado, se evaluó el consenso entre 14 radio-oncólogos certificados. Se evaluó la calidad de la evidencia que sustentó las recomendaciones sobre esquemas de tratamiento.
Resultados
Se incluyeron un total de 57 documentos. De 25 trabajos se extrajeron las estrategias para reducir el riesgo de infección. De los restantes, se obtuvieron las recomendaciones para cada patología. Las recomendaciones están orientadas a establecer escenarios específicos donde se pueden omitir, diferir, priorizar y acortar los tratamientos. En el ítem de acortar se recomiendan esquemas de tratamiento para cada patología, priorizando los esquemas hipofraccionados cuando fue posible.
Conclusión
Se plantean estrategias para la gestión de los servicios de radioterapia con el objetivo de garantizar que los tratamientos de alta calidad para pacientes oncológicos sigan entregándose, pese a la crisis sanitaria ocasionada por COVID-19.
Ideas clave
|
Desde que la Organización Mundial de la Salud, OMS, declaró la enfermedad por coronavirus 2019 (COVID-19) como una pandemia global, en marzo de 2020, esta se ha extendido rápidamente por el mundo[1]. Según la OMS actualmente en América Latina y El Caribe, la epidemia está más activa con respecto a otras regiones con 2,7 millones de contagios y más de 121 900 muertes, siendo la segunda zona del mundo con más casos detectados de la enfermedad. Ecuador es uno de los países más afectados de la región, con más de 61 000 casos confirmados y 4770 fallecidos distribuidos en todas las provincias[1]. Se ha calculado que en Ecuador la tasa de mortalidad por COVID-19 es de 19,5 por 100 000 habitantes, una de las más altas de la región[2].
La pandemia ha afectado severamente a los sistemas de salud a nivel mundial y esto inevitablemente tendrá consecuencias en la atención de pacientes oncológicos. No se sabe qué efecto tendrán las demoras en el inicio de los tratamientos sobre la supervivencia a largo plazo de esta cohorte, así como tampoco se sabe por cuánto tiempo se mantendrán estos retrasos[3]. Además, la propia malignidad y las terapias anticancerígenas convierten a estos pacientes en un grupo vulnerable frente a la infección. Cohortes retrospectivas han reportado que los pacientes oncológicos tienen tasas de mortalidad por COVID-19 tres veces más altas que los pacientes sin cáncer, así como también mayor probabilidad de requerir cuidados intensivos, mayor riesgo de eventos severos y mayor posibilidad de necesitar ventilación mecánica invasiva[4],[5].
La radioterapia tiene un papel crucial en el tratamiento de la mayor parte de pacientes con cáncer[6]. Asegurar la atención durante la pandemia sin interrupciones prolongadas, reduciendo el riesgo de infección en pacientes y personal, en medio de una restricción de recursos; es un problema al que se enfrentan muchos departamentos de radio-oncología.
Este trabajo tiene como objetivo realizar una revisión rápida de la evidencia disponible sobre medidas para reducir el riesgo de infección por COVID-19 en las unidades de radioterapia, y estrategias para priorizar la atención de los pacientes oncológicos. Su finalidad es establecer recomendaciones sobre la entrega del tratamiento de radioterapia durante la pandemia, adaptadas a un país con recursos limitados.
Definición del alcance y búsqueda de la literatura
En un protocolo escrito a priori se definió el alcance de la revisión, enfocada en pacientes que reciben tratamiento de radioterapia durante la pandemia de COVID-19, buscando:
1) Estrategias para reducir el riesgo de infección de los pacientes y del personal.
1) Sistemas de categorización para priorización del tratamiento de radioterapia.
2) Esquemas de tratamiento para omitir, diferir y acortar el tratamiento en las patologías más frecuentes en el país: tumores ginecológicos, cáncer de mama, tumores gastrointestinales, tumores genitourinarios, tumores de cabeza y cuello, cáncer de piel, tumores del sistema nervioso central, linfomas y manejo paliativo.
Estas patologías fueron establecidas como prioritarias por el grupo de expertos en función de la frecuencia de su presentación y perfil epidemiológico de las distintas unidades de radioterapia del país.
Se realizó una búsqueda mediante la combinación de términos en vocabulario controlado y no controlado en MEDLINE a través de PubMed, actualizada al 6 de abril de 2020. Los términos usados fueron: "COVID-19", "COVID", "coronavirus", "radiotherapy", "radiation". Se buscaron artículos adicionales en los repositorios de la American Society of Radiation Oncology/European Society for Radiotherapy and Oncology, ASTRO/ESTRO y la Royal College of Radiologist, donde dichas instituciones compilaron documentos relacionados con COVID-19 y radioterapia.
También se revisaron las referencias de los manuscritos incluidos y se solicitó al grupo de expertos que recomendaran documentos relevantes.
Selección de los estudios
Un revisor determinó la elegibilidad de los documentos por título y resumen. Un segundo revisor verificó el 20% de los documentos tamizados, para comprobar la elegibilidad. Finalmente, otro revisor evaluó la elegibilidad de los artículos en texto completo.
Se incluyeron documentos que emitan estrategias y recomendaciones para el manejo de pacientes que reciben tratamiento en las unidades de radioterapia durante la pandemia por COVID-19. Debido a la característica emergente de este escenario, se previó la falta de guías de práctica clínica con recomendaciones con los mejores niveles de evidencia, y la falta de revisiones sistemáticas. Por estas razones se incluyeron opiniones de expertos, experiencias, comunicaciones cortas, guías clínicas y protocolos institucionales. Se incorporaron también declaraciones de posición de instituciones académicas y gubernamentales publicadas en sus respectivas páginas web. Se incluyeron sólo aquellos documentos publicados en inglés y español. Se excluyeron los documentos con recomendaciones específicas sobre patologías fuera del alcance de esta revisión.
Extracción de datos
Un revisor extrajo el tipo de estudio, país de procedencia, tópico y ámbito de las recomendaciones. Los categorizó según si daban solución a algunos de los aspectos señalados previamente. Posteriormente, dos revisores extrajeron individualmente las estrategias o intervenciones propuestas en cada documento en una hoja de extracción de datos preestablecida. Cuando el grado de discrepancias en la extracción de los datos fue mayor al 60%, un tercer revisor resolvió tales discrepancias.
A un grupo se les pidió que extrajeran las medidas propuestas para reducir la transmisión del virus en las unidades de radioterapia. Una vez discutidas en el grupo, estas fueron evaluadas por dos expertas en microbiología, quienes individualmente determinaron si técnicamente eran adecuadas.
Para las recomendaciones por grupo de patología se utilizó el enfoque RADS (por sus siglas en inglés, Remote Visits, Avoid Radiation, Defer Radiation, Shorten Radiation)[7]. Para cada patología se les pidió extraer recomendaciones que respondan a las siguientes preguntas:
1) ¿En qué pacientes se puede omitir el tratamiento de manera segura?
2) ¿En qué pacientes se puede diferir el tratamiento y por cuánto tiempo?
3) ¿Qué pacientes deben recibir tratamiento prioritario?
4) ¿Cuál sería la técnica de tratamiento preferida y en qué fraccionamiento?
5) ¿Se justifica el uso de compensación de dosis en caso de suspensiones prolongadas de tratamiento?
Las recomendaciones se compilaron en una sola hoja y fueron entregadas a los grupos de expertos para su discusión. Se les solicitó que consideraran un escenario en el que la pandemia duraría varios meses, con una proporción significativa no disponible de personal y en un sistema sanitario colapsado, lo que limitaría los recursos.
Evaluación de la calidad de la evidencia
Se evaluó la calidad de la evidencia de las recomendaciones sobre esquemas de tratamiento utilizando el método descrito por Varker y colaboradores[8]. Este considera los niveles de evidencia según el Centro de Medicina Basada en Evidencia (Center for Evidence-Based Medicine, CEBM, por sus siglas en inglés), el riesgo de sesgo de los estudios y la consistencia de los hallazgos. Se calificó como alta calidad de la evidencia si uno o más estudios de nivel I con bajo riesgo de sesgo o tres o más estudios de nivel II con bajo riesgo de sesgo, sustentan la recomendación. Se señaló como moderada calidad, cuando uno o dos estudios de nivel II con bajo riesgo de sesgo o dos o más estudios de nivel III con bajo riesgo de sesgo y hallazgos consistentes, fundamentan la recomendación. Se consideró de baja calidad cuando uno o más estudios de nivel I al IV con un alto riesgo de sesgo, sustentan la recomendación.
Un revisor evaluó la calidad de la evidencia de cada recomendación sobre esquemas de tratamiento.
Desarrollo del consenso
El grupo de consenso estuvo conformado por 14 radio-oncólogos certificados pertenecientes a siete unidades de radioterapia del país. Se emitieron invitaciones dirigidas para lograr la inclusión de una muestra representativa que permitiera contar con médicos especialistas en radioterapia de las distintas ciudades del país, con diferentes grados de experticia, especializados en varios campos de la especialidad y con equidad de género.
Para la elaboración del consenso se siguió el enfoque de Delphi modificado por la American Society of Clinical Oncology, ASCO[9]. En la primera ronda se solicitó a los miembros del grupo que calificaran el acuerdo con cada recomendación en una escala Likert de cinco puntos, que va desde muy de acuerdo a muy en desacuerdo, mediante encuesta en línea. El formulario de calificación incluyó un espacio para comentarios. Para cada pregunta se calculó el porcentaje de acuerdo y el puntaje promedio. El porcentaje de acuerdo se refiere al número de evaluadores que indicaron estar de acuerdo o totalmente de acuerdo, dividido por el número total de evaluadores. No se incluyeron los no respondedores en el denominador. Se definió consenso con un acuerdo del 80% y un puntaje promedio de 1 o 2[9]. Para todas las recomendaciones, los resultados detallados de las rondas de consenso se proporcionarán bajo requerimiento, junto con las opiniones discrepantes.
Al completar la primera ronda de calificaciones, cinco miembros del grupo de expertos discutieron los resultados, abordaron los comentarios y revisaron las recomendaciones que no alcanzaron el umbral de consenso. Posteriormente se solicitó a todo el grupo de consenso calificar su acuerdo con la recomendación revisada. Los miembros del grupo recibieron la iteración previa de las recomendaciones, la distribución de calificaciones y las recomendaciones revisadas. No se revaloraron las recomendaciones que alcanzaron el acuerdo en la primera ronda. Los resultados se reportan de manera narrativa, describiendo la recomendación, la fuente y el grado de consenso.
Se incluyeron un total de 57 documentos. Las características de los documentos incluidos se pueden observar en la Tabla 1 del material suplementario. El diagrama de flujo del proceso de inclusión se puede observar en la Figura 1.
Figura 1. Diagrama de flujo para la selección de los estudios.
De los 57 documentos, 25 aportaron estrategias para reducir la transmisión del virus[10],[11],[12],[13],[14],[15],[16],[17],[18],[19],[20],[21],[22],[23],[24],[25],[26],[27],[28],[29],[30],[31],[32],[33],[34]; nueve incluyeron recomendaciones para cáncer de cabeza y cuello[22],[23],[26],[27],[35],[36],[37],[38],[39]; 13 para tumores gastroinestinales[22],[26],[27],[38],[40],[41],[42],[43],[44],[45],[46],[47],[48]; nueve para tumores genitourinarios[7],[22],[23],[26],[27],[36],[38],[49],[50]; diez para tumores ginecológicos[22],[23],[26],[27],[36],[38],[51],[52],[53],[54]; tres para linfomas[22],[26],[27]; 13 para cáncer de mama[22],[23],[26],[27],[36],[38],[55],[56],[57],[58],[59],[60],[61]; cinco para tumores del sistema nervioso central [22],[26],[27],[38],[62]; tres para cáncer de piel[22],[26],[27] y seis para paliativos[22],[26],[27],[38],[59],[63]. Catorce radio-oncólogos certificados, pertenecientes a siete unidades de radioterapia del país, contribuyeron en las discusiones en línea y votaron a través de encuestas electrónicas.
Estrategias para reducir la transmisión del virus
Las estrategias están orientadas a reducir la probabilidad de infección en pacientes y personal, cubriendo los problemas que pueden presentarse en un departamento de radioterapia. Para su implementación se debe hacer un análisis en cada centro basado en las circunstancias y recursos disponibles, los protocolos establecidos en cada hospital, así como la normativa vigente establecida por el Ministerio de Salud Pública.
Estas medias se han clasificado en las siguientes categorías:
1. Sistemas de triaje
- Establecer un punto de triaje en el ingreso al hospital que indague sobre sintomatología respiratoria alta, control de temperatura, historial de viaje y contacto con casos confirmados[10],[13],[14],[15],[16],[17],[18],[19],[20],[23].
- Se recomienda un triaje clínico adicional en el ingreso al servicio, en las unidades donde existan los recursos para hacerlo[14],[15],[18],[19],[24].
- Telefonear a los pacientes antes de la simulación y del primer día de tratamiento para averiguar sobre síntomas respiratorios, si ha sido diagnosticado o ha tenido contacto cercano con caso positivo de COVID-19[10],[15],[22],[23].
- Enviar a los pacientes con sospecha de COVID-19 para valoración en emergencia o unidad especializada y toma de muestra, registro y notificación del caso. Diferir su cita o inicio de tratamiento. Para definir responsables de este proceso, se deberán seguir los protocolos de manejo de casos sospechosos de cada hospital[10],[14],[15],[17],[18],[23].
- Diferir por al menos 14 días la simulación o inicio de tratamiento en pacientes que hayan estado en contacto cercano con un caso de COVID-19 confirmado o probable en los últimos 14 días. El Ministerio de Salud Pública establece como contacto cercano: exposición por más de 15 minutos de contacto cara a cara o más de dos horas en un espacio cerrado, incluye el domicilio[14],[19],[23].
- Tomar la temperatura del personal a la llegada a la unidad y luego del almuerzo, manteniendo un umbral de 37,5 grados Celsius[10],[13],[14],[16],[17],[19].
- Indagar por síntomas respiratorios altos entre el personal[14],[15],[16],[17],[22].
- No deberá asistir el personal con síntomas respiratorios altos o temperatura mayor a 37,5 grados Celsius[10],[17],[22].
- Cumplir con las reglas nacionales de retorno de viaje y auto-aislamiento[10],[22].
2. Medidas generales de higiene
- Lavarse las manos 20 segundos como mínimo antes y después de posicionar a los pacientes, después de manipular implementos, cuando las manos estén visiblemente sucias y regularmente durante el día. Si no tienen cerca un lavabo, se podría usar alcohol gel[10],[13],[14],[15],[16],[17],[18],[19].
- Limpiar regularmente todas las superficies de contacto de alto volumen, incluidos mostradores, teléfonos celulares, interruptores de luz, grifos e inodoros, perillas de puertas y los teclados, de acuerdo con las instrucciones del fabricante y las políticas de cada institución[10],[17],[22].
- Reducir el uso de teléfonos móviles cuando se está en contacto con pacientes y superficies. Desinfectarlo frecuentemente con alcohol al 70%[10].
- Proveer de dispensadores de alcohol gel, pañuelos antisépticos y medidas informativas en las salas de espera de pacientes[15],[18],[22],[23].
3. Uso de equipos de protección personal
- Los técnicos de radioterapia que interactúan con un gran volumen de pacientes, deben usar rutinariamente mascarillas quirúrgicas[13],[24],[25],[26],[27],[28],[29],[30],[31],[33],[34].
- Cuando la examinación de faringe y cavidad oral sean estrictamente necesarias, deberán realizarse con mascarilla N95 o equivalentes, gafas y guantes[10].
- El personal en contacto con pacientes sospechosos o confirmados deben usar mascarilla N95, o FFP2 o FFP3 estándar o equivalentes[19],[28],[32].
- Pacientes y acompañantes deberán usar obligatoriamente mascarilla quirúrgica[14],[16],[17],[18],[21].
- Paciente con sintomatología respiratoria, pero con condición clínica respiratoria preexistente recogida en el historial clínico, debe acudir con mascarilla quirúrgica y continuar tratamiento[16].
- Hacer uso racional del equipo de protección, en concordancia con los protocolos de cada institución[14],[15],[16],[18],[19].
4. Medidas de distanciamiento social
- Evitar cualquier reunión presencial, preferir herramientas electrónicas[10],[13],[14],[16],[21],[22].
- Cuando las reuniones sean inevitables, permitir máximo cinco personas con 1,5 metros de separación entre ellas[15],[17].
- Evitar al máximo los acompañantes de los pacientes, excepto cuando estos requieran asistencia[10],[13],[17],[22].
- El paciente debe permanecer en la sala de espera el menor tiempo posible, cumpliendo estrictamente los horarios de los aceleradores[20],[25],[26].
- Diferenciar tres zonas en el servicio: contaminada, semicontaminada y limpia[13],[19],[21].
- En áreas comunes, el personal deberá conservar una distancia de al menos 1,5 metros entre sí[13],[17],[22].
- En la sala de espera los pacientes deben sentarse a una distancia de al menos 2 metros (o por lo menos una silla entre pacientes)[32].
- Dar prioridad al tratamiento de niños, para disminuir el tiempo de estancia en las salas de espera[25],[27],[29],[31],[32],[34].
- Restringir la movilización del personal en el hospital y entre hospitales[10],[19].
5. Limpieza y desinfección de dispositivos de inmovilización y aceleradores
- Desinfectar los inmovilizadores de uso compartido con alcohol al 70% después de cada tratamiento de radioterapia[14],[18],[25],[27],[29],[32],[34].
- Evitar el uso de cualquier dispositivo que no pueda ser desinfectado adecuadamente[15].
- Desinfectar dispositivos como máscaras termoplásticas con alcohol al 70%, luego de cada tratamiento y almacenar por separado las de pacientes con sintomatología respiratoria[18],[22],[23],[25],[27],[28],[32],[34].
- Desinfectar los dispositivos de inmovilización personalizados tales como bolsas al vacío o cunas α después de cada tratamiento con un desinfectante de base alcohólica, aplicado con un paño suave (consulte las instrucciones del fabricante). Evite aerosoles, blanqueadores, solventes o detergentes abrasivos[15],[16].
- Guardar las máscaras termoplásticas y bolsas al vacío en fundas plásticas individuales, luego de cada uso[15],[16],[28].
- Desinfectar luego de cada tratamiento las superficies del acelerador que entren en contacto con el paciente, con sustancias de base alcohólica y según las especificaciones técnicas del fabricante[14],[24],[26],[29],[31].
- Se recomienda aseo del piso al menos tres veces al día y cuando esté visiblemente sucio[24],[25].
- Limpiar áreas comunes como sala de espera o vestidores al menos dos veces al día[27].
- Aplicar desinfección terminal a todas las áreas después de finalizar los tratamientos programados[32].
6. Reorganización del trabajo
- Para reducir el riesgo de exposición, hay que considerar la división del personal en dos grupos de trabajo rotativo que no tengan contacto entre sí, para preservar una reserva de proveedores de atención[10],[13],[14],[15],[19],[21],[22],[23].
- Organizar el trabajo, para que un grupo acuda al servicio y el otro pueda trabajar en la planificación remota de los tratamientos[13],[14],[15],[16],[18],[19],[32].
- Mantener el mínimo número de personal necesario trabajando en la unidad[15],[18],[21],[22],[23].
- Si una persona del grupo se confirma como caso positivo, considerar que todo el grupo pudiese ir a cuarentena de 14 días[14],[19].
- Identificar al personal que podría realizar trabajo remoto, garantizando la calidad de la atención[10],[18],[22],[23].
- Gestionar actividades para hacer posible la planificación remota de tratamientos[26],[32],[34].
- Realizar reuniones clínicas o de trabajo vía video conferencia[10],[13],[15],[16],[17],[20],[23].
- Mantener el servicio de consulta externa al mínimo, solo para pacientes en tratamiento activo o nuevos[10],[14],[15],[16],[17],[22].
- Diferir controles de pacientes subsecuentes o en seguimiento[20],[21],[23],[30],[34].
- Adaptar los esquemas para tener el mínimo de consultas posibles durante el tratamiento[10],[16],[21],[22].
- Realizar seguimiento vía telefónica y/o por telemedicina de pacientes que culminaron tratamiento sin toxicidad y con dificultad en la movilidad para acudir a control[24],[25],[26],[28],[29],[30],[31].
- Cancelar los controles semanales a pacientes sin toxicidad radioinducida[31].
- Llamar por teléfono a pacientes de seguimiento, para solicitar resultados de exámenes y modificar fecha de cita hasta después de la emergencia[17],[22],[23].
7. Medidas para personal de física médica
- Priorizar tareas esenciales y urgentes, posponiendo aquellas tareas que pueden tolerar demoras[32].
- Los controles de calidad anuales podrían ser pospuestos por tres o cuatro meses[31],[32],[33],[34].
- Asegurar la disponibilidad de un grupo de físicos para los controles de calidad de aceleradores y dosimetrías urgentes[17],[22],[23].
- El personal de física médica amerita de una segregación estricta para garantizar que no haya contaminación cruzada. Para esto se debe dedicar diferentes salas a los médicos para contornear y a los físicos para la planificación del tratamiento, en donde haya disponibilidad de espacio físico[17],[31],[32],[33],[34].
- El personal se debería organizar en turnos de trabajo separados, para minimizar la exposición en un espacio cerrado como las sala de planificación, en donde haya disponibilidad de espacio físico[31],[32],[33],[34].
Recomendaciones por patología
En las Tablas 1 a 6 se presentan las recomendaciones por patología, orientadas a establecer escenarios donde se pueden omitir, diferir, priorizar y acortar los tratamientos. Se recomiendan esquemas de tratamiento para cada patología priorizando el hipofraccionamiento cuando sea posible. En la Tabla 2 del material suplementario se describen estrategias en el caso de que existan suspensiones de tratamiento.
Tabla 1. Cáncer de cabeza y cuello.
Tabla 2. Tumores gastrointestinales.
Tabla 3. Tumores genitourinarios.
Tabla 4. Tumores ginecológicos
Tabla 6. Otros grupos de patologías menos frecuentes.
Radioterapia con intención paliativa
En el caso de la radioterapia entregada con intención paliativa se recomienda omitir el tratamiento de radioterapia en los siguientes casos:
- Pacientes metastásicos con expectativa de vida menor a tres meses[38] (consenso: 82%).
- Metástasis óseas asintomáticas o controladas con analgésicos[26] (consenso: 100%).
- Cáncer de próstata oligometastásico, radioterapia pre-operatoria en fracturas patológicas[26] (consenso: 100%).
Se podría diferir en:
- Pacientes estables sin síntomas emergentes, se puede esperar hasta progresión de los síntomas[63] (consenso: 100%).
- Metástasis cerebrales estables con manejo sintomático[26] (consenso: 91%).
- Metástasis en columna sin invasión del canal medular[27] (consenso 91%).
Los siguientes casos deberían recibir tratamiento prioritario:
- Síndrome de vena cava superior con categorización de severidad 3 a 5 según la escala de Yu y colaboradores[38],[109] (consenso 100%).
- Compresión medular y metástasis cerebrales sintomáticas no candidatos a cirugía[22],[26],[27] (consenso 100%).
- Metástasis óseas con o sin fractura, sin respuestas a opiáceos[22],[26] (consenso 100%).
- Obstrucción de vía aérea[27] (consenso 100%).
- Hemorragia aguda sin posibilidad de otros tratamientos[26],[27],[63] (consenso 100%).
- Dolor severo que no responde a manejo conservador[27] (consenso 100%).
Algunos esquemas recomendados:
- Metástasis cerebrales 20 Gy en 5 fracciones (3D o radioterapia de intensidad modulada). Radioterapia estereotáctica corporal una fracción, si son de 1 a 3 lesiones en casos seleccionados[22],[63],[110](moderada calidad, consenso: 100%).
- Metástasis cerebrales, con mal pronóstico dos fracciones de 6 Gy, técnica 3D[26], (evidencia de baja calidad,consenso: 100%).
- En metástasis óseas que ocasionen síndrome de compresión medular se recomienda una sola sesión de 8Gy, o 16 Gy en 2, o 15 Gy en 3 o 20 Gy en 5 fracciones, esta última se prefiere en pacientes con mejor pronóstico[22],[58],[111],[112](evidencia de alta calidad, consenso: 100%).
- Sangrado tumoral gastrointestinal o ginecológico, 20 Gy en 5 fracciones [26],[63], (evidencia de baja calidad, consenso: 100%).
- Síndrome de vena cava superior 20 Gy en 5 fracciones (técnica 3D) o 17 Gy en 2 fracciones una cada semana (con técnica avanzada donde esté disponible)[63],[113] (evidencia de moderada calidad, consenso: 100%).
- Obstrucción de vía aérea 20 Gy en 5 fracciones[63] (moderada calidad, consenso: 91%).
El objetivo del presente documento fue proporcionar un apoyo urgente a los profesionales de las unidades de radioterapia de países con sistemas sanitarios limitados, donde la pandemia ha golpeado fuertemente. Hay una serie de recomendaciones sustanciales, estructuradas en torno a distintos escenarios, pero las decisiones de tratamiento en la práctica deberán tener en cuenta todos los factores clínicos relevantes.
Al considerar la implementación de estas recomendaciones, deben abordarse varios problemas que pueden afectar su uso clínico. Si bien se han analizado las realidades de la mayoría de las unidades de Ecuador, cada pauta podría o no ser implementada en función de los recursos humanos y técnicos disponibles. Según el Directorio de Centros de Radioterapia del Organismo Internacional de Energía Atómica, con datos actualizados a 2018, en Ecuador existen 11 centros de radioterapia concentrados en las ciudades de Quito, Guayaquil y Cuenca. En estos centros hay un total de 21 aceleradores lineales, seis unidades de braquiterapia y sólo en ocho centros se entregan tratamientos con radioterapia de intensidad modulada (IMRT, del inglés Intensity Modulated Radiotherapy).
Incluso dentro de una misma unidad de radioterapia, la capacidad o necesidad de implementar las recomendaciones podrían variar según qué fase de la pandemia estén atravesando. Por otra parte, es importante recalcar que las unidades de radioterapia deben regirse según las normativas emitidas por el Ministerio de Salud Pública. Es por ello, que de ningún modo estas recomendaciones pretenden suplantar a las emitidas por la autoridad competente.
Un efecto importante de COVID-19 es un cambio en la forma como se evalúa la relación riesgo-beneficio para la toma de decisiones. Ante la reducción de recursos, pueden ser necesarias decisiones de manejo fuera de los protocolos establecidos, con la consecuencia de verse obligados a adoptar tratamientos con mayor riesgo de efectos adversos o que podrían considerarse sub-óptimos, con el objetivo de garantizar seguridad y beneficio terapéutico para un mayor número de personas[39].
Varios trabajos han sido publicados desde el inicio de la pandemia haciendo un llamado a las unidades de radioterapia para que se priorice la entrega de tratamientos en función del tipo de tumor, de la intencionalidad del tratamiento y de los recursos disponibles[11],[20],[59]. Así, las guías disponibles insisten en la priorización del tratamiento de tumores considerados rápidamente proliferativos como cáncer de cabeza y cuello o cáncer de cérvix, especialmente cuando la intención es radical, ya que el diferir o suprimir la radioterapia en estos tumores afectaría significativamente el control de la enfermedad[26],[31],[35],,[39],[54].
Por otra parte, otros trabajos también han sugerido el uso de medidas prácticas para mitigar el impacto de las interrupciones del tratamiento[23],[38], así como también una implementación más amplia de programas hipofraccionados en la práctica clínica[7],[11],[12],[26],[38],[41],[47],[56],,[63]. Dichos documentos concuerdan en señalar que aunque la evidencia actual sobre esquemas hipofraccionados no ha logrado estandarizarse para todas las patologías, se debería considerar implementarlos, cuando sea factible, como el paradigma esencial para disminuir el acceso de los pacientes a los hospitales[7],[41],[56],,[63].
Las presentes recomendaciones intentan recoger de manera sistemática estos trabajos publicados. La idea es proponer un sistema de priorización de la entrega de tratamiento por patología, esquemas hipofraccionados donde la evidencia lo permite, y sistemas para compensación de las dosis, según han sido propuestos por varios autores e instituciones.
Estas recomendaciones han sido desarrolladas bajo consenso y sustentándose en una metodología sujeta a las limitaciones que suponen datos clínicos acotados. A esto se suma la necesidad de desarrollarlas en el menor tiempo posible para dar una respuesta rápida a esta grave situación impuesta por la pandemia de CIVID-19. Es por ello que, por una parte, se incluyeron como artículos fuente documentos publicados a través de procesos editoriales acortados y sin el rigor metodológico deseable para la toma de decisiones. Por otra parte, sólo se realizó una evaluación formal de la calidad de la evidencia de las recomendaciones de esquemas de tratamiento. Para el resto de recomendaciones, la calidad de la evidencia se evaluó de forma global durante las discusiones entre expertos. Estas limitaciones deben considerarse a la hora de implementar las recomendaciones.
Finalmente, un grupo de patologías estuvieron fuera del alcance de esta revisión por considerarse de baja prevalencia y bajo impacto en las unidades de radioterapia. Estas patologías fueron cáncer de pulmón o tumores del tejido conectivo. En estos casos consideramos que se debe mantener la práctica habitual antes de la pandemia por COVID-19.
Se plantean estrategias orientadas a la gestión de los servicios de radioterapia para reducir el riesgo de infección de pacientes y personal.
También se hacen recomendaciones por patología, con el objetivo de garantizar que los tratamientos de radioterapia de alta calidad continúen en beneficio de todos los pacientes oncológicos que requieren este tratamiento.
Finalmente, dada la urgente necesidad de procesar dichas recomendaciones, y ante el carácter emergente de esta pandemia, se trabajó con diversas limitaciones como el análisis de datos clínicos acotados, inclusión de documentos con procesos editoriales de rigor insuficiente y falencias en la evaluación de la calidad de evidencia, entre otros. Por estos motivos, es importante considerar las limitaciones al momento de implementar estas recomendaciones.
Roles de autoría
NMO: concibió y diseñó el trabajo, participó en las sesiones de discusión, revisión de las recomendaciones y la escritura del manuscrito. RPV, BLM, AIC, MS, BAR, NS, PA, CNS, KZV, AC, JMJ, ARB, YB: participaron en la selección de los estudios, la extracción de datos, en la redacción de las recomendaciones, en las sesiones de discusión, revisión de las recomendaciones y en la escritura del manuscrito. LDR, EG: participaron en las sesiones de discusión, revisión de las recomendaciones y en la escritura del manuscrito. Todos/as los/las autores/as han revisado y aprobado la versión final del artículo.
Agradecimientos
Agradecemos a Estefanía Ochoa-Toasa y Johana Salgado por su contribución en la revisión técnica de las estrategias para reducir el riesgo de infección.
Conflictos de intereses
Los autores completaron la declaración de conflictos de interés de ICMJE y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo. Los formularios se pueden solicitar contactando al autor responsable o al Comité Editorial de la Revista.
Financiamiento
Los autores no recibieron financiamiento para la realización de este estudio.
Consideraciones éticas
Debido a que en este tipo de trabajos se usan datos publicados ya previamente por otros estudios, el presente documento no fue evaluado por comité de ética.

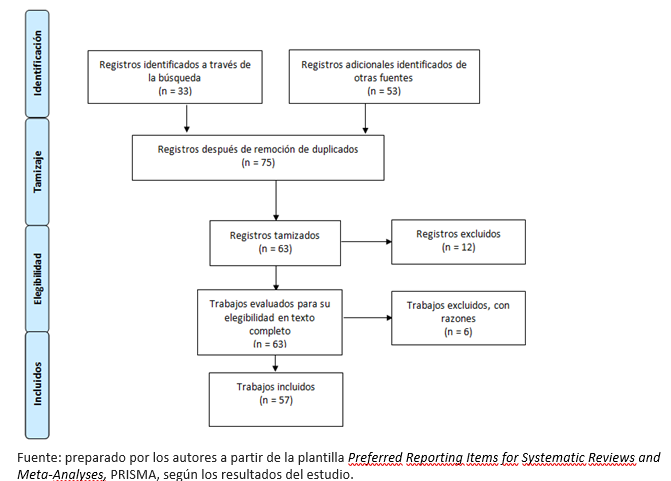 Figura 1. Diagrama de flujo para la selección de los estudios.
Figura 1. Diagrama de flujo para la selección de los estudios.

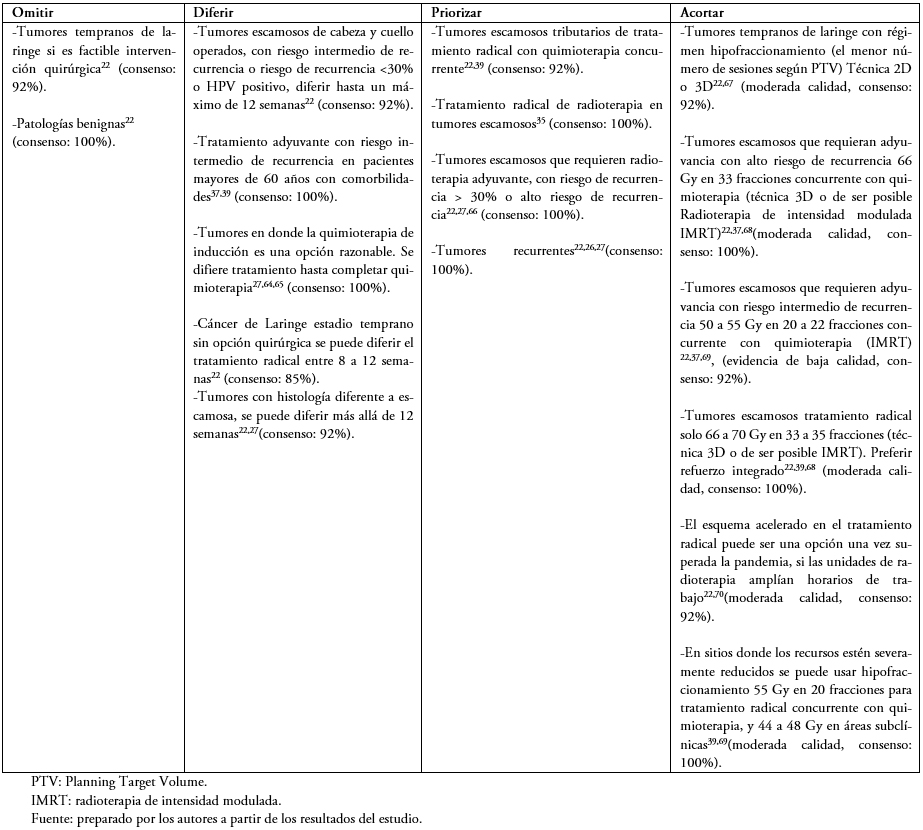 Tabla 1. Cáncer de cabeza y cuello.
Tabla 1. Cáncer de cabeza y cuello.

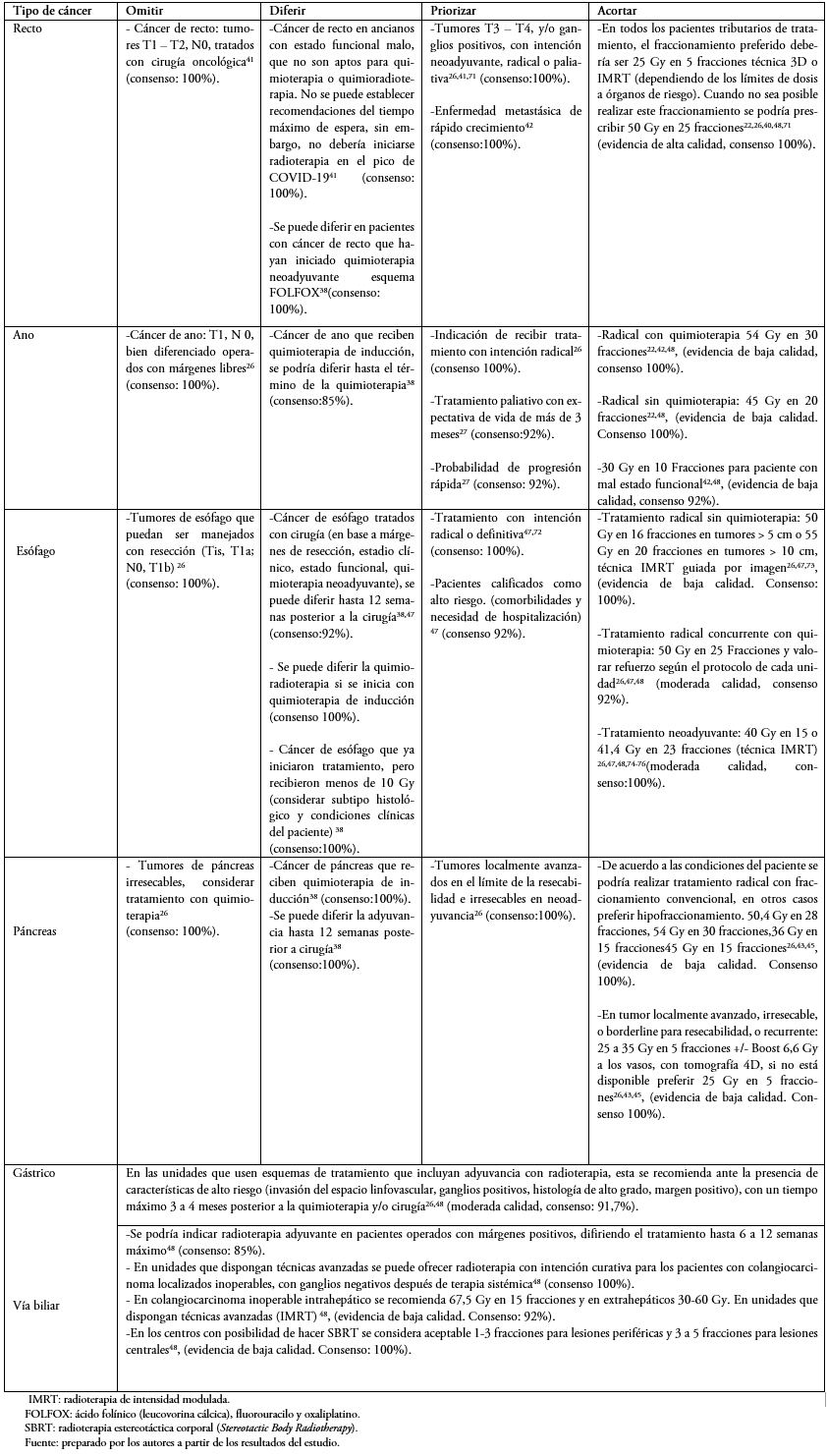 Tabla 2. Tumores gastrointestinales.
Tabla 2. Tumores gastrointestinales.

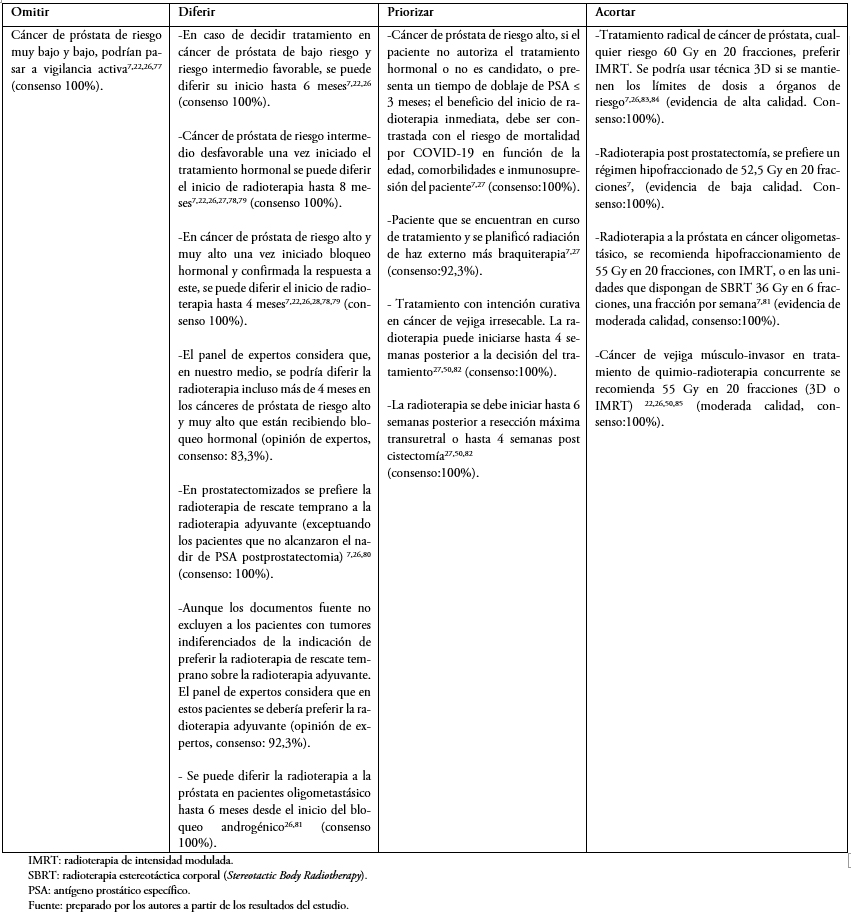 Tabla 3. Tumores genitourinarios.
Tabla 3. Tumores genitourinarios.

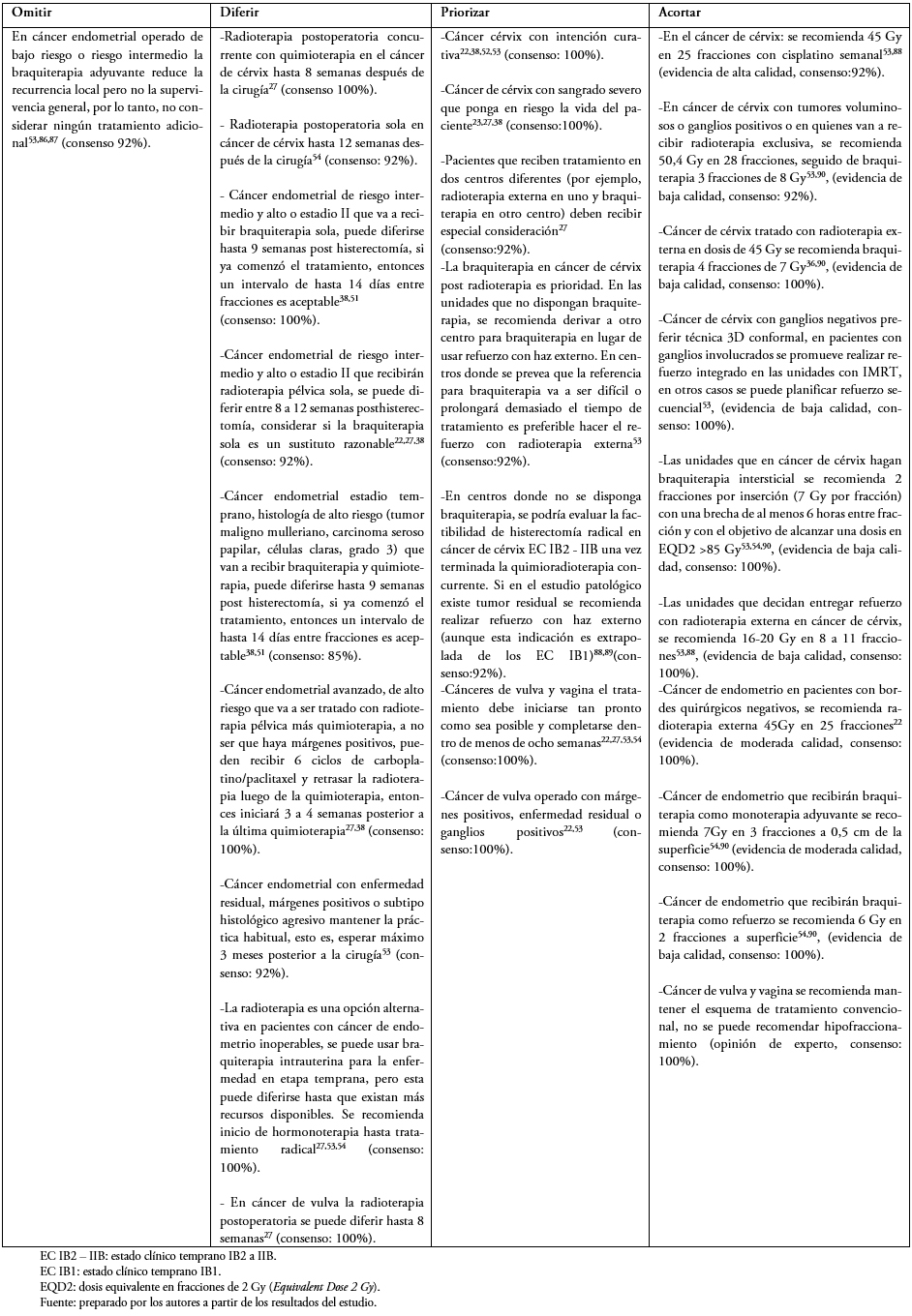 Tabla 4. Tumores ginecológicos
Tabla 4. Tumores ginecológicos

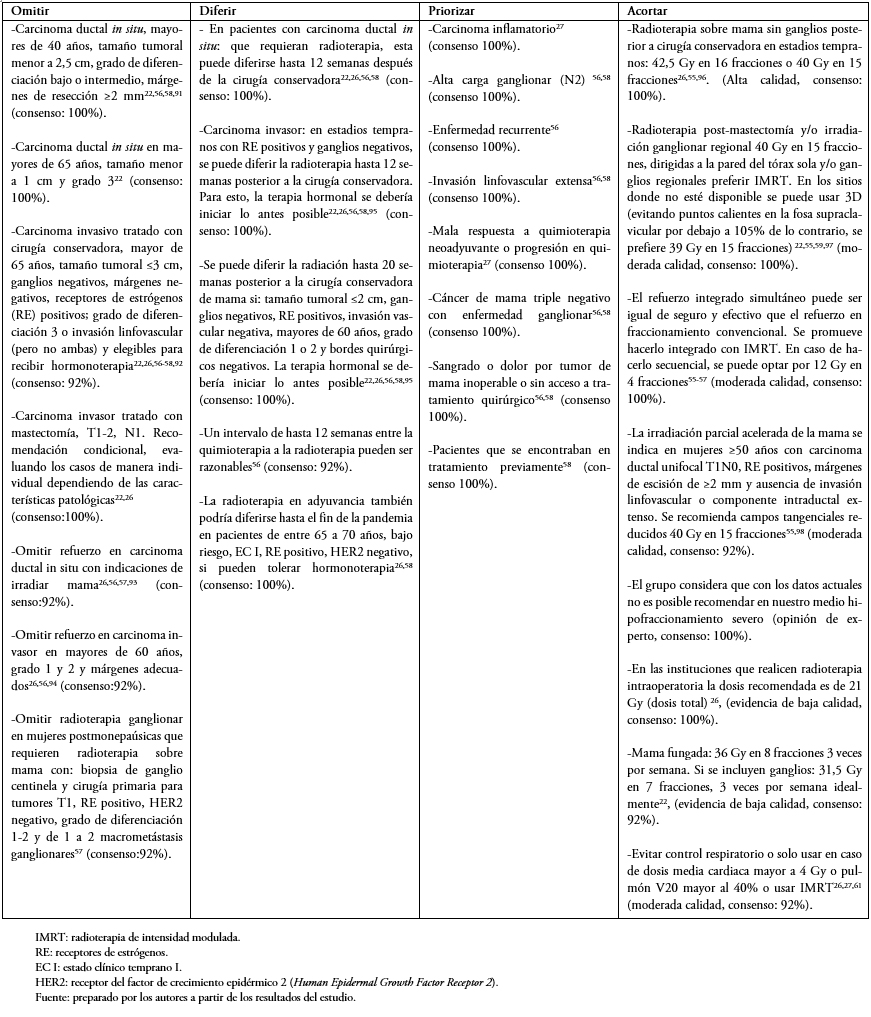 Tabla 5. Cáncer de mama.
Tabla 5. Cáncer de mama.

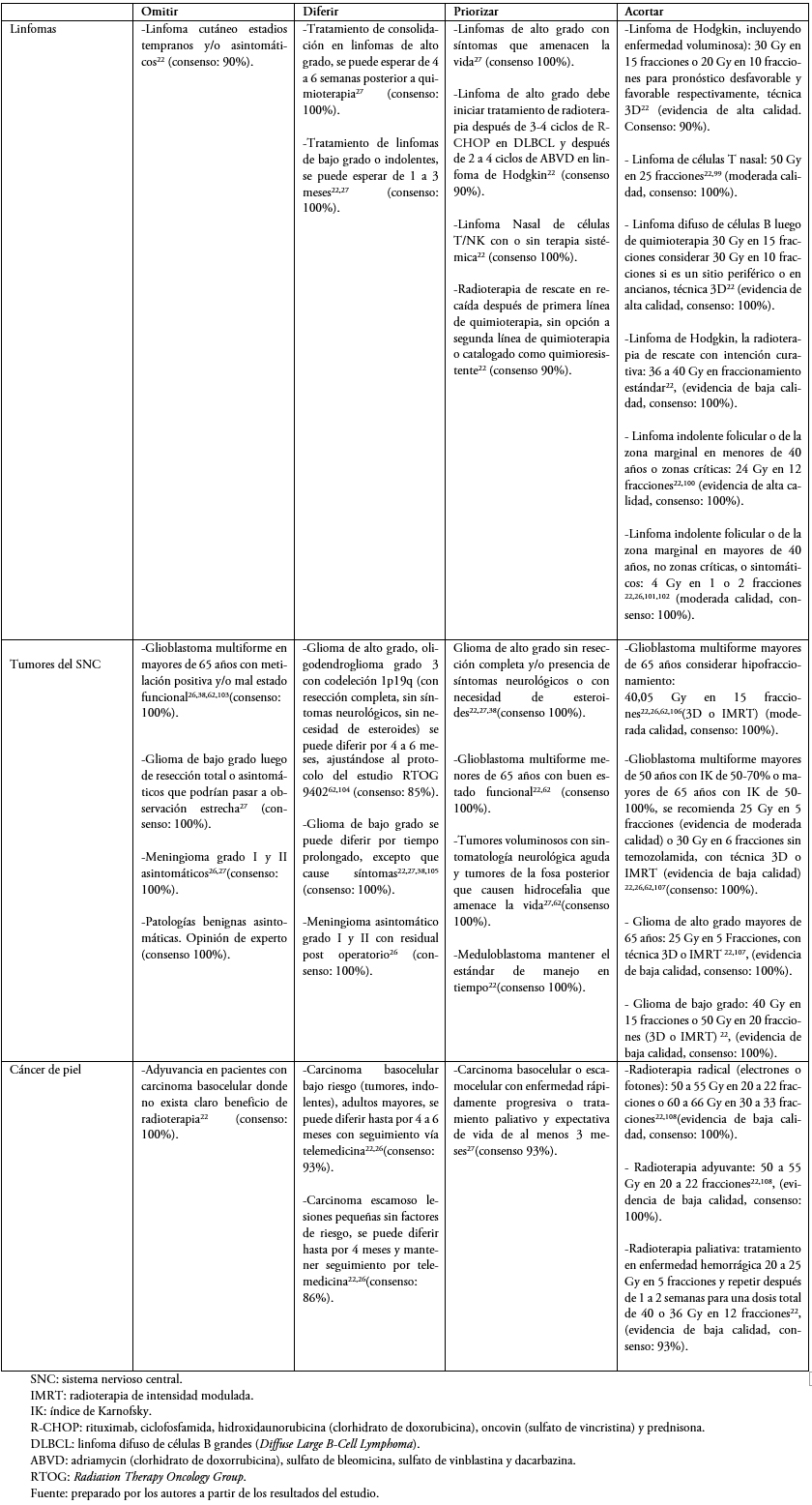 Tabla 6. Otros grupos de patologías menos frecuentes.
Tabla 6. Otros grupos de patologías menos frecuentes.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Objective
To generate recommendations on the management of radiotherapeutic treatments during the pandemic, adapted to a country with limited health resources.
Methods
We did a rapid review of the literature, searching for papers that describe any measures to reduce the risk of COVID-19 infection, as well as management guidelines to reduce the workload, in radiotherapy units. The following conditions were included in the scope of this review: gynecological tumors, breast cancer, gastrointestinal tumors, genitourinary tumors, head and neck tumors, skin cancer, tumors of the central nervous system, and lymphomas. An expert group discussed online the extracted data and drafted the recommendations. Using a modified Delphi method, the consensus was reached among 14 certificated radio-oncologists. The quality of the evidence that supported the recommendations on treatment schedules was assessed.
Results
A total of 57 documents were included. Of these, 25 provided strategies to reduce the risk of infection. Recommendations for each condiction were extracted from the remaining documents. The recommendations aim to establish specific parameters where treatments can be omitted, deferred, prioritized, and shortened. Treatment schemes are recommended for each condition, prioritizing hypo-fractionated schemes whenever possible.
Conclusions
We propose strategies for the management of radiotherapy services to guarantee the continuity of high-quality treatments despite the health crisis caused by COVID-19.
 Autores:
Nadia Montero-Oleas[1], Raúl Puente-Vallejo[2], Bárbara León-Micheli[3], Andrés Imbaquingo-Cabrera[2], Mónica Silva[4], Elizabeth Gamarra[5], Byron Álvarez-Rodas[6], Nelson Segovia[3], Pablo Aldaz-Roldan[7], Cristina Nuñez-Silva[2], Karina Zurita-Vivero[2], Alex Carrión[2], José Molina-Jaramillo[6], Andrés Rodríguez-Balarezo[8], Yuri Betancourt[1], Luis De Los Reyes[2]
Autores:
Nadia Montero-Oleas[1], Raúl Puente-Vallejo[2], Bárbara León-Micheli[3], Andrés Imbaquingo-Cabrera[2], Mónica Silva[4], Elizabeth Gamarra[5], Byron Álvarez-Rodas[6], Nelson Segovia[3], Pablo Aldaz-Roldan[7], Cristina Nuñez-Silva[2], Karina Zurita-Vivero[2], Alex Carrión[2], José Molina-Jaramillo[6], Andrés Rodríguez-Balarezo[8], Yuri Betancourt[1], Luis De Los Reyes[2]

Citación: Montero-Oleas N, Puente-Vallejo R, León-Micheli B, Imbaquingo-Cabrera A, Silva M, Gamarra E, et al. Reducing the impact of COVID-19 on radiation oncology units of developing countries: A rapid review and expert consensus. Medwave 2020;20(8):e8012 doi: 10.5867/medwave.2020.08.8012
Fecha de envío: 25/5/2020
Fecha de aceptación: 11/8/2020
Fecha de publicación: 7/9/2020
Origen: No solicitado
Tipo de revisión: Con revisión por pares externa, por tres árbitros a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Muñoz N. COVID-19 in Latin America: a first glance to the mortality. Colomb Med. 2020; 51(2). | CrossRef |
Muñoz N. COVID-19 in Latin America: a first glance to the mortality. Colomb Med. 2020; 51(2). | CrossRef | El-Shakankery KH, Kefas J, Crusz SM. Caring for our cancer patients in the wake of COVID-19. Br J Cancer. 2020 Jul;123(1):3-4.
| CrossRef | PubMed |
El-Shakankery KH, Kefas J, Crusz SM. Caring for our cancer patients in the wake of COVID-19. Br J Cancer. 2020 Jul;123(1):3-4.
| CrossRef | PubMed | Liang W, Guan W, Chen R, Wang W, Li J, Xu K, et al. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020 Mar;21(3):335-337. | CrossRef | PubMed |
Liang W, Guan W, Chen R, Wang W, Li J, Xu K, et al. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020 Mar;21(3):335-337. | CrossRef | PubMed | Dai M, Liu D, Liu M, Zhou F, Li G, Chen Z, et al. Patients with Cancer Appear More Vulnerable to SARS-CoV-2: A Multicenter Study during the COVID-19 Outbreak. Cancer Discov. 2020 Jun;10(6):783-791. | CrossRef | PubMed |
Dai M, Liu D, Liu M, Zhou F, Li G, Chen Z, et al. Patients with Cancer Appear More Vulnerable to SARS-CoV-2: A Multicenter Study during the COVID-19 Outbreak. Cancer Discov. 2020 Jun;10(6):783-791. | CrossRef | PubMed | Yap ML, Hanna TP, Shafiq J, Ferlay J, Bray F, Delaney GP, et al. The Benefits of Providing External Beam Radiotherapy in Low- and Middle-income Countries. Clin Oncol (R Coll Radiol). 2017 Feb;29(2):72-83. | CrossRef | PubMed |
Yap ML, Hanna TP, Shafiq J, Ferlay J, Bray F, Delaney GP, et al. The Benefits of Providing External Beam Radiotherapy in Low- and Middle-income Countries. Clin Oncol (R Coll Radiol). 2017 Feb;29(2):72-83. | CrossRef | PubMed | Zaorsky NG, Yu JB, McBride SM, Dess RT, Jackson WC, Mahal BA, et al. Prostate Cancer Radiation Therapy Recommendations in Response to COVID-19. Adv Radiat Oncol. 2020 Apr 1;5(4):659-665. | CrossRef | PubMed |
Zaorsky NG, Yu JB, McBride SM, Dess RT, Jackson WC, Mahal BA, et al. Prostate Cancer Radiation Therapy Recommendations in Response to COVID-19. Adv Radiat Oncol. 2020 Apr 1;5(4):659-665. | CrossRef | PubMed | Varker T, Forbes D, Dell L, Weston A, Merlin T, Hodson S, et al. Rapid evidence assessment: increasing the transparency of an emerging methodology. J Eval Clin Pract. 2015 Dec;21(6):1199-204. | CrossRef | PubMed |
Varker T, Forbes D, Dell L, Weston A, Merlin T, Hodson S, et al. Rapid evidence assessment: increasing the transparency of an emerging methodology. J Eval Clin Pract. 2015 Dec;21(6):1199-204. | CrossRef | PubMed | Loblaw DA, Prestrud AA, Somerfield MR, Oliver TK, Brouwers MC, Nam RK, et al.
American Society of Clinical Oncology Clinical Practice Guidelines: formal systematic review-based consensus methodology. J Clin Oncol. 2012 Sep 1;30(25):3136-40. | CrossRef | PubMed |
Loblaw DA, Prestrud AA, Somerfield MR, Oliver TK, Brouwers MC, Nam RK, et al.
American Society of Clinical Oncology Clinical Practice Guidelines: formal systematic review-based consensus methodology. J Clin Oncol. 2012 Sep 1;30(25):3136-40. | CrossRef | PubMed | The Royal College of Radiologist. PRINCIPLES FOR RADIATION THERAPY SERVICES DURING COVID19. [On line] | Link |
The Royal College of Radiologist. PRINCIPLES FOR RADIATION THERAPY SERVICES DURING COVID19. [On line] | Link | Achard V, Tsoutsou P, Zilli T. Radiotherapy in the time of the Coronavirus pandemic: when less is better. Int J Radiat Oncol Biol Phys. 2020 Jul 1;107(3):600-601.
Achard V, Tsoutsou P, Zilli T. Radiotherapy in the time of the Coronavirus pandemic: when less is better. Int J Radiat Oncol Biol Phys. 2020 Jul 1;107(3):600-601.  Provincial Health Services Authority. Provincial Cancer Clinical Management Guidelines in Pandemic Situation ( COVID-19 ). 2020. [On line] | Link |
Provincial Health Services Authority. Provincial Cancer Clinical Management Guidelines in Pandemic Situation ( COVID-19 ). 2020. [On line] | Link | Chen W, Su XY, Wang VJ, Wang EC, Xu R, Zhong S, et al. Novel Coronavirus International Public Health Emergency: Guidance on Radiation Oncology Facility Operation. Adv Radiat Oncol. 2020 Apr 1;5(4):560-566 | CrossRef | PubMed |
Chen W, Su XY, Wang VJ, Wang EC, Xu R, Zhong S, et al. Novel Coronavirus International Public Health Emergency: Guidance on Radiation Oncology Facility Operation. Adv Radiat Oncol. 2020 Apr 1;5(4):560-566 | CrossRef | PubMed | Chen YL, Hsu FM, Tsai CJ, Cheng JC. Efforts to Reduce the Impact of Coronavirus Disease 2019 Outbreak on Radiation Oncology in Taiwan. Adv Radiat Oncol. 2020 Apr 6;5(4):534-537. | CrossRef | PubMed |
Chen YL, Hsu FM, Tsai CJ, Cheng JC. Efforts to Reduce the Impact of Coronavirus Disease 2019 Outbreak on Radiation Oncology in Taiwan. Adv Radiat Oncol. 2020 Apr 6;5(4):534-537. | CrossRef | PubMed | Dinh TT, Halasz LM, Ford E, Rengan R. Radiation Therapy in King County, Washington During the COVID-19 Pandemic: Balancing Patient Care, TransmissionMitigation, and Resident Training. Adv Radiat Oncol. 2020 Mar 27;5(4):544-547. | CrossRef | PubMed |
Dinh TT, Halasz LM, Ford E, Rengan R. Radiation Therapy in King County, Washington During the COVID-19 Pandemic: Balancing Patient Care, TransmissionMitigation, and Resident Training. Adv Radiat Oncol. 2020 Mar 27;5(4):544-547. | CrossRef | PubMed | Filippi AR, Russi E, Magrini SM, Corvò R. Letter from Italy: First practical indications for radiation therapy departments during COVID-19 outbreak. Int J Radiat Oncol Biol Phys. 2020 Jul 1;107(3):597-599. | CrossRef | PubMed |
Filippi AR, Russi E, Magrini SM, Corvò R. Letter from Italy: First practical indications for radiation therapy departments during COVID-19 outbreak. Int J Radiat Oncol Biol Phys. 2020 Jul 1;107(3):597-599. | CrossRef | PubMed | Krengli M, Ferrara E, Mastroleo F, Brambilla M, Ricardi U. Running a Radiation Oncology Department at the Time of Coronavirus: An Italian Experience. Adv Radiat Oncol. 2020 Mar 20;5(4):527-530. | CrossRef | PubMed |
Krengli M, Ferrara E, Mastroleo F, Brambilla M, Ricardi U. Running a Radiation Oncology Department at the Time of Coronavirus: An Italian Experience. Adv Radiat Oncol. 2020 Mar 20;5(4):527-530. | CrossRef | PubMed | Sociedad Española de Oncología Médica, Sociedad Española de Oncología Radioterápica. Documento técnico Recomendaciones para el manejo , prevención y control de COVID-19 en los hospitales de día onco-hematológicos y servicios de oncología radioterápica. 2020. [On line] | Link |
Sociedad Española de Oncología Médica, Sociedad Española de Oncología Radioterápica. Documento técnico Recomendaciones para el manejo , prevención y control de COVID-19 en los hospitales de día onco-hematológicos y servicios de oncología radioterápica. 2020. [On line] | Link | Mukherjee RK, Back MF, Lu JJ, Shakespeare TP, Wynne CJ. Hiding in the bunker: Challenges for a radiation oncology department operating in the Severe Acute Respiratory Syndrome outbreak. Australas Radiol. 2003 Jun;47(2):143-5. | CrossRef | PubMed |
Mukherjee RK, Back MF, Lu JJ, Shakespeare TP, Wynne CJ. Hiding in the bunker: Challenges for a radiation oncology department operating in the Severe Acute Respiratory Syndrome outbreak. Australas Radiol. 2003 Jun;47(2):143-5. | CrossRef | PubMed | National Institute for Health and Care Excellence. COVID-19 rapid guideline: delivery of radiotherapy. 2020;1–15.[On line] | Link |
National Institute for Health and Care Excellence. COVID-19 rapid guideline: delivery of radiotherapy. 2020;1–15.[On line] | Link | Papachristofilou A, Finazzi T, Kohler G, Dott C, Zimmermann F. Contingency Plans in a Radiation Oncology Department Amid the 2019-nCoV Outbreak in Switzerland. Adv Radiat Oncol. 2020 Mar 31;5(4):577-581. | CrossRef | PubMed |
Papachristofilou A, Finazzi T, Kohler G, Dott C, Zimmermann F. Contingency Plans in a Radiation Oncology Department Amid the 2019-nCoV Outbreak in Switzerland. Adv Radiat Oncol. 2020 Mar 31;5(4):577-581. | CrossRef | PubMed | Peter MacCallum Cancer Centre. COVID-19 Clinical Services Response Plan - DRO - March 2020 V3. 2020.[On line] | Link |
Peter MacCallum Cancer Centre. COVID-19 Clinical Services Response Plan - DRO - March 2020 V3. 2020.[On line] | Link | Rao YJ, Provenzano D, Gay HA, Read PW, Ojong M, Goyal S. A Radiation Oncology Departmental Policy for the 2019 Novel Coronavirus (COVID-19) Pandemic. Preprints 2020:1–17. | CrossRef |
Rao YJ, Provenzano D, Gay HA, Read PW, Ojong M, Goyal S. A Radiation Oncology Departmental Policy for the 2019 Novel Coronavirus (COVID-19) Pandemic. Preprints 2020:1–17. | CrossRef | Rivera A, Ohri N, Thomas E, Miller R, Knoll MA. The Impact of COVID-19 on Radiation Oncology Clinics and Patients With Cancer in the United States. Adv Radiat Oncol. 2020 Mar 27;5(4):538-543. | CrossRef | PubMed |
Rivera A, Ohri N, Thomas E, Miller R, Knoll MA. The Impact of COVID-19 on Radiation Oncology Clinics and Patients With Cancer in the United States. Adv Radiat Oncol. 2020 Mar 27;5(4):538-543. | CrossRef | PubMed | Sociedad Española de Oncología Radioterapica. Recomendaciones Generales ante la situación de pandemia por COVID-19 en el área de Oncología Radioterápica. 2020.[On line] | Link |
Sociedad Española de Oncología Radioterapica. Recomendaciones Generales ante la situación de pandemia por COVID-19 en el área de Oncología Radioterápica. 2020.[On line] | Link | Simcock R, Thomas TV, Estes C, Filippi AR, Katz MA, Pereira IJ, et al. COVID-19: Global radiation oncology's targeted response for pandemic preparedness. Clin Transl Radiat Oncol. 2020 Mar 24;22:55-68. | CrossRef | PubMed |
Simcock R, Thomas TV, Estes C, Filippi AR, Katz MA, Pereira IJ, et al. COVID-19: Global radiation oncology's targeted response for pandemic preparedness. Clin Transl Radiat Oncol. 2020 Mar 24;22:55-68. | CrossRef | PubMed | Wright JL, Alcorn SR, McNutt T, Han-Oh S, Gonzalez R, Lin L, et al. An Integrated Program in a Pandemic: Johns Hopkins Radiation Oncology Department. Adv Radiat Oncol. 2020 Apr 9;5(4):666-672. | CrossRef | PubMed |
Wright JL, Alcorn SR, McNutt T, Han-Oh S, Gonzalez R, Lin L, et al. An Integrated Program in a Pandemic: Johns Hopkins Radiation Oncology Department. Adv Radiat Oncol. 2020 Apr 9;5(4):666-672. | CrossRef | PubMed | Wu S, Zheng D, Liu Y, Hu D, Wei W, Han G. Radiation Therapy Care During a Major Outbreak of COVID-19 in Wuhan. Adv Radiat Oncol. 2020 Mar 27;5(4):531-533. | CrossRef | PubMed |
Wu S, Zheng D, Liu Y, Hu D, Wei W, Han G. Radiation Therapy Care During a Major Outbreak of COVID-19 in Wuhan. Adv Radiat Oncol. 2020 Mar 27;5(4):531-533. | CrossRef | PubMed | Mascarin M, Coassin E, Provenzi M, Franchin G, Mariotto A. How to Reorganize Children's Access to Radiation Therapy in the Era of COVID-19, to Protect Them and Elderly Patients. Adv Radiat Oncol. 2020 Apr 11;5(4):673-674. | CrossRef | PubMed |
Mascarin M, Coassin E, Provenzi M, Franchin G, Mariotto A. How to Reorganize Children's Access to Radiation Therapy in the Era of COVID-19, to Protect Them and Elderly Patients. Adv Radiat Oncol. 2020 Apr 11;5(4):673-674. | CrossRef | PubMed | Lu JJ. Experience of a Radiation Oncology Center Operating During the COVID-19 Outbreak. Adv Radiat Oncol. 2020 Apr 10;5(4):548-549. | CrossRef | PubMed |
Lu JJ. Experience of a Radiation Oncology Center Operating During the COVID-19 Outbreak. Adv Radiat Oncol. 2020 Apr 10;5(4):548-549. | CrossRef | PubMed | Samiee S, Hadjilooei F, Alamolhoda M, Akhlaghpoor S. New Policy and Regulations for a Radiology-Oncology Center During the COVID-19 Outbreak in Tehran, Iran. Adv Radiat Oncol. 2020 Apr 14;5(4):550-557. | CrossRef | PubMed |
Samiee S, Hadjilooei F, Alamolhoda M, Akhlaghpoor S. New Policy and Regulations for a Radiology-Oncology Center During the COVID-19 Outbreak in Tehran, Iran. Adv Radiat Oncol. 2020 Apr 14;5(4):550-557. | CrossRef | PubMed | Wei W, Zheng D, Lei Y, Wu S, Verma V, Liu Y, et al. Radiotherapy workflow and protection procedures during the Coronavirus Disease 2019 (COVID-19) outbreak: Experience of the Hubei Cancer Hospital in Wuhan, China. Radiother Oncol. 2020 Jul;148:203-210. | CrossRef | PubMed |
Wei W, Zheng D, Lei Y, Wu S, Verma V, Liu Y, et al. Radiotherapy workflow and protection procedures during the Coronavirus Disease 2019 (COVID-19) outbreak: Experience of the Hubei Cancer Hospital in Wuhan, China. Radiother Oncol. 2020 Jul;148:203-210. | CrossRef | PubMed | Wei W, Jiang H, Chen W, Zhou Y, Guo S, Zhong G, et al. How should we implement radiotherapy for cancer patients in China during the endemic period of COVID-19? Radiother Oncol. 2020 Jun;147:100-102. | CrossRef | PubMed |
Wei W, Jiang H, Chen W, Zhou Y, Guo S, Zhong G, et al. How should we implement radiotherapy for cancer patients in China during the endemic period of COVID-19? Radiother Oncol. 2020 Jun;147:100-102. | CrossRef | PubMed | Tey J, Ho S, Choo BA, Ho F, Yap SP, Tuan JKL, et al. Navigating the challenges of the COVID-19 outbreak: Perspectives from the radiation oncology service in Singapore. Radiother Oncol. 2020 Jul;148:189-193. | CrossRef | PubMed |
Tey J, Ho S, Choo BA, Ho F, Yap SP, Tuan JKL, et al. Navigating the challenges of the COVID-19 outbreak: Perspectives from the radiation oncology service in Singapore. Radiother Oncol. 2020 Jul;148:189-193. | CrossRef | PubMed | De Felice F, Polimeni A, Tombolini V. The impact of Coronavirus (COVID-19) on head and neck cancer patients' care. Radiother Oncol. 2020 Jun;147:84-85.
| CrossRef | PubMed |
De Felice F, Polimeni A, Tombolini V. The impact of Coronavirus (COVID-19) on head and neck cancer patients' care. Radiother Oncol. 2020 Jun;147:84-85.
| CrossRef | PubMed | Gay HA, Santiago R, Gil B, Remedios C, Montes PJ, López-Araujo J, et al. Lessons Learned From Hurricane Maria in Puerto Rico: Practical Measures to Mitigate the Impact of a Catastrophic Natural Disaster on Radiation Oncology Patients. Pract Radiat Oncol. 2019 Sep-Oct;9(5):305-321. | CrossRef | PubMed |
Gay HA, Santiago R, Gil B, Remedios C, Montes PJ, López-Araujo J, et al. Lessons Learned From Hurricane Maria in Puerto Rico: Practical Measures to Mitigate the Impact of a Catastrophic Natural Disaster on Radiation Oncology Patients. Pract Radiat Oncol. 2019 Sep-Oct;9(5):305-321. | CrossRef | PubMed | Roques T, Prestwich R. Head and neck cancer and COVID-19. The Royal College of Radiologist. 2020. [On line] | Link |
Roques T, Prestwich R. Head and neck cancer and COVID-19. The Royal College of Radiologist. 2020. [On line] | Link | Yale School of Medicine Department of Therapeutic Radiology faculty. COVID19 Yale Radiation Oncology Flowchart –. 2020. | Link |
Yale School of Medicine Department of Therapeutic Radiology faculty. COVID19 Yale Radiation Oncology Flowchart –. 2020. | Link | Thomson DJ, Palma D, Guckenberger M, Balermpas P, Beitler JJ, Blanchard P, et al. Practice Recommendations for Risk- Adapted Head and Neck Cancer Radiation Therapy During the COVID-19 Pandemic: An ASTRO-ESTRO Consensus Statement. Int J Radiat Oncol Biol Phys. 2020 Jul 15;107(4):618-627. | CrossRef | PubMed |
Thomson DJ, Palma D, Guckenberger M, Balermpas P, Beitler JJ, Blanchard P, et al. Practice Recommendations for Risk- Adapted Head and Neck Cancer Radiation Therapy During the COVID-19 Pandemic: An ASTRO-ESTRO Consensus Statement. Int J Radiat Oncol Biol Phys. 2020 Jul 15;107(4):618-627. | CrossRef | PubMed | De Felice F, Petrucciani N. Treatment approach in locally advanced rectal cancer during coronavirus (COVID-19) pandemic: long course or short course? Colorectal Dis. 2020 Jun;22(6):642-643. | CrossRef | PubMed |
De Felice F, Petrucciani N. Treatment approach in locally advanced rectal cancer during coronavirus (COVID-19) pandemic: long course or short course? Colorectal Dis. 2020 Jun;22(6):642-643. | CrossRef | PubMed | Marijnen CAM, Peters FP, Rödel C, Bujko K, Haustermans K, Fokas E, et al. International expert consensus statement regarding radiotherapy treatment options for rectal cancer during the COVID 19 pandemic. Radiother Oncol. 2020 Jul;148:213-215. | CrossRef | PubMed |
Marijnen CAM, Peters FP, Rödel C, Bujko K, Haustermans K, Fokas E, et al. International expert consensus statement regarding radiotherapy treatment options for rectal cancer during the COVID 19 pandemic. Radiother Oncol. 2020 Jul;148:213-215. | CrossRef | PubMed | Oxford Colorrectal Oncologists. Lower GI response to Covid-19 outbreak. 2020;:1–2.[On line] | Link |
Oxford Colorrectal Oncologists. Lower GI response to Covid-19 outbreak. 2020;:1–2.[On line] | Link | Grose D, Hunt A, Katharine Aitken, Mukherjee S, Hawkins M, Radhakrishna G, et al. RADIOTHERAPY PROTOCOL : Radical Pancreas 15 fraction ( adapted from PRIMUS 002 radiotherapy protocol and RMH research protocol ). The Royal College of Radiologists. 2020. [On line] | Link |
Grose D, Hunt A, Katharine Aitken, Mukherjee S, Hawkins M, Radhakrishna G, et al. RADIOTHERAPY PROTOCOL : Radical Pancreas 15 fraction ( adapted from PRIMUS 002 radiotherapy protocol and RMH research protocol ). The Royal College of Radiologists. 2020. [On line] | Link | Mukjerjee S, Hawkins M, Aitkin K, Radhakrishna G, Gose D, Godoy R, et al. Hypofractionated Radical Pancreas (5 fraction) (adapted from Oxford Protocol and SPARC trial). 2020. [On line] | Link |
Mukjerjee S, Hawkins M, Aitkin K, Radhakrishna G, Gose D, Godoy R, et al. Hypofractionated Radical Pancreas (5 fraction) (adapted from Oxford Protocol and SPARC trial). 2020. [On line] | Link | Mukherjee S, Jones C. Considerations for treatment of pancreatic cancer within the United Kingdom during the COVID-19 pandemic.[On line] | Link |
Mukherjee S, Jones C. Considerations for treatment of pancreatic cancer within the United Kingdom during the COVID-19 pandemic.[On line] | Link | Sociedad Española de Oncología Radioterapica. La radioterapia en el cáncer de recto puede hacer que la suspensión de quirófanos por el COVID-19 no merme las posibilidades de curación de los pacientes. 2020.[On line]
Sociedad Española de Oncología Radioterapica. La radioterapia en el cáncer de recto puede hacer que la suspensión de quirófanos por el COVID-19 no merme las posibilidades de curación de los pacientes. 2020.[On line]  Jones CM, Hawkins M, Mukherjee S, Radhakrishna G, Crosby T. Considerations for the Treatment of Oesophageal Cancer With Radiotherapy During the COVID-19 Pandemic. Clin Oncol (R Coll Radiol). 2020 Jun;32(6):354-357. | CrossRef | PubMed |
Jones CM, Hawkins M, Mukherjee S, Radhakrishna G, Crosby T. Considerations for the Treatment of Oesophageal Cancer With Radiotherapy During the COVID-19 Pandemic. Clin Oncol (R Coll Radiol). 2020 Jun;32(6):354-357. | CrossRef | PubMed | Tchelebi LT, Haustermans K, Scorsetti M, Hosni A, Huguet F, Hawkins MA, et al. Recommendations for the use of radiation therapy in managing patients with gastrointestinal malignancies in the era of COVID-19. | CrossRef | PubMed |
Tchelebi LT, Haustermans K, Scorsetti M, Hosni A, Huguet F, Hawkins MA, et al. Recommendations for the use of radiation therapy in managing patients with gastrointestinal malignancies in the era of COVID-19. | CrossRef | PubMed | Alonzi R, Antoniou G, Anyamene N, Hoskin P, Hughes R, Ostler P, et al. Guidance for treatment of uro-oncology patients during COVID-19 pandemic. R. Coll. Radiol. 2020. [On line] | Link |
Alonzi R, Antoniou G, Anyamene N, Hoskin P, Hughes R, Ostler P, et al. Guidance for treatment of uro-oncology patients during COVID-19 pandemic. R. Coll. Radiol. 2020. [On line] | Link | Birtle A, Varughese M, Hoskin P, Choudhury A, James N, Huddart R. Guidance for management of urothelial cancer during COVID19 pandemic- radiotherapy. R. Coll. Radiol. 2020.[On line] | Link |
Birtle A, Varughese M, Hoskin P, Choudhury A, James N, Huddart R. Guidance for management of urothelial cancer during COVID19 pandemic- radiotherapy. R. Coll. Radiol. 2020.[On line] | Link | Ramirez PT, Chiva L, Eriksson AGZ, Frumovitz M, Fagotti A, Gonzalez Martin A, et al. COVID-19 Global Pandemic: Options for Management of Gynecologic Cancers. Int J Gynecol Cancer. 2020 May;30(5):561-563. | CrossRef | PubMed |
Ramirez PT, Chiva L, Eriksson AGZ, Frumovitz M, Fagotti A, Gonzalez Martin A, et al. COVID-19 Global Pandemic: Options for Management of Gynecologic Cancers. Int J Gynecol Cancer. 2020 May;30(5):561-563. | CrossRef | PubMed | Cooper AR, Taylor A. Proposed guidance for radiotherapy for gynaecological cancer and COVID-19. R. Coll. Radiol. 2020. | Link |
Cooper AR, Taylor A. Proposed guidance for radiotherapy for gynaecological cancer and COVID-19. R. Coll. Radiol. 2020. | Link | Williams VM, Kahn JM, Harkenrider MM, Chino J, Chen J, Fang LC, et al. COVID-19 impact on timing of brachytherapy treatment and strategies for risk mitigation. Brachytherapy. 2020 Jul-Aug;19(4):401-411. | CrossRef | PubMed |
Williams VM, Kahn JM, Harkenrider MM, Chino J, Chen J, Fang LC, et al. COVID-19 impact on timing of brachytherapy treatment and strategies for risk mitigation. Brachytherapy. 2020 Jul-Aug;19(4):401-411. | CrossRef | PubMed | Al-Rashdan A, Roumeliotis M, Quirk S, Grendarova P, Phan T, Cao J, et al. Adapting Radiation Therapy Treatments for Patients with Breast Cancer During the COVID-19 Pandemic: Hypo-Fractionation and Accelerated Partial Breast Irradiation to Address World Health Organization Recommendations. Adv Radiat Oncol. 2020 Apr 2;5(4):575–6. | CrossRef | PubMed |
Al-Rashdan A, Roumeliotis M, Quirk S, Grendarova P, Phan T, Cao J, et al. Adapting Radiation Therapy Treatments for Patients with Breast Cancer During the COVID-19 Pandemic: Hypo-Fractionation and Accelerated Partial Breast Irradiation to Address World Health Organization Recommendations. Adv Radiat Oncol. 2020 Apr 2;5(4):575–6. | CrossRef | PubMed | Braunstein LZ, Gillespie EF, Hong L, Xu A, Bakhoum SF, Cuaron J, et al. Breast Radiation Therapy Under COVID-19 Pandemic Resource Constraints-Approaches to Defer or Shorten Treatment From a Comprehensive Cancer Center in the United States. Adv Radiat Oncol. 2020 Apr 1;5(4):582-588. | CrossRef | PubMed |
Braunstein LZ, Gillespie EF, Hong L, Xu A, Bakhoum SF, Cuaron J, et al. Breast Radiation Therapy Under COVID-19 Pandemic Resource Constraints-Approaches to Defer or Shorten Treatment From a Comprehensive Cancer Center in the United States. Adv Radiat Oncol. 2020 Apr 1;5(4):582-588. | CrossRef | PubMed | Coles CE, Aristei C, Bliss J, Boersma L, Brunt AM, Chatterjee S, et al. International Guidelines on Radiation Therapy for Breast Cancer During the COVID-19 Pandemic. Clin Oncol (R Coll Radiol). 2020 May;32(5):279-281. | CrossRef | PubMed |
Coles CE, Aristei C, Bliss J, Boersma L, Brunt AM, Chatterjee S, et al. International Guidelines on Radiation Therapy for Breast Cancer During the COVID-19 Pandemic. Clin Oncol (R Coll Radiol). 2020 May;32(5):279-281. | CrossRef | PubMed | National Accreditation Program for Breast Cancer Centers. Recommendations for Prioritization, Treatment and Triage of Breast Cancer Patients During the COVID-19 Pandemic: Executive Summary. [On line] | Link |
National Accreditation Program for Breast Cancer Centers. Recommendations for Prioritization, Treatment and Triage of Breast Cancer Patients During the COVID-19 Pandemic: Executive Summary. [On line] | Link | National Health Service - England. Clinical guide for the management of non-coronavirus patients requiring acute treatment : Cancer. 2020. [On line] | Link |
National Health Service - England. Clinical guide for the management of non-coronavirus patients requiring acute treatment : Cancer. 2020. [On line] | Link | Brunt M, Chakraborty S, Chatterjee S, Cleator S, Coles C, Kirby A, et al. Emergency guidelines for pre-operative breast radiotherapy during the COVID- 19 pandemic. 2020.[On line] | Link |
Brunt M, Chakraborty S, Chatterjee S, Cleator S, Coles C, Kirby A, et al. Emergency guidelines for pre-operative breast radiotherapy during the COVID- 19 pandemic. 2020.[On line] | Link | Song AJ, Manukian G, Taylor AK, Anne PR, Simone NL. Concerns for Active Breathing Control (ABC) With Breast Cancer in the Era of COVID-19: Maximizing Infection Control While Minimizing Heart Dose. Adv Radiat Oncol. 2020 Apr 1;5(4):573-574. | CrossRef | PubMed |
Song AJ, Manukian G, Taylor AK, Anne PR, Simone NL. Concerns for Active Breathing Control (ABC) With Breast Cancer in the Era of COVID-19: Maximizing Infection Control While Minimizing Heart Dose. Adv Radiat Oncol. 2020 Apr 1;5(4):573-574. | CrossRef | PubMed | The Royal College of Radiologist. Neuro-oncology treatment guidance during COVID-19 pandemic. 2020.[On line] | Link |
The Royal College of Radiologist. Neuro-oncology treatment guidance during COVID-19 pandemic. 2020.[On line] | Link | Yerramilli D, Xu AJ, Gillespie EF, Shepherd AF, Beal K, Gomez D, et al. Palliative Radiation Therapy for Oncologic Emergencies in the Setting of COVID-19: Approaches to Balancing Risks and Benefits. Adv Radiat Oncol. 2020 Apr 8;5(4):589-594. | CrossRef | PubMed |
Yerramilli D, Xu AJ, Gillespie EF, Shepherd AF, Beal K, Gomez D, et al. Palliative Radiation Therapy for Oncologic Emergencies in the Setting of COVID-19: Approaches to Balancing Risks and Benefits. Adv Radiat Oncol. 2020 Apr 8;5(4):589-594. | CrossRef | PubMed | Haddad R, O'Neill A, Rabinowits G, Tishler R, Khuri F, Adkins D, et al. Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial. Lancet Oncol. 2013 Mar;14(3):257-64 | CrossRef | PubMed |
Haddad R, O'Neill A, Rabinowits G, Tishler R, Khuri F, Adkins D, et al. Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial. Lancet Oncol. 2013 Mar;14(3):257-64 | CrossRef | PubMed | Zhang B, Li MM, Chen WH, Zhao JF, Chen WQ, Dong YH, et al. Association of Chemoradiotherapy Regimens and Survival Among Patients With Nasopharyngeal Carcinoma: A Systematic Review and Meta-analysis. JAMA Netw Open. 2019 Oct 2;2(10):e1913619. | CrossRef | PubMed |
Zhang B, Li MM, Chen WH, Zhao JF, Chen WQ, Dong YH, et al. Association of Chemoradiotherapy Regimens and Survival Among Patients With Nasopharyngeal Carcinoma: A Systematic Review and Meta-analysis. JAMA Netw Open. 2019 Oct 2;2(10):e1913619. | CrossRef | PubMed | Rosenthal DI, Mohamed ASR, Garden AS, Morrison WH, El-Naggar AK, Kamal M, et al. Final Report of a Prospective Randomized Trial to Evaluate the Dose-Response Relationship for Postoperative Radiation Therapy and Pathologic Risk Groups in Patients With Head and Neck Cancer. Int J Radiat Oncol Biol Phys. 2017 Aug 1;98(5):1002-1011. | CrossRef | PubMed |
Rosenthal DI, Mohamed ASR, Garden AS, Morrison WH, El-Naggar AK, Kamal M, et al. Final Report of a Prospective Randomized Trial to Evaluate the Dose-Response Relationship for Postoperative Radiation Therapy and Pathologic Risk Groups in Patients With Head and Neck Cancer. Int J Radiat Oncol Biol Phys. 2017 Aug 1;98(5):1002-1011. | CrossRef | PubMed | Moon SH, Cho KH, Chung EJ, Lee CG, Lee KC, Chai GY, et al. A prospective randomized trial comparing hypofractionation with conventional fractionation radiotherapy for T1-2 glottic squamous cell carcinomas: results of a Korean Radiation Oncology Group (KROG-0201) study. Radiother Oncol. 2014 Jan;110(1):98-103. | CrossRef | PubMed |
Moon SH, Cho KH, Chung EJ, Lee CG, Lee KC, Chai GY, et al. A prospective randomized trial comparing hypofractionation with conventional fractionation radiotherapy for T1-2 glottic squamous cell carcinomas: results of a Korean Radiation Oncology Group (KROG-0201) study. Radiother Oncol. 2014 Jan;110(1):98-103. | CrossRef | PubMed | Sher DJ, Adelstein DJ, Bajaj GK, Brizel DM, Cohen EEW, Halthore A, et al. Radiation therapy for oropharyngeal squamous cell carcinoma: Executive summary of an ASTRO Evidence-Based Clinical Practice Guideline. Pract Radiat Oncol. 2017 Jul-Aug;7(4):246-253. | CrossRef | PubMed |
Sher DJ, Adelstein DJ, Bajaj GK, Brizel DM, Cohen EEW, Halthore A, et al. Radiation therapy for oropharyngeal squamous cell carcinoma: Executive summary of an ASTRO Evidence-Based Clinical Practice Guideline. Pract Radiat Oncol. 2017 Jul-Aug;7(4):246-253. | CrossRef | PubMed | Tobias JS, Monson K, Gupta N, Macdougall H, Glaholm J, Hutchison I, et al. Chemoradiotherapy for locally advanced head and neck cancer: 10-year follow-up of the UK Head and Neck (UKHAN1) trial. Lancet Oncol. 2010 Jan;11(1):66-74. | CrossRef | PubMed |
Tobias JS, Monson K, Gupta N, Macdougall H, Glaholm J, Hutchison I, et al. Chemoradiotherapy for locally advanced head and neck cancer: 10-year follow-up of the UK Head and Neck (UKHAN1) trial. Lancet Oncol. 2010 Jan;11(1):66-74. | CrossRef | PubMed | Lacas B, Bourhis J, Overgaard J, Zhang Q, Grégoire V, Nankivell M, et al. Role of radiotherapy fractionation in head and neck cancers (MARCH): an updated meta- analysis. Lancet Oncol. 2017 Sep;18(9):1221-1237. | CrossRef | PubMed |
Lacas B, Bourhis J, Overgaard J, Zhang Q, Grégoire V, Nankivell M, et al. Role of radiotherapy fractionation in head and neck cancers (MARCH): an updated meta- analysis. Lancet Oncol. 2017 Sep;18(9):1221-1237. | CrossRef | PubMed | Zhou ZR, Liu SX, Zhang TS, Chen LX, Xia J, Hu ZD, et al. Short-course preoperative radiotherapy with immediate surgery versus long-course chemoradiation with delayed surgery in the treatment of rectal cancer: a systematic review and meta-analysis. Surg Oncol. 2014 Dec;23(4):211-21. | CrossRef | PubMed |
Zhou ZR, Liu SX, Zhang TS, Chen LX, Xia J, Hu ZD, et al. Short-course preoperative radiotherapy with immediate surgery versus long-course chemoradiation with delayed surgery in the treatment of rectal cancer: a systematic review and meta-analysis. Surg Oncol. 2014 Dec;23(4):211-21. | CrossRef | PubMed | Crosby T, Hurt CN, Falk S, Gollins S, Staffurth J, Ray R, et al. Long-term results and recurrence patterns from SCOPE-1: a phase II/III randomised trial of definitive chemoradiotherapy +/- cetuximab in oesophageal cancer. Br J Cancer. 2017 Mar 14;116(6):709-716. | CrossRef | PubMed |
Crosby T, Hurt CN, Falk S, Gollins S, Staffurth J, Ray R, et al. Long-term results and recurrence patterns from SCOPE-1: a phase II/III randomised trial of definitive chemoradiotherapy +/- cetuximab in oesophageal cancer. Br J Cancer. 2017 Mar 14;116(6):709-716. | CrossRef | PubMed | Jones CM, Spencer K, Hitchen C, Pelly T, Wood B, Hatfield P, et al. Hypofractionated Radiotherapy in Oesophageal Cancer for Patients Unfit for Systemic Therapy: A Retrospective Single-Centre Analysis. Clin Oncol (R Coll Radiol). 2019 Jun;31(6):356-364. | CrossRef | PubMed |
Jones CM, Spencer K, Hitchen C, Pelly T, Wood B, Hatfield P, et al. Hypofractionated Radiotherapy in Oesophageal Cancer for Patients Unfit for Systemic Therapy: A Retrospective Single-Centre Analysis. Clin Oncol (R Coll Radiol). 2019 Jun;31(6):356-364. | CrossRef | PubMed | Walsh TN, Noonan N, Hollywood D, Kelly A, Keeling N, Hennessy TP. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med. 1996 Aug 15;335(7):462-7. | CrossRef | PubMed |
Walsh TN, Noonan N, Hollywood D, Kelly A, Keeling N, Hennessy TP. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med. 1996 Aug 15;335(7):462-7. | CrossRef | PubMed | Deressa BT, Tigeneh W, Bogale N, Buwenge M, Morganti AG, Farina E. Short- Course 2 Dimensional Radiation Therapy in the Palliative Treatment of Esophageal Cancer in a Developing Country: A Phase II Study (Sharon Project). Int J Radiat Oncol Biol Phys. 2020 Jan 1;106(1):67-72. | CrossRef | PubMed |
Deressa BT, Tigeneh W, Bogale N, Buwenge M, Morganti AG, Farina E. Short- Course 2 Dimensional Radiation Therapy in the Palliative Treatment of Esophageal Cancer in a Developing Country: A Phase II Study (Sharon Project). Int J Radiat Oncol Biol Phys. 2020 Jan 1;106(1):67-72. | CrossRef | PubMed | Shapiro J, van Lanschot JJB, Hulshof MCCM, van Hagen P, van Berge Henegouwen MI, Wijnhoven BPL, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol. 2015 Sep;16(9):1090-1098. | CrossRef | PubMed |
Shapiro J, van Lanschot JJB, Hulshof MCCM, van Hagen P, van Berge Henegouwen MI, Wijnhoven BPL, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol. 2015 Sep;16(9):1090-1098. | CrossRef | PubMed | Hamdy FC, Donovan JL, Lane JA, Mason M, Metcalfe C, Holding P, et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med. 2016 Oct 13;375(15):1415-1424. | CrossRef | PubMed |
Hamdy FC, Donovan JL, Lane JA, Mason M, Metcalfe C, Holding P, et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med. 2016 Oct 13;375(15):1415-1424. | CrossRef | PubMed | Pisansky TM, Hunt D, Gomella LG, Amin MB, Balogh AG, Chinn DM, et al. Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol. 2015 Feb 1;33(4):332-9. | CrossRef | PubMed |
Pisansky TM, Hunt D, Gomella LG, Amin MB, Balogh AG, Chinn DM, et al. Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol. 2015 Feb 1;33(4):332-9. | CrossRef | PubMed | Crook J, Ludgate C, Malone S, Perry G, Eapen L, Bowen J, et al. Final report of multicenter Canadian Phase III randomized trial of 3 versus 8 months of neoadjuvant androgen deprivation therapy before conventional- dose radiotherapy for clinically localized prostate cancer. Int J Radiat Oncol Biol Phys. 2009 Feb 1;73(2):327-33. | CrossRef | PubMed |
Crook J, Ludgate C, Malone S, Perry G, Eapen L, Bowen J, et al. Final report of multicenter Canadian Phase III randomized trial of 3 versus 8 months of neoadjuvant androgen deprivation therapy before conventional- dose radiotherapy for clinically localized prostate cancer. Int J Radiat Oncol Biol Phys. 2009 Feb 1;73(2):327-33. | CrossRef | PubMed | Vale CL, Brihoum M, Chabaud S, Cook A, Fisher D, Forcat S, et al. Adjuvant or salvage radiotherapy for the treatment of localised prostate cancer? A prospectively planned aggregate data meta-analysis. Ann Oncol 2019;30:v883. | CrossRef |
Vale CL, Brihoum M, Chabaud S, Cook A, Fisher D, Forcat S, et al. Adjuvant or salvage radiotherapy for the treatment of localised prostate cancer? A prospectively planned aggregate data meta-analysis. Ann Oncol 2019;30:v883. | CrossRef | Parker CC, James ND, Brawley CD, Clarke NW, Hoyle AP, Ali A, et al. Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet. 2018 Dec 1;392(10162):2353-2366. | CrossRef | PubMed |
Parker CC, James ND, Brawley CD, Clarke NW, Hoyle AP, Ali A, et al. Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial. Lancet. 2018 Dec 1;392(10162):2353-2366. | CrossRef | PubMed | El-Monim HA, El-Baradie MM, Younis A, Ragab Y, Labib A, El-Attar I. A prospective randomized trial for postoperative vs. preoperative adjuvant radiotherapy for muscle-invasive bladder cancer. Urol Oncol. 2013 Apr;31(3):359-65. | CrossRef | PubMed |
El-Monim HA, El-Baradie MM, Younis A, Ragab Y, Labib A, El-Attar I. A prospective randomized trial for postoperative vs. preoperative adjuvant radiotherapy for muscle-invasive bladder cancer. Urol Oncol. 2013 Apr;31(3):359-65. | CrossRef | PubMed | Morgan SC, Hoffman K, Loblaw DA, Buyyounouski MK, Patton C, Barocas D, et al. Hypofractionated Radiation Therapy for Localized Prostate Cancer: Executive Summary of an ASTRO, ASCO, and AUA Evidence-Based Guideline. Pract Radiat Oncol. 2018 Nov-Dec;8(6):354-360. | CrossRef | PubMed |
Morgan SC, Hoffman K, Loblaw DA, Buyyounouski MK, Patton C, Barocas D, et al. Hypofractionated Radiation Therapy for Localized Prostate Cancer: Executive Summary of an ASTRO, ASCO, and AUA Evidence-Based Guideline. Pract Radiat Oncol. 2018 Nov-Dec;8(6):354-360. | CrossRef | PubMed | Dearnaley D, Syndikus I, Mossop H, Khoo V, Birtle A, Bloomfield D, et al. Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol. 2016 Aug;17(8):1047-1060. | CrossRef | PubMed |
Dearnaley D, Syndikus I, Mossop H, Khoo V, Birtle A, Bloomfield D, et al. Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol. 2016 Aug;17(8):1047-1060. | CrossRef | PubMed | Porta N, Song YP, Hall E, Choudhury A, Owen R, Lewis R, et al. Hypo-Fractionation in Muscle-Invasive Bladder Cancer: An Individual Patient Data (IPD) Meta-Analysis of the BC2001 and BCON Trials. Int J Radiat Oncol 2019;105:S138. | CrossRef |
Porta N, Song YP, Hall E, Choudhury A, Owen R, Lewis R, et al. Hypo-Fractionation in Muscle-Invasive Bladder Cancer: An Individual Patient Data (IPD) Meta-Analysis of the BC2001 and BCON Trials. Int J Radiat Oncol 2019;105:S138. | CrossRef | ASTEC/EN.5 Study Group, Blake P, Swart AM, Orton J, Kitchener H, Whelan T, et al. Adjuvant external beam radiotherapy in the treatment of endometrial cancer (MRC ASTEC and NCIC CTG EN.5 randomised trials): pooled trial results, systematic review, and meta-analysis. Lancet. 2009 Jan 10;373(9658):137-46. | CrossRef | PubMed |
ASTEC/EN.5 Study Group, Blake P, Swart AM, Orton J, Kitchener H, Whelan T, et al. Adjuvant external beam radiotherapy in the treatment of endometrial cancer (MRC ASTEC and NCIC CTG EN.5 randomised trials): pooled trial results, systematic review, and meta-analysis. Lancet. 2009 Jan 10;373(9658):137-46. | CrossRef | PubMed | Creutzberg CL, van Putten WL, Koper PC, Lybeert ML, Jobsen JJ, Wárlám-Rodenhuis CC, et al. Surgery and postoperative radiotherapy versus surgery alone for patients with stage-1 endometrial carcinoma: multicentre randomised trial. PORTEC Study Group. Post Operative Radiation Therapy in Endometrial Carcinoma. Lancet. 2000 Apr 22;355(9213):1404-11. | CrossRef | PubMed |
Creutzberg CL, van Putten WL, Koper PC, Lybeert ML, Jobsen JJ, Wárlám-Rodenhuis CC, et al. Surgery and postoperative radiotherapy versus surgery alone for patients with stage-1 endometrial carcinoma: multicentre randomised trial. PORTEC Study Group. Post Operative Radiation Therapy in Endometrial Carcinoma. Lancet. 2000 Apr 22;355(9213):1404-11. | CrossRef | PubMed | Chuang LT, Feldman S, Nakisige C, Temin S, Berek JS. Management and Care of Women With Invasive Cervical Cancer: ASCO Resource-Stratified Clinical Practice Guideline. J Clin Oncol. 2016 Sep 20;34(27):3354-5. | CrossRef | PubMed |
Chuang LT, Feldman S, Nakisige C, Temin S, Berek JS. Management and Care of Women With Invasive Cervical Cancer: ASCO Resource-Stratified Clinical Practice Guideline. J Clin Oncol. 2016 Sep 20;34(27):3354-5. | CrossRef | PubMed | Kokka F, Bryant A, Brockbank E, Powell M, Oram D. Hysterectomy with radiotherapy or chemotherapy or both for women with locally advanced cervical cancer. Cochrane Database Syst Rev. 2015 Apr 7;(4):CD010260. | CrossRef | PubMed |
Kokka F, Bryant A, Brockbank E, Powell M, Oram D. Hysterectomy with radiotherapy or chemotherapy or both for women with locally advanced cervical cancer. Cochrane Database Syst Rev. 2015 Apr 7;(4):CD010260. | CrossRef | PubMed | Albuquerque K, Hrycushko BA, Harkenrider MM, Mayadev J, Klopp A, Beriwal S, et al. Compendium of fractionation choices for gynecologic HDR brachytherapy-An American Brachytherapy Society Task Group Report. Brachytherapy. 2019 Jul-Aug;18(4):429-436. | CrossRef | PubMed |
Albuquerque K, Hrycushko BA, Harkenrider MM, Mayadev J, Klopp A, Beriwal S, et al. Compendium of fractionation choices for gynecologic HDR brachytherapy-An American Brachytherapy Society Task Group Report. Brachytherapy. 2019 Jul-Aug;18(4):429-436. | CrossRef | PubMed | Morrow M, Van Zee KJ, Solin LJ, Houssami N, Chavez-MacGregor M, Harris JR, et al. Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology Consensus Guideline on Margins for Breast- Conserving Surgery With Whole-Breast Irradiation in Ductal Carcinoma in Situ. Pract Radiat Oncol. 2016 Sep-Oct;6(5):287-295. | CrossRef | PubMed |
Morrow M, Van Zee KJ, Solin LJ, Houssami N, Chavez-MacGregor M, Harris JR, et al. Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology Consensus Guideline on Margins for Breast- Conserving Surgery With Whole-Breast Irradiation in Ductal Carcinoma in Situ. Pract Radiat Oncol. 2016 Sep-Oct;6(5):287-295. | CrossRef | PubMed | Kunkler IH, Williams LJ, Jack WJ, Cameron DA, Dixon JM. Breast-conserving surgery with or without irradiation in women aged 65 years or older with early breast cancer (PRIME II): a randomised controlled trial. Lancet Oncol. 2015 Mar;16(3):266-73. | CrossRef | PubMed |
Kunkler IH, Williams LJ, Jack WJ, Cameron DA, Dixon JM. Breast-conserving surgery with or without irradiation in women aged 65 years or older with early breast cancer (PRIME II): a randomised controlled trial. Lancet Oncol. 2015 Mar;16(3):266-73. | CrossRef | PubMed | McCormick B, Winter K, Hudis C, Kuerer HM, Rakovitch E, Smith BL, et al. RTOG 9804: a
prospective randomized trial for good-risk ductal carcinoma in situ comparing radiotherapy with observation. J Clin Oncol. 2015 Mar 1;33(7):709-15. | CrossRef | PubMed |
McCormick B, Winter K, Hudis C, Kuerer HM, Rakovitch E, Smith BL, et al. RTOG 9804: a
prospective randomized trial for good-risk ductal carcinoma in situ comparing radiotherapy with observation. J Clin Oncol. 2015 Mar 1;33(7):709-15. | CrossRef | PubMed | Bartelink H, Maingon P, Poortmans P, Weltens C, Fourquet A, Jager J, et al. Whole-breast irradiation with or without a boost for patients treated with breast-conserving surgery for early cancer: 20-year follow-up of a randomised phase 3 trial. Lancet Oncol. 2015 Jan;16(1):47-56. | CrossRef | PubMed |
Bartelink H, Maingon P, Poortmans P, Weltens C, Fourquet A, Jager J, et al. Whole-breast irradiation with or without a boost for patients treated with breast-conserving surgery for early cancer: 20-year follow-up of a randomised phase 3 trial. Lancet Oncol. 2015 Jan;16(1):47-56. | CrossRef | PubMed | Karlsson P, Cole BF, Colleoni M, Roncadin M, Chua BH, Murray E, et al. Timing of radiotherapy and outcome in patients receiving adjuvant endocrine therapy. Int J Radiat Oncol Biol Phys. 2011 Jun 1;80(2):398-402. | CrossRef | PubMed |
Karlsson P, Cole BF, Colleoni M, Roncadin M, Chua BH, Murray E, et al. Timing of radiotherapy and outcome in patients receiving adjuvant endocrine therapy. Int J Radiat Oncol Biol Phys. 2011 Jun 1;80(2):398-402. | CrossRef | PubMed | Smith BD, Bellon JR, Blitzblau R, Freedman G, Haffty B, Hahn C, et al. Radiation therapy for the whole breast: Executive summary of an American Society for Radiation Oncology (ASTRO) evidence-based guideline. Pract Radiat Oncol. 2018 May-Jun;8(3):145-152. | CrossRef | PubMed |
Smith BD, Bellon JR, Blitzblau R, Freedman G, Haffty B, Hahn C, et al. Radiation therapy for the whole breast: Executive summary of an American Society for Radiation Oncology (ASTRO) evidence-based guideline. Pract Radiat Oncol. 2018 May-Jun;8(3):145-152. | CrossRef | PubMed | Wang SL, Fang H, Song YW, Wang WH, Hu C, Liu YP, et al. Hypofractionated versus conventional fractionated postmastectomy radiotherapy for patients with high-risk breast cancer: a randomised, non- inferiority, open-label, phase 3 trial. Lancet Oncol. 2019 Mar;20(3):352-360. | CrossRef | PubMed |
Wang SL, Fang H, Song YW, Wang WH, Hu C, Liu YP, et al. Hypofractionated versus conventional fractionated postmastectomy radiotherapy for patients with high-risk breast cancer: a randomised, non- inferiority, open-label, phase 3 trial. Lancet Oncol. 2019 Mar;20(3):352-360. | CrossRef | PubMed | Correa C, Harris EE, Leonardi MC, Smith BD, Taghian AG, Thompson AM, et al. Accelerated Partial Breast Irradiation: Executive summary for the update of an ASTRO Evidence-Based Consensus Statement. Pract Radiat Oncol. 2017 Mar-Apr;7(2):73-79. | CrossRef | PubMed |
Correa C, Harris EE, Leonardi MC, Smith BD, Taghian AG, Thompson AM, et al. Accelerated Partial Breast Irradiation: Executive summary for the update of an ASTRO Evidence-Based Consensus Statement. Pract Radiat Oncol. 2017 Mar-Apr;7(2):73-79. | CrossRef | PubMed | Yamaguchi M, Tobinai K, Oguchi M, Ishizuka N, Kobayashi Y, Isobe Y, et al. Concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: an updated analysis of the Japan clinical oncology group study JCOG0211. J Clin Oncol. 2012 Nov 10;30(32):4044-6. | CrossRef | PubMed |
Yamaguchi M, Tobinai K, Oguchi M, Ishizuka N, Kobayashi Y, Isobe Y, et al. Concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: an updated analysis of the Japan clinical oncology group study JCOG0211. J Clin Oncol. 2012 Nov 10;30(32):4044-6. | CrossRef | PubMed | Lowry L, Smith P, Qian W, Falk S, Benstead K, Illidge T, et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: a randomised phase III trial. Radiother Oncol. 2011 Jul;100(1):86-92. | CrossRef | PubMed |
Lowry L, Smith P, Qian W, Falk S, Benstead K, Illidge T, et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: a randomised phase III trial. Radiother Oncol. 2011 Jul;100(1):86-92. | CrossRef | PubMed | Hoskin PJ, Kirkwood AA, Popova B, Smith P, Robinson M, Gallop-Evans E, et al. 4 Gy versus 24 Gy radiotherapy for patients with indolent lymphoma (FORT): a randomised phase 3 non-inferiority trial. Lancet Oncol. 2014 Apr;15(4):457-63. | CrossRef | PubMed |
Hoskin PJ, Kirkwood AA, Popova B, Smith P, Robinson M, Gallop-Evans E, et al. 4 Gy versus 24 Gy radiotherapy for patients with indolent lymphoma (FORT): a randomised phase 3 non-inferiority trial. Lancet Oncol. 2014 Apr;15(4):457-63. | CrossRef | PubMed | Haas RL, Poortmans P, de Jong D, Aleman BM, Dewit LG, Verheij M, et al. High response rates and lasting remissions after low-dose involved field radiotherapy in indolent lymphomas. J Clin Oncol. 2003 Jul 1;21(13):2474-80. | CrossRef | PubMed |
Haas RL, Poortmans P, de Jong D, Aleman BM, Dewit LG, Verheij M, et al. High response rates and lasting remissions after low-dose involved field radiotherapy in indolent lymphomas. J Clin Oncol. 2003 Jul 1;21(13):2474-80. | CrossRef | PubMed | Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomide
chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. 2012 Jul;13(7):707-15. | CrossRef | PubMed |
Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomide
chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. 2012 Jul;13(7):707-15. | CrossRef | PubMed | Cairncross G, Wang M, Shaw E, Jenkins R, Brachman D, Buckner J, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol. 2013 Jan 20;31(3):337-43. | CrossRef | PubMed |
Cairncross G, Wang M, Shaw E, Jenkins R, Brachman D, Buckner J, et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol. 2013 Jan 20;31(3):337-43. | CrossRef | PubMed | Van den Bent MJ, Afra D, de Witte O, Ben Hassel M, Schraub S, Hoang-Xuan K, et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005 Sep 17 23;366(9490):985-90. | CrossRef | PubMed |
Van den Bent MJ, Afra D, de Witte O, Ben Hassel M, Schraub S, Hoang-Xuan K, et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005 Sep 17 23;366(9490):985-90. | CrossRef | PubMed | Hanna C, Lawrie TA, Rogozińska E, Kernohan A, Jefferies S, Bulbeck H, et al. Treatment of newly diagnosed glioblastoma in the elderly: a network meta-analysis. Cochrane Database Syst Rev. 2020 Mar 23;3(3):CD013261. | CrossRef | PubMed |
Hanna C, Lawrie TA, Rogozińska E, Kernohan A, Jefferies S, Bulbeck H, et al. Treatment of newly diagnosed glioblastoma in the elderly: a network meta-analysis. Cochrane Database Syst Rev. 2020 Mar 23;3(3):CD013261. | CrossRef | PubMed | Guedes de Castro D, Matiello J, Roa W, Ghosh S, Kepka L, Kumar N, et al. Survival Outcomes With Short- Course Radiation Therapy in Elderly Patients With Glioblastoma: Data From a Randomized Phase 3 Trial. Int J Radiat Oncol Biol Phys. 2017 Jul 15;98(4):931-938. | CrossRef | PubMed |
Guedes de Castro D, Matiello J, Roa W, Ghosh S, Kepka L, Kumar N, et al. Survival Outcomes With Short- Course Radiation Therapy in Elderly Patients With Glioblastoma: Data From a Randomized Phase 3 Trial. Int J Radiat Oncol Biol Phys. 2017 Jul 15;98(4):931-938. | CrossRef | PubMed | Likhacheva A, Awan M, Barker CA, Bhatnagar A, Bradfield L, Brady MS, et al. Definitive and Postoperative Radiation Therapy for Basal and Squamous Cell Cancers of the Skin: Executive Summary of an American Society for Radiation Oncology Clinical Practice Guideline. Pract Radiat Oncol. 2020 Jan-Feb;10(1):8-20. | CrossRef | PubMed |
Likhacheva A, Awan M, Barker CA, Bhatnagar A, Bradfield L, Brady MS, et al. Definitive and Postoperative Radiation Therapy for Basal and Squamous Cell Cancers of the Skin: Executive Summary of an American Society for Radiation Oncology Clinical Practice Guideline. Pract Radiat Oncol. 2020 Jan-Feb;10(1):8-20. | CrossRef | PubMed | Yu JB, Wilson LD, Detterbeck FC. Superior vena cava syndrome--a proposed classification system and algorithm for management. J Thorac Oncol. 2008 Aug;3(8):811-4. | CrossRef | PubMed |
Yu JB, Wilson LD, Detterbeck FC. Superior vena cava syndrome--a proposed classification system and algorithm for management. J Thorac Oncol. 2008 Aug;3(8):811-4. | CrossRef | PubMed | Tsao MN, Xu W, Wong RK, Lloyd N, Laperriere N, Sahgal A, et al. Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases. Cochrane Database Syst Rev. 2018 Jan 25;1(1):CD003869. | CrossRef | PubMed |
Tsao MN, Xu W, Wong RK, Lloyd N, Laperriere N, Sahgal A, et al. Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases. Cochrane Database Syst Rev. 2018 Jan 25;1(1):CD003869. | CrossRef | PubMed | Lutz S, Balboni T, Jones J, Lo S, Petit J, Rich SE, et al. Palliative radiation therapy for bone metastases: Update of an ASTRO Evidence- Based Guideline. Pract Radiat Oncol. 2017 Jan Feb;7(1):4-12. | CrossRef | PubMed |
Lutz S, Balboni T, Jones J, Lo S, Petit J, Rich SE, et al. Palliative radiation therapy for bone metastases: Update of an ASTRO Evidence- Based Guideline. Pract Radiat Oncol. 2017 Jan Feb;7(1):4-12. | CrossRef | PubMed | Rich SE, Chow R, Raman S, Liang Zeng K, Lutz S, Lam H, et al. Update of the systematic review of palliative radiation therapy fractionation for bone metastases. Radiother Oncol. 2018 Mar;126(3):547-557. | CrossRef | PubMed |
Rich SE, Chow R, Raman S, Liang Zeng K, Lutz S, Lam H, et al. Update of the systematic review of palliative radiation therapy fractionation for bone metastases. Radiother Oncol. 2018 Mar;126(3):547-557. | CrossRef | PubMed | Sundstrøm S, Bremnes R, Aasebø U, Aamdal S, Hatlevoll R, Brunsvig P, et al. Hypofractionated palliative radiotherapy (17 Gy per two fractions) in advanced non-small-cell lung carcinoma is comparable to standard fractionation for symptom control and survival: a national phase III trial. J Clin Oncol. 2004 Mar 1;22(5):801-10. | CrossRef | PubMed |
Sundstrøm S, Bremnes R, Aasebø U, Aamdal S, Hatlevoll R, Brunsvig P, et al. Hypofractionated palliative radiotherapy (17 Gy per two fractions) in advanced non-small-cell lung carcinoma is comparable to standard fractionation for symptom control and survival: a national phase III trial. J Clin Oncol. 2004 Mar 1;22(5):801-10. | CrossRef | PubMed |