 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Introducción
Objetivos Específicos
Metodología y Resultados de la Búsqueda de la Literatura
Síntesis de la Evidencia y Recomendaciones
1. Identificación de Mujeres de Alto Riesgo
1.1 ¿Cuáles son y Cómo se Clasifican los Factores de Riesgo de Cáncer de Mama según su Magnitud?
1.2 ¿Cuáles son las Lesiones Histopatológicas de Alto Riesgo y de qué Magnitud es el Riesgo Asociado a Ellas?
1.3 ¿Cuáles son las Diferencias entre Riesgo de Cáncer Familiar y Riesgo de Cáncer Hereditario?
2. Objetivando el Riesgo de Cáncer de Mama
2.1 ¿Cuáles son los Modelos Matemáticos que han Demostrado Utilidad en la Cuantificación del Riesgo de Cáncer de Mama y que Parámetros Utilizan?
2.2 ¿Cómo Seleccionar a las Mujeres que Necesitan un Estudio del Riesgo Genético de Cáncer de Mama?
2.3 ¿Qué Debe Analizar el Estudio Genético?
2.4 ¿Cómo se Clasifican las Mujeres según el Nivel de Riesgo de Cáncer de Mama después de la Aplicación de los Distintos Modelos Matemáticos y Estudios Genéticos?
3. Estrategias de Vigilancia y Seguimiento
3.1 ¿Cuál es el Valor del Auto-Examen y Examen Clínico en el Seguimiento de Mujeres de Alto Riesgo?
3.2 ¿Con qué Frecuencia se Debe Realizar el Estudio de Imágenes (Mamografía y Ecotomografía) en el Seguimiento de Mujeres de Alto Riesgo de Cáncer de Mama?
3.3 ¿Qué Tipo de Mamografía Debe Utilizarse: Convencional o Digital?
3.4 ¿Cuál es la Utilidad de la Resonancia Magnética Mamaria (RM) en la Vigilancia de Mujeres de Alto Riesgo?
3.5 ¿Cuál es la Utilidad de las Muestras de Epitelio Mamario (Lavado Ductal, Ductoscopía) en la Vigilancia de Mujeres de Alto Riesgo?
4. Estrategias de Prevención de Cáncer de Mama
4.1 Cambios de Estilo de Vida: ¿Cuáles han Demostrado Utilidad en la Prevención del Cáncer de Mama?
4.2 Métodos de Quimioprevención. ¿A Quiénes Pueden Beneficiar, Cuándo y por Cuánto Tiempo?
4.3 Cirugías Profilácticas: (Mastectomía-Ooforectomia), a Quienes Puede Beneficiar? Cuándo Debiesen Indicarse?
Referencias
Hasta hace poco tiempo atrás, los esfuerzos médicos se concentraban en el diagnóstico precoz y tratamiento oportuno del cáncer de mama. La incorporación de programas de pesquisa precoz o “screening” o “tamizaje” por mamografía ha permitido diagnosticar tumores cada vez más pequeños, lo que ha permitido una disminución en aproximadamente 30% de la mortalidad por cáncer de mama en mujeres mayores de 50 años. En la actualidad se han identificado diferentes factores de riesgo que están presentes en mujeres sanas que las hacen aumentar en distinto grado su probabilidad de desarrollar un cáncer mamario en el futuro. La ventaja de conocer estos factores, es que permite distinguir diferentes grupos de mujeres de mayor riesgo de cáncer mamario, lo que contribuye a elaborar estrategias de vigilancia en el tiempo de estas mujeres, como también permite establecer estrategias para disminuir el riesgo aumentado y de esta forma, prevenir el desarrollo de un cáncer de mama. El manejo clínico racional de mujeres de alto riesgo constituye un desafío que deberá incorporarse en todos los centros de diagnóstico y tratamiento de cáncer de mama.
Revisión de la literatura relevante de mayor impacto. Se incluyeron estudios prospectivos aleatorizados, estudios de cohorte, ensayos de distribución aleatoria, revisiones sistemáticas, revisiones narrativas, metanálisis, estudios descriptivos de corte transversal, estudios de casos y controles y series de casos prospectivas.
Síntesis de la evidencia:
Riesgo es un término relativo derivado de la comparación de la incidencia de una enfermedad en un grupo de personas que tienen un factor de riesgo particular, con relación a otro grupo de iguales características pero que no tienen dicho factor de riesgo. En este documento, factor de riesgo se considera a cualquier variable que aumente el riesgo de cáncer de mama a individuos. Se revisaron la mayoría de los factores importantes de riesgo y su contribución a la probabilidad de desarrollar cáncer de mama.
Estudios observacionales han permitido identificar estos factores y estimar la magnitud del riesgo asociado a ellos. Se han clasificado en factores de riesgo mayores aquellos que aumentan en 2 o más veces el riesgo y factores de riesgo menores los que aumentan en menos de 2 veces el riesgo (Schwartz, 2007; Gomez, 2006; Worsham, 2007; Vogel, 2003; Peralta, 2006; Fournier, 2005; Parvin, 2009; Zuzuki, 2005; Begum, 2009; Chlebowski, 2006; Hartmann, 2005; Li, 2007; Travis, 2005).
Se han establecido los riesgos absolutos y relativos para la mayoría de los factores de riesgo mayores; sin embargo, para los factores de riesgo menores, los riesgos relativos son estimativos, especialmente cuando se asocian a factores mayores. Como ejemplo, si una mujer es de alto riesgo por ser portador de mutaciones genéticas o de hiperplasia atípica (factores mayores), conocer la edad de la menarquia o la edad del primer parto agrega poca información adicional.
Nivel de evidencia II
Factores de Riesgo Mayores:
Factores de Riesgo Menores:
Recomendaciones:
Síntesis de la evidencia:
Esta pregunta se analiza desde dos puntos de vista diferentes:
A- Lesiones histopatológicas de alto riesgo de desarrollar un cáncer de mama en el futuro (lesiones precursoras).
B- Lesiones histopatológicas de alto riesgo en cáncer de mama recientemente diagnosticado.
Este punto se discutirá en el artículo de Diagnóstico Patológico.
La evidencia en ambos casos deriva fundamentalmente de estudios observacionales (principalmente cohortes retrospectivas), estudios transversales y series de casos.
Nivel de evidencia II-III
A- Lesiones histopatológicas de alto riesgo de desarrollar cáncer de mama en el futuro (lesiones precursoras)
La clasificación patológica de lesiones benignas de la mama incluye entidades que representan un leve riesgo de subdiagnóstico o de desarrollo de cáncer de mama (RR: 1,2-2,0). Ellas son la adenosis esclerosante, lesiones esclerosantes radiales y complejas (cicatriz radiada) y fibroadenomas complejos.
Lesiones precursoras son aquellas lesiones proliferativas benignas que presenta relación demostrada con riesgo aumentado de desarrollo posterior de carcinoma. Según la Organización Mundial de la Salud se aceptan como precursoras, la neoplasia lobulillar in situ, las lesiones proliferativas intraductales, hiperplasia ductal atípica, atipia plana, el carcinoma microinvasor y a las neoplasias papilares intraductales.
Neoplasia lobulillar in situ (NLIS): se considera como marcador pronóstico de baja frecuencia (0,5 a 3,9%; 1,2% en la serie de Liberman) porque en forma pura rara vez se encuentra asociado a carcinoma invasor (Jacobs, 2002). Es considerada un marcador de riesgo con una frecuencia de multicentricidad de 85% y bilateralidad de 35% (Zagouri, 2007). Carece de clínica o imagenología característica siendo su hallazgo incidental en el estudio histológico de otras lesiones. Para el carcinoma lobulillar in situ se acepta un riesgo relativo (RR) de 5 a 10 (Ben-David, 2005; Zagouri, 2007). Sólo la variante pleomórfica se asemeja fenotípica y genotípicamente al carcinoma ductal in situ de alto grado (Honrado, 2005). Los estudios revisados describen una incidencia de carcinoma de 10-31% después de una biopsia escisional. (Liberman, 1999; Shin, 2002; Middleton, 2003; Dershaw, 2003; Arpino, 2004; Elsheikh, 2005; Anderson, 2006; Karabakhtsian, 2007).
Clasificación Neoplasias Lobulillares (WHO, 2003):
Hiperplasia ductal atípica (HDA): se define como una lesión proliferativa intraductal en que coexisten patrones de hiperplasia ductal usual y carcinoma ductal in situ de bajo grado. El criterio cuantitativo aplicado como límite superior corresponde a un tamaño ≤ 2 milímetros y tiene un RR = 4 - 5; hasta RR 9,7 si se asocia a historia familiar. Frecuentemente está asociada a carcinomas de bajo grado (Jacobs, 2003).
Atipia plana (AP): se define como una lesión intraductal de 1 a 5 capas de células levemente atípicas, cuboidales o columnares, micropapilares sin eje conectivo y con distensión variable de la unidad túbulo lobulillar. Su RR no está aún bien establecido y se asume 4 veces mayor (WHO, 2003). Se considera más un precursor de carcinoma ductal in situ (CDIS) de bajo grado, así como de neoplasia lobulillar y carcinoma tubular, por lo tanto no se ha asociado claramente a cánceres de alto riesgo.
Papilomas intraductales: suelen provocar sangrado por el pezón. No tienen traducción radiológica exclusiva. Al ultrasonido puede aparecer como nódulo sólido en el interior de un conducto galactóforo. Se debe establecer el diagnóstico diferencial con el carcinoma papilar. El tratamiento es la resección del galactóforo comprometido. Los papilomas únicos no tienen riesgo de malignizarse. Los papilomas múltiples en mujeres jóvenes tienen mayor riesgo de carcinoma posterior.
Carcinoma ductal in situ (CDIS): lesión neoplásica intraductal caracterizada por aumento de la proliferación epitelial con leve a marcada atipia celular que puede progresar a cáncer invasor y que se caracteriza por una distensión de las unidades tubulares de más de 2 milímetros con células de bajo grado nuclear. También se define como cualquier lesión intraductal con células atípicas de grado nuclear 2 ó 3. Puede estar acompañada o no de necrosis y microcalcificaciones (Bethwaite, 1998). La multicentricidad varía entre 9 y 75% en la literatura. Se le acepta un riesgo relativo de 8-10. El 50% de las pacientes portadoras de CDIS desarrolla un cáncer invasor. El tipo histológico es relevante pues el carcinoma tipo comedocarcinoma progresa más frecuentemente y más rápido a carcinoma invasor (Zagouri, 2007).
Históricamente, en tumores agresivos no se han reconocido lesiones precursoras. Se sugiere que el crecimiento acelerado de este grupo de tumores puede explicar la baja frecuencia de hallazgo de lesiones precursoras. El aumento del uso de técnicas para la detección precoz y profilaxis ha permitido encontrar lesiones precursoras en estadios precoces de tumores triple negativo o de tipo basal.
Recomendaciones:
Síntesis de la evidencia:
Aproximadamente 10% de los casos de cáncer de mama y 25%–40% de los casos en mujeres menores de 35 años tienen predisposición genética. Las mutaciones de los genes BRCA1 y BRCA2 son responsables de 3-8% de todos los casos de cáncer de mama y 15% a 20% de los casos de cáncer familiar. Además contribuye a aumento del riesgo de cáncer epitelial de ovario. 10% de todos los casos de cáncer de ovario tienen predisposición genética a través de mutaciones BRCA1/2 (Lux, 2006).
Los primeros trabajos luego de la secuenciación de los genes BRCA1 y BRCA2 describían cáncer hereditario con criterios básicos que fueron los que se utilizaron en la selección de las familias con cáncer de mama y de alto riesgo. Este criterio de hereditario ha sido mayoritariamente utilizado en numerosos manuscritos publicados en los que se realizó el tamizaje de los genes BRCA1 y BRCA2. El término cáncer familiar ha sido poco empleado en la selección de familias de alto riesgo de cáncer de mama, y se refiere a la presencia de un familiar (aparte del caso índice) sin importar el grado de parentesco y la edad de aparición del cáncer de mama.
En cáncer hereditario se han identificado al menos dos oncogenes supresores denominados BRCA1 y BRCA2 relacionados con el control de proliferación, expresión génica y reparación del daño producido en el DNA (Schwartz, 2007; Lux, 2006). Se transmiten por herencia autosómica dominante. La pérdida de su funcionalidad requiere de la alteración de ambos alelos del cromosoma. Las alteraciones corresponden a mutaciones puntuales, inserciones, deleciones, etc. La mutación que inactiva funcionalmente a estos genes supresores de tumor suele corresponder a una deleción de una región del gen lo que produce la pérdida de heterozigocidad. Cuando estos genes están mutados y son heredados, se asocian a un riesgo de 50% a 80% de desarrollar cáncer de mama y de 20% a 40% de cáncer de ovario durante toda la vida. Esto debido a que las proteínas codificadas por estos genes mutados influyen en la reparación del DNA y en el control de la replicación de las células epiteliales de la mama (Lux, 2006; Berliner, 2007; Veltman, 2008). Las portadoras de las mutaciones descritas desarrollarán la enfermedad a edades más tempranas que lo observado en casos de cánceres esporádicos. Como se trata de herencia autonómica dominante, cada hijo tiene 50% de probabilidades de heredar la mutación, es transmitido igualmente por ambos sexos y lo habitual es que no se salten generaciones.
Los genes BRCA1 y BRCA2, representan un tercio de los casos de cáncer hereditario de la mama. Los casos restantes estarían ligados a la presencia de mutaciones en genes diversos, la mayoría aún desconocidos.
En el cáncer de mama familiar existe afectación de una mujer con 2 ó más familiares de 1º y 2º grado con cáncer de mama a cualquier edad. Se debe probablemente a interacción de factores medioambientales con factores genéticos (no identificados). Se han realizado intentos de cuantificar el riesgo de desarrollar cáncer de mama en función del número y de la edad de familiares afectos con riesgo relativo de cáncer de mama de 1,8 a 3,8 (Cuzick, 2006; Sivell, 2007).
Nivel de evidencia II-III
Recomendaciones:
Síntesis de la evidencia:
Los modelos matemáticos cuantifican y objetivan el riesgo de desarrollar cáncer de mama a una edad determinada. Esto permite expresar el riesgo en forma cuantitativa con datos numéricos. Los distintos modelos han sido evaluados a través de estudios observacionales y modelos de simulación.
Nivel de evidencia II
1. Modelo de Gail modificado por Costantino (Gomez, 2006; Decarli, 2006; Bondy, 2006; Crispo, 2008).
Predice el riesgo a 5 años y hasta el final de la vida. Se considera riesgo alto cuando el riesgo de desarrollo de cáncer de mama es > 1,7% en los siguientes 5 años. Incluye las variables: edad, raza, edad de menarquia, edad del primer parto, historia familiar de primer grado con cáncer de mama, antecedentes de biopsias mamarias previas y la presencia de hiperplasias atípicas en biopsias previas. La inclusión de la densidad mamaria radiológica en el modelo de Gail junto a otros factores modificables parecen promisorios pero aun no existe evidencia suficiente. El modelo de Gail ha identificado grupos de mujeres de alto riesgo para estudios de quimioprevención, pero subestima el grado del riesgo en mujeres con historia familiar (Crispo, 2008). El modelo ha sido validado por numerosos estudios demostrando una relación entre los cánceres esperados y los observados de 1,03.
Limitaciones del Modelo de Gail:
Considerando las limitaciones del modelo, éste otorga en forma rápida la estimación del riesgo de cáncer de mama en muchas mujeres. Es una herramienta útil y ha sido utilizado en los estudios de prevención NSABP P-1 y NSABP P-2 o STAR.
2. Modelo de Claus
Publicado en 1994 con los datos del estudio CASH, diseñado para mujeres con antecedentes familiares de cáncer de mama, incluye antecedentes familiares de primer y de segundo grado y la edad de diagnóstico de ellos. El modelo calcula la probabilidad de desarrollar cáncer de mama en un período de tiempo determinado o a una edad determinada. Es buen complemento del modelo de Gail en mujeres con antecedentes familiares de cáncer de mama. Tanto el modelo de Gail modificado por Costantino como el modelo de Claus, no deben ser utilizados en pacientes con antecedentes personales de cáncer de mama o en portadoras conocidas de mutaciones genéticas de alta penetrancia (Gómez, 2006).
3. Otros programas computacionales
Existen diversos programas computacionales para evaluación de pacientes de alto riesgo de cáncer de mama. Uno de ellos es el creado por Parmigiani y colaboradores llamado el BRCA Program o BRCA-PRO®, diseñado para determinar la probabilidad de mutación en los genes BRCA1 y BRCA2. Presenta correlación en la predicción de mutaciones. Si aparece una probabilidad mayor de 10% se recomienda la realización de estudio genético, ya que estas mujeres tienen 100 veces más riesgo de mutaciones al compararlas con la población general cuyo riesgo es de 0,1%.
Otro programa es el CancerGene®, diseñado para construir el árbol genealógico de las mujeres. Calcula los riesgos y probabilidades en función de datos ingresados en la construcción del pedigrí. Además incorpora a los otros modelos, como el Gail, Claus, BRCA-PRO, Myriad I y Myriad II.
La objetivación del riesgo según modelos matemáticos se revisa según cada modelo con énfasis en las fortalezas y debilidades de cada método. Es fundamental combinar los diferentes modelos para la mejor cuantificación del riesgo de cada mujer (Gómez, 2006; Consenso Italiano, 2008).
Ventajas de los modelos matemáticos:
Desventajas de los modelos matemáticos:
Recomendaciones:
Síntesis de la evidencia:
La identificación de mujeres y hombres para realizar el estudio genético ha sido controvertida. Se han diseñado numerosos sistemas para cuantificar el riesgo genético, muchos de ellos difíciles y que requieren de tiempo adecuado para estudiar detalladamente los antecedentes oncológicos familiares de al menos tres generaciones.
Existen criterios clínicos para definir cáncer de mama hereditario debido a probables mutaciones en los genes BRCA1 y BRCA2, que corresponden a los criterios de historia familiar con los que se han seleccionado familias a las que se les ha realizado el estudio de ligamiento genético para la identificación de los genes (Schwartz, 2007; Lux, 2006; Berliner, 2007; Veltman, 2008). La edad recomendada es sobre 25 años.
Estos criterios son:
Las mutaciones BRCA1 y BRCA2 presentan alta probabilidad de cáncer mamario de aparición en edades precoces, de cáncer de mama bilateral y de multifocalidad/multicentricidad.
Los modelos matemáticos ayudan a seleccionar mujeres para el estudio genético. El BRCA-PRO®, diseñado para determinar la probabilidad de mutación en los genes BRCA1 y BRCA2, presenta correlación en la predicción de mutaciones. Sobre 10% de probabilidad sugiere test genético, ya que estas mujeres tienen 100 veces más riesgo de mutaciones al compararlas con la población general de 0,1% (Schwartz, 2007; Lux, 2006). La indicación del examen genético debe ser siempre evaluada por el médico y ofrecerse al individuo afectado; si ello es imposible, al familiar asintomático con grado de parentesco más cercano (Consenso Italiano, 2008).
Nivel de evidencia II-III
La American Society of Clinical Oncology (ASCO) recomienda realizar el estudio de mutaciones en los genes BRCA1 y 2 en las siguientes situaciones (Vogel, 2003):
Nivel de evidencia IV
Recomendaciones:
A. Selección en base a criterios clínicos de historia familiar:
B. Selección apoyado por modelos matemáticos
Síntesis de la evidencia:
El estudio de mutaciones genéticas que aumentan el riesgo de cáncer de mama se ha desarrollado progresivamente en los últimos años. Los factores genéticos se han dividido en forma arbitraria en genes de baja penetrancia y genes de alta penetrancia.
Genes de baja penetrancia. Cada vez se están conociendo más. Las mutaciones de estos genes confieren un leve a moderado aumento del riesgo de cáncer de mama. Dependiendo de la sensibilidad de cada individuo, pueden interactuar con otros factores de riesgo ambientales, uso de alcohol, terapia de reemplazo hormonal, etc. Desgraciadamente, aún no se conoce exactamente la interacción de estas mutaciones con otros factores de riesgo por lo que, hasta el momento, no se recomienda su estudio y detección (Schwartz, 2007).
Genes de alta penetrancia. Son genes supresores de tumor que regulan la proliferación celular creando proteínas que reparan el DNA previniendo la carcinogénesis. Son conocidos el BRCA1, BRCA2, PTEN y Tp53, cuyas mutaciones son responsables de los síndromes de cáncer de mama hereditario. Mutaciones de los genes PTEN y Tp53 conllevan a los síndromes de Cowden y Li-Fraumeni.
Las mutaciones BRCA1 y BRCA2, aunque diferentes en sus características, se consideran juntas para todos los estudios debido a que sus consecuencias son similares, 50%-80% de riesgo de desarrollar cáncer de mama y 20%-40% de riesgo de cáncer epitelial de ovario a lo largo de la vida. El cáncer de mama en portador de mutación BRCA1 tiende a desarrollarse en mujeres jóvenes, es de alto grado histológico y con frecuencia de tipo “triple negativo”. El cáncer en portador de BRCA2 es frecuentemente de tipo luminal, es decir, receptores de estrógenos y progesterona positivos. El papel de estas dos mutaciones en el desarrollo del “cáncer ductal in situ” es incierto.
Entre aproximadamente 10 y 15% de los individuos testeados se puede detectar una mutación de significado incierto (VUS) que causa dificultades en la consejería y en la estimación del riesgo. El manejo clínico de mujeres con mutaciones VUS debe ser personalizado y considerar factores de riesgo personales y familiares. Se necesita mayor investigación para reclasificar este tipo de mutaciones. El hecho de no encontrar una mutación conocida en el examen no descarta la posibilidad que existan algunas otras mutaciones aún no determinadas.
La alteración genética indica alto riesgo de presentar cáncer de mama (50-80%) y cáncer de ovario (20-40%) en el transcurso de la vida (hasta los 75-80 años) (Schwartz, 2007; Lux, 2006). Si bien no hay estudios de riesgo realizados en Chile, se puede asumir que el riesgo en nuestro país es similar al reportado en los estudios de los Estados Unidos de América y Europa. La prevalencia estimada de mutaciones BRCA1 y 2 es de 1 por 250-500 individuos en poblaciones no judías. Mientras menor es la edad del familiar afectado y mayor el número de familiares enfermos, mayor es la probabilidad de ser portador de las mutaciones. En judíos Ashkenazi, 1% portan la mutación 185delAG (BRCA1), 0,5% portan la mutación 5382insC (BRCA1) y 1% la mutación 6174delT (BRCA2). En esta población judía, la frecuencia de las tres mutaciones es 1 en 40 individuos.
Análisis. En los pacientes con cáncer de mama no de origen Ashkenazi el estudio debe incluir la secuenciación completa del DNA de los genes BRCA1 y 2. Si a un individuo enfermo de cáncer mamario se le detecta una determinada mutación, en los familiares se recomienda buscar sólo esa mutación y no secuenciar todo el gen. Si se trata de un paciente judío Ashkenazi la sugerencia es realizar el estudio de las tres mutaciones propias de esta población. Si ellas son negativas, se sugiere entonces la secuenciación completa (Schwartz, 2007; Lux, 2006)
Información.
Antes del estudio: asegurar la confidencialidad del examen y de sus resultados. Informar que el resultado demora varias semanas debido a lo complejo de la metodología para secuenciar el DNA. Informar que la probabilidad de encontrar una mutación en el gen BRCA1 o BRCA2 es alrededor de 20%. En aproximadamente 10 a 15% de los individuos testeados se puede detectar una mutación de significado incierto (VUS) que causará dificultades en la consejería y en la estimación del riesgo. Finalmente, el hecho de no encontrar una mutación conocida en el examen no descarta la posibilidad que existan algunas otras mutaciones aún no determinadas (Schwartz, 2007).
Presencia de mutación en el familiar con cáncer de mama: explicar que en la familia existe una mutación en el gen BRCA y que la alteración genética indica alto riesgo de presentar cáncer de mama (50-80%) y cáncer de ovario (20-40%) en el transcurso de la vida. Como no hay estudios de riesgo realizados en Chile, se debe informar que este riesgo es una estimación según estudios europeos y de Norteamérica.
Presencia de una mutación en BRCA1/2 en una persona sana: informar que la mutación encontrada es responsable del cáncer de mama (u ovario) en su familiar, y que puede causarle a ella un cáncer de mama con riesgo de 50-80% y/o cáncer de ovario con riesgo de 20-40% en el transcurso de la vida (hasta los 75-80 años). Se debe informar que el riesgo es una estimación según estudios europeos y de Norteamérica. Además se debe referir a su médico especialista para una adecuada vigilancia y prevención.
Recomendaciones:
Síntesis de la evidencia:
Según los factores de riesgo, las mujeres se pueden clasificar en 4 grupos según su categoría de riesgo (Schwartz, 2007; Gómez, 2006; Worsham, 2007; Vogel, 2003):
Nivel de evidencia II
Las estrategias actualmente disponibles basadas exclusivamente en el examen clínico y autoexamen para la detección temprana del cáncer de mama en la población en general no son suficientes para la vigilancia de mujeres con alto riesgo y riesgo hereditario de cáncer de mama y/o de ovario. No se encontró evidencia científica para responder a esta pregunta.
Síntesis de la evidencia:
La mamografía continúa siendo la base del tamizaje de cáncer de mama (Berg, 2008), aunque la tasa de cáncer de intervalo con mamografía es alta, entre 36 y 56%.
Nivel de evidencia I
Un estudio de cohorte con seguimiento clínico y mamográfico en pacientes de riesgo moderado, alto y portadoras de mutaciones BRCA1 y 2, encuentra en estas últimas altas tasas de detección, ratio observado-esperado y menor sensibilidad, con un estadio tumoral desfavorable al momento del diagnóstico, sugiriendo la necesidad de seguimiento más intensivo, especialmente en menores de 40 años (Brekelmans, 2001).
Nivel de evidencia II
En una serie de casos en mujeres de altísimo riesgo por irradiación previa por linfoma de Hodgkin el tiempo de desarrollo del cáncer fue de 8 a 34 años con un promedio de 18 años. La mamografía demostró el 90% de los canceres (Dershaw, 1992).
Nivel de evidencia III
El ultrasonido (US) tiene algunas ventajas sobre la resonancia magnética (RM). Es bien tolerado, ampliamente disponible y relativamente barato. La sensibilidad es mejor con mamografía + US que con mamografía sola (52%-77%), pero inferior al uso suplementario de resonancia magnética. (Berg, 2008; Berg, 2009).
Nivel de evidencia I-II
A partir de la evidencia disponible se han recomendado distintos esquemas de seguimiento para grupos de alto riesgo (Dershaw, 2000; Berg, 2009), que sirven de base a las recomendaciones de este consenso:
Tamizaje con Ultrasonido (O’Driscoll, 2001; Berg 2009):
Recomendaciones:
Se recomienda realizar mamografía anual desde la siguiente edad de la mujer de alto riesgo:
Síntesis de la evidencia:
La evidencia de ensayos aleatorios y estudios diagnósticos ha demostrado que la mamografía digital tiene igual o mayor detección de cáncer y mayor especificidad que la técnica convencional. En especial ha demostrado mayor sensibilidad en mujeres con mamas densas y/o menores de 50 años (Berg, 2008).
Nivel de evidencia I
Recomendaciones:
Síntesis de la evidencia:
Tamizaje suplementario con resonancia magnética mamaria:
Una revisión sistemática de 11 estudios prospectivos no aleatorios en mujeres de alto riesgo, emplea resonancia magnética además de mamografía con o sin ultrasonido y examen físico. Los cánceres de intervalo fueron menos de 10% en los estudios con más de una ronda de tamizaje.
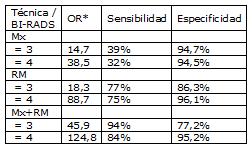
En trabajos con mayor tasa de detección de carcinoma ductal in situ, la mayoría de estos fueron detectados por resonancia magnética. Del total de cánceres detectados, más de 50% correspondieron a cáncer in situ o menores de 1 cm. Sólo entre 12 y 21% de los tumores infiltrantes se acompañaron de linfonodos positivos. En los pocos estudios en que existen datos por año de tamizaje, el estadio tumoral fue similar para prevalencia e incidencia. La sensibilidad de la resonancia magnética fue mayor que la de la mamografía en todos los estudios y la especificidad de la resonancia fue menor que la de la mamografía en todos excepto uno (Kuhl, 2007). En dos de tres estudios que reportaron especificidades por ronda, ésta fue superior en las rondas posteriores.
Definiendo positivo sólo a los BI-RADS 4 o 5, la resonancia magnética asociada a mamografía se asoció al mayor OR diagnóstico y asumiendo una probabilidad de enfermedad pretest de 2%, hallazgos negativos en mamografía y resonancia reducen la probabilidad de lesiones biopsiadas sospechosas a 0,3%, mientras que una mamografía sola la reduce a 1,4%.
Resultados combinados:
*OR=Razón entre la posibilidad de Ca si el test es (+) entre quienes tienen la enfermedad, y la posibilidad de Ca si el test es (+) entre quienes no tienen la enfermedad. Mide la exactitud global del test. A mayor OR, mayor poder discriminatorio del test (mayor posibilidad de que el resultado sea cierto si efectivamente la persona tiene cáncer).
Aunque los 11 estudios usaron intervalo de 1 año para tamizaje, puede no ser lo mejor para todos los grupos de alto riesgo. Algunas limitaciones de la investigación son las diferencias en la población de pacientes, experiencia del centro y criterios para resultados positivos de tamizaje que resultan en heterogeneidad entre los estudios incluidos (Warner, 2008).
Nivel de evidencia II
No existen estudios con datos de supervivencia total o libre de enfermedad al agregar resonancia magnética mamaria a la mamografía en el grupo de alto riesgo, pero se asume que al detectar más cánceres con linfonodos negativos, reduciría la mortalidad por cáncer de mama (Warner, 2008; Berg, 2009). La Sociedad Americana de Oncología Clínica (ASCO) y la Guía Clínica Europea de Panel de Expertos acerca de tamizaje con resonancia magnética como complemento de mamografía (Saslow, 2007) sugieren las siguientes recomendaciones:
Resonancia magnética anual, basada en evidencia derivada de ensayos de tamizaje no aleatorios y estudios observacionales:
Resonancia magnética anual, basada en opinión de consenso de expertos, a partir del riesgo estimado de desarrollar cáncer a lo largo de la vida en cada grupo:
Evidencia insuficiente a favor o en contra de resonancia magnética como tamizaje (recomienda decisiones caso a caso):
Recomendación contraria a resonancia magnética como tamizaje, basada en opinión de consenso de expertos:
Un estudio de serie de casos en pacientes con cáncer e historia familiar, seleccionadas a partir de un estudio de cohorte prospectivo, encuentra que los fenotipos de imágenes difieren entre las categorías de riesgo. Del total de cánceres infiltrantes, 20% apareció como impregnación del tipo no masa y 33% tuvo características cinéticas benignas. 23% de los cánceres infiltrantes se presentaron como masas bien delimitadas, sin calcificaciones, como frecuentemente aparece en los fibroadenomas, pero sin los signos típicos de realce de estos.
Las portadoras de mutación BRCA1 exhibieron 80% de estas lesiones con morfología benigna y ninguno de sus cánceres presentó microcalcificaciones ni fue carcinoma ductal in situ. En cambio, los cánceres de las portadoras de mutación BRCA2 y mujeres en riesgo moderado presentaron características similares a los cánceres esporádicos. Con respecto a la ubicación, 67% de los tumores en mujeres de alto riesgo y con mutaciones (p<0,009) (Schrading, 2008) se encontró en localización posterior y prepectoral.
Otro estudio retrospectivo que evaluó el aspecto en mamografía y resonancia magnética de lesiones malignas en pacientes portadoras de mutación BRCA1 y 2, encontró diferencias significativas como mayor índice de actividad mitótica y tumores más redondeados y bien definidos en comparación con los cánceres esporádicos. Además, en resonancia magnética se aprecia frecuentemente realce en anillo. No hubo diferencias significativas en la cinética de impregnación (Veltman, 2008).
Nivel de evidencia III
Recomendaciones:
Síntesis de la evidencia:
El fundamento de estas técnicas se basa en que el cáncer de mama se genera a partir de cambios en el epitelio de los conductos mamarios (Gomez, 2006). Las técnicas propuestas para ello son principalmente la aspiración periareolar con aguja fina, el lavado ductal y la ductoscopía (Arun, 2007; Khan, 2004; Sarakbi, 2006). El lavado ductal consiste en la obtención de células mediante la canulación de conductos mamarios y lavado de ellos con suero fisiológico. La ductoscopía utiliza fibra óptica que canaliza los conductos mamarios y visualiza endoscópicamente el árbol ductal.
La comparación entre aspiración periareolar con aguja fina y lavado ductal aparece reportada en un estudio en 86 mujeres de alto riesgo y reporta que ambos procedimientos son bien tolerados con obtención de muestras adecuadas, siendo levemente superior la aspiración con aguja fina. Sin embargo, se necesitan más estudios para validar las técnicas (Arun, 2007).
Otro estudio analiza en 39 mujeres el lavado ductal con el estudio de la pieza de mastectomía después de cirugía de cáncer de mama. La sensibilidad del lavado ductal fue 17%, la especificidad de 100% y la correlación sólo de 19% (Khan, 2004).
Un estudio colaborativo en Reino Unido y Australia en mujeres de alto riesgo reporta que la citología aspirativa fue exitosa en 38% con sensibilidad de 4 a 21%. El lavado ductal es suficiente en 27% y detecta atipias en 6% de los casos. La ductoscopia puede detectar lesiones precoces pero colabora en reducir márgenes positivos sólo en 5 a 23% (Locke, 2004).
Otra serie de 26 mujeres de alto riesgo con ductoscopía reporta sensibilidad del método de 16% y pudiera ser útil para guiar la cirugía conservadora (Sarakbi, 2006).
Nivel de evidencia III
Recomendaciones:
Síntesis de la evidencia:
Numerosos estudios observacionales han evaluado cambios en el estilo de vida con relación a prevención del cáncer de mama. Un factor de estilo de vida es la actividad física ya que produce tardanza de la menarquia, mayor porcentaje de ciclos anovulatorios y menor cantidad de hormonas sexuales endógenas. Los ejercicios aeróbicos influyen en la recurrencia y en la progresión de la enfermedad después del diagnóstico de cáncer de mama (Rock, 2009). Las mujeres que realizan 3 a 4 horas semanales de ejercicios moderados a vigorosos tienen entre 30 y 40% menor riesgo de desarrollar cáncer de mama que las mujeres sedentarias (McTiernan, 2003). La resistencia a la insulina es un biomarcador de riesgo para cáncer de mama al favorecer el desarrollo tumoral estimulando la proliferación celular o inhibiendo la apoptosis. El ejercicio crónico aumenta la sensibilidad a la insulina, pero tiene mayor efecto el ejercicio intenso que el de mayor duración. La obesidad y sobrepeso también están asociadas a la resistencia a la insulina y a hiperinsulinemia (Campbell, 2007).
Nivel de evidencia II
Un ensayo aleatorio evaluó si era efectivo introducir cambios en la dieta para reducir el consumo de grasa hasta llegar al 20% de total de energía, aumentado el consumo de vegetales y frutas al menos 5 veces al día y cereales 6 veces al día (Ross, 2006). A pesar de no existir diferencia significativa, hubo disminución del riesgo de cáncer de mama en el grupo intervenido. Aunque la evidencia es inconsistente, otros estudios observacionales sugieren que las mujeres sometidas a dieta baja en grasa tienen disminución del riesgo y la dieta podría influir en las características de los receptores hormonales del tumor.
Nivel de evidencia I-II
Estudios observacionales muestran que niveles moderados y altos de consumo de alcohol se asocian a mayor riesgo de cáncer de mama. La ingesta de alcohol produce un aumento de 7% de riesgo de cáncer de mama por cada 10 grs. de alcohol adicional consumido diariamente (McTiernan, 2003).
Nivel de evidencia II
Recomendaciones:
Síntesis de la evidencia:
La quimioprevención es la administración de preparados químicos, naturales o sintéticos, para impedir o revertir la carcinogénesis evitando el desarrollo de un cáncer (Peralta, 2006). Los preparados más estudiados son los que actúan por competencia como los moduladores selectivos de receptores de estrógenos que incluye tamoxifeno y raloxifeno.
A- Tamoxifeno. Cuatro estudios prospectivos randomizados en mujeres de alto riesgo de cáncer de mama (Powles, 2007; Veronesi, 2006; Fisher, 2005; Cuzick, 2007) suman 28.419 mujeres que se randomizan a tamoxifeno 20 mg/día vs placebo durante 5 años. En los dos primeros estudios (Powles, 2007;Veronesi, 2006) si bien no reportan clara prevención de cáncer de mama, el estudio italiano sugiere beneficio para el subgrupo de mujeres que usaron concomitantemente terapia de reemplazo hormonal en la menopausia y tamoxifeno (6 de 793 mujeres vs 17 de 791).
El estudio P1 (Fisher, 2005) reporta disminución del riesgo relativo de cáncer de mama infiltrante de 43% y de cáncer in situ de 37%. La incidencia acumulada de cáncer de mama fue 2,5% para el grupo de tamoxifeno y 4,3% para el grupo placebo. La reducción de la incidencia se observa sólo para tumores receptores estrógenos positivos (RR 0,31 CI 0,22-0,45). El efecto beneficioso es levemente superior en mujeres sobre 60 años.
El estudio IBIS I (Cuzick, 2007) reporta prevención con tamoxifeno de 32%; odds ratio de 0,68 (95% CI 0,50-0,92) en mujeres con riesgo de cáncer de mama RE positivo, confirmando y validando los resultados del P1. Si se suman los 4 estudios de prevención con tamoxifeno se reporta un efecto protector de 38%, hazard ratio de 0,62 (Cuzick, 2003).
Nivel de evidencia I
B - Raloxifeno. Se identifican dos estudios aleatorios.
En cuanto a los efectos adversos, tanto el tamoxifeno como el raloxifeno aumentan entre 2 y 3 veces el riego de eventos venosos tromboembólicos. El tamoxifeno aumenta también 2 a 3 veces el riesgo de cáncer de endometrio en mujeres postmenopáusicas.
Nivel de evidencia I
Otros agentes quimiopreventivos.
Recomendaciones:
Síntesis de la evidencia:
Se distinguen tres tipos de cirugías de reducción de riesgo (profilácticas) en mujeres de alto riesgo de cáncer de mama (Zakaría, 2007):
La mastectomía profiláctica es la exéresis completa de la glándula mamaria con o sin conservación del complejo areola-pezón. La ooforectomía profiláctica es la extirpación de ambos ovarios en ausencia de cáncer de mama u ovario. Estos procedimientos se pueden realizar por separado o en conjunto a fin de aumentar el efecto preventivo.
Mastectomía de reducción de riesgo bilateral
Seis estudios de casos-controles o de cohorte, han evaluado el rol de la mastectomía profiláctica en la incidencia de cáncer de mama, tres de ellos en mujeres portadoras de mutación BRCA1-2 (Meijers, 2001; Hartman, 2001; Rebbeck, 2004) y tres en mujeres de alto riesgo por antecedentes familiares marcados (Zakaria, 2007; Hartman, 1999).
En portadoras de mutaciones BRCA1-2, la mastectomía total logra 85-90% de reducción de riesgo con seguimiento promedio de 8 años (Meijers, 2001; Hartman, 2001; Rebbeck, 2004). Al combinar mastectomía con ooforectomía profiláctica, el riesgo relativo de cáncer de mama baja a 0,05 (IC 95% 0,01-0,22) evaluada a 6 años (Rebbeck, 2004).
En mujeres con marcados antecedentes familiares y considerados de muy alto riesgo, la reducción de riesgo alcanza a 89-94% (Hartman, 1999; Zakaria, 2007). No hay evidencia respecto al impacto en la supervivencia global. Un trabajo reporta menor mortalidad por cáncer de mama, con reducción de riesgo de 81-94% (Hartman, 1999).
Nivel de evidencia II
Mastectomía de reducción de riesgo contralateral
Se identificaron seis estudios de cohorte en portadoras de BRCA 1-2 y en mujeres con antecedentes familiares importantes (van Sprundel, 2005; McDonnell, 2001; Herrington, 2005; Peralta, 2000; Kass, 2008; Burke, 2008). En portadoras de mutaciones BRCA1-2 se describe disminución significativa de la incidencia de cáncer mamario contralateral, HR: 0,09 (IC 95% 0,01-0,78) con seguimiento de 4 años. No hay diferencia en supervivencia global (Sprundel, 2005), pero si se asocia a ooforectomía profiláctica, la supervivencia global mejora con HR de 0,12 y la supervivencia especifica asociada a cáncer de mama HR: 0,16. Ambas diferencias alcanzan significación estadística. En mujeres con antecedentes familiares disminuye la incidencia de cáncer contralateral HR: 0,03-0,05. No existen datos concluyentes respecto a supervivencia (Herrington, 2005).
Nivel de evidencia II
Ooforectomía
Cinco estudios, tres de ellos de cohorte, analizan la reducción de riesgo de la ooforectomía profiláctica en mujeres BRCA1-2 (Eisen, 2005; Rebbeck, 2002-1999; Kauff, 2002-2008; Rebbeck, 2009). Existe reducción significativa del riesgo de cáncer de mama con HR: 0,49 IC 95% (0,37-0,65) con seguimiento promedio de 8 años. No hay evidencia respecto al impacto en supervivencia global de las pacientes sometidas a ooforectomía profiláctica.
Nivel de evidencia II
Recomendaciones:
Este artículo fue redactado en su versión final después de haber recibido las contribuciones y comentarios de los delegados que asistieron a la III Jornada Nacional de Diagnóstico y Tratamiento de Cáncer de Mama, realizada en Coquimbo, Chile, en agosto de 2009. A su vez, las ponencias que se presentaron en esa jornada fueron la síntesis del artículo completo de revisión de la literatura y trabajo previo de la comisión correspondiente. Este trabajo de formulación duró un año, comenzó en junio de 2008 y se llevó a cabo bajo la asesoría de Medwave Estudios Ltda., en el marco del proyecto denominado “Asesoría en la Formulación de Consenso y Recomendaciones en Cáncer de Mama Basados en la Evidencia”. El financiamiento para la ejecución de la asesoría provino de la Sociedad Chilena de Mastología.
La coordinación de la asesoría fue realizada por Vivienne Bachelet; el metodólogo jefe fue Miguel Araujo; y la metodóloga adjunta fue Gabriela Moreno. Colaboró en la sistematización bibliográfica y en el formato final de los documentos, Matías Goyenechea. El artículo definitivo es el resultado del trabajo final presentado a las jornadas de consenso, donde fue conocido, revisado y discutido por los concurrentes, y luego fue revisado por un comité editorial de pares constituido por la misma Sociedad Chilena de Mastología, tras lo cual fue enviado a Medwave para su publicación.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Autores:
Octavio Peralta[1], María Eugenia Bravo[1], Marcela Amar[1], Francisca Arnello[1], Carolina Barriga[1], Pilar Carvallo[1], Francisco Domínguez[1], Jorge Gamboa[1], Lorena Gutiérrez[1], Lilian Jara[1], Leonor Moyano[1], Paulina Neira[1], Mario Pardo[1], Dravna Razmilic[1], Carla Sáez[1], Gonzalo Vigueras[1]
Autores:
Octavio Peralta[1], María Eugenia Bravo[1], Marcela Amar[1], Francisca Arnello[1], Carolina Barriga[1], Pilar Carvallo[1], Francisco Domínguez[1], Jorge Gamboa[1], Lorena Gutiérrez[1], Lilian Jara[1], Leonor Moyano[1], Paulina Neira[1], Mario Pardo[1], Dravna Razmilic[1], Carla Sáez[1], Gonzalo Vigueras[1]

Citación: Peralta O, Bravo ME, Amar M, Arnello F, Barriga C, Carvallo P, et al. High-risk for breast cancer and prevention strategies: a literature review. Medwave 2010 Ene;10(01):e4358 doi: 10.5867/medwave.2010.01.4358
Fecha de envío: 17/8/2009
Fecha de aceptación: 28/8/2009
Fecha de publicación: 1/1/2010
Origen: no solicitado
Tipo de revisión: con revisión por pares externa

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Al Sarakbi W, Salhab M, Mokbel K. Does mammary ductoscopy have a role in clinical practice? Int Semin Surg Oncol. 2006 Jun 30;3:16. | CrossRef | PubMed | PMC |
Al Sarakbi W, Salhab M, Mokbel K. Does mammary ductoscopy have a role in clinical practice? Int Semin Surg Oncol. 2006 Jun 30;3:16. | CrossRef | PubMed | PMC | Arun B, Valero V, Logan C, Broglio K, Rivera E, Brewster A, et al. Comparison of ductal lavage and random periareolar fine needle aspiration as tissue acquisition methods in early breast cancer prevention trials. Clin Cancer Res. 2007 Aug 15;13(16):4943-8. | CrossRef | PubMed |
Arun B, Valero V, Logan C, Broglio K, Rivera E, Brewster A, et al. Comparison of ductal lavage and random periareolar fine needle aspiration as tissue acquisition methods in early breast cancer prevention trials. Clin Cancer Res. 2007 Aug 15;13(16):4943-8. | CrossRef | PubMed | Begum P, Richardson CE, Carmichael AR. Obesity in post menopausal women with a family history of breast cancer: prevalence and risk awareness. Int Semin Surg Oncol. 2009 Jan 8;6:1. | CrossRef | PubMed | PMC |
Begum P, Richardson CE, Carmichael AR. Obesity in post menopausal women with a family history of breast cancer: prevalence and risk awareness. Int Semin Surg Oncol. 2009 Jan 8;6:1. | CrossRef | PubMed | PMC | Berg WA. Tailored supplemental screening for breast cancer: what now and what next? AJR Am J Roentgenol. 2009 Feb;192(2):390-9. | CrossRef | PubMed |
Berg WA. Tailored supplemental screening for breast cancer: what now and what next? AJR Am J Roentgenol. 2009 Feb;192(2):390-9. | CrossRef | PubMed | Bethwaite P, Smith N, Delahunt B, Kenwright D. Reproducibility of new classification schemes for the pathology of ductal carcinoma in situ of the breast. J Clin Pathol. 1998 Jun;51(6):450-4. | CrossRef | PubMed | PMC |
Bethwaite P, Smith N, Delahunt B, Kenwright D. Reproducibility of new classification schemes for the pathology of ductal carcinoma in situ of the breast. J Clin Pathol. 1998 Jun;51(6):450-4. | CrossRef | PubMed | PMC | Bijker N, Peterse JL, Duchateau L, Julien JP, Fentiman IS, Duval C, et al. Risk factors for recurrence and metastasis after breast-conserving therapy for ductal carcinoma-in-situ: analysis of European Organization for Research and Treatment of Cancer Trial 10853. J Clin Oncol. 2001 Apr 15;19(8):2263-71. | PubMed |
Bijker N, Peterse JL, Duchateau L, Julien JP, Fentiman IS, Duval C, et al. Risk factors for recurrence and metastasis after breast-conserving therapy for ductal carcinoma-in-situ: analysis of European Organization for Research and Treatment of Cancer Trial 10853. J Clin Oncol. 2001 Apr 15;19(8):2263-71. | PubMed | Bondy ML, Newman LA. Assessing breast cancer risk: evolution of the Gail Model. J Natl Cancer Inst. 2006 Sep 6;98(17):1172-3. | CrossRef | PubMed |
Bondy ML, Newman LA. Assessing breast cancer risk: evolution of the Gail Model. J Natl Cancer Inst. 2006 Sep 6;98(17):1172-3. | CrossRef | PubMed | Brekelmans CT, Seynaeve C, Bartels CC, Tilanus-Linthorst MM, Meijers-Heijboer EJ, Crepin CM, et al. Effectiveness of breast cancer surveillance in BRCA1/2 gene mutation carriers and women with high familial risk. J Clin Oncol. 2001 Feb 15;19(4):924-30. | PubMed |
Brekelmans CT, Seynaeve C, Bartels CC, Tilanus-Linthorst MM, Meijers-Heijboer EJ, Crepin CM, et al. Effectiveness of breast cancer surveillance in BRCA1/2 gene mutation carriers and women with high familial risk. J Clin Oncol. 2001 Feb 15;19(4):924-30. | PubMed | Bryan BB, Schnitt SJ, Collins LC. Ductal carcinoma in situ with basal-like phenotype: a possible precursor to invasive basal-like breast cancer. Mod Pathol. 2006 May;19(5):617-21. | CrossRef | PubMed |
Bryan BB, Schnitt SJ, Collins LC. Ductal carcinoma in situ with basal-like phenotype: a possible precursor to invasive basal-like breast cancer. Mod Pathol. 2006 May;19(5):617-21. | CrossRef | PubMed | Campbell KL, McTiernan A. Exercise and biomarkers for cancer prevention studies. J Nutr. 2007 Jan;137(1 Suppl):161S-169S. | PubMed |
Campbell KL, McTiernan A. Exercise and biomarkers for cancer prevention studies. J Nutr. 2007 Jan;137(1 Suppl):161S-169S. | PubMed | Collins LC, Schnitt SJ. HER2 protein overexpression in estrogen receptor-positive ductal carcinoma in situ of the breast: frequency and implications for tamoxifen therapy. Mod Pathol. 2005 May;18(5):615-20. | CrossRef | PubMed |
Collins LC, Schnitt SJ. HER2 protein overexpression in estrogen receptor-positive ductal carcinoma in situ of the breast: frequency and implications for tamoxifen therapy. Mod Pathol. 2005 May;18(5):615-20. | CrossRef | PubMed | Crispo A, D'Aiuto G, De Marco M, Rinaldo M, Grimaldi M, Capasso I, et al. Gail model risk factors: impact of adding an extended family history for breast cancer. Breast J. 2008 May-Jun;14(3):221-7. Epub 2008 Mar 26. | CrossRef | PubMed |
Crispo A, D'Aiuto G, De Marco M, Rinaldo M, Grimaldi M, Capasso I, et al. Gail model risk factors: impact of adding an extended family history for breast cancer. Breast J. 2008 May-Jun;14(3):221-7. Epub 2008 Mar 26. | CrossRef | PubMed | Cuzick J, Forbes JF, Sestak I, Cawthorn S, Hamed H, Holli K, et al. Long-term results of tamoxifen prophylaxis for breast cancer--96-month follow-up of the randomized IBIS-I trial. J Natl Cancer Inst. 2007 Feb 21;99(4):272-82. | CrossRef | PubMed |
Cuzick J, Forbes JF, Sestak I, Cawthorn S, Hamed H, Holli K, et al. Long-term results of tamoxifen prophylaxis for breast cancer--96-month follow-up of the randomized IBIS-I trial. J Natl Cancer Inst. 2007 Feb 21;99(4):272-82. | CrossRef | PubMed | Dabbs DJ, Johnson R. The optimal number of sentinel lymph nodes for focused pathologic examination. Breast J. 2004 May-Jun;10(3):186-9. | CrossRef | PubMed |
Dabbs DJ, Johnson R. The optimal number of sentinel lymph nodes for focused pathologic examination. Breast J. 2004 May-Jun;10(3):186-9. | CrossRef | PubMed | De Tavassoli FA, Devilee P. World Health Organization Classification of Tumors. Pathology and Genetics: Tumors of the reast and Female Genital Organs. Lyon: IARC Press, 2001.
De Tavassoli FA, Devilee P. World Health Organization Classification of Tumors. Pathology and Genetics: Tumors of the reast and Female Genital Organs. Lyon: IARC Press, 2001.  Decarli A, Calza S, Masala G, Specchia C, Palli D, Gail MH. Gail model for prediction of absolute risk of invasive breast cancer: independent evaluation in the Florence-European Prospective Investigation Into Cancer and Nutrition cohort. J Natl Cancer Inst. 2006 Dec 6;98(23):1686-93. | CrossRef | PubMed |
Decarli A, Calza S, Masala G, Specchia C, Palli D, Gail MH. Gail model for prediction of absolute risk of invasive breast cancer: independent evaluation in the Florence-European Prospective Investigation Into Cancer and Nutrition cohort. J Natl Cancer Inst. 2006 Dec 6;98(23):1686-93. | CrossRef | PubMed | Dershaw DD. Mammographic screening of the high-risk woman. Am J Surg. 2000 Oct;180(4):288-9. | CrossRef | PubMed |
Dershaw DD. Mammographic screening of the high-risk woman. Am J Surg. 2000 Oct;180(4):288-9. | CrossRef | PubMed | Dershaw DD. Does LCIS or ALH without other high-risk lesions diagnosed on core biopsy require surgical excision? Breast J. 2003 Jan-Feb;9(1):1-3. | CrossRef | PubMed |
Dershaw DD. Does LCIS or ALH without other high-risk lesions diagnosed on core biopsy require surgical excision? Breast J. 2003 Jan-Feb;9(1):1-3. | CrossRef | PubMed | Dershaw DD, Yahalom J, Petrek JA. Breast carcinoma in women previously treated for Hodgkin disease: mammographic evaluation. Radiology. 1992 Aug;184(2):421-3. | PubMed |
Dershaw DD, Yahalom J, Petrek JA. Breast carcinoma in women previously treated for Hodgkin disease: mammographic evaluation. Radiology. 1992 Aug;184(2):421-3. | PubMed | Di Saverio S, Catena F, Santini D, Ansaloni L, Fogacci T, Mignani S, et al. 259 Patients with DCIS of the breast applying USC/Van Nuys prognostic index: a retrospective review with long term follow up. Breast Cancer Res Treat. 2008 Jun;109(3):405-16. Epub 2007 Aug 9. | CrossRef | PubMed |
Di Saverio S, Catena F, Santini D, Ansaloni L, Fogacci T, Mignani S, et al. 259 Patients with DCIS of the breast applying USC/Van Nuys prognostic index: a retrospective review with long term follow up. Breast Cancer Res Treat. 2008 Jun;109(3):405-16. Epub 2007 Aug 9. | CrossRef | PubMed | Eerola H, Heikkilä P, Tamminen A, Aittomäki K, Blomqvist C, Nevanlinna H. Histopathological features of breast tumours in BRCA1, BRCA2 and mutation-negative breast cancer families. Breast Cancer Res. 2005;7(1):R93-100. Epub 2004 Nov 19. | CrossRef | PubMed | PMC |
Eerola H, Heikkilä P, Tamminen A, Aittomäki K, Blomqvist C, Nevanlinna H. Histopathological features of breast tumours in BRCA1, BRCA2 and mutation-negative breast cancer families. Breast Cancer Res. 2005;7(1):R93-100. Epub 2004 Nov 19. | CrossRef | PubMed | PMC | Elsheikh TM, Silverman JF. Follow-up surgical excision is indicated when breast core needle biopsies show atypical lobular hyperplasia or lobular carcinoma in situ: a correlative study of 33 patients with review of the literature. Am J Surg Pathol. 2005 Apr;29(4):534-43. | CrossRef | PubMed |
Elsheikh TM, Silverman JF. Follow-up surgical excision is indicated when breast core needle biopsies show atypical lobular hyperplasia or lobular carcinoma in situ: a correlative study of 33 patients with review of the literature. Am J Surg Pathol. 2005 Apr;29(4):534-43. | CrossRef | PubMed | Fisher B, Costantino JP, Wickerham DL, Cecchini RS, Cronin WM, Robidoux A, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst. 2005 Nov 16;97(22):1652-62. | CrossRef | PubMed |
Fisher B, Costantino JP, Wickerham DL, Cecchini RS, Cronin WM, Robidoux A, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst. 2005 Nov 16;97(22):1652-62. | CrossRef | PubMed | Fournier A, Berrino F, Riboli E, Avenel V, Clavel-Chapelon F. Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort. Int J Cancer. 2005 Apr 10;114(3):448-54. | CrossRef | PubMed |
Fournier A, Berrino F, Riboli E, Avenel V, Clavel-Chapelon F. Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort. Int J Cancer. 2005 Apr 10;114(3):448-54. | CrossRef | PubMed | Gilleard O, Goodman A, Cooper M, Davies M, Dunn J. The significance of the Van Nuys prognostic index in the management of ductal carcinoma in situ. World J Surg Oncol. 2008 Jun 18;6:61. | CrossRef | PubMed | PMC |
Gilleard O, Goodman A, Cooper M, Davies M, Dunn J. The significance of the Van Nuys prognostic index in the management of ductal carcinoma in situ. World J Surg Oncol. 2008 Jun 18;6:61. | CrossRef | PubMed | PMC | Gómez F. Evaluación cuantitativa del riesgo de cáncer de mama. Rev Rev. Med. Clin. Condes - 2006; 17(4): 149 – 63. | Link |
Gómez F. Evaluación cuantitativa del riesgo de cáncer de mama. Rev Rev. Med. Clin. Condes - 2006; 17(4): 149 – 63. | Link | Habel LA, Shak S, Jacobs MK, Capra A, Alexander C, Pho M, et al. A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients. Breast Cancer Res. 2006;8(3):R25. Epub 2006 May 31. | CrossRef | PubMed | PMC |
Habel LA, Shak S, Jacobs MK, Capra A, Alexander C, Pho M, et al. A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients. Breast Cancer Res. 2006;8(3):R25. Epub 2006 May 31. | CrossRef | PubMed | PMC | Harris EE, Solin LJ. The Diagnosis and Treatment of Ductal Carcinoma In Situ of the Breast. Breast J. 2000 Mar;6(2):78-95. | CrossRef | PubMed |
Harris EE, Solin LJ. The Diagnosis and Treatment of Ductal Carcinoma In Situ of the Breast. Breast J. 2000 Mar;6(2):78-95. | CrossRef | PubMed | Harris L, Fritsche H, Mennel R, Norton L, Ravdin P, Taube S, et al. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer. J Clin Oncol. 2007 Nov 20;25(33):5287-312. Epub 2007 Oct 22. | CrossRef | PubMed |
Harris L, Fritsche H, Mennel R, Norton L, Ravdin P, Taube S, et al. American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer. J Clin Oncol. 2007 Nov 20;25(33):5287-312. Epub 2007 Oct 22. | CrossRef | PubMed | Honrado E, Benítez J, Palacios J. The molecular pathology of hereditary breast cancer: genetic testing and therapeutic implications. Mod Pathol. 2005 Oct;18(10):1305-20. | CrossRef | PubMed |
Honrado E, Benítez J, Palacios J. The molecular pathology of hereditary breast cancer: genetic testing and therapeutic implications. Mod Pathol. 2005 Oct;18(10):1305-20. | CrossRef | PubMed | Jacobi CE, de Bock GH, Siegerink B, van Asperen CJ. Differences and similarities in breast cancer risk assessment models in clinical practice: which model to choose? Breast Cancer Res Treat. 2009 May;115(2):381-90. Epub 2008 May 30. | CrossRef | PubMed |
Jacobi CE, de Bock GH, Siegerink B, van Asperen CJ. Differences and similarities in breast cancer risk assessment models in clinical practice: which model to choose? Breast Cancer Res Treat. 2009 May;115(2):381-90. Epub 2008 May 30. | CrossRef | PubMed | Jacobs TW. Recently Recognized Variants of Lobular Carcinoma In Situ (LCIS) With an Emphasis on Management of LCIS on Core Needle Biopsy. Pathology Case Review. 2003; 8(5): 211-19.
Jacobs TW. Recently Recognized Variants of Lobular Carcinoma In Situ (LCIS) With an Emphasis on Management of LCIS on Core Needle Biopsy. Pathology Case Review. 2003; 8(5): 211-19.  Jirström K, Ringberg A, Fernö M, Anagnostaki L, Landberg G. Tissue microarray analyses of G1/S-regulatory proteins in ductal carcinoma in situ of the breast indicate that low cyclin D1 is associated with local recurrence. Br J Cancer. 2003 Nov 17;89(10):1920-6. | CrossRef | PubMed | PMC |
Jirström K, Ringberg A, Fernö M, Anagnostaki L, Landberg G. Tissue microarray analyses of G1/S-regulatory proteins in ductal carcinoma in situ of the breast indicate that low cyclin D1 is associated with local recurrence. Br J Cancer. 2003 Nov 17;89(10):1920-6. | CrossRef | PubMed | PMC | Kaas R, Verhoef S, Wesseling J, Rookus MA, Oldenburg HS, Peeters MJ, et al. Prophylactic mastectomy in BRCA1 and BRCA2 mutation carriers: very low risk for subsequent breast cancer. Ann Surg. 2010 Mar;251(3):488-92. | CrossRef | PubMed |
Kaas R, Verhoef S, Wesseling J, Rookus MA, Oldenburg HS, Peeters MJ, et al. Prophylactic mastectomy in BRCA1 and BRCA2 mutation carriers: very low risk for subsequent breast cancer. Ann Surg. 2010 Mar;251(3):488-92. | CrossRef | PubMed | Karabakhtsian RG, Johnson R, Sumkin J, Dabbs DJ. The clinical significance of lobular neoplasia on breast core biopsy. Am J Surg Pathol. 2007 May;31(5):717-23. | CrossRef | PubMed |
Karabakhtsian RG, Johnson R, Sumkin J, Dabbs DJ. The clinical significance of lobular neoplasia on breast core biopsy. Am J Surg Pathol. 2007 May;31(5):717-23. | CrossRef | PubMed | Kauff ND, Domchek SM, Friebel TM, Robson ME, Lee J, Garber JE, et al. Risk-reducing salpingo-oophorectomy for the prevention of BRCA1- and BRCA2-associated breast and gynecologic cancer: a multicenter, prospective study. J Clin Oncol. 2008 Mar 10;26(8):1331-7. Epub 2008 Feb 11. | CrossRef | PubMed |
Kauff ND, Domchek SM, Friebel TM, Robson ME, Lee J, Garber JE, et al. Risk-reducing salpingo-oophorectomy for the prevention of BRCA1- and BRCA2-associated breast and gynecologic cancer: a multicenter, prospective study. J Clin Oncol. 2008 Mar 10;26(8):1331-7. Epub 2008 Feb 11. | CrossRef | PubMed | Khan SA, Wiley EL, Rodriguez N, Baird C, Ramakrishnan R, Nayar R, et al. Ductal lavage findings in women with known breast cancer undergoing mastectomy. J Natl Cancer Inst. 2004 Oct 20;96(20):1510-7. | CrossRef | PubMed |
Khan SA, Wiley EL, Rodriguez N, Baird C, Ramakrishnan R, Nayar R, et al. Ductal lavage findings in women with known breast cancer undergoing mastectomy. J Natl Cancer Inst. 2004 Oct 20;96(20):1510-7. | CrossRef | PubMed | King MC, Wieand S, Hale K, Lee M, Walsh T, Owens K, et al. Tamoxifen and breast cancer incidence among women with inherited mutations in BRCA1 and BRCA2: National Surgical Adjuvant Breast and Bowel Project (NSABP-P1) Breast Cancer Prevention Trial. JAMA. 2001 Nov 14;286(18):2251-6. | CrossRef | PubMed |
King MC, Wieand S, Hale K, Lee M, Walsh T, Owens K, et al. Tamoxifen and breast cancer incidence among women with inherited mutations in BRCA1 and BRCA2: National Surgical Adjuvant Breast and Bowel Project (NSABP-P1) Breast Cancer Prevention Trial. JAMA. 2001 Nov 14;286(18):2251-6. | CrossRef | PubMed | Komenaka IK, Ditkoff BA, Joseph KA, Russo D, Gorroochurn P, Ward M, et al. The development of interval breast malignancies in patients with BRCA mutations. Cancer. 2004 May 15;100(10):2079-83. | CrossRef | PubMed |
Komenaka IK, Ditkoff BA, Joseph KA, Russo D, Gorroochurn P, Ward M, et al. The development of interval breast malignancies in patients with BRCA mutations. Cancer. 2004 May 15;100(10):2079-83. | CrossRef | PubMed | Kuerer HM, Albarracin CT, Yang WT, Cardiff RD, Brewster AM, Symmans WF, et al. Ductal carcinoma in situ: state of the science and roadmap to advance the field. J Clin Oncol. 2009 Jan 10;27(2):279-88. Epub 2008 Dec 8. | CrossRef | PubMed |
Kuerer HM, Albarracin CT, Yang WT, Cardiff RD, Brewster AM, Symmans WF, et al. Ductal carcinoma in situ: state of the science and roadmap to advance the field. J Clin Oncol. 2009 Jan 10;27(2):279-88. Epub 2008 Dec 8. | CrossRef | PubMed | Liberman L, Sama M, Susnik B, Rosen PP, LaTrenta LR, Morris EA, et al. Lobular carcinoma in situ at percutaneous breast biopsy: surgical biopsy findings. AJR Am J Roentgenol. 1999 Aug;173(2):291-9. | PubMed |
Liberman L, Sama M, Susnik B, Rosen PP, LaTrenta LR, Morris EA, et al. Lobular carcinoma in situ at percutaneous breast biopsy: surgical biopsy findings. AJR Am J Roentgenol. 1999 Aug;173(2):291-9. | PubMed | Livasy CA, Karaca G, Nanda R, Tretiakova MS, Olopade OI, Moore DT, et al. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma. Mod Pathol. 2006 Feb;19(2):264-71. | CrossRef | PubMed |
Livasy CA, Karaca G, Nanda R, Tretiakova MS, Olopade OI, Moore DT, et al. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma. Mod Pathol. 2006 Feb;19(2):264-71. | CrossRef | PubMed | Locke I, Mitchell G, Eeles R. Ductal approaches to assessment and management of women at high risk for developing breast cancer. Breast Cancer Res. 2004;6(2):75-81. Epub 2004 Jan 26. | CrossRef | PubMed | PMC |
Locke I, Mitchell G, Eeles R. Ductal approaches to assessment and management of women at high risk for developing breast cancer. Breast Cancer Res. 2004;6(2):75-81. Epub 2004 Jan 26. | CrossRef | PubMed | PMC | Longacre TA, Ennis M, Quenneville LA, Bane AL, Bleiweiss IJ, Carter BA, et al. Interobserver agreement and reproducibility in classification of invasive breast carcinoma: an NCI breast cancer family registry study. Mod Pathol. 2006 Feb;19(2):195-207. | CrossRef | PubMed |
Longacre TA, Ennis M, Quenneville LA, Bane AL, Bleiweiss IJ, Carter BA, et al. Interobserver agreement and reproducibility in classification of invasive breast carcinoma: an NCI breast cancer family registry study. Mod Pathol. 2006 Feb;19(2):195-207. | CrossRef | PubMed | Lord SJ, Lei W, Craft P, Cawson JN, Morris I, Walleser S, et al. A systematic review of the effectiveness of magnetic resonance imaging (MRI) as an addition to mammography and ultrasound in screening young women at high risk of breast cancer. Eur J Cancer. 2007 Sep;43(13):1905-17. Epub 2007 Aug 2. | CrossRef | PubMed |
Lord SJ, Lei W, Craft P, Cawson JN, Morris I, Walleser S, et al. A systematic review of the effectiveness of magnetic resonance imaging (MRI) as an addition to mammography and ultrasound in screening young women at high risk of breast cancer. Eur J Cancer. 2007 Sep;43(13):1905-17. Epub 2007 Aug 2. | CrossRef | PubMed | Lux MP, Fasching PA, Beckmann MW. Hereditary breast and ovarian cancer: review and future perspectives. J Mol Med (Berl). 2006 Jan;84(1):16-28. Epub 2005 Nov 11. | PubMed |
Lux MP, Fasching PA, Beckmann MW. Hereditary breast and ovarian cancer: review and future perspectives. J Mol Med (Berl). 2006 Jan;84(1):16-28. Epub 2005 Nov 11. | PubMed | Lyman GH, Cosler LE, Kuderer NM, Hornberger J. Impact of a 21-gene RT-PCR assay on treatment decisions in early-stage breast cancer: an economic analysis based on prognostic and predictive validation studies. Cancer. 2007 Mar 15;109(6):1011-8. | CrossRef | PubMed |
Lyman GH, Cosler LE, Kuderer NM, Hornberger J. Impact of a 21-gene RT-PCR assay on treatment decisions in early-stage breast cancer: an economic analysis based on prognostic and predictive validation studies. Cancer. 2007 Mar 15;109(6):1011-8. | CrossRef | PubMed | Mariuzzi L, Mombello A, Granchelli G, Rucco V, Tarocco E, Frank D, et al. Quantitative study of breast cancer progression: different pathways for various in situ cancers. Mod Pathol. 2002 Jan;15(1):18-25. | CrossRef | PubMed |
Mariuzzi L, Mombello A, Granchelli G, Rucco V, Tarocco E, Frank D, et al. Quantitative study of breast cancer progression: different pathways for various in situ cancers. Mod Pathol. 2002 Jan;15(1):18-25. | CrossRef | PubMed | Martin RF. Surgical Clinics of North America. Surg Clin N Am 87. 2007.
Martin RF. Surgical Clinics of North America. Surg Clin N Am 87. 2007.  Martino S, Cauley JA, Barrett-Connor E, Powles TJ, Mershon J, Disch D, et al. Continuing outcomes relevant to Evista: breast cancer incidence in postmenopausal osteoporotic women in a randomized trial of raloxifene. J Natl Cancer Inst. 2004 Dec 1;96(23):1751-61. | CrossRef | PubMed |
Martino S, Cauley JA, Barrett-Connor E, Powles TJ, Mershon J, Disch D, et al. Continuing outcomes relevant to Evista: breast cancer incidence in postmenopausal osteoporotic women in a randomized trial of raloxifene. J Natl Cancer Inst. 2004 Dec 1;96(23):1751-61. | CrossRef | PubMed | McTiernan A. Behavioral risk factors in breast cancer: can risk be modified? Oncologist. 2003;8(4):326-34. | CrossRef | PubMed |
McTiernan A. Behavioral risk factors in breast cancer: can risk be modified? Oncologist. 2003;8(4):326-34. | CrossRef | PubMed | Middleton LP, Grant S, Stephens T, Stelling CB, Sneige N, Sahin AA. Lobular carcinoma in situ diagnosed by core needle biopsy: when should it be excised? Mod Pathol. 2003 Feb;16(2):120-9. | CrossRef | PubMed |
Middleton LP, Grant S, Stephens T, Stelling CB, Sneige N, Sahin AA. Lobular carcinoma in situ diagnosed by core needle biopsy: when should it be excised? Mod Pathol. 2003 Feb;16(2):120-9. | CrossRef | PubMed | Norum J, Hagen AI, Maehle L, Apold J, Burn J, Møller P. Prophylactic bilateral salpingo-oophorectomy (PBSO) with or without prophylactic bilateral mastectomy (PBM) or no intervention in BRCA1 mutation carriers: a cost-effectiveness analysis. Eur J Cancer. 2008 May;44(7):963-71. Epub 2008 Mar 24. | CrossRef | PubMed |
Norum J, Hagen AI, Maehle L, Apold J, Burn J, Møller P. Prophylactic bilateral salpingo-oophorectomy (PBSO) with or without prophylactic bilateral mastectomy (PBM) or no intervention in BRCA1 mutation carriers: a cost-effectiveness analysis. Eur J Cancer. 2008 May;44(7):963-71. Epub 2008 Mar 24. | CrossRef | PubMed | O'Driscoll D, Warren R, MacKay J, Britton P, Day NE. Screening with breast ultrasound in a population at moderate risk due to family history. J Med Screen. 2001;8(2):106-9. | CrossRef | PubMed |
O'Driscoll D, Warren R, MacKay J, Britton P, Day NE. Screening with breast ultrasound in a population at moderate risk due to family history. J Med Screen. 2001;8(2):106-9. | CrossRef | PubMed | Oratz R, Paul D, Cohn AL, Sedlacek SM. Impact of a commercial reference laboratory test recurrence score on decision making in early-stage breast cancer. J Oncol Pract. 2007 Jul;3(4):182-6. | CrossRef | PubMed | PMC |
Oratz R, Paul D, Cohn AL, Sedlacek SM. Impact of a commercial reference laboratory test recurrence score on decision making in early-stage breast cancer. J Oncol Pract. 2007 Jul;3(4):182-6. | CrossRef | PubMed | PMC | Paik S, Shak S, Tang G, Kim C, Baker J, Cronin M, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med. 2004 Dec 30;351(27):2817-26. Epub 2004 Dec 10. | CrossRef | PubMed |
Paik S, Shak S, Tang G, Kim C, Baker J, Cronin M, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med. 2004 Dec 30;351(27):2817-26. Epub 2004 Dec 10. | CrossRef | PubMed | Peralta O, Reyes JM. Quimioprevención en cáncer de mama. Rev. Med. Clin. Condes - 2006; 17(4): 186 – 93. | Link |
Peralta O, Reyes JM. Quimioprevención en cáncer de mama. Rev. Med. Clin. Condes - 2006; 17(4): 186 – 93. | Link | Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, et al. Molecular portraits of human breast tumours. Nature. 2000 Aug 17;406(6797):747-52. | CrossRef | PubMed |
Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, et al. Molecular portraits of human breast tumours. Nature. 2000 Aug 17;406(6797):747-52. | CrossRef | PubMed | Plevritis SK, Kurian AW, Sigal BM, Daniel BL, Ikeda DM, Stockdale FE, et al. Cost-effectiveness of screening BRCA1/2 mutation carriers with breast magnetic resonance imaging. JAMA. 2006 May 24;295(20):2374-84. | CrossRef | PubMed |
Plevritis SK, Kurian AW, Sigal BM, Daniel BL, Ikeda DM, Stockdale FE, et al. Cost-effectiveness of screening BRCA1/2 mutation carriers with breast magnetic resonance imaging. JAMA. 2006 May 24;295(20):2374-84. | CrossRef | PubMed | Rock CL, Demark-Wahnefried W. Can lifestyle modification increase survival in women diagnosed with breast cancer? J Nutr. 2002 Nov;132(11 Suppl):3504S-3507S. | PubMed |
Rock CL, Demark-Wahnefried W. Can lifestyle modification increase survival in women diagnosed with breast cancer? J Nutr. 2002 Nov;132(11 Suppl):3504S-3507S. | PubMed | Ross JS, Hatzis C, Symmans WF, Pusztai L, Hortobágyi GN. Commercialized multigene predictors of clinical outcome for breast cancer. Oncologist. 2008 May;13(5):477-93. | CrossRef | PubMed |
Ross JS, Hatzis C, Symmans WF, Pusztai L, Hortobágyi GN. Commercialized multigene predictors of clinical outcome for breast cancer. Oncologist. 2008 May;13(5):477-93. | CrossRef | PubMed | Saslow D, Boetes C, Burke W, Harms S, Leach MO, Lehman CD, et al. American Cancer Society guidelines for breast screening with MRI as an adjunct to mammography. CA Cancer J Clin. 2007 Mar-Apr;57(2):75-89. | CrossRef | PubMed |
Saslow D, Boetes C, Burke W, Harms S, Leach MO, Lehman CD, et al. American Cancer Society guidelines for breast screening with MRI as an adjunct to mammography. CA Cancer J Clin. 2007 Mar-Apr;57(2):75-89. | CrossRef | PubMed | Schrading S, Kuhl CK. Mammographic, US, and MR imaging phenotypes of familial breast cancer. Radiology. 2008 Jan;246(1):58-70. | PubMed |
Schrading S, Kuhl CK. Mammographic, US, and MR imaging phenotypes of familial breast cancer. Radiology. 2008 Jan;246(1):58-70. | PubMed | Schwartz GF, Hughes KS, Lynch HT, Fabian CJ, Fentiman IS, Robson ME, et al. Proceedings of the international consensus conference on breast cancer risk, genetics, & risk management, April, 2007. Cancer. 2008 Nov 15;113(10):2627-37. | CrossRef | PubMed |
Schwartz GF, Hughes KS, Lynch HT, Fabian CJ, Fentiman IS, Robson ME, et al. Proceedings of the international consensus conference on breast cancer risk, genetics, & risk management, April, 2007. Cancer. 2008 Nov 15;113(10):2627-37. | CrossRef | PubMed | Shin SJ, Rosen PP. Excisional biopsy should be performed if lobular carcinoma in situ is seen on needle core biopsy. Arch Pathol Lab Med. 2002 Jun;126(6):697-701. | PubMed |
Shin SJ, Rosen PP. Excisional biopsy should be performed if lobular carcinoma in situ is seen on needle core biopsy. Arch Pathol Lab Med. 2002 Jun;126(6):697-701. | PubMed | Sloane JP, Amendoeira I, Apostolikas N, Bellocq JP, Bianchi S, Boecker W, et al. Consistency achieved by 23 European pathologists in categorizing ductal carcinoma in situ of the breast using five classifications. European Commission Working Group on Breast Screening Pathology. Hum Pathol. 1998 Oct;29(10):1056-62. | PubMed |
Sloane JP, Amendoeira I, Apostolikas N, Bellocq JP, Bianchi S, Boecker W, et al. Consistency achieved by 23 European pathologists in categorizing ductal carcinoma in situ of the breast using five classifications. European Commission Working Group on Breast Screening Pathology. Hum Pathol. 1998 Oct;29(10):1056-62. | PubMed | Sørlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A. 2001 Sep 11;98(19):10869-74. | CrossRef | PubMed | PMC |
Sørlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A. 2001 Sep 11;98(19):10869-74. | CrossRef | PubMed | PMC | Suzuki R, Ye W, Rylander-Rudqvist T, Saji S, Colditz GA, Wolk A. Alcohol and postmenopausal breast cancer risk defined by estrogen and progesterone receptor status: a prospective cohort study. J Natl Cancer Inst. 2005 Nov 2;97(21):1601-8. | CrossRef | PubMed |
Suzuki R, Ye W, Rylander-Rudqvist T, Saji S, Colditz GA, Wolk A. Alcohol and postmenopausal breast cancer risk defined by estrogen and progesterone receptor status: a prospective cohort study. J Natl Cancer Inst. 2005 Nov 2;97(21):1601-8. | CrossRef | PubMed | Veltman J, Mann R, Kok T, Obdeijn IM, Hoogerbrugge N, Blickman JG, et al. Breast tumor characteristics of BRCA1 and BRCA2 gene mutation carriers on MRI. Eur Radiol. 2008 May;18(5):931-8. Epub 2008 Feb 13. | CrossRef | PubMed | PMC |
Veltman J, Mann R, Kok T, Obdeijn IM, Hoogerbrugge N, Blickman JG, et al. Breast tumor characteristics of BRCA1 and BRCA2 gene mutation carriers on MRI. Eur Radiol. 2008 May;18(5):931-8. Epub 2008 Feb 13. | CrossRef | PubMed | PMC | Vogel VG. Management of the high-risk patient. Surg Clin North Am. 2003 Aug;83(4):733-51. | CrossRef | PubMed |
Vogel VG. Management of the high-risk patient. Surg Clin North Am. 2003 Aug;83(4):733-51. | CrossRef | PubMed | Vogel VG, Costantino JP, Wickerham DL, Cronin WM, Cecchini RS, Atkins JN, et al. Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial. JAMA. 2006 Jun 21;295(23):2727-41. Epub 2006 Jun 5. | CrossRef | PubMed |
Vogel VG, Costantino JP, Wickerham DL, Cronin WM, Cecchini RS, Atkins JN, et al. Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial. JAMA. 2006 Jun 21;295(23):2727-41. Epub 2006 Jun 5. | CrossRef | PubMed | Warner E, Messersmith H, Causer P, Eisen A, Shumak R, Plewes D. Systematic review: using magnetic resonance imaging to screen women at high risk for breast cancer. Ann Intern Med. 2008 May 6;148(9):671-9. | PubMed |
Warner E, Messersmith H, Causer P, Eisen A, Shumak R, Plewes D. Systematic review: using magnetic resonance imaging to screen women at high risk for breast cancer. Ann Intern Med. 2008 May 6;148(9):671-9. | PubMed | Worsham MJ, Abrams J, Raju U, Kapke A, Lu M, Cheng J, et al. Breast cancer incidence in a cohort of women with benign breast disease from a multiethnic, primary health care population. Breast J. 2007 Mar-Apr;13(2):115-21. | CrossRef | PubMed | PMC |
Worsham MJ, Abrams J, Raju U, Kapke A, Lu M, Cheng J, et al. Breast cancer incidence in a cohort of women with benign breast disease from a multiethnic, primary health care population. Breast J. 2007 Mar-Apr;13(2):115-21. | CrossRef | PubMed | PMC | Zagouri F, Sergentanis TN, Zografos GC. Precursors and preinvasive lesions of the breast: the role of molecular prognostic markers in the diagnostic and therapeutic dilemma. World J Surg Oncol. 2007 May 31;5:57. | CrossRef | PubMed | PMC |
Zagouri F, Sergentanis TN, Zografos GC. Precursors and preinvasive lesions of the breast: the role of molecular prognostic markers in the diagnostic and therapeutic dilemma. World J Surg Oncol. 2007 May 31;5:57. | CrossRef | PubMed | PMC |