 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: actualización de normas, seguimiento, cáncer de mama
Introducción
Objetivos Específicos
Síntesis de la Evidencia y Recomendaciones
1. ¿Cuáles son las Recomendaciones Básicas para el Seguimiento?
2. ¿Cuál es el Rol de la Mamografía?
3. ¿Cuánto Tiempo se Debe Extender el Seguimiento?
4. ¿Quién Puede Realizar el Seguimiento?
5. ¿Cómo Influyen las Mutaciones BRCA en el Seguimiento?
6. ¿Cuáles son las Complicaciones Alejadas del Tratamiento?
7. ¿Cuál es el Seguimiento Ginecológico Adecuado?
8. ¿Se Puede Usar Terapia de Reemplazo Hormonal (TRH)?
9. ¿En qué Consiste el Seguimiento luego de una Mastectomía Total?
10. ¿Se Puede Recomendar el Uso de Mastectomía Contralateral Profiláctica (MCP), en Ausencia de Mutaciones de BRCA?
11. ¿Qué Impacto Tienen las Guías para el Seguimiento de Pacientes Tratadas por Cáncer de Mama?
12. ¿Qué Estudios No se Deben Hacer en Pacientes Asintomáticos?
Referencias
El tiempo total de sobrevida luego del tratamiento de un cáncer de mama se divide en el lapso sin enfermedad detectable y el período complementario con enfermedad detectable hasta la muerte. El uso de exámenes de seguimiento en pacientes asintomáticos, salvo para la detección de una recurrencia local potencialmente curable (mamografía y examen físico), no produce aumento de sobrevida global ni mejor calidad de vida, sino tan sólo la migración de una categoría a otra.
Estando la paciente en el grupo de recurrencia sistémica, la curación prácticamente no existe y la sobrevida global no ha sido impactada con los tratamientos disponibles en las últimas 2 décadas: mediana de SV global de 2,5 años; Figura N°1 (Dawood, 2008: Journal of Clinical Oncology, Vol 26, No 30 -October 20-, 2008: pp. 4891-4898). De este modo, el uso indiscriminado de exámenes de rutina en pacientes asintomáticas sólo produce ansiedad, deterioro de la calidad de vida y aumento en los costos del sistema de salud. En este capítulo se revisan las recomendaciones actuales para el seguimiento de pacientes tratadas por un cáncer de mama.
Figura N°1: Sobrevida global y específica de pacientes con cáncer de mama etapa IV.
El objetivo de esta revisión es identificar, sintetizar y evaluar la mejor evidencia disponible para la actualización de las Normas de Seguimiento de Pacientes Tratadas por Cáncer de Mama (etapas 0-III) a partir de lo señalado en el Consenso de Cáncer de Mama del año 2003.
Para esto se revisaron las siguientes preguntas:
Síntesis de la evidencia:
El principal objetivo del seguimiento es reconocer las recurrencias locales potencialmente curables en pacientes tratadas por cáncer de mama, y la detección de enfermedad metastásica, que por lo general es incurable. En este esfuerzo en pacientes asintomáticas, el 60% de recurrencias son detectadas por las mismas pacientes entre controles y un 40% por examen físico médico y exámenes de rutina (Bock, 2004; Pandya, 1985). Ensayos aleatorizados no han demostrado diferencia en sobrevida entre las pacientes seguidas con examen físico y mamografía comparadas con aquéllas incluidas en sistemas de seguimientos más intensivos que asocian test de laboratorio y estudios de imágenes (GIVIO, 1994; Rojas, 2005; Rosselli Del Turco, 1994; Joseph, 1998).
Nivel de evidencia I.
La tasa esperada de recurrencia oscila entre 1% y 1,5% por año, siendo el segundo año del seguimiento el de mayor diagnóstico de recurrencias sistémicas. Las pacientes con recurrencia mamaria clínica tienen peor pronóstico que las pacientes con recurrencias detectadas por mamografía (Montgomery, 2007).
Nivel de evidencia II.
Recomendación:
Síntesis de la evidencia:
La mamografía muy probablemente ayuda al diagnóstico de lesiones más tempranas (< de 1 cm o DCIS) de cáncer metacrónico (Mellink, 1991). Sin embargo, el método de detección de recurrencia ipsilateral no afecta la sobrevida global. El diagnóstico de cáncer contralateral ocurre en etapas más tempranas que el primario original en las pacientes seguidas con mamografía (Grunfeld, 2002). Cada mamografía adicional durante el seguimiento se asocia con una disminución de 0,69 veces en la probabilidad de morir por cáncer. La protección es más fuerte en pacientes inicialmente tratadas en etapa I, sometidas a mastectomía y las de mayor edad (Lash, 2007). Las recurrencias sólo mamográficas son de menor tamaño (Orel, 1993). El uso de mamografía de seguimiento decae con el tiempo, especialmente en pacientes con comorbilidades o tratadas con mastectomía (Doubeni, 2006). El riesgo contralateral es bajo y cuando ocurre no se afecta la sobrevida global (Fisher, 1984).
Nivel de evidencia II.
Recomendación:
Síntesis de la evidencia:
El seguimiento se debería extender por largo tiempo, probablemente de por vida (EBCTCG, 2005; Hayes, 2007).
Nivel de evidencia I.
Adquiere especial relevancia en la detección de recurrencias locales o primarios contralaterales luego de pasados los 5 primeros años después del tratamiento sin la aparición de enfermedad metastásica (Schootman, 2008; Burstein, 2000; Stierer, 1989). El riesgo de recurrencia local o un primario contralateral es estable en el tiempo (Jatoi, 2005). El 50% de las pacientes que desarrollarán metástasis ocurren en los primeros 5 años cuando RE- y en los primeros 10 años cuando RE+ (Kattlove, 2003).
Nivel de evidencia II.
Recomendación:
Síntesis de la evidencia:
La mayoría de las pacientes tratadas por un cáncer de mama sobreviven largo tiempo o se curan de su enfermedad (Hayes, 2007). Eso produce un gran número de pacientes que deben ser seguidas por mucho tiempo. En los sistemas en que se produce una sobrecarga de los recursos especializados se podría entrenar a médicos generales para realizar el seguimiento específico y esto tendría buenos resultados; ensayos aleatorios no han encontrado diferencias en pronóstico con seguimiento por especialista o médico de familia especialmente entrenados para este propósito (Grunfeld, 1999; Grunfeld 2006).
Nivel de evidencia I.
Recomendación:
Síntesis de la evidencia:
La presencia de mutaciones de BRCA aumenta el riesgo de recurrencia local y de cáncer contralateral. Además, están asociadas a mayor riesgo de desarrollar cáncer de ovario y próstata (Struewing, 1997; Modan, 2001).
Nivel de evidencia II.
Recomendaciones:
Síntesis de la evidencia:
El seguimiento debe considerar la detección de complicaciones alejadas del tratamiento como: bochornos y síntomas relacionados a la deprivación de estrógenos (Grunfeld, 2005); osteoporosis y su asociación con inhibidores de aromatasa (Brown, 2002; Perez, 2006; Hillner, 2003; Bundred, 2008); linfedema de brazo en pacientes sometidas a una disección axilar, especialmente si se ha asociado radioterapia a la axila y a la fosa supraclavicular (prevalencia entre 10% y 40%); alza de peso en relación a la quimioterapia y el tratamiento adyuvante que induce menopausia; alteraciones cognitivas y neoplasias hematológicas secundarias a quimioterapia (Ahles, 2002).
Nivel de evidencia I-II.
Recomendaciones:
Síntesis de la evidencia:
En pacientes asintomáticas que se encuentran tomando tamoxifeno, el uso de ecografía transvaginal de rutina se asocia a un alto índice de falsos positivos, produce procedimientos innecesarios y no se recomienda su uso en ausencia de metrorragia (Geber, 2000). En ausencia de síntomas específicos basta el examen ginecológico anual (Khatcheressian, 2006).
Nivel de evidencia II.
Recomendaciones:
Síntesis de la evidencia:
En una revisión sistemática de estudios observacionales para cuantificar el riesgo de recurrencia de cáncer de mama relacionado con TRH, se estimó que el uso de TRH no parece aumentar el riesgo de recurrencia de un cáncer de mama tratado (Col, 2001). En un estudio de casos y controles, se observó una menor recurrencia y mortalidad por cáncer de mama en las pacientes USUARIAS de TRH (O´Meara, 2001).
Nivel de evidencia II.
Por otro lado, el estudio WHI confirmó el aumento de riesgo de desarrollar cáncer de mama en TRH con asociación de estrógenos + progestinas (Rossouw, 2002; WHI Group). En estudios aleatorios que evalúan el riesgo de recurrencia de cáncer en pacientes postmenopáusicas al momento del tratamiento de su cáncer mamario, tratadas con tamoxifeno o inhibidores de aromatasa, tanto el uso de estrógenos + progestinas se asoció a mayor riesgo de recurrencia (Holmberg, 2008; HABBITS Study Group), como también el uso de tibolona se asoció a mayor riesgo de recurrencia de cáncer mamario (Kenemans, 2009; LIBERATE Study Group).
Nivel de evidencia I.
Recomendación:
Síntesis de la evidencia:
Cuando se ha realizado una mastectomía total con o sin reconstrucción, la probabilidad de una recurrencia local está asociada al uso de radioterapia postoperatoria. La ausencia de este tratamiento se relaciona con una mayor probabilidad de recurrencia local en las pacientes con tumores de mayor tamaño, un recuento mayor de linfonodos con metástasis, los tumores con RE- y un recuento bajo de linfonodos en la pieza de disección axilar (Recht, 1999).
Nivel de evidencia I.
Recomendación:
Síntesis de la evidencia:
Estudios descriptivos han mostrado que el uso de MCP se casi triplicó en Estados Unidos en un período de 6 años, especialmente para las pacientes cuyo primario requirió una mastectomía, para las pacientes más jóvenes, para las tratadas por un cáncer lobulillar invasor, y para las pacientes con diagnóstico anterior de cáncer mamario (Tuttle, 2007). El grado de satisfacción de las pacientes que optan por esta decisión es, en general, adecuado. La insatisfacción se asocia a las complicaciones derivadas de los procedimientos reconstructivos (Frost, 2005).
Nivel de evidencia III.
Recomendación:
Síntesis de la evidencia:
Existe una gran dispersión en los criterios para el seguimiento de las pacientes tratadas por un cáncer de mama con intención curativa. El uso rutinario de múltiples exámenes de laboratorio e imágenes como práctica habitual en los estudios clínicos controlados hizo extender esa costumbre hacia la práctica médica habitual. Luego de la comprobación de la inutilidad de estos procedimientos fuera de estudios clínicos controlados, ha sido difícil la erradicación de esta costumbre que aumenta enormemente los gastos en salud sin beneficio clínico alguno demostrado. La incorporación de guías clínicas de seguimiento producen una homogenización de la conducta médica y una disminución importante de los costos de salud relacionados (Mille, 2002).
Nivel de evidencia III.
Recomendación:
Síntesis de la evidencia:
Las pacientes con cáncer de mama que participan de protocolos de investigación son sometidas a numerosas evaluaciones periódicamente. Estas evaluaciones son parte del sistema de registro de eventos adversos y del registro de eventos de enfermedad y son parte integral inevitable en los estudios actuales. La extensión de esta práctica dentro de los protocolos de investigación a la práctica clínica habitual no debería ocurrir, debido a que esta última no requiere de la pesquisa de eventos adversos en paciente asintomáticos. En ellos basta con un examen físico adecuado, la educación respecto de síntomas relevantes y una mamografía de buena calidad (Hayes, 2007; Khatcheressian, 2006).
Nivel de evidencia II.
Recomendación:
Exámenes NO recomendados en pacientes asintomáticos:
Este artículo fue redactado en su versión final después de haber recibido las contribuciones y comentarios de los delegados que asistieron a la III Jornada Nacional de Diagnóstico y Tratamiento de Cáncer de Mama, realizada en Coquimbo, Chile, en agosto de 2009. A su vez, las ponencias que se presentaron en esa jornada fueron la síntesis del artículo completo de revisión de la literatura y trabajo previo de la comisión correspondiente. Este trabajo de formulación duró un año, comenzó en junio de 2008 y se llevó a cabo bajo la asesoría de Medwave Estudios Ltda., en el marco del proyecto denominado “Asesoría en la Formulación de Consenso y Recomendaciones en Cáncer de Mama Basados en la Evidencia”. El financiamiento para la ejecución de la asesoría provino de la Sociedad Chilena de Mastología.
La coordinación de la asesoría fue realizada por Vivienne Bachelet; el metodólogo jefe fue Miguel Araujo; y la metodóloga adjunta fue Gabriela Moreno. Colaboró en la sistematización bibliográfica y en el formato final de los documentos, Matías Goyenechea. El artículo definitivo es el resultado del trabajo final presentado a las jornadas de consenso, donde fue conocido, revisado y discutido por los concurrentes, y luego fue revisado por un comité editorial de pares constituido por la misma Sociedad Chilena de Mastología, tras lo cual fue enviado a Medwave para su publicación.

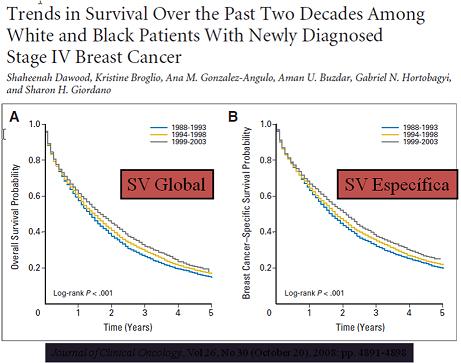 Figura N°1: Sobrevida global y específica de pacientes con cáncer de mama etapa IV.
Figura N°1: Sobrevida global y específica de pacientes con cáncer de mama etapa IV.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Autores:
Enrique Waugh[1], Fernando Gómez[1], Ricardo Schwartz[1]
Autores:
Enrique Waugh[1], Fernando Gómez[1], Ricardo Schwartz[1]

Citación: Waugh E, Gómez F, Schwartz R. Literature review for the update on the guidelines for follow-up of patients treated for breast cancer (stages 0-III). Medwave 2010 Ene;10(01):e4357 doi: 10.5867/medwave.2010.01.4357
Fecha de envío: 17/8/2009
Fecha de aceptación: 28/8/2009
Fecha de publicación: 1/1/2010
Origen: no solicitado
Tipo de revisión: con revisión por pares externa

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Ahles TA, Saykin AJ, Furstenberg CT, Cole B, Mott LA, Skalla K, et al. Neuropsychologic impact of standard-dose systemic chemotherapy in long-term survivors of breast cancer and lymphoma. J Clin Oncol. 2002 Jan 15;20(2):485-93. | CrossRef | PubMed |
Ahles TA, Saykin AJ, Furstenberg CT, Cole B, Mott LA, Skalla K, et al. Neuropsychologic impact of standard-dose systemic chemotherapy in long-term survivors of breast cancer and lymphoma. J Clin Oncol. 2002 Jan 15;20(2):485-93. | CrossRef | PubMed | de Bock GH, Bonnema J, van der Hage J, Kievit J, van de Velde CJ. Effectiveness of routine visits and routine tests in detecting isolated locoregional recurrences after treatment for early-stage invasive breast cancer: a meta-analysis and systematic review. J Clin Oncol. 2004 Oct 1;22(19):4010-8. | CrossRef | PubMed |
de Bock GH, Bonnema J, van der Hage J, Kievit J, van de Velde CJ. Effectiveness of routine visits and routine tests in detecting isolated locoregional recurrences after treatment for early-stage invasive breast cancer: a meta-analysis and systematic review. J Clin Oncol. 2004 Oct 1;22(19):4010-8. | CrossRef | PubMed | Brown JP, Josse RG; Scientific Advisory Council of the Osteoporosis Society of Canada. 2002 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada. CMAJ. 2002 Nov 12;167(10 Suppl):S1-34. | PubMed | PMC |
Brown JP, Josse RG; Scientific Advisory Council of the Osteoporosis Society of Canada. 2002 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada. CMAJ. 2002 Nov 12;167(10 Suppl):S1-34. | PubMed | PMC | Bundred NJ, Campbell ID, Davidson N, DeBoer RH, Eidtmann H, Monnier A, et al. Effective inhibition of aromatase inhibitor-associated bone loss by zoledronic acid in postmenopausal women with early breast cancer receiving adjuvant letrozole: ZO-FAST Study results. Cancer. 2008 Mar 1;112(5):1001-10. | CrossRef | PubMed |
Bundred NJ, Campbell ID, Davidson N, DeBoer RH, Eidtmann H, Monnier A, et al. Effective inhibition of aromatase inhibitor-associated bone loss by zoledronic acid in postmenopausal women with early breast cancer receiving adjuvant letrozole: ZO-FAST Study results. Cancer. 2008 Mar 1;112(5):1001-10. | CrossRef | PubMed | Burstein HJ, Winer EP. Primary care for survivors of breast cancer. N Engl J Med. 2000 Oct 12;343(15):1086-94. | CrossRef | PubMed |
Burstein HJ, Winer EP. Primary care for survivors of breast cancer. N Engl J Med. 2000 Oct 12;343(15):1086-94. | CrossRef | PubMed | Col NF, Hirota LK, Orr RK, Erban JK, Wong JB, Lau J. Hormone replacement therapy after breast cancer: a systematic review and quantitative assessment of risk. J Clin Oncol. 2001 Apr 15;19(8):2357-63. | PubMed |
Col NF, Hirota LK, Orr RK, Erban JK, Wong JB, Lau J. Hormone replacement therapy after breast cancer: a systematic review and quantitative assessment of risk. J Clin Oncol. 2001 Apr 15;19(8):2357-63. | PubMed | Doubeni CA, Field TS, Ulcickas Yood M, Rolnick SJ, Quessenberry CP, Fouayzi H, et al. Patterns and predictors of mammography utilization among breast cancer survivors. Cancer. 2006 Jun 1;106(11):2482-8. | CrossRef | PubMed |
Doubeni CA, Field TS, Ulcickas Yood M, Rolnick SJ, Quessenberry CP, Fouayzi H, et al. Patterns and predictors of mammography utilization among breast cancer survivors. Cancer. 2006 Jun 1;106(11):2482-8. | CrossRef | PubMed | Clarke M, Collins R, Darby S, Davies C, Elphinstone P, Evans E, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet. 2005 Dec 17;366(9503):2087-106. | PubMed |
Clarke M, Collins R, Darby S, Davies C, Elphinstone P, Evans E, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials. Lancet. 2005 Dec 17;366(9503):2087-106. | PubMed | Fisher ER, Fisher B, Sass R, Wickerham L. Pathologic findings from the National Surgical Adjuvant Breast Project (Protocol No. 4). XI. Bilateral breast cancer. Cancer. 1984 Dec 15;54(12):3002-11. | CrossRef | PubMed |
Fisher ER, Fisher B, Sass R, Wickerham L. Pathologic findings from the National Surgical Adjuvant Breast Project (Protocol No. 4). XI. Bilateral breast cancer. Cancer. 1984 Dec 15;54(12):3002-11. | CrossRef | PubMed | Frost MH, Slezak JM, Tran NV, Williams CI, Johnson JL, Woods JE, et al. Satisfaction after contralateral prophylactic mastectomy: the significance of mastectomy type, reconstructive complications, and body appearance. J Clin Oncol. 2005 Nov 1;23(31):7849-56. Epub 2005 Oct 3. | CrossRef | PubMed |
Frost MH, Slezak JM, Tran NV, Williams CI, Johnson JL, Woods JE, et al. Satisfaction after contralateral prophylactic mastectomy: the significance of mastectomy type, reconstructive complications, and body appearance. J Clin Oncol. 2005 Nov 1;23(31):7849-56. Epub 2005 Oct 3. | CrossRef | PubMed | Gerber B, Krause A, Müller H, Reimer T, Külz T, Makovitzky J, et al. Effects of adjuvant tamoxifen on the endometrium in postmenopausal women with breast cancer: a prospective long-term study using transvaginal ultrasound. J Clin Oncol. 2000 Oct 15;18(20):3464-70. | PubMed |
Gerber B, Krause A, Müller H, Reimer T, Külz T, Makovitzky J, et al. Effects of adjuvant tamoxifen on the endometrium in postmenopausal women with breast cancer: a prospective long-term study using transvaginal ultrasound. J Clin Oncol. 2000 Oct 15;18(20):3464-70. | PubMed | Grunfeld E, Gray A, Mant D, Yudkin P, Adewuyi-Dalton R, Coyle D, et al. Follow-up of breast cancer in primary care vs specialist care: results of an economic evaluation. Br J Cancer. 1999 Mar;79(7-8):1227-33. | CrossRef | PubMed | PMC |
Grunfeld E, Gray A, Mant D, Yudkin P, Adewuyi-Dalton R, Coyle D, et al. Follow-up of breast cancer in primary care vs specialist care: results of an economic evaluation. Br J Cancer. 1999 Mar;79(7-8):1227-33. | CrossRef | PubMed | PMC | Grunfeld E, Noorani H, McGahan L, Paszat L, Coyle D, van Walraven C, et al. Surveillance mammography after treatment of primary breast cancer: a systematic review. Breast. 2002 Jun;11(3):228-35. | CrossRef | PubMed |
Grunfeld E, Noorani H, McGahan L, Paszat L, Coyle D, van Walraven C, et al. Surveillance mammography after treatment of primary breast cancer: a systematic review. Breast. 2002 Jun;11(3):228-35. | CrossRef | PubMed | Grunfeld E, Levine MN, Julian JA, Coyle D, Szechtman B, Mirsky D, et al. Randomized trial of long-term follow-up for early-stage breast cancer: a comparison of family physician versus specialist care. J Clin Oncol. 2006 Feb 20;24(6):848-55. Epub 2006 Jan 17. | CrossRef | PubMed |
Grunfeld E, Levine MN, Julian JA, Coyle D, Szechtman B, Mirsky D, et al. Randomized trial of long-term follow-up for early-stage breast cancer: a comparison of family physician versus specialist care. J Clin Oncol. 2006 Feb 20;24(6):848-55. Epub 2006 Jan 17. | CrossRef | PubMed | Grunfeld E, Dhesy-Thind S, Levine M; Steering Committee on Clinical Practice Guidelines for the Care and Treatment of Breast Cancer. Clinical practice guidelines for the care and treatment of breast cancer: follow-up after treatment for breast cancer (summary of the 2005 update). CMAJ. 2005 May 10;172(10):1319-20. | CrossRef | PubMed | PMC |
Grunfeld E, Dhesy-Thind S, Levine M; Steering Committee on Clinical Practice Guidelines for the Care and Treatment of Breast Cancer. Clinical practice guidelines for the care and treatment of breast cancer: follow-up after treatment for breast cancer (summary of the 2005 update). CMAJ. 2005 May 10;172(10):1319-20. | CrossRef | PubMed | PMC | Hayes DF. Clinical practice. Follow-up of patients with early breast cancer. N Engl J Med. 2007 Jun 14;356(24):2505-13. | CrossRef | PubMed |
Hayes DF. Clinical practice. Follow-up of patients with early breast cancer. N Engl J Med. 2007 Jun 14;356(24):2505-13. | CrossRef | PubMed | Hillner BE, Ingle JN, Chlebowski RT, Gralow J, Yee GC, Janjan NA, et al. American Society of Clinical Oncology 2003 update on the role of bisphosphonates and bone health issues in women with breast cancer. J Clin Oncol. 2003 Nov 1;21(21):4042-57. Epub 2003 Sep 8. | CrossRef | PubMed |
Hillner BE, Ingle JN, Chlebowski RT, Gralow J, Yee GC, Janjan NA, et al. American Society of Clinical Oncology 2003 update on the role of bisphosphonates and bone health issues in women with breast cancer. J Clin Oncol. 2003 Nov 1;21(21):4042-57. Epub 2003 Sep 8. | CrossRef | PubMed | Holmberg L, Iversen OE, Rudenstam CM, Hammar M, Kumpulainen E, Jaskiewicz J, et al. Increased risk of recurrence after hormone replacement therapy in breast cancer survivors. J Natl Cancer Inst. 2008 Apr 2;100(7):475-82. Epub 2008 Mar 25. | CrossRef | PubMed |
Holmberg L, Iversen OE, Rudenstam CM, Hammar M, Kumpulainen E, Jaskiewicz J, et al. Increased risk of recurrence after hormone replacement therapy in breast cancer survivors. J Natl Cancer Inst. 2008 Apr 2;100(7):475-82. Epub 2008 Mar 25. | CrossRef | PubMed | Jatoi I, Tsimelzon A, Weiss H, Clark GM, Hilsenbeck SG. Hazard rates of recurrence following diagnosis of primary breast cancer. Breast Cancer Res Treat. 2005 Jan;89(2):173-8. | CrossRef | PubMed |
Jatoi I, Tsimelzon A, Weiss H, Clark GM, Hilsenbeck SG. Hazard rates of recurrence following diagnosis of primary breast cancer. Breast Cancer Res Treat. 2005 Jan;89(2):173-8. | CrossRef | PubMed | Joseph E, Hyacinthe M, Lyman GH, Busch C, Demps L, Reintgen DS, et al. Evaluation of an intensive strategy for follow-up and surveillance of primary breast cancer. Ann Surg Oncol. 1998 Sep;5(6):522-8. | CrossRef | PubMed |
Joseph E, Hyacinthe M, Lyman GH, Busch C, Demps L, Reintgen DS, et al. Evaluation of an intensive strategy for follow-up and surveillance of primary breast cancer. Ann Surg Oncol. 1998 Sep;5(6):522-8. | CrossRef | PubMed | Kattlove H, Winn RJ. Ongoing care of patients after primary treatment for their cancer. CA Cancer J Clin. 2003 May-Jun;53(3):172-96. | CrossRef | PubMed |
Kattlove H, Winn RJ. Ongoing care of patients after primary treatment for their cancer. CA Cancer J Clin. 2003 May-Jun;53(3):172-96. | CrossRef | PubMed | Kenemans P, Bundred NJ, Foidart JM, Kubista E, von Schoultz B, Sismondi P, et al. Safety and efficacy of tibolone in breast-cancer patients with vasomotor symptoms: a double-blind, randomised, non-inferiority trial. Lancet Oncol. 2009 Feb;10(2):135-46. Epub 2009 Jan 23. | CrossRef | PubMed |
Kenemans P, Bundred NJ, Foidart JM, Kubista E, von Schoultz B, Sismondi P, et al. Safety and efficacy of tibolone in breast-cancer patients with vasomotor symptoms: a double-blind, randomised, non-inferiority trial. Lancet Oncol. 2009 Feb;10(2):135-46. Epub 2009 Jan 23. | CrossRef | PubMed | Khatcheressian JL, Wolff AC, Smith TJ, Grunfeld E, Muss HB, Vogel VG, et al. American Society of Clinical Oncology 2006 update of the breast cancer follow-up and management guidelines in the adjuvant setting. J Clin Oncol. 2006 Nov 1;24(31):5091-7. Epub 2006 Oct 10. | CrossRef | PubMed |
Khatcheressian JL, Wolff AC, Smith TJ, Grunfeld E, Muss HB, Vogel VG, et al. American Society of Clinical Oncology 2006 update of the breast cancer follow-up and management guidelines in the adjuvant setting. J Clin Oncol. 2006 Nov 1;24(31):5091-7. Epub 2006 Oct 10. | CrossRef | PubMed | Lash TL, Fox MP, Buist DS, Wei F, Field TS, Frost FJ, et al. Mammography surveillance and mortality in older breast cancer survivors. J Clin Oncol. 2007 Jul 20;25(21):3001-6. Epub 2007 Jun 4. | CrossRef | PubMed |
Lash TL, Fox MP, Buist DS, Wei F, Field TS, Frost FJ, et al. Mammography surveillance and mortality in older breast cancer survivors. J Clin Oncol. 2007 Jul 20;25(21):3001-6. Epub 2007 Jun 4. | CrossRef | PubMed | Mellink WA, Holland R, Hendriks JH, Peeters PH, Rutgers EJ, van Daal WA. The contribution of routine follow-up mammography to an early detection of asynchronous contralateral breast cancer. Cancer. 1991 Apr 1;67(7):1844-8. | CrossRef | PubMed |
Mellink WA, Holland R, Hendriks JH, Peeters PH, Rutgers EJ, van Daal WA. The contribution of routine follow-up mammography to an early detection of asynchronous contralateral breast cancer. Cancer. 1991 Apr 1;67(7):1844-8. | CrossRef | PubMed | Mille D, Roy T, Carrère MO, Ray I, Ferdjaoui N, Späth HM, et al. Economic impact of harmonizing medical practices: compliance with clinical practice guidelines in the follow-up of breast cancer in a French Comprehensive Cancer Center. J Clin Oncol. 2000 Apr;18(8):1718-24. | PubMed |
Mille D, Roy T, Carrère MO, Ray I, Ferdjaoui N, Späth HM, et al. Economic impact of harmonizing medical practices: compliance with clinical practice guidelines in the follow-up of breast cancer in a French Comprehensive Cancer Center. J Clin Oncol. 2000 Apr;18(8):1718-24. | PubMed | Modan B, Hartge P, Hirsh-Yechezkel G, Chetrit A, Lubin F, Beller U, et al. Parity, oral contraceptives, and the risk of ovarian cancer among carriers and noncarriers of a BRCA1 or BRCA2 mutation. N Engl J Med. 2001 Jul 26;345(4):235-40. | CrossRef | PubMed |
Modan B, Hartge P, Hirsh-Yechezkel G, Chetrit A, Lubin F, Beller U, et al. Parity, oral contraceptives, and the risk of ovarian cancer among carriers and noncarriers of a BRCA1 or BRCA2 mutation. N Engl J Med. 2001 Jul 26;345(4):235-40. | CrossRef | PubMed | Montgomery DA, Krupa K, Cooke TG. Alternative methods of follow up in breast cancer: a systematic review of the literature. Br J Cancer. 2007 Jun 4;96(11):1625-32. Epub 2007 May 8. | CrossRef | PubMed | PMC |
Montgomery DA, Krupa K, Cooke TG. Alternative methods of follow up in breast cancer: a systematic review of the literature. Br J Cancer. 2007 Jun 4;96(11):1625-32. Epub 2007 May 8. | CrossRef | PubMed | PMC | O'Meara ES, Rossing MA, Daling JR, Elmore JG, Barlow WE, Weiss NS. Hormone replacement therapy after a diagnosis of breast cancer in relation to recurrence and mortality. J Natl Cancer Inst. 2001 May 16;93(10):754-62. | CrossRef | PubMed |
O'Meara ES, Rossing MA, Daling JR, Elmore JG, Barlow WE, Weiss NS. Hormone replacement therapy after a diagnosis of breast cancer in relation to recurrence and mortality. J Natl Cancer Inst. 2001 May 16;93(10):754-62. | CrossRef | PubMed | Orel SG, Fowble BL, Solin LJ, Schultz DJ, Conant EF, Troupin RH. Breast cancer recurrence after lumpectomy and radiation therapy for early-stage disease: prognostic significance of detection method. Radiology. 1993 Jul;188(1):189-94. | PubMed |
Orel SG, Fowble BL, Solin LJ, Schultz DJ, Conant EF, Troupin RH. Breast cancer recurrence after lumpectomy and radiation therapy for early-stage disease: prognostic significance of detection method. Radiology. 1993 Jul;188(1):189-94. | PubMed | Pandya KJ, McFadden ET, Kalish LA, Tormey DC, Taylor SG 4th, Falkson G. A retrospective study of earliest indicators of recurrence in patients on Eastern Cooperative Oncology Group adjuvant chemotherapy trials for breast cancer. A preliminary report. Cancer. 1985 Jan 1;55(1):202-5. | CrossRef | PubMed |
Pandya KJ, McFadden ET, Kalish LA, Tormey DC, Taylor SG 4th, Falkson G. A retrospective study of earliest indicators of recurrence in patients on Eastern Cooperative Oncology Group adjuvant chemotherapy trials for breast cancer. A preliminary report. Cancer. 1985 Jan 1;55(1):202-5. | CrossRef | PubMed | Perez EA, Josse RG, Pritchard KI, Ingle JN, Martino S, Findlay BP, et al. Effect of letrozole versus placebo on bone mineral density in women with primary breast cancer completing 5 or more years of adjuvant tamoxifen: a companion study to NCIC CTG MA.17. J Clin Oncol. 2006 Aug 1;24(22):3629-35. Epub 2006 Jul 5. | CrossRef | PubMed |
Perez EA, Josse RG, Pritchard KI, Ingle JN, Martino S, Findlay BP, et al. Effect of letrozole versus placebo on bone mineral density in women with primary breast cancer completing 5 or more years of adjuvant tamoxifen: a companion study to NCIC CTG MA.17. J Clin Oncol. 2006 Aug 1;24(22):3629-35. Epub 2006 Jul 5. | CrossRef | PubMed | Recht A, Gray R, Davidson NE, Fowble BL, Solin LJ, Cummings FJ, et al. Locoregional failure 10 years after mastectomy and adjuvant chemotherapy with or without tamoxifen without irradiation: experience of the Eastern Cooperative Oncology Group. J Clin Oncol. 1999 Jun;17(6):1689-700. | PubMed |
Recht A, Gray R, Davidson NE, Fowble BL, Solin LJ, Cummings FJ, et al. Locoregional failure 10 years after mastectomy and adjuvant chemotherapy with or without tamoxifen without irradiation: experience of the Eastern Cooperative Oncology Group. J Clin Oncol. 1999 Jun;17(6):1689-700. | PubMed | Rojas MP, Telaro E, Russo A, Fossati R, Confalonieri C, Liberati A. Follow-up strategies for women treated for early breast cancer. Cochrane Database Syst Rev. 2000;(4):CD001768. | PubMed |
Rojas MP, Telaro E, Russo A, Fossati R, Confalonieri C, Liberati A. Follow-up strategies for women treated for early breast cancer. Cochrane Database Syst Rev. 2000;(4):CD001768. | PubMed | Rosselli Del Turco M, Palli D, Cariddi A, Ciatto S, Pacini P, Distante V. Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council Project on Breast Cancer follow-up. JAMA. 1994 May 25;271(20):1593-7. | CrossRef | PubMed |
Rosselli Del Turco M, Palli D, Cariddi A, Ciatto S, Pacini P, Distante V. Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council Project on Breast Cancer follow-up. JAMA. 1994 May 25;271(20):1593-7. | CrossRef | PubMed | Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women's Health Initiative randomized controlled trial. JAMA. 2002 Jul 17;288(3):321-33. | PubMed |
Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women's Health Initiative randomized controlled trial. JAMA. 2002 Jul 17;288(3):321-33. | PubMed | Schootman M, Jeffe DB, Lian M, Aft R, Gillanders WE. Surveillance mammography and the risk of death among elderly breast cancer patients. Breast Cancer Res Treat. 2008 Oct;111(3):489-96. Epub 2007 Oct 24. | CrossRef | PubMed |
Schootman M, Jeffe DB, Lian M, Aft R, Gillanders WE. Surveillance mammography and the risk of death among elderly breast cancer patients. Breast Cancer Res Treat. 2008 Oct;111(3):489-96. Epub 2007 Oct 24. | CrossRef | PubMed | Stierer M, Rosen HR. Influence of early diagnosis on prognosis of recurrent breast cancer. Cancer. 1989 Sep 1;64(5):1128-31. | CrossRef | PubMed |
Stierer M, Rosen HR. Influence of early diagnosis on prognosis of recurrent breast cancer. Cancer. 1989 Sep 1;64(5):1128-31. | CrossRef | PubMed | Struewing JP, Hartge P, Wacholder S, Baker SM, Berlin M, McAdams M, et al. The risk of cancer associated with specific mutations of BRCA1 and BRCA2 among Ashkenazi Jews. N Engl J Med. 1997 May 15;336(20):1401-8. | CrossRef | PubMed |
Struewing JP, Hartge P, Wacholder S, Baker SM, Berlin M, McAdams M, et al. The risk of cancer associated with specific mutations of BRCA1 and BRCA2 among Ashkenazi Jews. N Engl J Med. 1997 May 15;336(20):1401-8. | CrossRef | PubMed | Impact of follow-up testing on survival and health-related quality of life in breast cancer patients. A multicenter randomized controlled trial. The GIVIO Investigators. JAMA. 1994 May 25;271(20):1587-92. | CrossRef | PubMed |
Impact of follow-up testing on survival and health-related quality of life in breast cancer patients. A multicenter randomized controlled trial. The GIVIO Investigators. JAMA. 1994 May 25;271(20):1587-92. | CrossRef | PubMed |