 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: carcinoma in situ, cáncer de mama
Introducción
Objetivos Específicos
Síntesis de la Evidencia y Recomendaciones
1. Factores Histopatológicos para Recidiva Local (RL) en CDIS
2. ¿En qué Casos está Indicada la Cirugía Conservadora (CC)?
3. ¿Existen Algunos Casos de CDIS en que se Pueda Evitar la Radioterapia Post Operatoria (RT)?
4. ¿En qué Casos está Indicada la Mastectomía Total (MT)?
5. ¿Está Indicada la Biopsia de Linfonodo Centinela (BLC) en el CDIS?
6. ¿Cuáles son las Indicaciones de Hormonoterapia?
7. Neoplasia Lobulillar in Situ (NLIS)
7.1 ¿Cuáles son las Indicaciones de Tratamiento más allá de la Biopsia?
7.2 ¿Se Deben Tratar Todas las NLIS con Tamoxifeno?
Referencias
En Chile, el porcentaje de casos de cáncer de mama diagnosticado en etapa in situ alcanzaba un 5,6 % en 2003, cifra que ha experimentado un leve aumento durante los últimos años, llegando a 8,5% en el 2006 según la información aportada por la Unidad de Cáncer del MINSAL, que incluye los datos provenientes de la atención de la patología mamaria efectuada en el sistema público de salud.
Es posible esperar que esta cifra aumente en la medida que exista mayor disponibilidad de mamografía y mayor conciencia en la población acerca de la importancia del diagnóstico precoz del cáncer de mama.
El objetivo de este capítulo es revisar el estado actual del manejo del cáncer de mama in situ.
A diferencia de lo realizado en 2003, en que nos abocamos a discutir el diagnóstico y tratamiento sólo del carcinoma ductal in situ (CDIS), en esta ocasión hemos ampliado esta revisión incorporando a la neoplasia lobulillar in situ (NLIS).
Asimismo, hemos omitido los aspectos relacionados con el diagnóstico del CDIS debido a que no ha habido ningún cambio sustantivo al respecto, con excepción del uso de la resonancia mamaria en la evaluación preoperatoria de algunas pacientes con CDIS, materia que será tratada en el capítulo pertinente.
Del mismo modo, los aspectos relacionados con la manipulación y procesamiento de las muestras de pacientes con diagnóstico de CDIS, serán abordados en el capítulo de diagnóstico patológico.
El objetivo de esta revisión es identificar, sintetizar y evaluar la mejor evidencia disponible para la actualización del manejo del carcinoma in Situ de la mama en nuestro país.
1. En diagnóstico patológico:
a. ¿Cuáles son los factores de riesgo histopatológicos para la recurrencia local?
2. En tratamiento local:
a. ¿En qué casos se trata el CDIS con cirugía conservadora?
b. ¿Existen casos en que se pueda evitar la RT postoperatoria?
c. ¿Cuáles son las indicaciones de mastectomía total en CDIS?
d. ¿Está indicada la biopsia del linfonodo centinela en el CDIS?
3. En tratamiento sistémico:
a. ¿Cuáles son las indicaciones de hormonoterapia?
b. ¿Existe una alternativa distinta del tamoxifeno en la hormonoterapia del CDIS?
4. En neoplasia lobulillar in-situ:
a. ¿Cuáles son las indicaciones de tratamiento más allá de la biopsia en NLIS?
b. ¿Se deben tratar todas las NLIS con tamoxifeno?
Síntesis de la evidencia:
Se encontró sólo estudios retrospectivos que intentan definir las variables que influyen en el riesgo de recidiva local del CDIS.
Los principales factores pronósticos de RL identificados son el margen quirúrgico positivo o cercano <4mm (Rashtian, 2008; Rakovitch, 2007; Kerlikowske, 2003), la presencia de comedonecrosis (Boyages, 1999; Fisher, 2007; Ringberg, 2007; Gilleard, 2008) y el grado nuclear alto (Boyages, 1999; Rakovitch, 2007; Kerlikowske, 2003; Jones, 2006).
Otros factores pronósticos encontrados en algunos estudios son la multifocalidad (Rakovitch, 2007; Fisher, 2007) y el subtipo histológico micropapilar (Fisher, 2007).
Asimismo, el margen quirúrgico positivo resultó ser predictor de tumor residual en las piezas operatorias de re escisiones, en el análisis univariado (Sigal-Zafrani, 2004). El estado del margen en la primera resección fue predictor de la presencia de tumor residual en la segunda resección o ampliación. Hubo tumor residual en el 45% de los casos con margen cercano (≤1 mm) y en 67%, 71% y 94% de los casos con margen positivo focal, margen positivo moderado y margen positivo extenso respectivamente.
Un solo estudio evaluó la presencia de neoplasia lobulillar in situ (NLIS) asociada al CDIS, encontrando en el análisis multivariado, que el riesgo de RL es dos y media veces mayor en pacientes con NLIS que sin NLIS asociada al CDIS, con RR de 2,49, IC 95% 1,33 - 4,67, p=0,005. Los autores sugieren que en las pacientes en que se encuentre esta característica se considere el uso de estrategias adicionales de reducción de riesgo (Rudloff, 2009).
La utilidad del índice pronóstico de Van Nuys, que combina el tamaño tumoral, el estado del margen y el grado nuclear, ha sido re evaluada recientemente (Gilleard, 2008; Di Saveiro, 2007).
El estudio de Di Saveiro encontró 21 RL en 259 pacientes tratadas por CDIS con cirugía conservadora sola o cirugía conservadora más radioterapia, con una mediana de seguimiento de 130 meses. En el subgrupo de pacientes tratadas con cirugía sola, el período libre de enfermedad a 10 años fue de 94% para los casos con índice pronóstico bajo de Van Nuys; en cambio fue de 83% en los casos con índice pronóstico intermedio y alto de Van Nuys, p<0,05. Esta es la única comparación que alcanza significación estadística.
El estudio de Gilleard encontró 19 RL en 215 pacientes tratadas por CDIS con cirugía conservadora sola con una mediana de seguimiento de 53 meses. En el subgrupo de pacientes con índice bajo de Van Nuys, el riesgo de presentar RL fue 0, en cambio en los subgrupos con índice intermedio o alto el riesgo de presentar RL fue de 25,5% y 32,1% respectivamente (p=0,002). El índice pronóstico de Van Nuys y la comedonecrosis son los únicos factores pronósticos estadísticamente significativos en esta casuística. Pese a la limitación de este estudio por ser retrospectivo, presenta la característica que el porcentaje de falla local no está afectado por tratamientos complementarios a la cirugía.
No se ha logrado definir el margen adecuado. Sin embargo, uno de los principales estudios en términos del número de pacientes incluidas (Solin, 2005) indica que el estado del margen es la variable independiente que más potentemente de asocia con el riesgo de RL. El RR del margen positivo fue 3,35 (p=0,00035) y el RR del margen cercano definido como ≤ 2mm fue 1,90 (p=0,027).
El propósito de determinar los factores de riesgo que influyen en el riesgo de RL de esta enfermedad es identificar a priori en qué pacientes candidatas a cirugía conservadora se podría evitar la radioterapia post operatoria, objetivo que aún no se logra.
Nivel de evidencia: II
Recomendación:
Síntesis de la evidencia:
Se encontró una guía clínica (Shelley, 2006) y un artículo de revisión no sistemática, narrativo (Boughey, 2007), sobre el estado actual tratamiento del CDIS.
Con relación a la indicación de CC, concluyen que la mastectomía parcial o CC es una opción razonable siempre que todas las microcalcificaciones sospechosas sean extirpadas y se logre un margen libre de tumor de por lo menos entre 2 y 3 mm.
La principal condición que define si una paciente es candidata a cirugía conservadora es la factibilidad de obtener márgenes quirúrgicos microscópicamente negativos. La distancia óptima entre el margen quirúrgico y el tumor es aún controvertido porque no hay informes definitivos sobre este factor; sin embargo, existe un consenso general en que el margen apropiado debe medir entre 2 y 3 mm.
Aunque el CDIS no es una lesión invasora, aproximadamente un 40% de las pacientes tratadas con escisión incompleta y sin radioterapia (RT) postoperatoria, desarrolla un carcinoma invasor (Boughey, 2007).
El pronóstico a largo plazo, independientemente del tipo de tratamiento, es excelente, con una superviviencia global mayor del 95% a 10 años.
A las pacientes con diagnóstico de CDIS que son candidatas a CC, se les debe ofrecer la opción de CC o de mastectomía total (MT). Esta última con o sin reconstrucción inmediata, continúa siendo una opción aceptable para aquellas pacientes que prefieran maximizar el control local (Shelley, 2006). Ciertamente, la toma de decisión entre estas opciones involucra una conversación de la paciente con todo el equipo multidisciplinario. La evidencia indica que la CC debe ser seguida de RT.
Nivel de evidencia: III
Recomendación:
Síntesis de la evidencia:
Existe una revisión sistemática que incluye todos los ensayos aleatorios publicados a la fecha (Goodwin, 2009). Son 4 los estudios clínicos aleatorios controlados diseñados para definir el rol de RT adyuvante en CDIS operado con CC (Fisher, 2001; Houghton, 2003; Bijker, 2006 y Holmberg, 2008). Si bien existen diferentes criterios de inclusión de pacientes en estos estudios, el diseño fue idéntico en todos ellos: una rama tratada con cirugía conservadora (CC) y la otra con CC más RT adyuvante.
El ensayo NSABP B-17 arrojó resultados que con distinto seguimiento (reportados por Fisher en 1993, 1998 y 2001), son concordantes en cuanto a que la RT reduce la incidencia acumulada de RL de 31,7 a 15,7%.
El ensayo de la EORTC en sus 2 reportes (Julien, 2000; Bijker, 2006), el segundo con mayor seguimiento, demuestra beneficios en cuanto a supervivencia libre de RL aumentándola de 74 a 85% con RT (RR 0,53, estadísticamente significativo), con reducción de riesgo de RL preinvasora e invasora en 48 y 42% en términos absolutos, respectivamente.
El UKCCCR trial (Houghton, 2003) redujo la RL en un 8,9% en forma absoluta, disminuyendo la incidencia de 13,7 a 4,8% en el grupo irradiado.
El último ensayo publicado es el SweDCIS (Holmberg, 2008) y arrojó un RR de RL de 0,4 en el grupo experimental. Ningún estudio mostró beneficio en la supervivencia global ni en la incidencia de metástasis a distancia.
No se ha logrado identificar un grupo de pacientes cuyas características pronostiquen un riesgo bajo de RL que permita omitir la RT adyuvante en el análisis de subgrupos. En los 4 ensayos mencionados se incluyeron pacientes con tumores pequeños, algunos detectados por mamografía y que fueron operados con márgenes negativos. Se utilizaron distintas técnicas y dosis de RT. Goodwin en su revisión sistemática, analizando un total de 3925 mujeres enroladas en estos estudios, concluye que el beneficio de la RT es consistente para la reducción de las RL invasoras e in situ ipsilaterales, no existiendo efecto en el riesgo de falla contralateral, en las fallas a distancia ni en la supervivencia global.
Bijker (2002) mediante un análisis de cohortes con pacientes incluidos en ensayos versus pacientes inelegibles o que quedaron fuera del ensayo por decisión del tratante o de la paciente, concluye que entre pacientes irradiadas, aquellas incluidas en los ensayos presentaron una menor proporción de RL debido probablemente a un sesgo de selección. En las pacientes no irradiadas, las tasas de RL fueron idénticas, lo que sugiere que los resultados de los ensayos aleatorios no serían aplicables a todas las pacientes y que los beneficios reportados pudieran no ser tan evidentes en condiciones cotidianas.
Múltiples series de distinta índole (cohorte retrospectiva, revisiones no sistemáticas, opiniones de expertos, etc.) no han logrado establecer, utilizando los factores de riesgo clásicos (edad, márgenes quirúrgicos, grado histológico, tamaño tumoral, etc.) grupos de bajo riesgo de RL en los que se podría omitir la RT adyuvante. Wong (2006) desarrolló un ensayo terapéutico no controlado y reclutó a 156 pacientes con tumores inferiores a 25 mm, detectados por mamografía, márgenes negativos mayores a 10 mm, grado nuclear 2-3, los cuales fueron tratados sólo con cirugía. La tasa de recurrencia fue de 2,4% por paciente/año, es decir, 12% a 5 años. De éstas, el 69% fue de tipo in situ y el 31% de tipo invasor. Por lo tanto se suspendió el reclutamiento de pacientes y el estudio se finalizó antes de lo planificado, al sobrepasar la recurrencia máxima esperada. A pesar de los criterios de buen pronóstico, la omisión de RT resultó en un control local deficiente.
Es posible que los avances en técnicas de reconocimiento de perfil molecular pudiesen determinar la característica de radio resistencia y por ende identificar a pacientes que no se beneficiarían con este tratamiento.
Nivel de evidencia: I
Recomendación:
Síntesis de la evidencia:
No existen ensayos aleatorios prospectivos que comparen la efectividad de la MT con la CC para el CDIS (Mokbel, 2005).
A pesar de la superioridad de la MT sobre la CC + RT en términos del control local, no existe evidencia que la MT sea mejor que la CC + RT con respecto de la supervivencia global.
La MT está indicada en los casos de CDIS “suficientemente” extensos (Shelley, 2006; Boughey, 2007) o mayores de 4 cm (Mokbel, 2005); en los casos en que la CC provoque como resultado un defecto cosmético inaceptable (Shelley, 2006); en los casos de CDIS multicéntricos (Mokbel, 2005; Boughey, 2007); en los casos con persistencia de márgenes quirúrgicos positivos después de más de un intento de CC (Mokbel, 2005; Boughey, 2007); en pacientes que prefieran la MT para maximizar el control local (Mokbel, 2005; Shelley, 2006); y en los casos en que la RT esté contraindicada como en enfermedades del colágeno activas (Mokbel, 2005; Boughey, 2007). Mokbel es el único autor que recomienda la MT en lesiones centrales.
A todas las pacientes que requieren MT se les debe ofrecer la reconstrucción mamaria inmediata, la que está asociada con un beneficio psicológico (Mokbel, 2005; Shelley, 2006).
Nivel de evidencia: II
Recomendación
Síntesis de la evidencia:
El CDIS no puede dar metástasis axilares por definición.
Las metástasis axilares son muy poco frecuentes y se presume que son secundarias a invasión no detectada.
En una base de datos estadounidense se encontró sólo un 3,6% de compromiso axilar en 10.946 pacientes registradas con diagnóstico de CDIS. Esta cifra puede disminuir aún más si sólo se incluyen los casos de CDIS diagnosticados en programas de screening. Lo anterior, sumado al hecho que la BLC está asociada a un 7% de linfedema y a un 9% parestesias, hacen imposible recomendar rutinariamente esta técnica en todos los casos de CDIS (Morrow, 2008).
Diversos estudios reportan el hallazgo de invasión en el estudio histológico definitivo de pacientes originalmente diagnosticadas con CDIS. Estas cifras oscilan entre 13 y 32%. Destaca el hecho que estas series incluyen alrededor de un 20% de casos con masa palpable o masa mamográfica, lesiones de gran tamaño, mayores de 4 cm o con microinvasión presente en las muestras obtenidas por punción (Goyal, 2006; Yi, 2008; Moran, 2007).
Algunos estudios evaluaron los factores predictores de invasión, identificando en el análisis multivariado el tamaño mayor de 5 cm, los casos que se han diagnosticado mediante una biopsia percutánea (subdiagnóstico) (Yi, 2008), y la presencia de masa al examen clínico o en la mamografía como predictores independientes de invasión (Goyal, 2006).
Los hallazgos del único metaanálisis sobre BLC en CDIS coincide con lo anterior (Ansari, 2008).
Un análisis multivariado mostró 3 factores predictores para el compromiso del linfonodo centinela: tamaño entre 2 y 5 cm (RR 6,8), tamaño mayor de 5 cm (RR 21,9) y diagnóstico histológico final de invasión (RR 16,9) (Yi, 2008).
El porcentaje de linfonodos axilares comprometidos en CDIS varía entre 1,8 y 8,6% encontrados en biopsias de linfonodo centinela o de disección axilar (Mabry, 2006; Moran, 2007; Yi, 2008; Intra, 2008; Goyal, 2006; Ansari, 2008). Es importante mencionar que el único estudio prospectivo sobre esta materia encuentra sólo un 1,8% de compromiso axilar (Intra, 2008).
La publicación que comunica tasas de recurrencia axilar en el CDIS indica que 7 de 813 pacientes (NSABP B-17) y 6 de 1799 (NSABP B-24) presentaron recurrencia axilar. El riesgo fue de 0,83/1000 pacientes año y 0,36/1000 pacientes año respectivamente. El riesgo de recurrencia axilar en 253 pacientes del B-17 en las que se realizó disección axilar fue 0 y el riesgo de recurrencia axilar en las 560 del B-17 en las que no se realizó disección axilar fue 0,26/1000 pacientes año (p=0,67). El riesgo de recurrencia axilar en 162 pacientes del B-24 en que se realizó disección axilar fue 0 y el riesgo de recurrencia en 1637 del B-24 en que no se realizó disección axilar fue 0,52/ pacientes año (p=0,67) (Julian, 2007).
La principal limitación de la evidencia revisada consiste en que se trata de series retrospectivas y heterogéneas, con excepción de la de Intra.
Nivel de evidencia: II
Recomendación:
Síntesis de la evidencia:
Se identificaron dos ensayos aleatorios controlados y multicéntricos.
El estudio NSABP–B-24 (Fisher, 1999) comparó en el CDIS cirugía conservadora + radioterapia + tamoxifeno por 5 años, con cirugía conservadora + radioterapia + placebo por 5 años. Se incluyó 902 pacientes en cada rama del estudio.
El total de RL in situ e invasoras en la rama placebo fue de 130 (13%), y en la rama con tamoxifeno 84 (8%), con un RR de 0,63, IC 95% 0,47 – 0,83, para eventos globales. El RR para RL invasora fue de 0,57 (p=0,0004) y para in situ RR 0,69, no significativo. En el subgrupo de pacientes < 50 años, la reducción del riesgo de RL fue de 38% comparado con un 22% en pacientes > 50 años. Concluye que el tamoxifeno disminuyó principalmente las RL ipsilaterales invasoras.
No hubo un exceso estadísticamente significativo de cáncer del endometrio en el grupo con tamoxifeno, 7 vs 2, RR 3,4% IC 95% 0,6-33,4, p=0,2.
El mismo autor publica en 2001 datos con mayor seguimiento. La tasa de incidencia por 1000 pacientes por año de RL invasora ipsilateral se redujo en un 47%, de 9 a 4,8 (p=0,01) y la tasa de RL in situ ipsilateral se redujo de 9,4 a 8 (p=0,48). La incidencia acumulada de RL invasoras y no invasoras a 7 años disminuyó de 11,1 a 7,7% (p=0,02). Los resultados se mantienen al cabo de 7 años de seguimiento, disminuyendo fundamentalmente las RL de tipo invasor.
El estudio UKANZ (Houghton, 2003) incluyó 1576 pacientes en el análisis entre los grupos con y sin tamoxifeno, con una mediana de seguimiento de 56 meses. Hubo 251 RL en la mama, 114 de 794 (14%) en el grupo que recibió tamoxifeno y 137 de 782 (18%) en el grupo que no recibió tamoxifeno. RR 0,83, IC 95% 0,64–1,03, p=0,13.
El tamoxifeno no redujo la tasa global de RL, ipsi ni contralaterales, ni la tasa de RL invasoras, pero sí redujo la tasa global de RL in situ, especialmente las ipsilaterales RR 0,74, IC 95% 0,52 - 1,04, p=0,08.
Se observó que el efecto del tamoxifeno se concentra principalmente en las pacientes menores de 50 años, aunque el análisis de subgrupos no arroja resultados estadísticamente significativos, por el bajo número de eventos en cada estrato.
Hubo dos casos de cáncer de endometrio en las pacientes que recibieron tamoxifeno y ninguno en las que no recibieron tamoxifeno; no significativo.
Los autores no recomiendan el uso de tamoxifeno adyuvante en el CDIS en el subgrupo de mujeres mayores de 50 años.
Allred en el año 2002 publicó una serie retrospectiva que evaluó la respuesta al tamoxifeno de las pacientes con CDIS incluidas en el protocolo NSABP B-24 de acuerdo al estado de los receptores de estrógeno (RE). Encontró una reducción del riesgo de RL en las pacientes con RE positivos, RR 0,41, IC 95% 0,25 - 0,65, p=0,0002. En cambio el beneficio del tamoxifeno fue muy leve en las pacientes con RE - ; sin embargo, el número total de eventos en este subgrupo fue muy pequeño. Concluye que los datos sugieren que la expresión de RE es un predictor importante de la respuesta al tamoxifeno en las pacientes con RE +. En el subgrupo con RE – los datos no son concluyentes.
Los estudios que están evaluando otras opciones de hormonoterapia en CDIS aún se encuentran en curso.
Nivel de evidencia: I
Recomendación:
Síntesis de la evidencia:
Se analizaron 16 publicaciones, de las cuales 11 eran series de casos, 2 revisiones narrativas también de series de casos, 1 estudio de corte transversal, 1 cometario editorial y 1 carta al editor.
La NLIS se define como una proliferación dentro de una o más unidades terminales ducto lobulillares de células uniformes, generalmente pequeñas, poco cohesivas y que pueden o no distender al lobulillo.
La NLIS es un término que incluye un espectro de lesiones desde la hiperplasia lobulillar atípica (HLA) al carcinoma lobulillar in situ (CLIS) las que están asociadas con un mayor riesgo de desarrollar un cáncer invasor ulteriormente (lesión de alto riesgo). Sin embargo, diversos autores han planteado la duda si algunos subtipos de NLIS más agresivos, como el CLIS pleomórfico, pudieran provocar un riesgo de progresión hacia un carcinoma invasor y, por consiguiente, deberían ser manejados del mismo modo que un CDIS de bajo grado (lesión precursora) (Recht, 2004; Anderson, 2006).
Tavassoli ha propuesto que la NLIS se clasifique en NL1, NL2 y NL3, correspondiendo a HLA, CLIS clásico y CLIS pleomórfico respectivamente.
El riesgo relativo de desarrollar un carcinoma ulterior es de 4-5 veces para la HLA y de 8-10 veces para el CLIS (Lakhani, 2006).
En un estudio de cohorte retrospectivo se recolectó 4835 casos diagnosticados como NLIS, de los cuales 350 desarrollaron un carcinoma invasor en un período de 25 años. El 23,1% de estos casos presentó histología de tipo lobulillar infiltrante; en cambio, este tipo histológico se observó sólo en el 6,5% de los cánceres primarios diagnosticados en el mismo período (Chuba, 2005).
La presente revisión está orientada a analizar el eventual rol precursor de la NLIS.
La NLIS es una entidad poco frecuente encontrándose en alrededor de 1-2% de todas las biopsias percutáneas de mama (Middleton, 2003; Liberman, 1999; Berg, 2001). Carece de una clínica o imaginología propia, siendo su hallazgo incidental en el contexto del estudio histológico de otras lesiones.
Se encontró sólo estudios de carácter retrospectivo con un número pequeño de pacientes, los que evaluaron el hallazgo de cáncer invasor después de una biopsia percutánea diagnosticada como NLIS.
Los resultados sugieren que la NLIS no es una lesión tan inocua como se ha pensado.
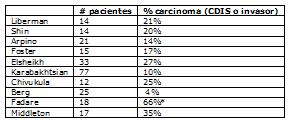
El porcentaje de CDIS o carcinoma invasor encontrado en la histología definitiva de la pieza operatoria de casos diagnosticados con NLIS por punción, varía entre 4 y 27% (Liberman, 1999; Shin, 2002; Arpino, 2004; Foster, 2004; Elsheikh, 2005; Karabakhtsian, 2007; Chivukula, 2008; Berg, 2001). La casuística de Fadare presenta un porcentaje mucho más alto de cáncer en la pieza operatoria debido a que este autor sólo incluyó un subtipo poco frecuente de CLIS con comedonecrosis, el cual tendría un riesgo mayor de cáncer invasor ulterior (Fadare, 2006).
Incidencia de carcinoma invasor en pieza operatoria después del hallazgo de NLIS en biopsia percutánea.
Pese a que los distintos autores concuerdan que se requiere de ulteriores estudios con un mayor número de pacientes para permitir recomendaciones más definitivas, en los últimos años se ha observado que existe una tendencia a realizar resección quirúrgica frente al hallazgo de NLIS en biopsia percutánea (Elsheik, 2005; Karabakhtsian, 2007; Berg, 2001; Recht, 2004; Crisi, 2005; Lakhani, 2006; Chivukula, 2008; Fadare, 2006; Foster, 2004; Anderson, 2006; Liberman, 1999; Arpino, 2004; Shin, 2002; Middleton, 2003). En particular, algunos autores recomiendan la resección quirúrgica post biopsia percutánea de NLIS cuando ésta se ha efectuado por microcalcificaciones (Karabakhtsian, 2007; Berg, 2001), cuando se asocia a otras lesiones de alto riesgo, cuando existe discordancia imaginológica-histológica y cuando hay características histológicas que se entrelazan con CDIS (Liberman, 1999), cuando esté asociada a una lesión sólida sincrónica (Middleton, 2003), cuando se trata de un CLIS con comedonecrosis (Fadare, 2006) o cuando se encuentra la variedad de CLIS pleomórfico (Anderson, 2006a; Cutuli, 2005; Chivukula, 2008).
No es posible dar recomendaciones generales acerca de la mastectomía profiláctica bilateral. Se podría indicar en casos altamente seleccionados de NLIS que además presenten otros factores de riesgo (Anderson, 2006).
Existe sólo un estudio retrospectivo pequeño que sobre el uso de RT post operatoria en NLIS (Cutuli, 2005).
Nivel de evidencia: III
Recomendación:
Síntesis de la evidencia:
Se encontró 2 estudios prospectivos aleatorios doble ciego, P-1 e IBIS I, que evaluaron el efecto preventivo del tamoxifeno versus placebo en mujeres de alto riesgo para desarrollar cáncer de mama (Fisher, 2005; Cuzick, 2007).
Se incluyó 13.207 y 7.154 mujeres de alto riesgo para cáncer de mama, respectivamente.
Un 15% y un 8% de las mujeres incluidas en los estudios P-1 e IBIS I tenían diagnóstico del NLIS, respectivamente.
Existen otros dos estudios de prevención con tamoxifeno, uno británico y otro italiano, en los que no se incluyó mujeres con el antecedente de NLIS.
En el estudio P-1, en el subgrupo de mujeres con NLIS, hubo 67 eventos (cáncer invasor o CDIS) en el grupo que recibió placebo y 25 eventos en el grupo que recibió tamoxifeno. La tasa de incidencia de cáncer invasor x 1000 mujeres fue de 22,1 con placebo y 8,82 con tamoxifeno.
En el estudio IBIS I hubo 337 cánceres en total (invasores e CDIS), 195 en el grupo placebo y 142 en el grupo tamoxifeno (RR IC 95%: 0,73 IC 0,58 – 0.91, p=0,004), pero no hubo análisis en el subgrupo de mujeres con NLIS.
Con relación a los efectos adversos, en el P-1 hubo un aumento significativo de cáncer del endometrio (etapa 1 FIGO) sólo en mujeres mayores de 50 años (RR: 3,28 IC 95% 1,87–6,03, p<0,001) en el grupo con tamoxifeno. Dentro de los eventos tromboembólicos, hubo un aumento de accidentes vasculares encefálicos, de trombosis venosa profunda y de tromboembolismo pulmonar, pero sólo en éste último caso el aumento fue estadísticamente significativo (RR: 2,15 IC 95% 1,08–4,51) afectando por igual a mujeres mayores o menores de 50 años.
En el IBIS I hubo cáncer del endometrio en 28 pacientes, 17 en grupo con tamoxifeno y 11 en el grupo con placebo (RR: 1,55 IC 95% 0,68–3,65, p=0,02), sólo 2 casos en premenopáusicas y 185 eventos tromboembólicos, 117 en el grupo con tamoxifeno y 68 en el grupo con placebo (RR: 1,72 IC 95% 1,27–2,36), estadísticamente significativo sin especificar valor p.
Con respecto de los síntomas vasomotores, sólo el estudio IBIS I aporta cifras. El RR de presentar dichos síntomas fue 1,20 IC 95% 1,16–1,25.
El estudio P-1 concluye que el subgrupo de mujeres con el antecedente de NLIS tiene el potencial de demostrar una relación beneficio/riesgo positiva con el uso de tamoxifeno. Dado que el número de casos con NLIS está aumentando progresivamente, se podría esperar que una proporción importante de mujeres con esta lesión que se beneficien con el tamoxifeno.
El estudio IBIS I concluye que es el tamoxifeno es una opción atractiva para mujeres premenopáusicas con diagnóstico de NLIS.
Nivel de evidencia: I
Recomendación:
Este artículo fue redactado en su versión final después de haber recibido las contribuciones y comentarios de los delegados que asistieron a la III Jornada Nacional de Diagnóstico y Tratamiento de Cáncer de Mama, realizada en Coquimbo, Chile, en agosto de 2009. A su vez, las ponencias que se presentaron en esa jornada fueron la síntesis del artículo completo de revisión de la literatura y trabajo previo de la comisión correspondiente. Este trabajo de formulación duró un año, comenzó en junio de 2008 y se llevó a cabo bajo la asesoría de Medwave Estudios Ltda., en el marco del proyecto denominado “Asesoría en la Formulación de Consenso y Recomendaciones en Cáncer de Mama Basados en la Evidencia”. El financiamiento para la ejecución de la asesoría provino de la Sociedad Chilena de Mastología.
La coordinación de la asesoría fue realizada por Vivienne Bachelet; el metodólogo jefe fue Miguel Araujo; y la metodóloga adjunta fue Gabriela Moreno. Colaboró en la sistematización bibliográfica y en el formato final de los documentos, Matías Goyenechea. El artículo definitivo es el resultado del trabajo final presentado a las jornadas de consenso, donde fue conocido, revisado y discutido por los concurrentes, y luego fue revisado por un comité editorial de pares constituido por la misma Sociedad Chilena de Mastología, tras lo cual fue enviado a Medwave para su publicación.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

 Autores:
Soledad Torres[1], Constanza Rojas[1], Bernardita Aguirre[1], Fernando Cádiz[1], Jamile Camacho[1], Eduardo Cunill[1], Arturo Espinoza[1], Marcela Fritis[1], Patricio Huidobro[1], Álvaro Ibarra[1], Jaime Letzkus[1], María Mañana[1], Raúl Martínez[1], Pablo Matamala[1], Leonor Moyano[1], Claudia Parra[1], Mauricio Rivas[1], Claudio Solé[1]
Autores:
Soledad Torres[1], Constanza Rojas[1], Bernardita Aguirre[1], Fernando Cádiz[1], Jamile Camacho[1], Eduardo Cunill[1], Arturo Espinoza[1], Marcela Fritis[1], Patricio Huidobro[1], Álvaro Ibarra[1], Jaime Letzkus[1], María Mañana[1], Raúl Martínez[1], Pablo Matamala[1], Leonor Moyano[1], Claudia Parra[1], Mauricio Rivas[1], Claudio Solé[1]

Citación: Torres S, Rojas C, Aguirre B, Cádiz F, Camacho J, Cunill E, et al. Update on the management of in situ breast carcinoma: a literature review. Medwave 2010 Ene;10(01):e4330 doi: 10.5867/medwave.2010.01.4330
Fecha de envío: 8/8/2009
Fecha de aceptación: 26/8/2009
Fecha de publicación: 1/1/2010
Origen: no solicitado
Tipo de revisión: con revisión por pares externa

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Allred DC, Land S, Bryant J. Estrogen receptor expression as a predictive marker of the effectiveness of tamoxifen in the treatment of DCIS: Findings from NSABP Protocol B-24. Breast Cancer Rest Treat. 2002; 76 (Supl 1): 36.
Allred DC, Land S, Bryant J. Estrogen receptor expression as a predictive marker of the effectiveness of tamoxifen in the treatment of DCIS: Findings from NSABP Protocol B-24. Breast Cancer Rest Treat. 2002; 76 (Supl 1): 36.  Anderson BO, Calhoun KE, Rosen EL. Evolving concepts in the management of lobular neoplasia. J Natl Compr Canc Netw. 2006 May;4(5):511-22. | PubMed |
Anderson BO, Calhoun KE, Rosen EL. Evolving concepts in the management of lobular neoplasia. J Natl Compr Canc Netw. 2006 May;4(5):511-22. | PubMed | Ansari B, Ogston SA, Purdie CA, Adamson DJ, Brown DC, Thompson AM. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. Br J Surg. 2008 May;95(5):547-54. | CrossRef | PubMed |
Ansari B, Ogston SA, Purdie CA, Adamson DJ, Brown DC, Thompson AM. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. Br J Surg. 2008 May;95(5):547-54. | CrossRef | PubMed | Arpino G, Allred DC, Mohsin SK, Weiss HL, Conrow D, Elledge RM. Lobular neoplasia on core-needle biopsy--clinical significance. Cancer. 2004 Jul 15;101(2):242-50. | CrossRef | PubMed |
Arpino G, Allred DC, Mohsin SK, Weiss HL, Conrow D, Elledge RM. Lobular neoplasia on core-needle biopsy--clinical significance. Cancer. 2004 Jul 15;101(2):242-50. | CrossRef | PubMed | Berg WA, Mrose HE, Ioffe OB. Atypical lobular hyperplasia or lobular carcinoma in situ at core-needle breast biopsy. Radiology. 2001 Feb;218(2):503-9. | PubMed |
Berg WA, Mrose HE, Ioffe OB. Atypical lobular hyperplasia or lobular carcinoma in situ at core-needle breast biopsy. Radiology. 2001 Feb;218(2):503-9. | PubMed | EORTC Breast Cancer Cooperative Group; EORTC Radiotherapy Group, Bijker N, Meijnen P, Peterse JL, Bogaerts J, et al. Breast-conserving treatment with or without radiotherapy in ductal carcinoma-in-situ: ten-year results of European Organisation for Research and Treatment of Cancer randomized phase III trial 10853--a study by the EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. J Clin Oncol. 2006 Jul 20;24(21):3381-7. Epub 2006 Jun 26. | CrossRef | PubMed |
EORTC Breast Cancer Cooperative Group; EORTC Radiotherapy Group, Bijker N, Meijnen P, Peterse JL, Bogaerts J, et al. Breast-conserving treatment with or without radiotherapy in ductal carcinoma-in-situ: ten-year results of European Organisation for Research and Treatment of Cancer randomized phase III trial 10853--a study by the EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. J Clin Oncol. 2006 Jul 20;24(21):3381-7. Epub 2006 Jun 26. | CrossRef | PubMed | Boughey JC, Gonzalez RJ, Bonner E, Kuerer HM. Current treatment and clinical trial developments for ductal carcinoma in situ of the breast. Oncologist. 2007 Nov;12(11):1276-87. | CrossRef | PubMed |
Boughey JC, Gonzalez RJ, Bonner E, Kuerer HM. Current treatment and clinical trial developments for ductal carcinoma in situ of the breast. Oncologist. 2007 Nov;12(11):1276-87. | CrossRef | PubMed | Boyages J, Delaney G, Taylor R. Predictors of local recurrence after treatment of ductal carcinoma in situ: a meta-analysis. Cancer. 1999 Feb 1;85(3):616-28. | CrossRef | PubMed |
Boyages J, Delaney G, Taylor R. Predictors of local recurrence after treatment of ductal carcinoma in situ: a meta-analysis. Cancer. 1999 Feb 1;85(3):616-28. | CrossRef | PubMed | Ceilley E, Jagsi R, Goldberg S, Kachnic L, Powell S, Taghian A. The management of ductal carcinoma in situ in North America and Europe. Results of a survey. Cancer. 2004 Nov 1;101(9):1958-67. | CrossRef | PubMed |
Ceilley E, Jagsi R, Goldberg S, Kachnic L, Powell S, Taghian A. The management of ductal carcinoma in situ in North America and Europe. Results of a survey. Cancer. 2004 Nov 1;101(9):1958-67. | CrossRef | PubMed | Chivukula M, Haynik DM, Brufsky A, Carter G, Dabbs DJ. Pleomorphic lobular carcinoma in situ (PLCIS) on breast core needle biopsies: clinical significance and immunoprofile. Am J Surg Pathol. 2008 Nov;32(11):1721-6. | CrossRef | PubMed |
Chivukula M, Haynik DM, Brufsky A, Carter G, Dabbs DJ. Pleomorphic lobular carcinoma in situ (PLCIS) on breast core needle biopsies: clinical significance and immunoprofile. Am J Surg Pathol. 2008 Nov;32(11):1721-6. | CrossRef | PubMed | Chuba PJ, Hamre MR, Yap J, Severson RK, Lucas D, Shamsa F, et al. Bilateral risk for subsequent breast cancer after lobular carcinoma-in-situ: analysis of surveillance, epidemiology, and end results data. J Clin Oncol. 2005 Aug 20;23(24):5534-41. | CrossRef | PubMed |
Chuba PJ, Hamre MR, Yap J, Severson RK, Lucas D, Shamsa F, et al. Bilateral risk for subsequent breast cancer after lobular carcinoma-in-situ: analysis of surveillance, epidemiology, and end results data. J Clin Oncol. 2005 Aug 20;23(24):5534-41. | CrossRef | PubMed | Crisi GM, Ricci A Jr. Follow-up surgical excision is indicated when breast core needle biopsies show atypical lobular hyperplasia or lobular carcinoma in situ. Am J Surg Pathol. 2005 Dec;29(12):1684-5; author reply 1685-6. | PubMed |
Crisi GM, Ricci A Jr. Follow-up surgical excision is indicated when breast core needle biopsies show atypical lobular hyperplasia or lobular carcinoma in situ. Am J Surg Pathol. 2005 Dec;29(12):1684-5; author reply 1685-6. | PubMed | Cutuli B, de Lafontan B, Quetin P, Mery E. Breast-conserving surgery and radiotherapy: a possible treatment for lobular carcinoma in situ? Eur J Cancer. 2005 Feb;41(3):380-5. | CrossRef | PubMed |
Cutuli B, de Lafontan B, Quetin P, Mery E. Breast-conserving surgery and radiotherapy: a possible treatment for lobular carcinoma in situ? Eur J Cancer. 2005 Feb;41(3):380-5. | CrossRef | PubMed | Cuzick J, Forbes JF, Sestak I, Cawthorn S, Hamed H, Holli K, et al. Long-term results of tamoxifen prophylaxis for breast cancer--96-month follow-up of the randomized IBIS-I trial. J Natl Cancer Inst. 2007 Feb 21;99(4):272-82. | CrossRef | PubMed |
Cuzick J, Forbes JF, Sestak I, Cawthorn S, Hamed H, Holli K, et al. Long-term results of tamoxifen prophylaxis for breast cancer--96-month follow-up of the randomized IBIS-I trial. J Natl Cancer Inst. 2007 Feb 21;99(4):272-82. | CrossRef | PubMed | Dershaw DD. Does LCIS or ALH without other high-risk lesions diagnosed on core biopsy require surgical excision? Breast J. 2003 Jan-Feb;9(1):1-3. | CrossRef | PubMed |
Dershaw DD. Does LCIS or ALH without other high-risk lesions diagnosed on core biopsy require surgical excision? Breast J. 2003 Jan-Feb;9(1):1-3. | CrossRef | PubMed | Di Saverio S, Catena F, Santini D, Ansaloni L, Fogacci T, Mignani S, et al. 259 Patients with DCIS of the breast applying USC/Van Nuys prognostic index: a retrospective review with long term follow up. Breast Cancer Res Treat. 2008 Jun;109(3):405-16. Epub 2007 Aug 9. | CrossRef | PubMed |
Di Saverio S, Catena F, Santini D, Ansaloni L, Fogacci T, Mignani S, et al. 259 Patients with DCIS of the breast applying USC/Van Nuys prognostic index: a retrospective review with long term follow up. Breast Cancer Res Treat. 2008 Jun;109(3):405-16. Epub 2007 Aug 9. | CrossRef | PubMed | Dodwell D, Clements K, Lawrence G, Kearins O, Thomson CS, Dewar J, et al. Radiotherapy following breast-conserving surgery for screen-detected ductal carcinoma in situ: indications and utilisation in the UK. Interim findings from the Sloane Project. Br J Cancer. 2007 Sep 17;97(6):725-9. | CrossRef | PubMed | PMC |
Dodwell D, Clements K, Lawrence G, Kearins O, Thomson CS, Dewar J, et al. Radiotherapy following breast-conserving surgery for screen-detected ductal carcinoma in situ: indications and utilisation in the UK. Interim findings from the Sloane Project. Br J Cancer. 2007 Sep 17;97(6):725-9. | CrossRef | PubMed | PMC | Elsheikh TM, Silverman JF. Follow-up surgical excision is indicated when breast core needle biopsies show atypical lobular hyperplasia or lobular carcinoma in situ: a correlative study of 33 patients with review of the literature. Am J Surg Pathol. 2005 Apr;29(4):534-43. | CrossRef | PubMed |
Elsheikh TM, Silverman JF. Follow-up surgical excision is indicated when breast core needle biopsies show atypical lobular hyperplasia or lobular carcinoma in situ: a correlative study of 33 patients with review of the literature. Am J Surg Pathol. 2005 Apr;29(4):534-43. | CrossRef | PubMed | Fadare O, Dadmanesh F, Alvarado-Cabrero I, Snyder R, Stephen Mitchell J, Tot T, et al. Lobular intraepithelial neoplasia [lobular carcinoma in situ] with comedo-type necrosis: A clinicopathologic study of 18 cases. Am J Surg Pathol. 2006 Nov;30(11):1445-53. | CrossRef | PubMed |
Fadare O, Dadmanesh F, Alvarado-Cabrero I, Snyder R, Stephen Mitchell J, Tot T, et al. Lobular intraepithelial neoplasia [lobular carcinoma in situ] with comedo-type necrosis: A clinicopathologic study of 18 cases. Am J Surg Pathol. 2006 Nov;30(11):1445-53. | CrossRef | PubMed | Fisher B, Dignam J, Wolmark N, Mamounas E, Costantino J, Poller W, et al. Lumpectomy and radiation therapy for the treatment of intraductal breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-17. J Clin Oncol. 1998 Feb;16(2):441-52. | PubMed |
Fisher B, Dignam J, Wolmark N, Mamounas E, Costantino J, Poller W, et al. Lumpectomy and radiation therapy for the treatment of intraductal breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-17. J Clin Oncol. 1998 Feb;16(2):441-52. | PubMed | Fisher B, Dignam J, Wolmark N, Wickerham DL, Fisher ER, Mamounas E, et al. Tamoxifen in treatment of intraductal breast cancer: National Surgical Adjuvant Breast and Bowel Project B-24 randomised controlled trial. Lancet. 1999 Jun 12;353(9169):1993-2000. | CrossRef | PubMed |
Fisher B, Dignam J, Wolmark N, Wickerham DL, Fisher ER, Mamounas E, et al. Tamoxifen in treatment of intraductal breast cancer: National Surgical Adjuvant Breast and Bowel Project B-24 randomised controlled trial. Lancet. 1999 Jun 12;353(9169):1993-2000. | CrossRef | PubMed | Fisher B, Costantino JP, Wickerham DL, Cecchini RS, Cronin WM, Robidoux A, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst. 2005 Nov 16;97(22):1652-62. | CrossRef | PubMed |
Fisher B, Costantino JP, Wickerham DL, Cecchini RS, Cronin WM, Robidoux A, et al. Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study. J Natl Cancer Inst. 2005 Nov 16;97(22):1652-62. | CrossRef | PubMed | Fisher B, Land S, Mamounas E, Dignam J, Fisher ER, Wolmark N. Prevention of invasive breast cancer in women with ductal carcinoma in situ: an update of the National Surgical Adjuvant Breast and Bowel Project experience. Semin Oncol. 2001 Aug;28(4):400-18. | CrossRef | PubMed |
Fisher B, Land S, Mamounas E, Dignam J, Fisher ER, Wolmark N. Prevention of invasive breast cancer in women with ductal carcinoma in situ: an update of the National Surgical Adjuvant Breast and Bowel Project experience. Semin Oncol. 2001 Aug;28(4):400-18. | CrossRef | PubMed | Fisher ER, Land SR, Saad RS, Fisher B, Wickerham DL, Wang M, et al. Pathologic variables predictive of breast events in patients with ductal carcinoma in situ. Am J Clin Pathol. 2007 Jul;128(1):86-91. | CrossRef | PubMed |
Fisher ER, Land SR, Saad RS, Fisher B, Wickerham DL, Wang M, et al. Pathologic variables predictive of breast events in patients with ductal carcinoma in situ. Am J Clin Pathol. 2007 Jul;128(1):86-91. | CrossRef | PubMed | Foster MC, Helvie MA, Gregory NE, Rebner M, Nees AV, Paramagul C. Lobular carcinoma in situ or atypical lobular hyperplasia at core-needle biopsy: is excisional biopsy necessary? Radiology. 2004 Jun;231(3):813-9. Epub 2004 Apr 22. | CrossRef | PubMed |
Foster MC, Helvie MA, Gregory NE, Rebner M, Nees AV, Paramagul C. Lobular carcinoma in situ or atypical lobular hyperplasia at core-needle biopsy: is excisional biopsy necessary? Radiology. 2004 Jun;231(3):813-9. Epub 2004 Apr 22. | CrossRef | PubMed | Gilleard O, Goodman A, Cooper M, Davies M, Dunn J. The significance of the Van Nuys prognostic index in the management of ductal carcinoma in situ. World J Surg Oncol. 2008 Jun 18;6:61. | CrossRef | PubMed | PMC |
Gilleard O, Goodman A, Cooper M, Davies M, Dunn J. The significance of the Van Nuys prognostic index in the management of ductal carcinoma in situ. World J Surg Oncol. 2008 Jun 18;6:61. | CrossRef | PubMed | PMC | Goodwin A, Parker S, Ghersi D, Wilcken N. Post-operative radiotherapy for ductal carcinoma in situ of the breast. Cochrane Database Syst Rev. 2009 Jan 21;(1):CD000563. | PubMed |
Goodwin A, Parker S, Ghersi D, Wilcken N. Post-operative radiotherapy for ductal carcinoma in situ of the breast. Cochrane Database Syst Rev. 2009 Jan 21;(1):CD000563. | PubMed | Goyal A, Douglas-Jones A, Monypenny I, Sweetland H, Stevens G, Mansel RE. Is there a role of sentinel lymph node biopsy in ductal carcinoma in situ?: analysis of 587 cases. Breast Cancer Res Treat. 2006 Aug;98(3):311-4. Epub 2006 Mar 22. | CrossRef | PubMed |
Goyal A, Douglas-Jones A, Monypenny I, Sweetland H, Stevens G, Mansel RE. Is there a role of sentinel lymph node biopsy in ductal carcinoma in situ?: analysis of 587 cases. Breast Cancer Res Treat. 2006 Aug;98(3):311-4. Epub 2006 Mar 22. | CrossRef | PubMed | Holmberg L, Garmo H, Granstrand B, Ringberg A, Arnesson LG, Sandelin K, et al. Absolute risk reductions for local recurrence after postoperative radiotherapy after sector resection for ductal carcinoma in situ of the breast. J Clin Oncol. 2008 Mar 10;26(8):1247-52. Epub 2008 Feb 4. | CrossRef | PubMed |
Holmberg L, Garmo H, Granstrand B, Ringberg A, Arnesson LG, Sandelin K, et al. Absolute risk reductions for local recurrence after postoperative radiotherapy after sector resection for ductal carcinoma in situ of the breast. J Clin Oncol. 2008 Mar 10;26(8):1247-52. Epub 2008 Feb 4. | CrossRef | PubMed | Houghton J, George WD, Cuzick J, Duggan C, Fentiman IS, Spittle M; et al. Radiotherapy and tamoxifen in women with completely excised ductal carcinoma in situ of the breast in the UK, Australia, and New Zealand: randomised controlled trial. Lancet. 2003 Jul 12;362(9378):95-102. | CrossRef | PubMed |
Houghton J, George WD, Cuzick J, Duggan C, Fentiman IS, Spittle M; et al. Radiotherapy and tamoxifen in women with completely excised ductal carcinoma in situ of the breast in the UK, Australia, and New Zealand: randomised controlled trial. Lancet. 2003 Jul 12;362(9378):95-102. | CrossRef | PubMed | Intra M, Rotmensz N, Veronesi P, Colleoni M, Iodice S, Paganelli G, et al. Sentinel node biopsy is not a standard procedure in ductal carcinoma in situ of the breast: the experience of the European institute of oncology on 854 patients in 10 years. Ann Surg. 2008 Feb;247(2):315-9. | CrossRef | PubMed |
Intra M, Rotmensz N, Veronesi P, Colleoni M, Iodice S, Paganelli G, et al. Sentinel node biopsy is not a standard procedure in ductal carcinoma in situ of the breast: the experience of the European institute of oncology on 854 patients in 10 years. Ann Surg. 2008 Feb;247(2):315-9. | CrossRef | PubMed | Jones JL. Overdiagnosis and overtreatment of breast cancer: progression of ductal carcinoma in situ: the pathological perspective. Breast Cancer Res. 2006;8(2):204. Epub 2006 Apr 21. | CrossRef | PubMed | PMC |
Jones JL. Overdiagnosis and overtreatment of breast cancer: progression of ductal carcinoma in situ: the pathological perspective. Breast Cancer Res. 2006;8(2):204. Epub 2006 Apr 21. | CrossRef | PubMed | PMC | Julian TB, Land SR, Fourchotte V, Haile SR, Fisher ER, Mamounas EP, et al. Is sentinel node biopsy necessary in conservatively treated DCIS? Ann Surg Oncol. 2007 Aug;14(8):2202-8. Epub 2007 May 30. | CrossRef | PubMed |
Julian TB, Land SR, Fourchotte V, Haile SR, Fisher ER, Mamounas EP, et al. Is sentinel node biopsy necessary in conservatively treated DCIS? Ann Surg Oncol. 2007 Aug;14(8):2202-8. Epub 2007 May 30. | CrossRef | PubMed | Julien JP, Bijker N, Fentiman IS, Peterse JL, Delledonne V, Rouanet P, et al. Radiotherapy in breast-conserving treatment for ductal carcinoma in situ: first results of the EORTC randomised phase III trial 10853. EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. Lancet. 2000 Feb 12;355(9203):528-33. | CrossRef | PubMed |
Julien JP, Bijker N, Fentiman IS, Peterse JL, Delledonne V, Rouanet P, et al. Radiotherapy in breast-conserving treatment for ductal carcinoma in situ: first results of the EORTC randomised phase III trial 10853. EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. Lancet. 2000 Feb 12;355(9203):528-33. | CrossRef | PubMed | Karabakhtsian RG, Johnson R, Sumkin J, Dabbs DJ. The clinical significance of lobular neoplasia on breast core biopsy. Am J Surg Pathol. 2007 May;31(5):717-23. | CrossRef | PubMed |
Karabakhtsian RG, Johnson R, Sumkin J, Dabbs DJ. The clinical significance of lobular neoplasia on breast core biopsy. Am J Surg Pathol. 2007 May;31(5):717-23. | CrossRef | PubMed | Kerlikowske K, Molinaro A, Cha I, Ljung BM, Ernster VL, Stewart K, et al. Characteristics associated with recurrence among women with ductal carcinoma in situ treated by lumpectomy. J Natl Cancer Inst. 2003 Nov 19;95(22):1692-702. | PubMed |
Kerlikowske K, Molinaro A, Cha I, Ljung BM, Ernster VL, Stewart K, et al. Characteristics associated with recurrence among women with ductal carcinoma in situ treated by lumpectomy. J Natl Cancer Inst. 2003 Nov 19;95(22):1692-702. | PubMed | Kuerer HM, Albarracin CT, Yang WT, Cardiff RD, Brewster AM, Symmans WF, et al. Ductal carcinoma in situ: state of the science and roadmap to advance the field. J Clin Oncol. 2009 Jan 10;27(2):279-88. Epub 2008 Dec 8. | CrossRef | PubMed |
Kuerer HM, Albarracin CT, Yang WT, Cardiff RD, Brewster AM, Symmans WF, et al. Ductal carcinoma in situ: state of the science and roadmap to advance the field. J Clin Oncol. 2009 Jan 10;27(2):279-88. Epub 2008 Dec 8. | CrossRef | PubMed | Lakhani SR, Audretsch W, Cleton-Jensen AM, Cutuli B, Ellis I, Eusebi V, Greco M, et al. The management of lobular carcinoma in situ (LCIS). Is LCIS the same as ductal carcinoma in situ (DCIS)? Eur J Cancer. 2006 Sep;42(14):2205-11. Epub 2006 Jul 28. | CrossRef | PubMed |
Lakhani SR, Audretsch W, Cleton-Jensen AM, Cutuli B, Ellis I, Eusebi V, Greco M, et al. The management of lobular carcinoma in situ (LCIS). Is LCIS the same as ductal carcinoma in situ (DCIS)? Eur J Cancer. 2006 Sep;42(14):2205-11. Epub 2006 Jul 28. | CrossRef | PubMed | Liberman L, Sama M, Susnik B, Rosen PP, LaTrenta LR, Morris EA, et al. Lobular carcinoma in situ at percutaneous breast biopsy: surgical biopsy findings. AJR Am J Roentgenol. 1999 Aug;173(2):291-9. | PubMed |
Liberman L, Sama M, Susnik B, Rosen PP, LaTrenta LR, Morris EA, et al. Lobular carcinoma in situ at percutaneous breast biopsy: surgical biopsy findings. AJR Am J Roentgenol. 1999 Aug;173(2):291-9. | PubMed | Mabry H, Giuliano AE, Silverstein MJ. What is the value of axillary dissection or sentinel node biopsy in patients with ductal carcinoma in situ? Am J Surg. 2006 Oct;192(4):455-7. | CrossRef | PubMed |
Mabry H, Giuliano AE, Silverstein MJ. What is the value of axillary dissection or sentinel node biopsy in patients with ductal carcinoma in situ? Am J Surg. 2006 Oct;192(4):455-7. | CrossRef | PubMed | Middleton LP, Grant S, Stephens T, Stelling CB, Sneige N, Sahin AA. Lobular carcinoma in situ diagnosed by core needle biopsy: when should it be excised? Mod Pathol. 2003 Feb;16(2):120-9. | CrossRef | PubMed |
Middleton LP, Grant S, Stephens T, Stelling CB, Sneige N, Sahin AA. Lobular carcinoma in situ diagnosed by core needle biopsy: when should it be excised? Mod Pathol. 2003 Feb;16(2):120-9. | CrossRef | PubMed | Mokbel K. Contemporary treatment of ductal carcinoma in situ of the breast. Med Sci Monit. 2005 Mar;11(3):RA86-93. | PubMed |
Mokbel K. Contemporary treatment of ductal carcinoma in situ of the breast. Med Sci Monit. 2005 Mar;11(3):RA86-93. | PubMed | Moran CJ, Kell MR, Flanagan FL, Kennedy M, Gorey TF, Kerin MJ. Role of sentinel lymph node biopsy in high-risk ductal carcinoma in situ patients. Am J Surg. 2007 Aug;194(2):172-5. | CrossRef | PubMed |
Moran CJ, Kell MR, Flanagan FL, Kennedy M, Gorey TF, Kerin MJ. Role of sentinel lymph node biopsy in high-risk ductal carcinoma in situ patients. Am J Surg. 2007 Aug;194(2):172-5. | CrossRef | PubMed | Morrow M. Axillary surgery in DCIS: is less more? Ann Surg Oncol. 2008 Oct;15(10):2641-2. Epub 2008 Aug 5. | CrossRef | PubMed |
Morrow M. Axillary surgery in DCIS: is less more? Ann Surg Oncol. 2008 Oct;15(10):2641-2. Epub 2008 Aug 5. | CrossRef | PubMed | O'Sullivan MJ, Morrow M. Ductal carcinoma in situ--current management. Surg Clin North Am. 2007 Apr;87(2):333-51, viii. | CrossRef | PubMed |
O'Sullivan MJ, Morrow M. Ductal carcinoma in situ--current management. Surg Clin North Am. 2007 Apr;87(2):333-51, viii. | CrossRef | PubMed | Rakovitch E, Pignol JP, Hanna W, Narod S, Spayne J, Nofech-Mozes S, et al. Significance of multifocality in ductal carcinoma in situ: outcomes of women treated with breast-conserving therapy. J Clin Oncol. 2007 Dec 10;25(35):5591-6. Epub 2007 Nov 5. | CrossRef | PubMed |
Rakovitch E, Pignol JP, Hanna W, Narod S, Spayne J, Nofech-Mozes S, et al. Significance of multifocality in ductal carcinoma in situ: outcomes of women treated with breast-conserving therapy. J Clin Oncol. 2007 Dec 10;25(35):5591-6. Epub 2007 Nov 5. | CrossRef | PubMed | Rashtian A, Iganej S, Amy Liu IL, Natarajan S. Close or positive margins after mastectomy for DCIS: pattern of relapse and potential indications for radiotherapy. Int J Radiat Oncol Biol Phys. 2008 Nov 15;72(4):1016-20. | CrossRef | PubMed |
Rashtian A, Iganej S, Amy Liu IL, Natarajan S. Close or positive margins after mastectomy for DCIS: pattern of relapse and potential indications for radiotherapy. Int J Radiat Oncol Biol Phys. 2008 Nov 15;72(4):1016-20. | CrossRef | PubMed | Recht A. Should patients with lobular carcinoma in situ be irradiated? --not yet, but.... Eur J Cancer. 2005 Feb;41(3):344-5. | CrossRef | PubMed |
Recht A. Should patients with lobular carcinoma in situ be irradiated? --not yet, but.... Eur J Cancer. 2005 Feb;41(3):344-5. | CrossRef | PubMed | Ringberg A, Nordgren H, Thorstensson S, Idvall I, Garmo H, Granstrand B, et al. Histopathological risk factors for ipsilateral breast events after breast conserving treatment for ductal carcinoma in situ of the breast--results from the Swedish randomised trial. Eur J Cancer. 2007 Jan;43(2):291-8. Epub 2006 Nov 21. | CrossRef | PubMed |
Ringberg A, Nordgren H, Thorstensson S, Idvall I, Garmo H, Granstrand B, et al. Histopathological risk factors for ipsilateral breast events after breast conserving treatment for ductal carcinoma in situ of the breast--results from the Swedish randomised trial. Eur J Cancer. 2007 Jan;43(2):291-8. Epub 2006 Nov 21. | CrossRef | PubMed | Rudloff U, Brogi E, Brockway JP, Goldberg JI, Cranor M, Wynveen CA, et al. Concurrent lobular neoplasia increases the risk of ipsilateral breast cancer recurrence in patients with ductal carcinoma in situ treated with breast-conserving therapy. Cancer. 2009 Mar 15;115(6):1203-14. | CrossRef | PubMed |
Rudloff U, Brogi E, Brockway JP, Goldberg JI, Cranor M, Wynveen CA, et al. Concurrent lobular neoplasia increases the risk of ipsilateral breast cancer recurrence in patients with ductal carcinoma in situ treated with breast-conserving therapy. Cancer. 2009 Mar 15;115(6):1203-14. | CrossRef | PubMed | Shelley W, McCready D, Holloway C, Trudeau M, Sinclair S, Breast Cancer Disease Site Group. Management of ductal carcinoma in situ of the breast: a clinical practice guideline. Toronto (ON): Cancer Care Ontario (CCO); 2006 Sep 19. 41 p. (Evidence-based series; no. 1-10). | Link |
Shelley W, McCready D, Holloway C, Trudeau M, Sinclair S, Breast Cancer Disease Site Group. Management of ductal carcinoma in situ of the breast: a clinical practice guideline. Toronto (ON): Cancer Care Ontario (CCO); 2006 Sep 19. 41 p. (Evidence-based series; no. 1-10). | Link | Shin SJ, Rosen PP. Excisional biopsy should be performed if lobular carcinoma in situ is seen on needle core biopsy. Arch Pathol Lab Med. 2002 Jun;126(6):697-701. | PubMed |
Shin SJ, Rosen PP. Excisional biopsy should be performed if lobular carcinoma in situ is seen on needle core biopsy. Arch Pathol Lab Med. 2002 Jun;126(6):697-701. | PubMed | Sigal-Zafrani B, Lewis JS, Clough KB, Vincent-Salomon A, Fourquet A, Meunier M, et al. Histological margin assessment for breast ductal carcinoma in situ: precision and implications. Mod Pathol. 2004 Jan;17(1):81-8. | CrossRef | PubMed |
Sigal-Zafrani B, Lewis JS, Clough KB, Vincent-Salomon A, Fourquet A, Meunier M, et al. Histological margin assessment for breast ductal carcinoma in situ: precision and implications. Mod Pathol. 2004 Jan;17(1):81-8. | CrossRef | PubMed | Smith BD, Haffty BG, Buchholz TA, Smith GL, Galusha DH, Bekelman JE, et al. Effectiveness of radiation therapy in older women with ductal carcinoma in situ. J Natl Cancer Inst. 2006 Sep 20;98(18):1302-10. | CrossRef | PubMed |
Smith BD, Haffty BG, Buchholz TA, Smith GL, Galusha DH, Bekelman JE, et al. Effectiveness of radiation therapy in older women with ductal carcinoma in situ. J Natl Cancer Inst. 2006 Sep 20;98(18):1302-10. | CrossRef | PubMed | Solin LJ. Is excision alone adequate treatment for low-risk ductal carcinoma-in-situ of the breast? J Clin Oncol. 2006 Mar 1;24(7):1017-9. Epub 2006 Feb 6. | CrossRef | PubMed |
Solin LJ. Is excision alone adequate treatment for low-risk ductal carcinoma-in-situ of the breast? J Clin Oncol. 2006 Mar 1;24(7):1017-9. Epub 2006 Feb 6. | CrossRef | PubMed | Solin LJ, Fourquet A, Vicini FA, Taylor M, Olivotto IA, Haffty B, et al. Long-term outcome after breast-conservation treatment with radiation for mammographically detected ductal carcinoma in situ of the breast. Cancer. 2005 Mar 15;103(6):1137-46. | CrossRef | PubMed |
Solin LJ, Fourquet A, Vicini FA, Taylor M, Olivotto IA, Haffty B, et al. Long-term outcome after breast-conservation treatment with radiation for mammographically detected ductal carcinoma in situ of the breast. Cancer. 2005 Mar 15;103(6):1137-46. | CrossRef | PubMed | Wong JS, Kaelin CM, Troyan SL, Gadd MA, Gelman R, Lester SC, et al. Prospective study of wide excision alone for ductal carcinoma in situ of the breast. J Clin Oncol. 2006 Mar 1;24(7):1031-6. Epub 2006 Feb 6. | CrossRef | PubMed |
Wong JS, Kaelin CM, Troyan SL, Gadd MA, Gelman R, Lester SC, et al. Prospective study of wide excision alone for ductal carcinoma in situ of the breast. J Clin Oncol. 2006 Mar 1;24(7):1031-6. Epub 2006 Feb 6. | CrossRef | PubMed | Yi M, Krishnamurthy S, Kuerer HM, Meric-Bernstam F, Bedrosian I, Ross MI, et al. Role of primary tumor characteristics in predicting positive sentinel lymph nodes in patients with ductal carcinoma in situ or microinvasive breast cancer. Am J Surg. 2008 Jul;196(1):81-7. Epub 2008 Apr 23. | CrossRef | PubMed |
Yi M, Krishnamurthy S, Kuerer HM, Meric-Bernstam F, Bedrosian I, Ross MI, et al. Role of primary tumor characteristics in predicting positive sentinel lymph nodes in patients with ductal carcinoma in situ or microinvasive breast cancer. Am J Surg. 2008 Jul;196(1):81-7. Epub 2008 Apr 23. | CrossRef | PubMed |