 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: high intensity interval training, aerobic exercises, oxidative stress, reactive oxygen species, type 2 diabetes mellitus
INTRODUCCIÓN
El estrés oxidativo es causado por un desequilibrio entre una excesiva producción de especies reactivas de oxígeno y/o un déficit en el nivel de defensas antioxidantes endógenas y exógenas. La presencia de especies reactivas de oxígeno en grandes cantidades y por tiempos prolongados, se asocia a la aparición de diversas patologías, entre ellas la diabetes mellitus tipo 2. El ejercicio físico representa un medio efectivo para la prevención y el tratamiento de la diabetes mellitus tipo 2, también es capaz de reducir los niveles de estrés oxidativo a largo plazo. El entrenamiento interválico de alta intensidad ha mostrado ser una opción eficaz y viable en el control de la diabetes mellitus tipo 2. A su vez, el entrenamiento interválico de alta intensidad parece tener efectos positivos sobre los niveles de estrés oxidativo, aumentando los niveles de antioxidantes endógenos.
OBJETIVO
Comprobar la validez y aplicabilidad de los resultados en la efectividad que presenta el entrenamiento interválico de alta intensidad, en comparación con el entrenamiento continuo de moderada intensidad en la reducción del estrés oxidativo de pacientes con diabetes mellitus tipo 2. También se busca responder a la siguiente interrogante: en pacientes adultos con diabetes mellitus tipo 2, ¿puede el entrenamiento interválico de alta intensidad, en comparación con el entrenamiento continuo de moderada intensidad, reducir los niveles de estrés oxidativo?
MÉTODOS
Se analizó críticamente el artículo “Entrenamiento continuo versus interválico en el control glicémico y la reactividad macro y microvascular en pacientes con diabetes tipo 2”.
RESULTADOS
No se observaron cambios estadísticamente significativos en las concentraciones de superóxido dismutasa en ninguno de los grupos experimentales. Sólo en el grupo de entrenamiento interválico se observa una disminución significativa de malondialdehído en comparación al grupo control y a los niveles basales (p<0,05). Respecto a la enzima glutatión peroxidasa sólo en el grupo de entrenamiento interválico se observaron cambios significativos en comparación al grupo de entrenamiento aeróbico continuo y a los niveles basales (p<0,05). El óxido nítrico aumentó significativamente en el grupo de entrenamiento interválico respecto del grupo control, del grupo aeróbico continuo y del inicio del estudio (p<0,05).
CONCLUSIÓN
Si bien en ambos grupos de entrenamiento se observaron mejoras respecto de marcadores de perfil lipídico y de la condición física general, el entrenamiento interválico de alta intensidad mostró ser más efectivo en la normalización del estrés oxidativo, incidiendo de forma positiva en la concentración de marcadores pro-oxidantes y antioxidantes.
En pacientes adultos con diabetes mellitus tipo 2, ¿puede el entrenamiento interválico de alta intensidad, en comparación con el entrenamiento continuo de moderada intensidad, reducir los niveles de estrés oxidativo?
1. Estrés oxidativo
Durante el proceso evolutivo, los seres vivos se han ido desarrollando para poder utilizar diferentes elementos que se encuentran en el ambiente. Uno de éstos elementos, vital para la sobrevivencia, es el oxígeno (O2) [1]. El oxígeno es utilizado por las diferentes células del organismo durante el proceso de producción de energía en la cadena transportadora de electrones de la mitocondria. Diferentes macronutrientes, como hidratos de carbono, lípidos y proteínas, son metabolizados a través de diferentes reacciones enzimáticas conocidas como metabolismo intermediario, para producir energía en forma de adenosina trifosfato junto con agua (H2O) y dióxido de carbono (CO2) [1]. En este proceso, el oxígeno participa como un aceptor final de electrones (e-) y protones (H+).
El oxígeno es altamente reactivo, pudiendo ser letal en altas dosis. Durante la producción de energía en la cadena transportadora mitocondrial, algunos electrones pueden liberarse desde ciertos complejos y son aceptados de forma inespecífica por el oxígeno, conduciendo a la formación de moléculas conocidas como especies reactivas de oxígeno o reactive oxygen species (ROS por sus siglas en inglés) [2]. Algunas de estas moléculas son el anión súper óxido (O2•-), el peróxido de hidrógeno (H2O2), y el radical hidroxilo (•OH), los que se forman por las siguientes reacciones [2]:
Reacción 1: O2+ e-→ O2•-
Reacción 2: O2•- + e-→ H2O2
Reacción 3: H2O2 + e-→ •OH
Reacción 4: •OH + e-→ H2O
El anión súper óxido y el radical hidroxilo son radicales libres propiamente tal, ya que poseen un electrón desapareado en sus orbitales. Si bien el peróxido de hidrógeno es un componente reactivo, no se considera radical libre en estricto rigor [2].
En altas concentraciones las especies reactivas de oxígeno pueden ser peligrosas ya que pueden reaccionar indiscriminadamente con cualquier molécula, siendo el radical hidroxilo la especie reactiva más potente. Estos efectos nocivos pueden afectar diversos componentes de la célula tales como lípidos, proteínas, diversas enzimas y al ADN [3].
Existen diferentes enzimas que producen especies reactivas de oxígeno tales como xantinaoxidasa (XO), NADPH oxidasa, óxido nítrico sintetasa endotelial (eNOS), citocromo P450, entre otros [4],[5],[6]. La xantinaoxidasa puede catalizar la oxidación de hipoxantina en xantina, además de cumplir un rol importante en el catabolismo de las purinas en algunas especies, incluyendo humanos. A su vez, la xantinaoxidasa cataliza la oxidación de la xantina a ácido úrico. En ambos procesos se genera anión súper óxido tal como se muestra en las siguientes reacciones:
Hipoxantina + O2 → Xantina + O2•-
Xantina + H2O+ O2 → Ácido úrico + O2•-
Por su parte, la NADPH oxidasa cataliza la reducción de una partícula de oxígeno para generar anión súper óxido, utilizando NADPH como la fuente de electrones. Esta enzima tiene una función bactericida en neutrófilos activados, en los que se generan grandes cantidades de anión súper óxido tóxico y otras especies reactivas de oxígeno importantes. Las óxido nítrico sintetasa (NOS) son una familia de enzimas que convierten el aminoácido L-arginina en L-citrulina y óxido nítrico (NO). Su función más conocida es la regulación del tono vascular a través del óxido nítrico. Existen tres isoformas de la óxido nítrico sintetasa: óxido nítrico sintetasa neuronal (nNOS), óxido nítrico sintetasa endotelial (eNOS) y óxido nítrico sintetasa inducible (iNOS). La óxido nítrico sintetasa endotelial puede ser desacoplada en la ausencia de L-arginina. En este estado el óxido nítrico sintetasa endotelial puede producir anión súper óxido en vez de óxido nítrico [2].
En mamíferos se ha observado que en condiciones de reposo, entre 0,15 y 5% del total de oxígeno consumido por las células se convierte en especies reactivas de oxígeno [7]. Frente a esta situación, los seres vivos han desarrollado diferentes formas de disminuir las especies reactivas de oxígeno en la célula, con tal de evitar daños. Esta respuesta antioxidante endógena permite mantener en niveles óptimos a las especies reactivas de oxígeno para la vida y está basada en la acción de distintas enzimas antioxidantes, tales como la superóxido dismutasa (SOD), catalasa, glutatión peroxidasa y glutatión reductasa [6].
Existen distintas variedades de superóxido dismutasa (SOD): Cu-SOD, Zn-SOD y Mn-SOD. Las enzimas Cu-SOD y Zn-SOD se ubican en el citosol, núcleo y en el espacio intermembrana de la mitocondria [8]. Por su parte, la Mn-SOD se encuentra en la matriz mitocondrial. Tal como su nombre lo indica, la superóxido dismutasa cataliza la dismutación de anión súper óxido, generando peróxido de hidrógeno y oxígeno, a través de la siguiente reacción [2]:
O2•- + O2•- + 2H+→ H2O2 + O2
Si bien la superóxido dismutasa produce peróxido de hidrógeno, esta especie reactiva es menos tóxica que el anión súper óxido. La disminución de anión súper óxido merma la probabilidad de formar radical hidroxilo. Además, el peróxido de hidrógeno puede ser metabolizado por la catalasa. Esta proteína es otra enzima antioxidante, presente en todos los tejidos, principalmente en hepatocitos y eritrocitos. A nivel celular se localiza en mitocondrias y peroxisomas, excepto en los eritrocitos donde se sitúa en el citosol. La catalasa es capaz de transformar el peróxido de hidrógeno en oxígenos y en agua a través de la siguiente reacción [2]:
H2O2+ H2O2→ O2+ 2H2O
La glutatión peroxidasa cataliza la reducción de peróxido de hidrógeno a expensas de glutatión, convirtiendo el glutatión reducido (GSH) en glutatión oxidado (GSSG) y formando agua mediante la siguiente reacción [2]:
2GSH + H2O2→ GSSG + 2H2O
El glutatión oxidado es reducido por la acción de la glutatión reductasa, enzima que utiliza NADPH como el donante de equivalentes reductores, a través de la siguiente reacción [2]:
GSSG + NADPH + H+→ 2GSH + NADP+
Además de estas enzimas, existen diversas moléculas antioxidantes exógenas, generalmente provenientes de la dieta, como las vitaminas E, A y C que contribuyen a la disminución de especies reactivas de oxígeno [2],[6].
Cuando existe una excesiva producción de especies reactivas de oxígeno y/o un déficit en el nivel de defensas antioxidantes endógenas y exógenas, se produce un estado de desbalance denominado estrés oxidativo [2]. Una forma de evaluar el daño por estrés oxidativo es a través de la medición del malondialdehido (MDA). Este compuesto es sintetizado como producto de una peroxidación de ácidos grasos poliinsaturados presentes en la membrana celular y en otros fosfolípidos, por acción de radicales libres y especies reactivas de oxígeno. Por esta razón, la concentración plasmática de malondialdehído es proporcional a los ácidos grasos poliinsaturados oxidados, siendo un buen indicador de peroxidación lipídica [9].
A pesar de tener efectos tóxicos para el organismo en altas concentraciones, es preciso consignar que las especies reactivas de oxígeno en concentraciones normales pueden actuar como moduladores beneficiosos en una serie de procesos fisiológicos. Entre ellos se cuentan el crecimiento celular [7],[10],[11], aumento de la transcripción de ADN mitocondrial [8], contractibilidad del corazón [12], mejora en la captación de glucosa en músculos activos [13], efectos cardio protectores tras leves periodos de isquemia o de ejercicio [14],[15], incremento de la capacidad antioxidante general del organismo [5],[10],[16], entre otros.
2. Aspectos epidemiológicos generales
La presencia de especies reactivas de oxígeno en altas concentraciones y por períodos prolongados de tiempo, se asocia a la aparición de diferentes patologías como la hipertensión [4], resistencia a la insulina y diabetes [17]; sarcopenia [18], sobrepeso y obesidad [19],[20]; síndrome metabólico [21], cáncer y caquexia [22]; entre otros. En Chile existe una gran prevalencia de estas patologías, asociadas fundamentalmente a un estado de vida sedentario y a una mala nutrición (Tabla 1).
Por lo tanto, es esencial lograr un equilibrio entre los factores pro-oxidantes y los antioxidantes, de modo que las especies reactivas de oxígeno se comporten como factores moduladores y no patológicos [11].
2.1 Diabetes mellitus tipo 2 y estrés oxidativo
La diabetes mellitus tipo 2 es una de las enfermedades crónicas no transmisibles de mayor prevalencia en Chile [23] y en el mundo [24]. Existe a su vez una estudiada asociación entre estrés oxidativo, resistencia a la insulina y la diabetes mellitus tipo 2 [17],[25],[26]. Esto se debe a que en estados crónicos de hiperglicemia y/o hiperlipidemia se producen altas concentraciones de especies reactivas de oxígeno. Dicha situación conduce a un deterioro progresivo en la función normal de las células β del páncreas, afectándose así la síntesis y secreción de insulina [26].
Por otra parte, en aquellos casos en que la diabetes mellitus tipo 2 se encuentra vinculada a cuadros de obesidad, se pueden afectar las vías de señalización de la insulina por cambios en la conformación de los sustratos del receptor de insulina. De esta forma se altera funcionalmente el receptor de insulina y se disminuye la translocación de transportadores de glucosa dependientes de insulina como los GLUT-4 [27].
3. Efectos del ejercicio en la producción de especies reactivas de oxígeno
Durante la realización de ejercicio físico existe una redistribución del flujo sanguíneo debido a un aumento en el metabolismo de las células activas, especialmente en las fibras de músculo esquelético. Asimismo, existe un menor flujo sanguíneo en los órganos viscerales. Si bien hay un aumento del flujo sanguíneo hacia los músculos, éstos pueden experimentar breves períodos de hipoxia, seguidos de períodos de reperfusión. Ello se debe a que contracciones musculares superiores al 50% de la capacidad funcional del músculo son capaces de generar una breve oclusión vascular [28]. Dicha situación puede conducir a un incremento paradójico en la producción de especies reactivas de oxígeno mitocondrial debido a que, en ausencia de oxígeno, el complejo III de la cadena transportadora de electrones generaría anión súper óxido de forma controlada [6],[8]. El anión súper óxido daría origen, a su vez, a otras especies reactivas de oxígeno, siendo el peróxido de hidrógeno el principal mediador de la señalización intracelular (segundo mensajero) [29].
Durante el período de recuperación existe un proceso inflamatorio post-ejercicio, el cual también conduce a la generación de especies reactivas de oxígeno. Este proceso estaría mediado en parte por la activación de leucocitos, los cuales inducen una reacción entre el oxígeno y la NADPH oxidasa para formar anión súper óxido [5]. Se ha observado que durante la contracción muscular la enzima xantinaoxidasa endotelial adyacente a un músculo activo, juega un papel importante en la producción y liberación de anión súper óxido, especie que estaría implicada en la fuerza de la contracción muscular [30],[31]. Durante la realización de ejercicios de alta intensidad existe una hipoxia muscular [8], ya que la demanda metabólica de los músculos activos supera el flujo de oxígeno. Esta situación vuelve a la normalidad en las pausas, existiendo un periodo de reperfusión de los tejidos activos [32].
Las especies reactivas de oxígeno cumplen un papel importante durante el ejercicio, ya que se ha observado que las fibras musculares aumentan su sensibilidad al calcio (Ca2+) intracelular, produciendo contracciones más fuertes tanto en cardiomiocitos como en fibras de músculo esquelético [33]. Inmediatamente después de una sesión de ejercicios de alta intensidad, existe un aumento de las especies reactivas de oxígeno en comparación a las 24 horas posteriores al ejercicio, independiente de la condición física del sujeto [16]. Las especies reactivas de oxígeno producidas durante y después de una sesión de ejercicios, activarían distintas vías de señalización intracelular asociadas a procesos de regulación génica. Estos procesos estarían mediados por distintos factores transcripcionales como el factor nuclear KB (NF-KB), el factor activador de proteínas-1 (AP-1), los factores de señalización transductoras y activadoras de transcripción 3 (STAT3) y los factores inducibles de hipoxia (HIF), entre otros [5],[6],[8],[34],[35]. El factor nuclear KB es un sensor del estado redox que regula genes relacionados con la inflamación, crecimiento celular [8],[10],[36] y aumentos de la Mn SOD [35]. El factor activador de proteínas-1 es un sensor intracelular del estado redox y regula la expresión de varios genes relacionados con las respuestas frente al estrés, crecimiento, diferenciación celular y al aumento de la Mn SOD [8],[35]. Los factores de señalización transductoras y activadoras de transcripción 3 regulan señales antiapoptóticas, de proliferación y diferenciación celular, regeneración del músculo esquelético y protección cardiaca. La activación de factores de señalización transductoras y activadoras de transcripción 3 es mediada por el ejercicio a través de los procesos inflamatorios que éste induce, tales como citoquinas, interleucina 6 (IL-6) y las especies reactivas de oxígeno [37]. En el cardiomiocito, los factores de señalización transductoras y activadoras de transcripción 3 regulan la protección cardiaca inducida por la isquemia [37]. Los factores inducibles de hipoxia (HIF-1α y HIF1-β) son mediadores de la activación transcripcional de genes de eritropoyetina, del factor de crecimiento del endotelio vascular [8], enzimas glicolíticas, entre otros.
3.1 Entrenamiento interválico de alta intensidad
El entrenamiento interválico de alta intensidad es un método fraccionado proveniente del entrenamiento interválico o interval training proveniente del atletismo [32],[38]. Por este motivo, el entrenamiento interválico de alta intensidad emplea ejercicios de modalidad aeróbico-cíclicas como pedestrismo, ciclismo y otros [32],[39]. Sin embargo, existen también algunas propuestas de modalidad neuromuscular o basadas en ejercicios de fuerza [38],[39].
El entrenamiento interválico de alta intensidad se caracteriza por alternar tandas breves de ejercicio de alta intensidad con sucesivos periodos de recuperación. Generalmente, los esfuerzos realizados durante cada intervalo son de una intensidad superior al umbral anaeróbico, cercanos al rango entre 80 y 95% de la frecuencia cardiaca máxima, con una duración entre 10 y 15 segundos hasta 4 o 5 minutos [40]. Asimismo, los periodos de recuperación pueden alcanzar una intensidad aproximada de 40 a 50% de la frecuencia cardiaca máxima y una duración similar o ligeramente superior a los periodos de esfuerzo [38]. La cantidad, duración e intensidad de los intervalos, además de la modalidad de ejercicio elegida, dependerán de la condición física del sujeto y de los objetivos perseguidos [32],[39].
Se ha observado en estudios experimentales con modelos humanos que luego de una intervención de tres semanas de entrenamiento interválico de alta intensidad del tipo sprint (4 a 6 intervalos de 30 segundos a la máxima intensidad, con 4 minutos de descanso entre cada intervalo), con una frecuencia semanal de tres sesiones, existe una mejora significativa en la capacidad antioxidante total de los sujetos entrenados [16].
3.2 Entrenamiento continuo de moderada intensidad
El entrenamiento continuo de moderada intensidad, también conocido como entrenamiento aeróbico continuo, es un método de preparación de la resistencia aeróbica que se caracteriza por la realización de esfuerzos de intensidad media (entre 40 y 70% de la frecuencia cardiaca máxima), con una duración que se puede prolongar entre 15 minutos hasta varias horas [38]. Por lo general, se recomienda realizar este tipo de ejercicio durante un mínimo de 30 minutos. Habitualmente, las modalidades de ejercicio empleadas para este tipo de entrenamiento son de tipo aeróbico-cíclicas como ciclismo, natación o pedestrismo. En la actualidad, la prescripción de ejercicio para los pacientes que presenten resistencia a la insulina o diabetes mellitus tipo 2, se centran en este tipo de entrenamiento [41].
La masificación del entrenamiento interválico de alta intensidad como método de preparación con fines terapéuticos, es un asunto que desde el punto de vista de la medicina basada en la evidencia aún requiere de un mayor sustento. Por este motivo y considerando la relación del estrés oxidativo y la prevalencia de la diabetes mellitus tipo 2, es que se analizarán los resultados del ensayo clínico aleatorizado "Continuous vs interval training on glycemic control and macro- and microvascular reactivity in type 2 diabetic patients" [42]. Este trabajo buscó determinar la efectividad del entrenamiento interválico de alta intensidad comparado con el entrenamiento continuo de moderada intensidad, en la reducción del estrés oxidativo de pacientes adultos con diabetes mellitus tipo 2.
Artículo analizado
Mitranun W, Deerochanawong C, Tanaka H, Suksom D. Continuous vs interval training on glycemic control and macro- and microvascular reactivity in type 2 diabetic patients. Scand J Med Sci Sports. 2014 Apr;24(2):e69-76. doi: 10.1111/sms.12112. Epub 2013 Sep 17.
Tipo de estudio: ensayo clínico aleatorizado.
Ensayo clínico aleatorizado que indaga acerca de los efectos del entrenamiento aeróbico interválico en comparación al entrenamiento aeróbico continuo, sobre el control glicémico, la condición física y la reactividad micro y macrovascular en pacientes adultos mayores con diagnóstico de diabetes mellitus tipo 2. Se reclutaron 43 sujetos que fueron estudiados en tres grupos aleatorios: entrenamiento aeróbico interválico, entrenamiento aeróbico continuo y grupo sedentarios. La intervención para los grupos experimentales (entrenamiento aeróbico interválico y entrenamiento aeróbico continuo) consistió en entrenamiento sobre un tapiz rodante durante 12 semanas con tres sesiones por cada semana. La planificación contempló tres fases de entrenamiento, las que contaron con el mismo volumen e intensidad para ambos grupos. Se midió el nivel de condición física, la reactividad vascular y el perfil bioquímico de la sangre en los pacientes, antes y después de la intervención.
Investigar los efectos del entrenamiento aeróbico interválico sobre el control glicémico, condición física y la reactividad micro y macrovascular en pacientes adultos mayores con diabetes mellitus tipo 2.
Criterios de inclusión
Criterios de exclusión
Intervención y comparación
De la muestra elegible, los individuos fueron distribuidos aleatoriamente en tres grupos:
Los planes de entrenamiento para las intervenciones (grupos entrenamiento aeróbico interválico y entrenamiento aeróbico continuo) consideraron tres sesiones semanales, durante un período de 12 semanas. Asimismo, la planificación contempló un ajuste progresivo de las cargas de trabajo, representado en tres periodos de entrenamiento o fases que se detallan en la Tabla 2.
Tabla 2. Resumen de las intervenciones de entrenamiento.
Datos de la condición física relacionada con la salud
Se evaluó la composición corporal utilizando un analizador de impedancia bioeléctrica (In Body 220, Biospace, Seúl, Corea). El consumo máximo de oxígeno se evaluó de manera directa con el sistema de intercambio de gas cardiopulmonar (Cortex) a través del protocolo de Bruce modificado sobre tapiz rodante. El ritmo cardíaco se midió con un pulsómetro (Polar Team 2 Pro, Polar Electro Inc., Lake Success, NY, USA). La fuerza muscular se evaluó utilizando el método de una repetición máxima en los siguientes ejercicios: extensión pierna, flexión de rodilla, presión pecho y polea al pecho. La medición se realizó con máquinas de fuerza tipo Nautilus. Para evaluar la flexibilidad del tronco se utilizó el test sit-and-reach (sentarse y alcanzar).
Datos de la bioquímica de la sangre
Datos de la reactividad vascular
Las características de la arteria braquial se evaluaron con el ultrasonido equipo (CX50, Philips, Andover, MA, Estados Unidos), utilizando la técnica de oclusión arterial en el antebrazo derecho. Se midió la media de velocidad de la sangre en el modo Doppler pulsado. Los datos evaluados fueron diámetro braquial de base, diámetro braquial máximo, dilatación mediada por flujo, tiempo máximo de diámetro, velocidad de cizallamiento en reposo, resistencia vascular (se calculó como la media presión arterial/flujo sanguíneo braquial), conductancia vascular (se calculó como el flujo sanguíneo braquial/presión arterial media), flujo sanguíneo cutáneo en reposo, flujo cutáneo sanguíneo maximal y proporción de flujo cutáneo continuo maximal (se midieron en la muñeca derecha con un láser Doppler de flujometría).
De 45 individuos que participaron en el estudio, los cuales fueron aleatorizados y asignados en sus grupos correspondientes, sólo dos no completaron el 80% del programa de entrenamiento por lo que fueron excluidos del análisis estadístico. Los niveles de grasa corporal y la frecuencia cardiaca en reposo disminuyeron, mientras que la fuerza muscular del miembro inferior aumentó (todos P<0,05), tanto en el grupo entrenamiento aeróbico continuo como en el grupo entrenamiento aeróbico interválico. Los niveles de glucosa sanguínea en ayunas disminuyeron (P<0,05) en ambos grupos de ejercicio, pero los niveles de hemoglobina glicosilada disminuyeron (P<0,05) sólo en el grupo entrenamiento aeróbico interválico. La capacidad aeróbica máxima, la dilatación mediada por flujo y la hiperemia cutánea reactiva aumentaron significativamente en ambos grupos de ejercicio. Sin embargo, la magnitud de las mejoras fue mayor en el grupo de entrenamiento aeróbico interválico.
Sólo en el grupo entrenamiento aeróbico interválico disminuyó de manera significativa la concentración de malondialdehído en eritrocitos y factor de Von Willebrand, además de observarse un aumento de la glutatión peroxidasa en el plasma y óxido nítrico (todos P<0,05).
Acerca de la validez
Tabla 3. Análisis acerca de la validez del estudio.
El ensayo analizado presenta una aleatorización de la muestra, la cual es declarada por los autores. Se pueden observar distribuciones bastante homogéneas entre los tres grupos experimentales. No obstante, la omisión de detalles acerca del proceso y métodos empleados en la aleatorización podría implicar un sesgo en la selección de la muestra.
En relación al ocultamiento de la asignación y al enmascaramiento, no son mencionados en el artículo. Esta situación podría contribuir a acrecentar el sesgo de selección de la muestra y, eventualmente, producir sesgos de realización y detección.
Respecto al seguimiento, los autores decidieron excluir del análisis final a todos aquellos pacientes que no completaran al menos un 80% del total de sesiones de entrenamiento. Según dicho criterio, fueron excluidos dos sujetos (uno de entrenamiento aeróbico interválico y otro de entrenamiento aeróbico continuo). A pesar de esto, la tasa de adhesión al programa de ejercicio fue alta por lo cual no se produciría un sesgo de desgaste.
Los autores declaran que todos los pacientes se encontraban previamente medicados con antihiperglicémicos y que las dosis de estos no sufrieron variaciones durante el estudio. Aún así, no se explicita qué fármacos antihiperglicémicos fueron utilizados y si existían o no diferencias en las dosis de administración entre cada paciente previo al programa.
El análisis estadístico empleado por los autores fue “por protocolo”, ya que sólo fueron considerados los datos de aquellos pacientes que completaron más del 80% de la intervención. Al realizar este tipo de tratamiento estadístico no se consideran a los pacientes que, por diversos motivos, podrían desertar de un plan de entrenamiento en la realidad. Asimismo, al sólo ser considerados aquellos pacientes que completan exitosamente el programa propuesto por los investigadores, los efectos de los distintos tipos de entrenamiento podrían ser sobreestimados. Como las razones que han motivado la no consideración de datos tienen que ver con no afectar los desenlaces del ensayo, podría producirse un sesgo en relación al tratamiento de la información. Los detalles se aprecian en la Tabla 3.
Acerca de los resultados
Tabla 4. Datos de la condición física relacionada con la salud.
Se observó una disminución significativa en la presión sanguínea sistólica en el grupo de entrenamiento aeróbico interválico, pero no en el grupo de entrenamiento aeróbico continuo. La fuerza de extensión de las piernas aumentó en ambos grupos de ejercicio, aunque la fuerza de flexión de rodilla sólo tuvo un incremento en el grupo de entrenamiento aeróbico interválico. Se incluyeron mediciones de fuerza en músculos del tren superior para observar posibles efectos de transferencia entre el tren inferior y superior. La fuerza del tren superior, según la evaluación de “fuerza de banca” y “subir y bajar (pull down) laterales”, no cambió en ningún grupo. El consumo máximo de oxígeno (VO2máx) aumentó en ambos grupos de ejercicio, pero la magnitud del incremento fue mayor en el grupo de entrenamiento aeróbico interválico que en el de entrenamiento aeróbico continuo. No hubo cambios en las características ni en las mediciones físicas del grupo sedentarios, como se aprecia en la Tabla 4.
Tabla 5. Datos bioquímicos de la sangre.
Se observó una disminución significativa de la glucosa sanguínea en ayunas y de la resistencia a la insulina (HOMA) en ambos grupos de ejercicio. Sólo en el grupo de entrenamiento aeróbico interválico hubo una disminución significativa de los niveles de hemoglobina glicosilada. Podemos contrastar estos resultados con los de otros estudios similares en diabetes mellitus tipo 2, que afirman la reducción significativa e inmediata de la glucosa en sangre luego de una sesión de entrenamiento interválico de alta intensidad, como también en efecto a largo plazo posterior a un programa de entrenamiento [43]. El perfil lipídico mejoró significativamente en ambos grupos (entrenamiento aeróbico continuo y entrenamiento aeróbico interválico), dejando en evidencia los efectos positivos que tiene el ejercicio aeróbico de moderada intensidad y el entrenamiento interválico de alta intensidad en la regulación del metabolismo lipoproteico.
En cuanto a factores asociados al estrés oxidativo, se observó una disminución significativa en los niveles de malondialdehído en el grupo de entrenamiento aeróbico interválico posterior a la intervención y respecto del grupo de sedentarios. Asimismo, se presentó un incremento en los niveles del factor de Von Willebrand, el óxido nítrico y la glutatión peroxidasa (Tabla 5). Respecto a esta última, ya existía evidencia del aumento de sus niveles en intervenciones con sujetos sanos, en los que la glutatión peroxidasa se elevó considerablemente después de una sesión de entrenamiento interválico de alta intensidad y manteniéndose varias horas después de ésta [16],[44]. Ello podría complementar y justificar la mejora en los niveles de la glutatión peroxidasa, tras someterse a un periodo de entrenamiento de entrenamiento interválico de alta intensidad.
Sería interesante analizar mejor los beneficios del entrenamiento interválico de alta intensidad en otros marcadores antioxidantes como la catalasa, que en sujetos sanos ha mostrados buenos resultados después de las sesiones de entrenamiento interválico de alta intensidad [16],[44]. También lo sería el indagar sus efectos sobre otros marcadores de estrés como el palmitoyl-2-(5-oxovaleroyl)-sn-glicero-3-phosphorylcholine y 1-palmitoyl-2-glutaroyl-sn-glycero-3-phosphorylcholine, los cuales han disminuido después de someterse a programas integrales de ejercicio [45].
Tabla 6. Datos de la reactividad vascular.
No se observaron cambios en el flujo sanguíneo cutáneo, tanto maximal como en reposo, en ninguno de los grupos. Sin embargo, la razón entre el flujo sanguíneo cutáneo maximal y en reposo (es decir, la hiperemia cutánea reactiva) aumentó en ambos grupos de ejercicio, pero fue significativamente mayor en el grupo de entrenamiento aeróbico interválico. De manera similar, la dilatación mediada por flujo mejoró significativamente (P<0,05) en ambos grupos (entrenamiento aeróbico interválico y entrenamiento aeróbico continuo) posterior a la intervención. Sin embargo, el incremento de dilatación mediada por flujo fue significativamente mayor en el grupo entrenamiento aeróbico interválico respecto del grupo de entrenamiento aeróbico continuo. Detalles en Tabla 6.
Al inicio del estudio, la hemoglobina glicosilada estuvo relacionada significativamente con el consumo máximo de oxígeno y con la dilatación mediada por flujo. Las concentraciones de óxido nítrico se relacionaron con la dilatación mediada por flujo (r=0,69). Analizando a la población de forma agrupada, se observó que las variaciones en los niveles de hemoglobina glicosilada mostraron una correlación con los cambios correspondientes al consumo máximo de oxígeno (r=-0,74) y a la dilatación mediada por flujo (r=-0,72).
Acerca de la aplicabilidad
Las patologías de tipo metabólico tienen su origen en diversos factores. No obstante, la gran mayoría de éstas convergen en procesos inflamatorios y en la generación de un estado de estrés oxidativo crónico [4],[17],[18],[19],[20],[21],[22].
Actualmente en Chile, el tratamiento de la diabetes mellitus tipo 2 contempla principalmente la prescripción farmacológica e intervenciones nutricionales para el control glicémico, asignándole un rol complementario a la realización regular de ejercicio físico. A pesar de ello, existe evidencia contundente acerca de la importancia del ejercicio físico en la prevención y el tratamiento de la diabetes mellitus tipo 2 [46].
Respecto de las modalidades de ejercicio apropiadas para pacientes con diabetes mellitus tipo 2, las guías del Ministerio de Salud de Chile ponen particular énfasis en el entrenamiento continuo de moderada intensidad para el entrenamiento de la resistencia y en el método 1x2x3 para el entrenamiento de la fuerza [41]. Existe evidencia contundente respecto a la efectividad del entrenamiento continuo de moderada intensidad en el control glicémico, en la reducción del tejido adiposo visceral y de la concentración sanguínea de triglicéridos de pacientes con diabetes mellitus tipo 2 [46]. No obstante ello, en los últimos años se ha observado que el entrenamiento interválico de alta intensidad tiene efectos similares al entrenamiento continuo de moderada intensidad en relación al desarrollo de la resistencia [47],[48], lo que también puede llegar a ser una herramienta válida para el control de la diabetes mellitus tipo 2 [49],[50].
La aplicabilidad de ambos métodos (entrenamiento continuo de moderada intensidad y entrenamiento interválico de alta intensidad), depende en gran parte de un buen equipamiento, de las competencias de los profesionales a cargo y del perfil clínico de los pacientes. Respecto al equipamiento se recomienda emplear cicloergómetros (bicicletas estáticas, elípticas, trotadoras, entre otros), o realizar ejercicios que no impliquen un gran impacto articular ni un daño excesivo en las extremidades inferiores [51]. Las sesiones de entrenamiento se podrían realizar en centros de salud familiar, centros comunitarios o en clínicas que cuenten con las condiciones previamente descritas. Finalmente, con relación a los pacientes, es importante tomar en cuenta que pueden existir distintas complicaciones o patologías asociadas a la diabetes mellitus tipo 2 [24]. Por ejemplo, en el ensayo clínico analizado no se consideraron pacientes con complicaciones macrovasculares (retinopatía, nefropatía y/o neuropatía), ni enfermedades del sistema cardiovascular. Por lo tanto, los resultados de esta investigación no se pueden extrapolar a cualquier población de pacientes con diabetes mellitus tipo 2.
Lo más importante es que exista una continua evaluación y supervisión de los pacientes que estén realizando el programa de actividad física, utilizando parámetros como la frecuencia cardiaca de reserva, escalas de percepción de esfuerzo (escala de Borg), frecuencia respiratoria, entre otros. Se debe recalcar que antes de comenzar cualquier tipo de programa de entrenamiento, es fundamental que los pacientes cuenten una con una evaluación y autorización médica, seguida de una evaluación de su condición física, además de un período de aprendizaje y asimilación de la ejecución técnica de los ejercicios y modelos a utilizar durante la intervención. Todo esto con el fin de garantizar una intervención progresiva y evitar posibles lesiones [52].
En pacientes adultos (entre 50 y 70 años) con diabetes mellitus tipo 2 controlada, tanto el entrenamiento continuo de moderada intensidad como el entrenamiento interválico de alta intensidad, parecen ser igualmente efectivos en la normalización de marcadores del perfil lipídico y en el incremento de la condición física general. Sin embargo, el entrenamiento interválico de alta intensidad parece ser más efectivo en la disminución de marcadores de daño por estrés oxidativo. Debido a las limitaciones metodológicas del ensayo analizado, se requieren más ensayos clínicos aleatorizados para confirmar o contrastar estos hallazgos.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del CAT y no tener conflictos de intereses asociados a la materia de este estudio. Los formularios pueden ser solicitados al autor responsable o a la dirección editorial de la Revista.

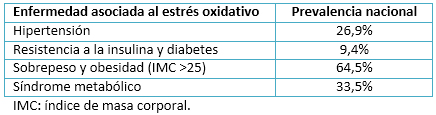 Tabla 1. Enfermedades asociadas a estrés oxidativo y su prevalencia en Chile. Datos obtenidos de Encuesta Nacional de Salud. Ministerio de Salud de Chile, 2010.
Tabla 1. Enfermedades asociadas a estrés oxidativo y su prevalencia en Chile. Datos obtenidos de Encuesta Nacional de Salud. Ministerio de Salud de Chile, 2010.

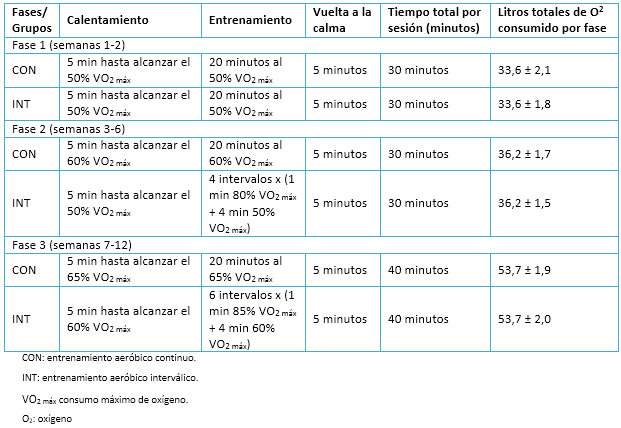 Tabla 2. Resumen de las intervenciones de entrenamiento.
Tabla 2. Resumen de las intervenciones de entrenamiento.

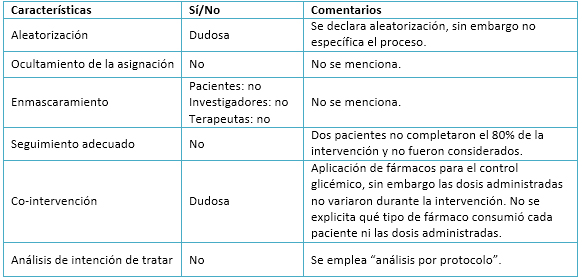 Tabla 3. Análisis acerca de la validez del estudio.
Tabla 3. Análisis acerca de la validez del estudio.

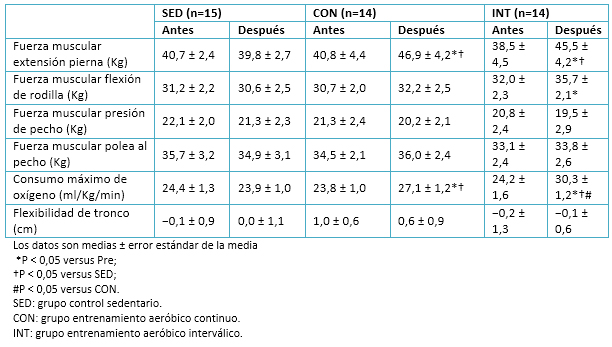 Tabla 4. Datos de la condición física relacionada con la salud.
Tabla 4. Datos de la condición física relacionada con la salud.

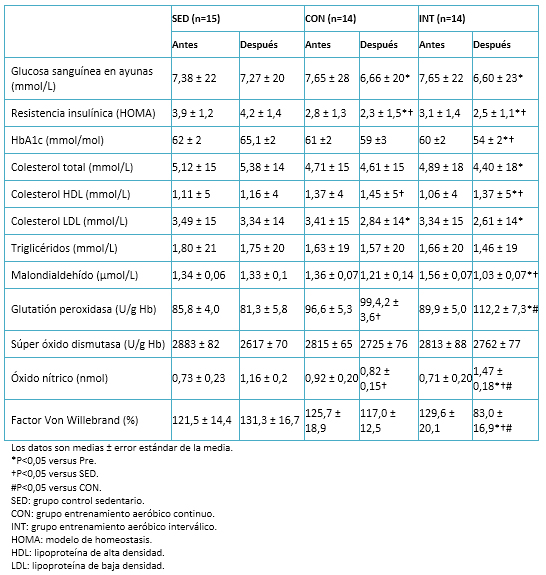 Tabla 5. Datos bioquímicos de la sangre.
Tabla 5. Datos bioquímicos de la sangre.

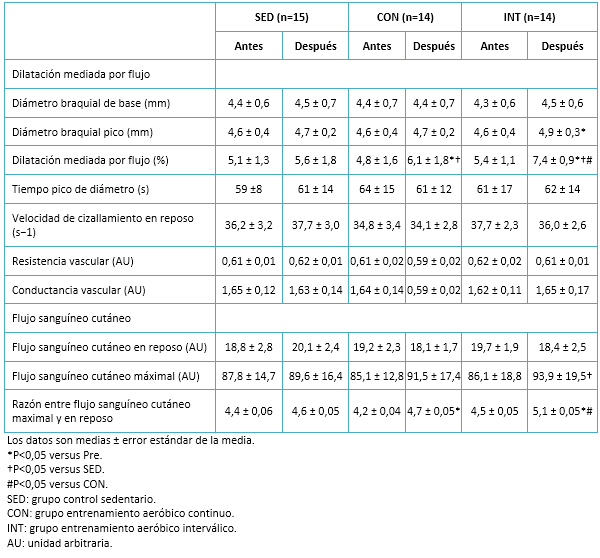 Tabla 6. Datos de la reactividad vascular.
Tabla 6. Datos de la reactividad vascular.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCTION
Oxidative stress is caused by an imbalance between an excessive production of reactive oxygen species and/or a deficiency in the level of endogenous and exogenous antioxidant defenses. The presence of reactive oxygen species in large concentrations and for long periods is associated with the occurrence of various diseases, including type 2 diabetes mellitus. Exercise represents an effective means for the prevention and treatment of type 2 diabetes mellitus, and is also able to reduce long-term oxidative stress levels. High-intensity interval training has shown to be an efficient and viable option for type 2 diabetes mellitus control. In turn, high-intensity interval training seems to have positive effects on oxidative stress levels by increasing levels of endogenous antioxidants.
OBJECTIVE
To assess the validity and applicability of the results regarding the effectiveness of high-intensity interval training compared to moderate intensity continuous training to reduce oxidative stress in patients with type 2 diabetes mellitus and to answer the following question: In adults with type 2 diabetes mellitus, can the method of high-intensity interval training, compared to moderate intensity continuous training reduce oxidative stress levels?
METHODS
We performed a critical analysis of the article "Continuous training vs Interval training in glycemic control and macro and microvascular reactivity in patients with type 2 diabetes".
RESULTS
No statistically significant differences were observed in concentrations of superoxide dismutase in any of the experimental groups. Only in the interval group a decrease in malondialdehyde regarding control group and baseline (p<0.05) was observed. In addition, only in the interval group there was an increase in glutathione peroxidase compared to the group of continuous aerobic training and baseline (p<0.05). Nitric oxide showed a significant increase regarding the control, continuous aerobic group and baseline (p<0.05) in the interval training group.
CONCLUSIONS
Despite the fact that both training groups show improvements over markers of lipid profile and fitness, high intensity interval training has shown to be more effective in the normalization of oxidative stress, impacting positively on the concentration of pro-oxidant markers and antioxidants.
 Autores:
Carlos Emilio Poblete Aro[1,2], Javier Antonio Russell Guzmán[1], Marcelo Enrique Soto Muñoz[1,3], Bastián Eduardo Villegas González[1,4]
Autores:
Carlos Emilio Poblete Aro[1,2], Javier Antonio Russell Guzmán[1], Marcelo Enrique Soto Muñoz[1,3], Bastián Eduardo Villegas González[1,4]

Citación: Poblete Aro CE, Russell Guzmán JA, Soto Muñoz ME, Villegas González BE. Effects of high intensity interval training versus moderate intensity continuous training on the reduction of oxidative stress in type 2 diabetic adult patients: CAT. Medwave 2015 Ago;15(7):e6212 doi: 10.5867/medwave.2015.07.6212
Fecha de envío: 30/6/2015
Fecha de aceptación: 6/8/2015
Fecha de publicación: 13/8/2015
Origen: no solicitado
Tipo de revisión: con revisión por tres pares revisores externos, a doble ciego
Fe de Errata
1. Se modificó un parrafo de este articulo | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Raymond J, Segrè D. The effect of oxygen on biochemical networks and the evolution of complex life. Science. 2006 Mar 24;311(5768):1764-7. | PubMed |
Raymond J, Segrè D. The effect of oxygen on biochemical networks and the evolution of complex life. Science. 2006 Mar 24;311(5768):1764-7. | PubMed | Rodrigo R. Oxidative stress and antioxidants: their role in human disease. New York: Nova; 2009.
Rodrigo R. Oxidative stress and antioxidants: their role in human disease. New York: Nova; 2009.  Dröge W. Free radicals in the physiological control of cell function. Physiol Rev. 2002 Jan;82(1):47-95. | PubMed |
Dröge W. Free radicals in the physiological control of cell function. Physiol Rev. 2002 Jan;82(1):47-95. | PubMed | González J, Valls N, Brito R, Rodrigo R. Essential hypertension and oxidative stress: New insights. World J Cardiol. 2014 Jun 26;6(6):353-66. | CrossRef | PubMed |
González J, Valls N, Brito R, Rodrigo R. Essential hypertension and oxidative stress: New insights. World J Cardiol. 2014 Jun 26;6(6):353-66. | CrossRef | PubMed | Reischak de Oliveira A, Dornelles Schneider C. Oxygen free radicals and exercise : mechanisms of synthesis and adaptation to the physical training. Soc Bras Med do Esporte. 2004;10(4):314–318. | CrossRef |
Reischak de Oliveira A, Dornelles Schneider C. Oxygen free radicals and exercise : mechanisms of synthesis and adaptation to the physical training. Soc Bras Med do Esporte. 2004;10(4):314–318. | CrossRef | Urbina-Bonilla AP. Nuevo papel de los radicales libres de oxígeno en el ejercicio:¿Otra paradoja ? Colomb Med. 2008;(3):39, 266–265. | Link |
Urbina-Bonilla AP. Nuevo papel de los radicales libres de oxígeno en el ejercicio:¿Otra paradoja ? Colomb Med. 2008;(3):39, 266–265. | Link | Ristow M, Schmeisser K. Mitohormesis: Promoting Health and Lifespan by Increased Levels of Reactive Oxygen Species (ROS). Dose Response. 2014 Jan 31;12(2):288-341. | CrossRef | PubMed |
Ristow M, Schmeisser K. Mitohormesis: Promoting Health and Lifespan by Increased Levels of Reactive Oxygen Species (ROS). Dose Response. 2014 Jan 31;12(2):288-341. | CrossRef | PubMed | Radak Z, Zhao Z, Koltai E, Ohno H, Atalay M. Oxygen consumption and usage during physical exercise: the balance between oxidative stress and ROS-dependent adaptive signaling. Antioxid Redox Signal. 2013 Apr 1;18(10):1208-46. | CrossRef | PubMed |
Radak Z, Zhao Z, Koltai E, Ohno H, Atalay M. Oxygen consumption and usage during physical exercise: the balance between oxidative stress and ROS-dependent adaptive signaling. Antioxid Redox Signal. 2013 Apr 1;18(10):1208-46. | CrossRef | PubMed | Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem. 1979 Jun;95(2):351-8. | PubMed |
Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem. 1979 Jun;95(2):351-8. | PubMed | Martindale JL, Holbrook NJ. Cellular response to oxidative stress: signaling for suicide and survival. J Cell Physiol. 2002 Jul;192(1):1-15. | PubMed |
Martindale JL, Holbrook NJ. Cellular response to oxidative stress: signaling for suicide and survival. J Cell Physiol. 2002 Jul;192(1):1-15. | PubMed | Ristow M, Zarse K. How increased oxidative stress promotes longevity and metabolic health: The concept of mitochondrial hormesis (mitohormesis). Exp Gerontol. 2010 Jun;45(6):410-8. | CrossRef | PubMed |
Ristow M, Zarse K. How increased oxidative stress promotes longevity and metabolic health: The concept of mitochondrial hormesis (mitohormesis). Exp Gerontol. 2010 Jun;45(6):410-8. | CrossRef | PubMed | Prosser BL, Ward CW, Lederer WJ. X-ROS signalling is enhanced and graded by cyclic cardiomyocyte stretch. Cardiovasc Res. 2013 May 1;98(2):307-14. | CrossRef | PubMed |
Prosser BL, Ward CW, Lederer WJ. X-ROS signalling is enhanced and graded by cyclic cardiomyocyte stretch. Cardiovasc Res. 2013 May 1;98(2):307-14. | CrossRef | PubMed | Sandström ME, Zhang SJ, Bruton J, Silva JP, Reid MB, Westerblad H, et al. Role of reactive oxygen species in contraction-mediated glucose transport in mouse skeletal muscle. J Physiol. 2006 Aug 15;575(Pt 1):251-62. | PubMed |
Sandström ME, Zhang SJ, Bruton J, Silva JP, Reid MB, Westerblad H, et al. Role of reactive oxygen species in contraction-mediated glucose transport in mouse skeletal muscle. J Physiol. 2006 Aug 15;575(Pt 1):251-62. | PubMed | Domenech RJ. Preconditioning: a new concept about the benefit of exercise. Circulation. 2006 Jan 3;113(1):e1-3.
| PubMed |
Domenech RJ. Preconditioning: a new concept about the benefit of exercise. Circulation. 2006 Jan 3;113(1):e1-3.
| PubMed | Donoso P, Finkelstein JP, Montecinos L, Said M, Sánchez G, Vittone L, et al. Stimulation of NOX2 in isolated hearts reversibly sensitizes RyR2 channels to activation by cytoplasmic calcium. J Mol Cell Cardiol. 2014 Mar;68:38-46.
| CrossRef | PubMed |
Donoso P, Finkelstein JP, Montecinos L, Said M, Sánchez G, Vittone L, et al. Stimulation of NOX2 in isolated hearts reversibly sensitizes RyR2 channels to activation by cytoplasmic calcium. J Mol Cell Cardiol. 2014 Mar;68:38-46.
| CrossRef | PubMed | Bogdanis GC, Stavrinou P, Fatouros IG, Philippou A, Chatzinikolaou A, Draganidis D, et al. Short-term high-intensity interval exercise training attenuates oxidative stress responses and improves antioxidant status in healthy humans. Food Chem Toxicol. 2013 Nov;61:171-7. | CrossRef | PubMed |
Bogdanis GC, Stavrinou P, Fatouros IG, Philippou A, Chatzinikolaou A, Draganidis D, et al. Short-term high-intensity interval exercise training attenuates oxidative stress responses and improves antioxidant status in healthy humans. Food Chem Toxicol. 2013 Nov;61:171-7. | CrossRef | PubMed | Houstis N, Rosen ED, Lander ES. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature. 2006 Apr 13;440(7086):944-8.
| PubMed |
Houstis N, Rosen ED, Lander ES. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature. 2006 Apr 13;440(7086):944-8.
| PubMed | Sriram S, Subramanian S, Sathiakumar D, Venkatesh R, Salerno MS, McFarlane CD, et al. Modulation of reactive oxygen species in skeletal muscle by myostatin is mediated through NF-κB. Aging Cell. 2011 Dec;10(6):931-48. | CrossRef | PubMed |
Sriram S, Subramanian S, Sathiakumar D, Venkatesh R, Salerno MS, McFarlane CD, et al. Modulation of reactive oxygen species in skeletal muscle by myostatin is mediated through NF-κB. Aging Cell. 2011 Dec;10(6):931-48. | CrossRef | PubMed | Mraz M, Haluzik M. The role of adipose tissue immune cells in obesity and low-grade inflammation. J Endocrinol. 2014 Sep;222(3):R113-27. | CrossRef | PubMed |
Mraz M, Haluzik M. The role of adipose tissue immune cells in obesity and low-grade inflammation. J Endocrinol. 2014 Sep;222(3):R113-27. | CrossRef | PubMed | Teixeira-Lemos E, Nunes S, Teixeira F, Reis F. Regular physical exercise training assists in preventing type 2 diabetes development: focus on its antioxidant and anti-inflammatory properties. Cardiovasc Diabetol. 2011 Jan 28;10:12. | CrossRef | PubMed |
Teixeira-Lemos E, Nunes S, Teixeira F, Reis F. Regular physical exercise training assists in preventing type 2 diabetes development: focus on its antioxidant and anti-inflammatory properties. Cardiovasc Diabetol. 2011 Jan 28;10:12. | CrossRef | PubMed | Hotamisligil G, Erbay E. Nutrient sensing and inflamation in metabolic diseases. Nat Rev Immunol. 2008 Dec; 8(12): 923. | CrossRef |
Hotamisligil G, Erbay E. Nutrient sensing and inflamation in metabolic diseases. Nat Rev Immunol. 2008 Dec; 8(12): 923. | CrossRef | Gould DW, Lahart I, Carmichael AR, Koutedakis Y, Metsios GS. Cancer cachexia prevention via physical exercise : molecular mechanisms. J Cachexia Sarcopenia and Muscle. 2013;4(2):111–124. | CrossRef |
Gould DW, Lahart I, Carmichael AR, Koutedakis Y, Metsios GS. Cancer cachexia prevention via physical exercise : molecular mechanisms. J Cachexia Sarcopenia and Muscle. 2013;4(2):111–124. | CrossRef | Gobierno de Chile, Ministerio de Salud. Encuesta Nacional de Salud. Chile (2009-2010). Santiago: MINSAL; 2010.
Gobierno de Chile, Ministerio de Salud. Encuesta Nacional de Salud. Chile (2009-2010). Santiago: MINSAL; 2010.  Kahn SE, Hull RL, Utzschneider KM. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 2006 Dec 14;444(7121):840-6. | PubMed |
Kahn SE, Hull RL, Utzschneider KM. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 2006 Dec 14;444(7121):840-6. | PubMed | Kaneto H, Katakami N, Matsuhisa M, Matsuoka TA. Role of reactive oxygen species in the progression of type 2 diabetes and atherosclerosis. Mediators Inflamm. 2010;2010:453892. | CrossRef | PubMed |
Kaneto H, Katakami N, Matsuhisa M, Matsuoka TA. Role of reactive oxygen species in the progression of type 2 diabetes and atherosclerosis. Mediators Inflamm. 2010;2010:453892. | CrossRef | PubMed | Olivares Reyes J, Arellano Plancarte A. Bases moleculares de las acciones de la Insulina. Rev Educ Bioquímica. 2008;27(1):9-18. | Link |
Olivares Reyes J, Arellano Plancarte A. Bases moleculares de las acciones de la Insulina. Rev Educ Bioquímica. 2008;27(1):9-18. | Link | Billat V. Fisiología y metodología del entrenamiento. De la teoría a la práctica. Paidotribo; 2002. | Link |
Billat V. Fisiología y metodología del entrenamiento. De la teoría a la práctica. Paidotribo; 2002. | Link | Forman HJ, Maiorino M, Ursini F. Signaling functions of reactive oxygen species. Biochemistry. 2010 Feb 9;49(5):835-42. | CrossRef | PubMed |
Forman HJ, Maiorino M, Ursini F. Signaling functions of reactive oxygen species. Biochemistry. 2010 Feb 9;49(5):835-42. | CrossRef | PubMed | Morales-Alamo D, Ponce-González JG, Guadalupe-Grau A, Rodríguez-García L, Santana A, Cusso R, et al. Critical role for free radicals on sprint exercise-induced CaMKII and AMPKα phosphorylation in human skeletal muscle. J Appl Physiol (1985). 2013 Mar 1;114(5):566-77. | CrossRef | PubMed |
Morales-Alamo D, Ponce-González JG, Guadalupe-Grau A, Rodríguez-García L, Santana A, Cusso R, et al. Critical role for free radicals on sprint exercise-induced CaMKII and AMPKα phosphorylation in human skeletal muscle. J Appl Physiol (1985). 2013 Mar 1;114(5):566-77. | CrossRef | PubMed | Morales-Alamo D, Calbet JA. Free radicals and sprint exercise in humans. Free Radic Res. 2014 Jan;48(1):30-42. | CrossRef | PubMed |
Morales-Alamo D, Calbet JA. Free radicals and sprint exercise in humans. Free Radic Res. 2014 Jan;48(1):30-42. | CrossRef | PubMed | Buchheit M, Laursen PB. High-intensity interval training, solutions to the programming puzzle: Part I: cardiopulmonary emphasis. Sports Med. 2013 May;43(5):313-38. | CrossRef | PubMed |
Buchheit M, Laursen PB. High-intensity interval training, solutions to the programming puzzle: Part I: cardiopulmonary emphasis. Sports Med. 2013 May;43(5):313-38. | CrossRef | PubMed | Jackson MJ. Control of reactive oxygen species production in contracting skeletal muscle. Antioxid Redox Signal. 2011 Nov 1;15(9):2477-86. | CrossRef | PubMed |
Jackson MJ. Control of reactive oxygen species production in contracting skeletal muscle. Antioxid Redox Signal. 2011 Nov 1;15(9):2477-86. | CrossRef | PubMed | Le Moine CM, Morash AJ, McClelland GB. Changes in HIF-1α protein, pyruvate dehydrogenase phosphorylation, and activity with exercise in acute and chronic hypoxia. Am J Physiol Regul Integr Comp Physiol. 2011 Oct;301(4):R1098-104. | CrossRef | PubMed |
Le Moine CM, Morash AJ, McClelland GB. Changes in HIF-1α protein, pyruvate dehydrogenase phosphorylation, and activity with exercise in acute and chronic hypoxia. Am J Physiol Regul Integr Comp Physiol. 2011 Oct;301(4):R1098-104. | CrossRef | PubMed | Hollander J, Fiebig R, Gore M, Ookawara T, Ohno H, Ji LL. Superoxide dismutase gene expression is activated by a single bout of exercise in rat skeletal muscle. Pflugers Arch. 2001 Jun;442(3):426-34. | PubMed |
Hollander J, Fiebig R, Gore M, Ookawara T, Ohno H, Ji LL. Superoxide dismutase gene expression is activated by a single bout of exercise in rat skeletal muscle. Pflugers Arch. 2001 Jun;442(3):426-34. | PubMed | Kim SY, Jun TW, Lee YS, Na HK, Surh YJ, Song W. Effects of exercise on cyclooxygenase-2 expression and nuclear factor-kappaB DNA binding in human peripheral blood mononuclear cells. Ann N Y Acad Sci. 2009 Aug;1171:464-71. | CrossRef | PubMed |
Kim SY, Jun TW, Lee YS, Na HK, Surh YJ, Song W. Effects of exercise on cyclooxygenase-2 expression and nuclear factor-kappaB DNA binding in human peripheral blood mononuclear cells. Ann N Y Acad Sci. 2009 Aug;1171:464-71. | CrossRef | PubMed | Trenerry MK, Carey KA, Ward AC, Cameron-Smith D. STAT3 signaling is activated in human skeletal muscle following acute resistance exercise. J Appl Physiol (1985). 2007 Apr;102(4):1483-9. Epub 2007 Jan 4. | PubMed |
Trenerry MK, Carey KA, Ward AC, Cameron-Smith D. STAT3 signaling is activated in human skeletal muscle following acute resistance exercise. J Appl Physiol (1985). 2007 Apr;102(4):1483-9. Epub 2007 Jan 4. | PubMed | Weineck J. Entrenamiento total. Paidotribo; 2005.
Weineck J. Entrenamiento total. Paidotribo; 2005.  Buchheit M, Laursen PB. High-intensity interval training, solutions to the programming puzzle. Part II: anaerobic energy, neuromuscular load and practical applications. Sports Med. 2013 Oct;43(10):927-54. | CrossRef | PubMed |
Buchheit M, Laursen PB. High-intensity interval training, solutions to the programming puzzle. Part II: anaerobic energy, neuromuscular load and practical applications. Sports Med. 2013 Oct;43(10):927-54. | CrossRef | PubMed | Laursen PB, Jenkins DG. The scientific basis for high-intensity interval training: optimising training programmes and maximising performance in highly trained endurance athletes. Sports Med. 2002;32(1):53-73. | PubMed |
Laursen PB, Jenkins DG. The scientific basis for high-intensity interval training: optimising training programmes and maximising performance in highly trained endurance athletes. Sports Med. 2002;32(1):53-73. | PubMed | Gobierno de Chile, Ministerio de Salud. Orientación programa vida sana. Santiago:MINSAL; 2015.
Gobierno de Chile, Ministerio de Salud. Orientación programa vida sana. Santiago:MINSAL; 2015.  Mitranun W, Deerochanawong C, Tanaka H, Suksom D. Continuous vs interval training on glycemic control and macro- and microvascular reactivity in type 2 diabetic patients. Scand J Med Sci Sports. 2014 Apr;24(2):e69-76. | CrossRef | PubMed |
Mitranun W, Deerochanawong C, Tanaka H, Suksom D. Continuous vs interval training on glycemic control and macro- and microvascular reactivity in type 2 diabetic patients. Scand J Med Sci Sports. 2014 Apr;24(2):e69-76. | CrossRef | PubMed | Little JP, Gillen JB, Percival ME, Safdar A, Tarnopolsky MA, Punthakee Z, et al. Low-volume high-intensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes. J Appl Physiol (1985). 2011 Dec;111(6):1554-60. | CrossRef | PubMed |
Little JP, Gillen JB, Percival ME, Safdar A, Tarnopolsky MA, Punthakee Z, et al. Low-volume high-intensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes. J Appl Physiol (1985). 2011 Dec;111(6):1554-60. | CrossRef | PubMed | Fisher G, Schwartz DD, Quindry J, Barberio MD, Foster EB, Jones KW, et al. Lymphocyte enzymatic antioxidant responses to oxidative stress following high-intensity interval exercise. J Appl Physiol (1985). 2011 Mar;110(3):730-7. | CrossRef | PubMed |
Fisher G, Schwartz DD, Quindry J, Barberio MD, Foster EB, Jones KW, et al. Lymphocyte enzymatic antioxidant responses to oxidative stress following high-intensity interval exercise. J Appl Physiol (1985). 2011 Mar;110(3):730-7. | CrossRef | PubMed | Vinetti G, Mozzini C, Desenzani P, Boni E, Bulla L, Lorenzetti I,et al. Supervised exercise training reduces oxidative stress and cardiometabolic risk in adults with type 2 diabetes: a randomized controlled trial. Sci Rep. 2015 Mar 18;5:9238. | CrossRef | PubMed |
Vinetti G, Mozzini C, Desenzani P, Boni E, Bulla L, Lorenzetti I,et al. Supervised exercise training reduces oxidative stress and cardiometabolic risk in adults with type 2 diabetes: a randomized controlled trial. Sci Rep. 2015 Mar 18;5:9238. | CrossRef | PubMed | Thomas DE, Elliott EJ, Naughton GA. Exercise for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2006 Jul 19;(3):CD002968. | PubMed |
Thomas DE, Elliott EJ, Naughton GA. Exercise for type 2 diabetes mellitus. Cochrane Database Syst Rev. 2006 Jul 19;(3):CD002968. | PubMed | Gibala MJ. High-intensity interval training: a time-efficient strategy for health promotion? Curr Sports Med Rep. 2007 Jul;6(4):211-3.
| PubMed |
Gibala MJ. High-intensity interval training: a time-efficient strategy for health promotion? Curr Sports Med Rep. 2007 Jul;6(4):211-3.
| PubMed | Gibala MJ, Little JP, Macdonald MJ, Hawley JA. Physiological adaptations to low-volume, high-intensity interval training in health and disease. J Physiol. 2012 Mar 1;590(Pt 5):1077-84. | CrossRef | PubMed |
Gibala MJ, Little JP, Macdonald MJ, Hawley JA. Physiological adaptations to low-volume, high-intensity interval training in health and disease. J Physiol. 2012 Mar 1;590(Pt 5):1077-84. | CrossRef | PubMed | Bird SR, Hawley JA. Exercise and type 2 diabetes: new prescription for an old problem. Maturitas. 2012 Aug;72(4):311-6. | CrossRef | PubMed |
Bird SR, Hawley JA. Exercise and type 2 diabetes: new prescription for an old problem. Maturitas. 2012 Aug;72(4):311-6. | CrossRef | PubMed | Terada T, Friesen A, Chahal BS, Bell GJ, McCargar LJ, Boulé NG. Feasibility and preliminary efficacy of high intensity interval training in type 2 diabetes. Diabetes Res Clin Pract. 2013 Feb;99(2):120-9. | CrossRef | PubMed |
Terada T, Friesen A, Chahal BS, Bell GJ, McCargar LJ, Boulé NG. Feasibility and preliminary efficacy of high intensity interval training in type 2 diabetes. Diabetes Res Clin Pract. 2013 Feb;99(2):120-9. | CrossRef | PubMed | López Chicharro J, López Mojares LM. Fisiología clínica del ejercicio. Panamericana; 2008.
López Chicharro J, López Mojares LM. Fisiología clínica del ejercicio. Panamericana; 2008.  Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee IM, et al. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011 Jul;43(7):1334-59. | CrossRef | PubMed |
Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee IM, et al. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011 Jul;43(7):1334-59. | CrossRef | PubMed |