 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: systematic review, randomized controlled trial, food, health
Las revisiones sistemáticas de literatura constituyen una de las principales metodologías utilizadas en la validación de las propiedades saludables de los alimentos, o factores alimentarios, que afectan la fisiología humana. Esta herramienta, basada en la evidencia obtenida a través de ensayos clínicos aleatorizados realizados con un diseño experimental adecuado, permite concluir si existe una relación causal entre el producto consumido y un efecto beneficioso para la salud, principio que sustenta el calificativo de los alimentos como “funcionales”. Se presentan y analizan las características y la forma en la que las revisiones sistemáticas pueden contribuir a que las agencias regulatorias aprueben un mensaje saludable (health claim), dirigido al consumidor.
|
Ideas clave
|
Los alimentos no solamente son vehículos de nutrientes y energía, sino que además proporcionan placer y bienestar; y, lo que es muy importante, aportan componentes que ejercen acciones fisiológicas en el organismo que van más allá de su aporte nutricional. Estas propiedades, denominadas saludables o funcionales, otorgadas por compuestos químicos “bioactivos” contenidos en una matriz alimentaria, constituyen un tema que ha ocupado la atención de los investigadores, los consumidores, la industria agroalimentaria y los legisladores durante muchos años. En este contexto, es especialmente relevante la promoción de los beneficios para la salud mediante mensajes dirigidos al consumidor, utilizando diversas técnicas de marketing. Los alimentos denominados funcionales, poseen atributos saludables que deben ser comprobados científicamente. Sin embargo, muchas veces no se cuenta con una evidencia lo suficientemente robusta que sustente las declaraciones o mensajes. Esta situación ha llevado a que las entidades regulatorias de países o grupos de países, establezcan criterios claros al respecto[1],[2].
Para hacer una declaración (mensaje saludable o health claim) que asocie el consumo de un alimento o factor alimentario con un efecto beneficioso, en relación con alguna enfermedad o condición de salud, primero debe demostrarse esta acción. Solo de esta forma se podrá lograr que las agencias regulatorias, tales como la EFSA (Agencia de Inocuidad Alimentaria Europea) (http://www.efsa.europa.eu/), la FDA (Agencia de Drogas y Alimentos de EEUU) (https://www.fda.gov/) o el Ministerio de Salud, Trabajo y Bienestar de Japón (https://www.mhlw.go.jp/english/), aprueben un mensaje saludable. En Chile, el organismo encargado de aprobar el uso de mensajes saludables es el Ministerio de Salud (https://www.minsal.cl/), de acuerdo con el Reglamento Sanitario de Alimentos (Decreto 977/96 y sus modificaciones).
Por su parte, el Codex Alimentarius (http://www.fao.org/fao-who-codexalimentarius/es/), referente en normativa alimentaria a nivel mundial, define la declaración de propiedades saludables como “cualquier representación que declara, sugiere o implica que existe una relación entre un alimento, o un constituyente de dicho alimento, y la salud”. Añade que “las declaraciones de propiedades saludables y funcionales deben estar apoyadas por una cantidad de evidencia científica válida y suficiente como para justificarlas, proveer información verídica y no engañosa para ayudar al consumidor a elegir dietas saludables, y ser apoyadas por una educación específica para el consumidor”. No obstante, hoy en día existe una gran promoción de alimentos y factores alimentarios a los que se les atribuyen propiedades beneficiosas para la salud, sin contar con la adecuada validación científica de estos efectos.
Las revisiones sistemáticas consisten en la búsqueda y compilación de evidencia empírica con criterios preestablecidos para responder una determinada pregunta de interés[3], permitiendo apoyar la nutrición basada en evidencia[4]. Por lo tanto, el presente artículo tiene por objetivo describir la metodología de las revisiones sistemáticas de la literatura y su rol en la validación de los posibles efectos saludables de estos productos, ya sea que se hayan extraído y aislado de su fuente original o que se encuentren incluidos en una matriz alimentaria, que es la forma habitual de consumo, formando parte de una dieta habitual.
La epidemiología clínica ha provisto una sistematización de distintos diseños metodológicos que dan cuenta de preguntas de investigación. Los estudios observacionales, como los de corte transversal, de casos y controles y de cohorte, aportan información relevante. Sin embargo, no permiten determinar causalidad y están sujetos a una gran cantidad de sesgos que pueden afectar los resultados obtenidos[5],[6]. En consecuencia, en el caso del estudio de los efectos fisiológicos de los alimentos, los diseños observacionales no constituyen la metodología más apropiada para este propósito.
Si lo que se busca es analizar una intervención dietética sobre una condición fisiológica específica, el diseño a elegir será un ensayo clínico aleatorizado (RCT por sus siglas en inglés, Randomized Clinical Trial), nombre que reciben los estudios experimentales en epidemiología clínica[7],[8]. En ellos, el factor de exposición (alimento o factor alimentario) es asignado aleatoriamente a un grupo de personas, mientras que un grupo de comparación recibe un producto semejante que no contiene el factor alimentario (placebo o comparador). La aleatorización constituye un hecho central en el control de los factores de confusión, puesto que pretende homogeneizar las condiciones basales de los participantes en el estudio, lo que reduce la probabilidad de que la asociación observada sea explicada por una variable distinta a la intervención[9]. Adicionalmente, su carácter prospectivo cumple con el criterio de temporalidad, dado que se sabe a ciencia cierta que la exposición precede al efecto, lo que daría respuesta a las hipótesis de causalidad[8]. A los ensayos clínicos aleatorizados se les ha llamado “la piedra angular” de la salud basada en evidencia, pues son el componente central de las revisiones sistemáticas dedicadas a responder preguntas de investigación asociadas a intervenciones. Debido a que las revisiones sistemáticas integran los resultados obtenidos por múltiples ensayos clínicos aleatorizados, refinan la estimación del tamaño del efecto, aportando un nivel mayor de evidencia científica para la evaluación de mensajes saludables al compararse con un único ensayo clínico aleatorizado. La pirámide de la jerarquía de la calidad de la evidencia científica en ciencias de la salud puede observarse en la Figura 1[10].
Figura 1. Conceptualización clásica de la jerarquía de la evidencia en salud.
En 1965, el epidemiólogo británico Austin Bradford Hill enunció el “principio de coherencia”, en el contexto de la presentación de nueve aspectos de asociación que responderían a su pregunta “¿en qué circunstancias podemos pasar de una asociación observada a un veredicto de causalidad?”[11]. Estos aspectos, reconocidos posteriormente como los criterios de Bradford Hill[12], dan cuenta de una mayor probabilidad de que la asociación observada entre dos factores sea causal. El principio de coherencia manifiesta que una conclusión causal no debería contradecir en sus fundamentos al conocimiento del momento[12]. Si bien este concepto es materia de discusión y debate, puede entenderse como la necesidad de que exista una congruencia entre la evidencia aportada por los estudios preclínicos (in vitro, in vivo) y los estudios clínicos. De no existir este correlato, se pondría en entredicho el establecimiento de una relación de causalidad.
Un buen ejemplo está dado por el caso de los compuestos fenólicos contenidos en alimentos. Si bien se han demostrado múltiples efectos potencialmente beneficiosos de diversas moléculas de este tipo en ensayos in vitro y en modelos animales, atribuidos a sus propiedades antioxidantes, antiinflamatorias, anticancerígenas, cardioprotectoras, neuroprotectoras, entre otras, esto no ha sido sistemáticamente observado a nivel clínico[13]. A la fecha, los estudios en seres humanos solo han logrado validar científicamente dos mensajes saludables para polifenoles que han sido aprobados por las agencias regulatorias, que corresponden al hidroxitirosol del aceite de oliva[14] y los flavanoles del cacao[15]. Así, la falta de coherencia entre los ensayos de laboratorio y los estudios en seres humanos, imposibilita la validación científica de los efectos fisiológicos que ejercen estos compuestos[16],[17].
Actualmente, para considerar como verdadera a una inferencia causal, la investigación debe integrar hallazgos de múltiples disciplinas científicas[18]. En este sentido, es fundamental contar con estudios en humanos con diseños metodológicos que analicen la efectividad de una intervención y que tengan la capacidad de establecer nexos de causalidad; que, como ha sido referido, está dada principalmente por los ensayos clínicos aleatorizados y con mayor robustez por las revisiones sistemáticas de ensayos clínicos aleatorizados. A modo de ejemplo, el Ministerio de Salud, Trabajo y Bienestar de Japón, establece específicamente que para validar la efectividad de un producto puede recurrirse a dos métodos: ensayos clínicos aleatorizados o revisiones sistemáticas de ensayos clínicos aleatorizados acerca del producto terminado o los componentes que ejercen el efecto (http://www.caa.go.jp/foods/index23.html).
Las revisiones sistemáticas constituyen un método ampliamente usado en la investigación biomédica aplicada a los efectos farmacológicos, entre otras intervenciones terapéuticas o dirigidas a mejorar la salud de las personas. Asimismo, esta herramienta es muy útil para evaluar la evidencia científica en relación con los efectos fisiológicos que ejerce el consumo de componentes bioactivos alimentarios en el organismo humano. Las revisiones sistemáticas permiten responder si se produce un efecto fisiológico o clínico específico mediante una metodología estandarizada y reproducible, que da cuenta de un protocolo de investigación fijado a priori[19]. Éstas incluyen varias etapas[20],[21],[22],[23],[24]: en un principio, se plantea una hipótesis con objetivos claros alrededor de una pregunta de investigación a responder. Se desarrolla una búsqueda exhaustiva de trabajos primarios (ensayos clínicos aleatorizados) en bases de datos pertinentes y también en literatura no publicada (“literatura gris”), tales como resúmenes de congresos u otros documentos[25]. Se identifican los ensayos clínicos aleatorizados que responden a la pregunta formulada, con una selección de acuerdo a criterios preestablecidos[26], por ejemplo, los trabajos incluidos debieran tener consistencia en el producto evaluado con respecto a la manera habitual y forma de su consumo, y la matriz alimentaria. Además de incluir trabajos de una intervención bien definida, se debe contemplar una población semejante, bien caracterizada, junto con desenlaces de interés bien definidos (biomarcador de efecto o un efecto clínico)[27],[28]. Etapas posteriores incluyen evaluación de la calidad metodológica y el análisis del riesgo de sesgo de cada estudio por medio de instrumentos estandarizados[29], extracción de datos desde los estudios primarios, síntesis de la evidencia recogida e interpretación de los hallazgos.
Es posible realizar un análisis estadístico (cuantitativo), el denominado metanálisis, donde se sintetizan y comparan los principales estimadores de cada estudio considerado en la revisión, de modo de generar un estimador combinado que integre los resultados de los estudios, siempre que su heterogeneidad lo permita[30]. En la etapa de conclusiones, la aplicación de la metodología GRADE (Grades of Recommendation, Assessment, Development and Evaluation) permite la elaboración de tablas de resumen de hallazgos (Summary of Findings) (http://www.gradeworkinggroup.org/), estableciendo una clasificación que hace referencia a la certeza de la totalidad de la evidencia, a partir de la evaluación de la calidad de los trabajos incluidos. En este esquema, la puntuación de la calidad de la evidencia disminuye si el cuerpo de la evidencia contiene ensayos clínicos aleatorizados de baja calidad, y eventualmente se podrían incluir estudios observacionales que hayan controlado los sesgos importantes durante su ejecución.
Murad y colaboradores[31] han propuesto una nueva conceptualización de la jerarquía de la evidencia tradicional (Figura 1), reconociendo el rol de las revisiones sistemáticas en la integración de la evidencia existente con el propósito de llevar los resultados a su aplicación, como un lupa a través de la cual se evalúa la evidencia (Figura 2). Además, este esquema hace referencia a la calificación mediante la metodología GRADE, pues presenta líneas onduladas entre los diseños metodológicos en la jerarquía, reflejando que la calidad de la evidencia es fluctuante de acuerdo con los estudios incluidos.
Figura 2. Nueva conceptualización de la jerarquía de la evidencia en salud.
Las revisiones sistemáticas son una herramienta de gran utilidad en la validación de efectos fisiológicos de alimentos o factores alimentarios, permitiendo sustentar científicamente sus propiedades funcionales. Se basan en los resultados de ensayos clínicos aleatorizados que cumplen con requisitos rigurosos en su diseño experimental, y permiten realizar una asociación causal entre el alimento y el efecto fisiológico evaluado.
Si los alimentos o algunos de sus componentes solo demuestran efectos en ensayos de laboratorio, pruebas in vitro o en modelos animales, como es el caso de numerosos compuestos bioactivos alimentarios (polifenoles, carotenoides, compuestos azufrados, entre otros), sin coherencia con resultados de los ensayos clínicos aleatorizados, no es posible validar su efecto y no cabría denominarlos alimentos funcionales. Esta falta de coherencia se refleja en el escaso número de mensajes saludables aprobados por las agencias regulatorias a nivel internacional, en contraste con una gran demanda.
El reconocimiento de las revisiones sistemáticas en la validación científica de propiedades saludables en el ámbito de los alimentos está siendo reconocido cada vez más por los interesados en este tema, no solo a nivel de la academia, sino también por la industria, las agencias regulatorias y los consumidores. La aplicación de metodologías como las revisiones sistemáticas permite entregar información relevante a los tomadores de decisiones. Además, son una herramienta fundamental en la comunicación veraz de las propiedades de los alimentos o factores alimentarios a los consumidores, previniendo la confusión, la desinformación y el engaño.
Roles y contribuciones de los autores
ML: conceptualización, metodología, investigación, escritura (preparación del borrador original), escritura (revisión y edición), visualización, supervisión, administración del proyecto.
MA: conceptualización, metodología, investigación, escritura (preparación del borrador original), escritura (revisión y edición), visualización, supervisión, administración del proyecto.
JS: conceptualización, metodología, investigación, escritura (preparación del borrador original), escritura (revisión y edición), visualización, supervisión, administración del proyecto.
Financiamiento
Los autores declaran que no hubo fuentes externas de financiamiento.
Conflictos de intereses
Los autores completaron la declaración de conflictos de interés de ICMJE y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo. Los formularios se pueden solicitar contactando al autor responsable o al Comité Editorial de la Revista.

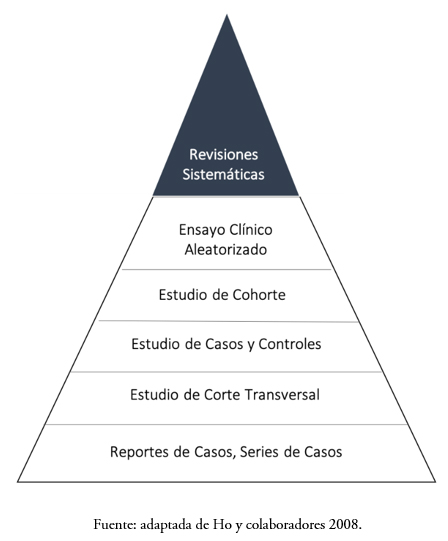 Figura 1. Conceptualización clásica de la jerarquía de la evidencia en salud.
Figura 1. Conceptualización clásica de la jerarquía de la evidencia en salud.

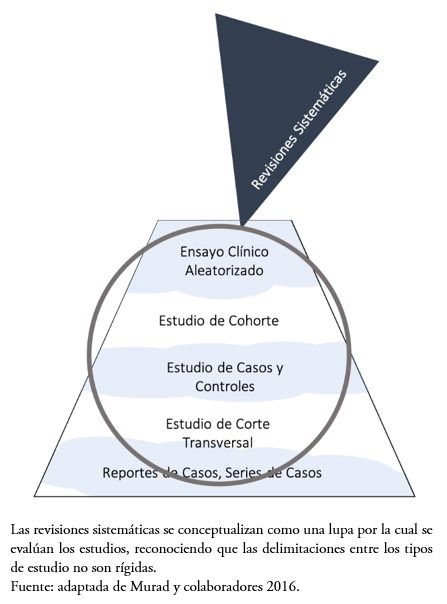 Figura 2. Nueva conceptualización de la jerarquía de la evidencia en salud.
Figura 2. Nueva conceptualización de la jerarquía de la evidencia en salud.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Systematic literature reviews are one of the main methodologies used to substantiate the health properties of foods and food constituents purported to affect human physiology. This tool is based on scientific evidence obtained from correctly performed randomized controlled trials. Systematic reviews make it possible to conclude whether there is a causal relationship between food consumed and health effects observed, thus supporting the use of the term “functional foods.” We present and analyze the prinicpal characteristics of, and ways by which, systematic reviews can contribute to the regulatory approval of health claims directed to consumers.
 Autores:
Mariane Lutz[1], Marcelo Arancibia[1], Jana Stojanova[1]
Autores:
Mariane Lutz[1], Marcelo Arancibia[1], Jana Stojanova[1]

Citación: Lutz M, Arancibia M, Stojanova J. Using systematic reviews in the scientific substantiation of health properties of foods and food constituents. Medwave 2019;19(6):e7664 doi: 10.5867/medwave.2019.06.7664
Fecha de envío: 25/5/2019
Fecha de aceptación: 25/6/2019
Fecha de publicación: 11/7/2019
Origen: no solicitado
Tipo de revisión: con revisión por pares externa, por tres pares revisores a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Lutz M. ¿Podemos Hablar De Alimentos Funcionales En Chile? Rev Chil Nutr.2012 Jun;39(2):211-6. | Link |
Lutz M. ¿Podemos Hablar De Alimentos Funcionales En Chile? Rev Chil Nutr.2012 Jun;39(2):211-6. | Link | Lutz M. Science behind the substantiation of health claims in functional foods: current regulations. In: Functional Foods and Biotechnology. CRC Press; 2019.
Lutz M. Science behind the substantiation of health claims in functional foods: current regulations. In: Functional Foods and Biotechnology. CRC Press; 2019.  Oxman AD, Guyatt GH. The science of reviewing research. Ann N Y Acad Sci. 1993 Dec 31;703:125-33; discussion 133-4. | CrossRef | PubMed |
Oxman AD, Guyatt GH. The science of reviewing research. Ann N Y Acad Sci. 1993 Dec 31;703:125-33; discussion 133-4. | CrossRef | PubMed | Mann JI. Evidence-based nutrition: Does it differ from evidence-based medicine? Ann Med. 2010 Oct;42(7):475-86. | CrossRef | PubMed |
Mann JI. Evidence-based nutrition: Does it differ from evidence-based medicine? Ann Med. 2010 Oct;42(7):475-86. | CrossRef | PubMed | Grimes DA, Schulz KF. Bias and causal associations in observational research. Lancet. 2002 Jan 19;359(9302):248-52. | PubMed |
Grimes DA, Schulz KF. Bias and causal associations in observational research. Lancet. 2002 Jan 19;359(9302):248-52. | PubMed | Lu CY. Observational studies: a review of study designs, challenges and strategies to reduce confounding. Int J Clin Pract. 2009 May;63(5):691-7. | CrossRef | PubMed |
Lu CY. Observational studies: a review of study designs, challenges and strategies to reduce confounding. Int J Clin Pract. 2009 May;63(5):691-7. | CrossRef | PubMed | Grimes DA, Schulz KF. An overview of clinical research: the lay of the land. Lancet. 2002 Jan 5;359(9300):57-61. | PubMed |
Grimes DA, Schulz KF. An overview of clinical research: the lay of the land. Lancet. 2002 Jan 5;359(9300):57-61. | PubMed | Spieth PM, Kubasch AS, Penzlin AI, Illigens BM, Barlinn K, Siepmann T. Randomized controlled trials - a matter of design. Neuropsychiatr Dis Treat. 2016 Jun 10;12:1341-9. | CrossRef | PubMed |
Spieth PM, Kubasch AS, Penzlin AI, Illigens BM, Barlinn K, Siepmann T. Randomized controlled trials - a matter of design. Neuropsychiatr Dis Treat. 2016 Jun 10;12:1341-9. | CrossRef | PubMed | Suresh K. An overview of randomization techniques: An unbiased assessment of outcome in clinical research. J Hum Reprod Sci. 2011 Jan;4(1):8-11. | CrossRef | PubMed |
Suresh K. An overview of randomization techniques: An unbiased assessment of outcome in clinical research. J Hum Reprod Sci. 2011 Jan;4(1):8-11. | CrossRef | PubMed | Ho PM, Peterson PN, Masoudi FA. Evaluating the evidence: is there a rigid hierarchy? Circulation. 2008 Oct 14;118(16):1675-84. | CrossRef | PubMed |
Ho PM, Peterson PN, Masoudi FA. Evaluating the evidence: is there a rigid hierarchy? Circulation. 2008 Oct 14;118(16):1675-84. | CrossRef | PubMed | Hill A. The environment and disease: association or causation? Proc R Soc Med. 1965 May;58(5):295–300. | PubMed |
Hill A. The environment and disease: association or causation? Proc R Soc Med. 1965 May;58(5):295–300. | PubMed | Höfler M. The Bradford Hill considerations on causality: a counterfactual perspective. Emerg Themes Epidemiol. 2005 Nov 3;2:11. | PubMed |
Höfler M. The Bradford Hill considerations on causality: a counterfactual perspective. Emerg Themes Epidemiol. 2005 Nov 3;2:11. | PubMed | Lutz M, Fuentes E, Ávila F, Alarcón M, Palomo I. Roles of Phenolic Compounds in the Reduction of Risk Factors of Cardiovascular Diseases. Molecules. 2019 Jan 21;24(2). pii: E366. | CrossRef | PubMed |
Lutz M, Fuentes E, Ávila F, Alarcón M, Palomo I. Roles of Phenolic Compounds in the Reduction of Risk Factors of Cardiovascular Diseases. Molecules. 2019 Jan 21;24(2). pii: E366. | CrossRef | PubMed | Scientific Opinion on the substantiation of health claims related to polyphenols in olive and protection of LDL particles from oxidative damage (ID 1333, 1638, 1639, 1696, 2865), maintenance of normal blood HDL cholesterol concentrations (ID 1639), mainte. EFSA J. 2011 Apr 1;9(4):2033. | Link |
Scientific Opinion on the substantiation of health claims related to polyphenols in olive and protection of LDL particles from oxidative damage (ID 1333, 1638, 1639, 1696, 2865), maintenance of normal blood HDL cholesterol concentrations (ID 1639), mainte. EFSA J. 2011 Apr 1;9(4):2033. | Link | Scientific Opinion on the substantiation of a health claim related to cocoa flavanols and maintenance of normal endothelium‐dependent vasodilation pursuant to Article 13(5) of Regulation (EC) No 1924/2006. EFSA J. 2012 Jul;10(7). | Link |
Scientific Opinion on the substantiation of a health claim related to cocoa flavanols and maintenance of normal endothelium‐dependent vasodilation pursuant to Article 13(5) of Regulation (EC) No 1924/2006. EFSA J. 2012 Jul;10(7). | Link | Ávila-Gálvez MÁ, González-Sarrías A, Espín JC. In Vitro Research on Dietary Polyphenols and Health: A Call of Caution and a Guide on How To Proceed. J Agric Food Chem. 2018 Aug 1;66(30):7857-7858. | CrossRef | PubMed |
Ávila-Gálvez MÁ, González-Sarrías A, Espín JC. In Vitro Research on Dietary Polyphenols and Health: A Call of Caution and a Guide on How To Proceed. J Agric Food Chem. 2018 Aug 1;66(30):7857-7858. | CrossRef | PubMed | Cory H, Passarelli S, Szeto J, Tamez M, Mattei J. The Role of Polyphenols in Human Health and Food Systems: A Mini-Review. Front Nutr. 2018 Sep 21;5:87. | CrossRef | PubMed |
Cory H, Passarelli S, Szeto J, Tamez M, Mattei J. The Role of Polyphenols in Human Health and Food Systems: A Mini-Review. Front Nutr. 2018 Sep 21;5:87. | CrossRef | PubMed | Fedak KM, Bernal A, Capshaw ZA, Gross S. Applying the Bradford Hill criteria in the 21st century: how data integration has changed causal inference in molecular epidemiology. Emerg Themes Epidemiol. 2015 Sep 30;12:14. | CrossRef | PubMed |
Fedak KM, Bernal A, Capshaw ZA, Gross S. Applying the Bradford Hill criteria in the 21st century: how data integration has changed causal inference in molecular epidemiology. Emerg Themes Epidemiol. 2015 Sep 30;12:14. | CrossRef | PubMed | Mittal N, Goyal M, Mittal PK. Understanding and Appraising Systematic Reviews and Meta-Analysis. J Clin Pediatr Dent. 2017;41(5):317-326. | CrossRef | PubMed |
Mittal N, Goyal M, Mittal PK. Understanding and Appraising Systematic Reviews and Meta-Analysis. J Clin Pediatr Dent. 2017;41(5):317-326. | CrossRef | PubMed | Glasziou P, Irwig L, Bain C, Colditz G. Systematic Reviews in Health Care. Cambridge: Cambridge University Press; 2001. | Link |
Glasziou P, Irwig L, Bain C, Colditz G. Systematic Reviews in Health Care. Cambridge: Cambridge University Press; 2001. | Link | Higgins J, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. The Cochrane Collaboration; 2011. | Link |
Higgins J, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0. The Cochrane Collaboration; 2011. | Link | Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions: explanation and elaboration. BMJ. 2009 Jul 21;339:b2700. | CrossRef | PubMed |
Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions: explanation and elaboration. BMJ. 2009 Jul 21;339:b2700. | CrossRef | PubMed | Gough G, Oliver S, Thomas J. An Introduction to Systematic Reviews. London: SAGE Publications; 2012.
Gough G, Oliver S, Thomas J. An Introduction to Systematic Reviews. London: SAGE Publications; 2012.  Khan K, Zunz R, Kleijnen J, Antes G. Systematic Reviews to Support Evidence-based Medicine. London: Royal Society of Medicine Press; 2003. | Link |
Khan K, Zunz R, Kleijnen J, Antes G. Systematic Reviews to Support Evidence-based Medicine. London: Royal Society of Medicine Press; 2003. | Link | Hopewell S, McDonald S, Clarke M, Egger M. Grey literature in meta-analyses of randomized trials of health care interventions. Cochrane Database Syst Rev. 2007 Apr 18;(2):MR000010. | PubMed |
Hopewell S, McDonald S, Clarke M, Egger M. Grey literature in meta-analyses of randomized trials of health care interventions. Cochrane Database Syst Rev. 2007 Apr 18;(2):MR000010. | PubMed | Buckley DI, Ansari MT, Butler M, Soh C, Chang CS. The refinement of topics for systematic reviews: lessons and recommendations from the Effective Health Care Program. J Clin Epidemiol. 2014 Apr;67(4):425-32. | CrossRef | PubMed |
Buckley DI, Ansari MT, Butler M, Soh C, Chang CS. The refinement of topics for systematic reviews: lessons and recommendations from the Effective Health Care Program. J Clin Epidemiol. 2014 Apr;67(4):425-32. | CrossRef | PubMed | Franco JVA, Arancibia M, Simancas-Racines D, Madrid E. Syntheses of biomedical information: narrative reviews, systematic reviews and emerging formats. Medwave. 2018 Nov 27;18(7):e7354. | CrossRef | PubMed |
Franco JVA, Arancibia M, Simancas-Racines D, Madrid E. Syntheses of biomedical information: narrative reviews, systematic reviews and emerging formats. Medwave. 2018 Nov 27;18(7):e7354. | CrossRef | PubMed | Pae C-U. Why Systematic Review rather than Narrative Review? Psychiatry Investig. 2015 Jul;12(3):417–9. | CrossRef | PubMed |
Pae C-U. Why Systematic Review rather than Narrative Review? Psychiatry Investig. 2015 Jul;12(3):417–9. | CrossRef | PubMed | Handu D, Moloney L, Wolfram T, Ziegler P, Acosta A, Steiber A. Academy of Nutrition and Dietetics Methodology for Conducting Systematic Reviews for the Evidence Analysis Library. J Acad Nutr Diet. 2016 Feb;116(2):311-8. | CrossRef | PubMed |
Handu D, Moloney L, Wolfram T, Ziegler P, Acosta A, Steiber A. Academy of Nutrition and Dietetics Methodology for Conducting Systematic Reviews for the Evidence Analysis Library. J Acad Nutr Diet. 2016 Feb;116(2):311-8. | CrossRef | PubMed | Higgins J, Thompson S, Deeks J, Altman D. Statistical heterogeneity in systematic reviews of clinical trials: a critical appraisal of guidelines and practice. J Health Serv Res Policy. 2002 Jan;7(1):51-61. | PubMed |
Higgins J, Thompson S, Deeks J, Altman D. Statistical heterogeneity in systematic reviews of clinical trials: a critical appraisal of guidelines and practice. J Health Serv Res Policy. 2002 Jan;7(1):51-61. | PubMed |