 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sociedad Chilena de Nefrología.
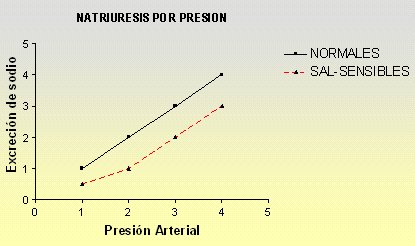
La importancia del daño túbulo-intersticial en la patogenia de la hipertensión arterial se puso en evidencia con los trabajos de Johnson, Rodríguez-Iturbe y Herrera-Acosta, quienes reactivando antiguos estudios de fisiología que demostraban que la natriuresis por presión estaba alterada en los sujetos sensibles a la sal; es decir, estos pacientes necesitaban mayor presión arterial para excretar una carga equivalente de sodio (Fig. 1). Los hipertensos arteriales esenciales humanos presentan frecuentemente este defecto y prácticamente todos los modelos experimentales de hipertensión arterial contemplan la presencia de un mecanismo alterado del manejo de la sal.
Figura 1. Sensibilidad a la sal y desviación a la derecha de la curva de natriuresis por presión
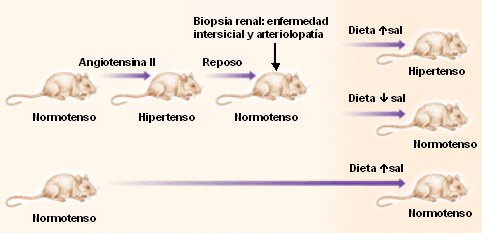
La sensibilidad a la sal se ha estudiado en muchos modelos y los protocolos experimentales incluyen tres etapas fundamentales: primero, se induce daño túbulo-intersticial (habitualmente asociado a isquemia); después viene un período de recuperación (washout), que dura 10 a 14 días; y luego los animales son expuestos a dieta hipersódica. La hipertensión arterial aparece sólo en presencia de una dieta rica en sal, en tanto que frente a una ingesta normosódica los animales permanecen normotensos. En el experimento inicial de Johnson (Fig. 2), a ratas normotensas se les infundió angiotensina II mediante una bomba subcutánea osmótica, observándose hipertensión durante ese período; luego se las dejó descansar hasta volverse normotensas. En la biopsia renal se observó que habían desarrollado una enfermedad intersticial y arteriopatía aferente renal, exactamente igual a la que se describe en la hipertensión arterial esencial humana. Luego del wash/out, un grupo de estos animales recibió una dieta normosódica, con lo que se mantuvieron normotensos y otro grupo recibió una dieta rica en sal, presentando hipertensión. Los animales de esta misma cepa que no recibieron angiotensina y, por tanto, no sufrieron daño túbulo-intersticial, permanecieron normotensos cuando recibieron dietas ricas en sal.
Figura 2. El modelo de sal-sensibilidad post-infusión de angiotensina
Entre los mecanismos propuestos para explicar la sensibilidad a la sal se ha planteado que se reduce el área vascular peritubular necesaria para la adecuada función del mecanismo de natriuresis por presión; hay hipertrofia de la arteriola aferente; y activación local de factores humorales que favorecen la retención de sodio, fundamentalmente, el sistema renina angiotensina (SRA) y la endotelina-1. Recientes experimentos han demostrado neoinducción de enzima convertidora y síntesis de angiotensina local en el citoplasma de células infiltrantes inflamatorias, en el intersticio renal. En el trabajo de Rodríguez-Iturbe, Johnson y Herrera-Acosta se infundió angiotensina II a ratas, las que presentaron hipertensión mientras eran perfundidas y posteriormente, sal-sensibilidad. Si a estos animales se les trataba con micofenolato, que disminuye la inflamación túbulo-intersticial inmune, se volvían normotensos. La disminución de la inflamación intersticial, que forma parte de un nuevo SRA intrarrenal, era afectada por el micofenolato (Kidney International 59 (6), 2.222-2.232).
Se debe recordar que el manejo fisiológico de la hipertensión arterial involucra un equilibrio exquisito entre factores vasoconstrictores, retenedores de sal, vasodilatadores y expoliadores de sal. Si bien es cierto en estos dos últimos se ha puesto menor atención, se ha demostrado que ellos son producidos en el riñón, particularmente en el espacio túbulo-intersticial y se pueden alterar durante el daño de este órgano, con la consiguiente pérdida del balance fisiológico necesario para la regulación normal de la presión arterial. Este hecho podría explicar las alteraciones presentes en la sensibilidad a la sal y en la hipertensión arterial asociada con ella.
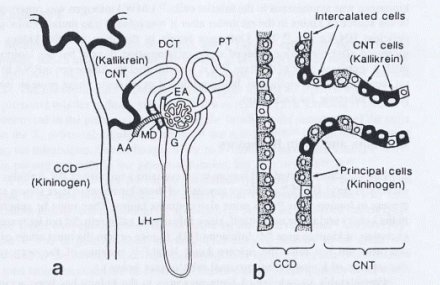
El Sistema Calicreína-Cininas (SCC) renal se compone de células del túbulo conector, que producen calicreína y, curiosamente, son las mismas que excretan el potasio; más abajo en la nefrona, en el túbulo colector distal, se produce cininógeno, que es el sustrato natural de la calicreína y que es el precursor de las cininas, que son las sustancias activas. En la figura 3 se puede observar que en el mismo segmento de conección hay células productoras de calicreínas y otras que no lo son, lo que se puede diferenciar muy fácilmente con la inmunohistoquímica para calicreína.
Figura 3. El Sistema Calicreína-Cininas renal se ubica en el espacio túbulo-intersticial (Bhoola, Figueroa, Worthy. Pharmacol Rev)
La acción del SCC se realiza a través de un complejo multienzimático de acción paracrina, es decir, que tiene efecto en el mismo riñón; pero las cininas también pasan hacia el sistema venoso renal, por lo que pueden actuar a nivel sistémico y reducir el tono vascular global. Este sistema interactúa con el SRA: la enzima convertidora de angiotensina es la cininasa por excelencia (de hecho tiene mucha más afinidad como cininasa que como enzima convertidora de angiotensina); con las prostaglandinas y con el óxido nítrico, que incluso actúa como mediador de la acción de las cininas. Los componentes del SCC son: la enzima calicreína renal, que se produce en el túbulo conector; sus sustratos, cininógenos de alto y bajo peso molecular, que esta enzima transforma en péptidos; los péptidos bioactivos efectores conocidos como cininas (lys-bradicinina y bradicinina); dos enzimas catabólicas, que son la enzima convertidora de angiotensina ECA (cininasa II) y la endopeptidasa neutra; los receptores B1 y B2 de cininas; y variados activadores e inhibidores. El SCC actúa en la regulación de la presión arterial, reduce el tono vascular, estimula el flujo sanguíneo renal, estimula la excreción de sodio y agua y es un factor modulador de crecimiento.
Hay evidencias experimentales de la importancia que tiene este sistema en la regulación de la presión arterial. Ciertas cepas de ratas con baja excreción de calicreína, cuando son expuestas a dietas ricas en sal presentan elevaciones significativas de la presión arterial, es decir, son sensibles a la sal. La otra evidencia se encuentra en las ratas mutantes Brown-Norway-Katoliek, que son deficientes en cininógenos y tienen un aspecto y fenotipo muy normales, pero son muy sensibles a la ingesta excesiva de sal y frente a la exposición a dietas hipersódicas desarrollan hipertensión y acumulación de sodio en el líquido cefalorraquídeo y en los eritrocitos.
Otros experimentos han demostrado que la estimulación de la actividad del SCC, mediante la inhibición del catabolismo de las cininas, puede aumentar la excreción de sal previniendo la aparición de hipertensión; hay varias sustancias capaces de lograrlo. Por último, la infusión de calicreína en ratas hipertensas o la transfección de calicreína humana a animales que son sensibles a la sal o que tienen daño renal, reduce la presión arterial, disminuye el daño renal y mejora el fenómeno de remodelación miocárdica asociado. A nivel clínico humano las evidencias están en la reducción de los niveles de calicreína urinaria en sujetos hipertensos y sus parientes, particularmente aquellos sensibles a la sal. También se ha visto que la administración farmacológica de calicreína a pacientes hipertensos reduce significativamente su presión arterial, lo que es más evidente en sujetos sensibles a la sal.
A nivel experimental, nuestro grupo ha trabajado en tres modelos de daño túbulo intersticial que se asocian con sensibilidad a la sal y que cumplen con la secuencia ya comentada: daño túbulo intersticial (habitualmente asociado con un fenómeno isquémico), un período de descanso y la evidencia de hipertensión cuando se someten a dietas ricas en sal. Estos son: el modelo L-NAME, o modelo de inhibición de la síntesis de óxido nítrico, que causa daño isquémico medular renal; la nefrectomía 5/6, que también puede causar hipertensión sensible a la sal; y el modelo de proteinuria por sobrecarga de albúmina de bovino intraperitoneal. Junto con un análisis estructural del tejido renal, hemos evaluado la actividad del SCC por cuantificación de la expresión inmunohistoquímica con un analizador de imágenes, y medición de la actividad enzimática urinaria específica de calicreína tisular renal, ya que estudiar las cininas resulta muy difícil, por su vida media corta y difícil extracción. La expresión inmunohistoquímica se analizó mediante el analizador de imágenes Zeiss KS-300, un software que permite segmentar las zonas de interés, excluyendo los glomérulos y los vasos sanguíneos, para determinar qué proporción el tejido túbulo-intersticial expresa el antígeno y con qué intensidad, integrando así las dos variables. La medición de la presión arterial se determinó en la cola de las ratas con un sistema doppler, usando un pequeño mango de compresión y un pequeño transductor. Las recolecciones urinarias se efectuaron en cajas metabólicas artesanales (Fig. 4).
Figura 4. Equipo para medición de presión arterial y recolección urinaria en ratas
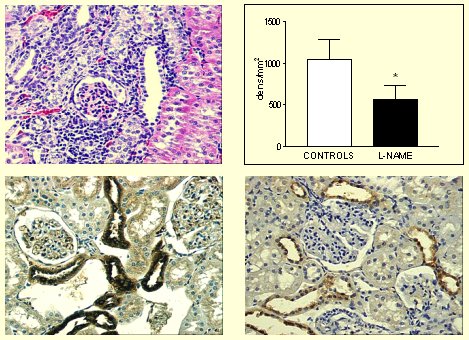
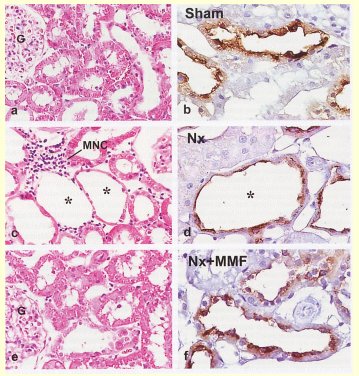
Cuando observamos la histología de una rata tratada con L-NAME por tres semanas para inhibir el óxido nítrico (Fig. 5), encontramos un gran daño túbulo-intersticial y una clara reducción de la expresión de calicreína, en comparación con animales controles normales.
Estos animales al ser expuestos posteriormente a dietas ricas en sal manifiestan hipertensión arterial.
Figura 5. Modelo L-NAME
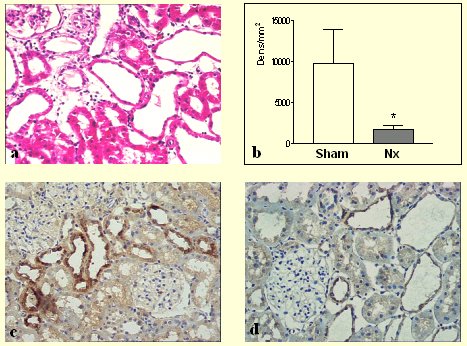
Nuestros primeros experimentos se efectuaron en el modelo de nefrectomía subtotal, comparando con una nefrectomía falsa o sham; los animales nefrectomizados mostraron una franca reducción de la expresión de calicreína (Fig. 6). Cuando se administró micofenolato en la etapa de inducción del daño, se observó una significativa mejoría; o sea, hay un efecto adicional a la reducción de la infiltración inmune, que corresponde muy probablemente a la reparación que sufre el tejido renal, aumentando la expresión de calicreína y promoviendo la normalización de la presión arterial. Experimentos paralelos descartaron que el micofenolato fuera capaz de estimular la calicreína por sí solo (Fig. 7). Los trabajos originales de Herrera-Acosta con este modelo tratado con micofenolato no mostraron un efecto hipotensor estadísticamente significativo, aunque sí una clara tendencia; sin embargo, el grupo de ratas nefrectomizadas no tratadas con micofenolato que se utilizaron en nuestros experimentos presentaron mayores cifras tensionales, lo que permitió demostrar la mejoría en la expresión de la calicreína y, además, evidenciar un efecto hipotensor de la intervención farmacológica con micofenolato.
Figura 6. Nefrectomía subtotal (5/6)
Figura 7. Efecto del micofenolato en la nefrectomía 5/6
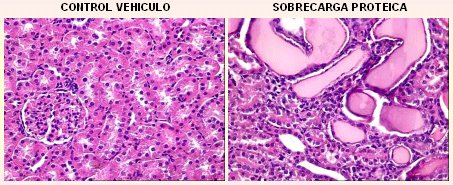
El modelo de proteinuria por sobrecarga proteica heteróloga intraperitoneal es un modelo de daño túbulo-intersticial no inmune en el cual, cuando se inyecta seroalbúmina de bovino, se origina una sobrecarga proteica tubular, frente a la cual los túbulos se activan y generan gran daño inflamatorio túbulo-intersticial como respuesta. Hay evidencias claras de que este daño es secundario a la proteinuria y no es inmunológico; de hecho, si se administra albúmina de rata a una rata, se causa el mismo efecto.
Cuando observamos la histología de un riñón de rata sometida a sobrecarga de proteína intraperitoneal pudimos apreciar inflamación, dilatación tubular y atrofia, es decir, daño túbulo-intersticial muy intenso. Las ratas tratadas con este modelo partieron con presiones normales y al tercer día comenzaron a presentar hipertensión arterial, que se mantuvo hasta los 14 días, mientras se inyectaba la proteína (Fig. 8). Este fenómeno no se había descrito con entusiasmo en los primeros estudios efectuados en este modelo, en los que se comunicó la hipertensión arterial solamente como un hecho anecdótico.
Figura 8. Modelo de proteinuria por sobrecarga proteica heteróloga intraperitoneal
En ratas proteinúricas, tanto a la dosis número 7 como a la 14 sucedió lo mismo: hubo una franca reducción en la expresión de la calicreína renal, lo que también se vio a nivel urinario, con una significativa correlación entre ellas, y una correlación inversa con la presión arterial.
Experimentos realizados hace algunos años en la Universidad Austral por Figueroa y Vío mostraron que la secreción de calicreína renal era estimulada por la administración de cloruro de potasio en la dieta. Entonces decidimos pretratar a los animales, durante cuatro semanas previo y durante el período de inyecciones i.p., con cloruro de potasio, para probar la hipótesis de que “si mejoraba la producción y excreción de calicreína, se podía proteger los animales contra la hipertensión”. Nuestros resultados mostraron una franca recuperación de la expresión y actividad urinaria de calicreína, acompañadas de una reducción significativa de las cifras tensionales. No logramos demostrar mejoría significativa del daño renal histológico, probablemente porque el período de análisis fue muy corto (7 días) pero esperamos que esto pueda ser evidenciado en experimentos más prolongados.
El importante hallazgo anterior fue reforzado con otro experimento, utilizando el bloqueador del receptor B2 de cininas (Icatibant) en ratas protenúricas tratadas con potasio, con el que demostramos que sin modificar la expresión de calicreína, se perdía el efecto hipotensor del potasio. Este efecto permite postular un efecto agudo, vasodilatador de las cininas estimuladas con el potasio. Estos resultados fueron publicados en Kidney International, en el número de Enero de 2006.
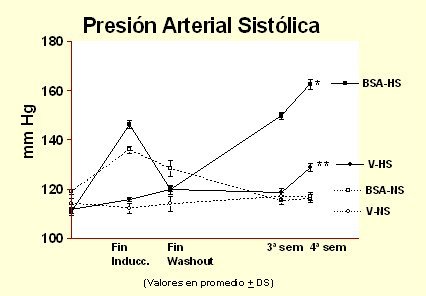
Una vez que se demostró que había hipertensión arterial y down regulation del sistema calicreína en la etapa de inyección, faltaba ver lo que ocurría en la etapa de sensibilidad a la sal. Para esto se inyectó albúmina o vehículo (suero fisiológico) a un grupo de animales y después de un wash/out se les sometió a diferentes dietas de sal, por 4 semanas. Las ratas tratadas con vehículo y sometidas a dieta normosódica no mostraron cambios en la presión arterial. En las ratas inyectadas con albúmina subió la presión arterial en la fase de inducción, se normalizó progresivamente la presión después del descanso y quedaron normotensas cuando recibieron dieta normosódica; pero cuando recibieron dieta hipersódica hicieron hipertensión arterial (Fig. 9). Inesperadamente, el grupo de ratas tratadas con vehículo, al recibir dieta hipersódica mostró un ascenso discreto de la presión arterial, que sin ser siquiera cercano al nivel mostrado por las ratas con daño túbulo-intersticial, sugiere un cierto grado de sensibilidad a la sal. Es probable que esta cepa tenga un SCC un poco más débil, pero no tenemos pruebas suficientes para afirmarlo.
Figura 9. Sensibilidad a la sal posterior a proteinuria por sobrecarga (overload proteinuria). Grupos: VL: vehículo-normosódico, VH: vehículo-hipersódico, BL: BSA-hiposódico, BH: BSA-hipersódico.
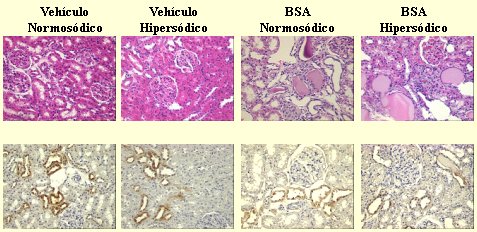
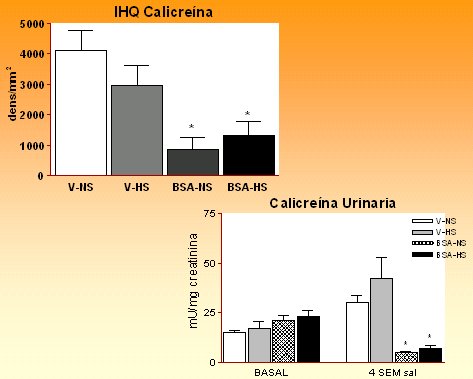
Cuando hicimos el análisis histológico de las ratas inyectadas con albúmina, al final de las 4 semanas de observación con dietas diferentes en sal (6 semanas después de la última inyección), todavía había alteraciones del SCC y signos de daño túbulo-intersticial en las ratas inyectadas con albúmina: todas ellas mostraron una reducción en la expresión y excreción de calicreína comparadas con las controles que recibieron vehículo, aunque sólo desarrollaron hipertensión cuando recibieron una dieta hipersódica.
Figura 10. Sensibilidad a la sal posterior a proteinuria por sobrecarga: histología e inmunohistoquímica de calicreína (BSA= seroalbúmina de bovino)
Figura 11: Expresión histoquímica (IHQ) de calicreína y excreción de calicreína urinaria frente a sobrecarga de proteínas. Grupos: VL: vehículo-normosódico, VH: vehículo-hipersódico, BL: BSA-hiposódico, BH: BSA-hipersódico.
Recientemente analizamos el daño túbulo-intersticial con una tinción específica para detectar fibrosis (tricrómica de Masson) y observamos que en las ratas inducidas con albúmina que recibieron dieta normosódica y no fueron hipertensas existe cierto grado de fibrosis renal. Interesantemente, en las ratas sometidas a albúmina que además se hicieron hipertensas con sal, la fibrosis aumentó al doble y cuando se les administró potasio, la fibrosis disminuyó. Este resultado es muy interesante, porque va más allá del problema de la presión arterial y se debe explorar, pues es posible que las cininas tengan un efecto protector renal intrínseco.
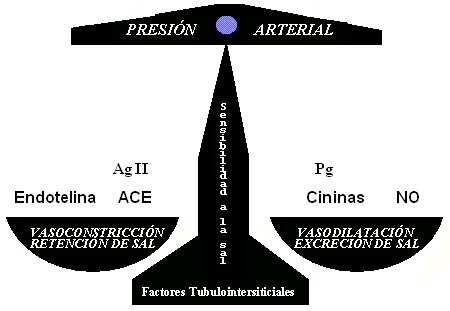
Finalmente, nuestra línea de investigación permite concluir que es probable que las alteraciones descritas a nivel renal se traduzcan en una reducción persistente de la producción de cininas y se establezca un desbalance, que era lo que se quería demostrar, a favor de los factores vasoconstrictores y retenedores de sal (endotelina, angiotensina y ACE). Por lo tanto, la preservación del SCC podría atenuar o prevenir el desarrollo de la sensibilidad a la sal y, eventualmente, proteger de la fibrosis renal (Fig. 12).
Figura 12. Relación entre factores vasoconstrictores y retenedores de sal en la regulación de la presión arterial













 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sociedad Chilena de Nefrología.
 Expositor:
Leopoldo Ardiles Arnaiz[1]
Expositor:
Leopoldo Ardiles Arnaiz[1]

Citación: Ardiles L. Kallikrein-kinin system and salt-sensitive hypertension. Medwave 2006 May;6(4):e2319 doi: 10.5867/medwave.2006.04.2319
Fecha de publicación: 1/5/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Mezzano S, Vió CP, Ardiles L, Olavarría F. Excreción de calicreína en pacientes con S. nefrítico y S. Nefrótico. Rev Med Chil. 1988 Sep;116(9):863-8 | PubMed |
Mezzano S, Vió CP, Ardiles L, Olavarría F. Excreción de calicreína en pacientes con S. nefrítico y S. Nefrótico. Rev Med Chil. 1988 Sep;116(9):863-8 | PubMed | Ardiles L, Figueroa CD, Ehrenfeld P, Quiroz Y, Rodriguez-Iturbe B, Herrera Acosta J, Mezzano S, et al. Effect of Mycophenolate mofetil on kallicrein expression in tha kidney of 5/6 nephrectomized rats. Kidney Blood Press Res. 2002;25(5):289-95. | CrossRef | PubMed |
Ardiles L, Figueroa CD, Ehrenfeld P, Quiroz Y, Rodriguez-Iturbe B, Herrera Acosta J, Mezzano S, et al. Effect of Mycophenolate mofetil on kallicrein expression in tha kidney of 5/6 nephrectomized rats. Kidney Blood Press Res. 2002;25(5):289-95. | CrossRef | PubMed | Ardiles L, Figueroa CD, Mezzano S. Renal kallikrein-kinin system damage and salt-sensitivity: insights from experimental models. Kidney Int Suppl. 2003 Oct;(86):S2-8. | CrossRef | PubMed |
Ardiles L, Figueroa CD, Mezzano S. Renal kallikrein-kinin system damage and salt-sensitivity: insights from experimental models. Kidney Int Suppl. 2003 Oct;(86):S2-8. | CrossRef | PubMed | Ruiz-Ortega M, Esteban V, Suzuki Y, Ruperez M, Mezzano S, Ardiles L, et al. Renal expression of Angiotensin type 2 (AT2) receptors during kidney damage. Kidney Int Suppl. 2003 Oct;(86):S21-6. | CrossRef | PubMed |
Ruiz-Ortega M, Esteban V, Suzuki Y, Ruperez M, Mezzano S, Ardiles L, et al. Renal expression of Angiotensin type 2 (AT2) receptors during kidney damage. Kidney Int Suppl. 2003 Oct;(86):S21-6. | CrossRef | PubMed | Ardiles L. Sistema Calicreína-Cininas (SCC) e Hipertensión Sal-sensible. Simposium Hipertensión (Fisiopatología), XIII Congreso Latinoamericano de Nefrología e Hipertensión. Nefrología Latinoamericana 2004; 11(1): p. 41.
Ardiles L. Sistema Calicreína-Cininas (SCC) e Hipertensión Sal-sensible. Simposium Hipertensión (Fisiopatología), XIII Congreso Latinoamericano de Nefrología e Hipertensión. Nefrología Latinoamericana 2004; 11(1): p. 41.