La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sociedad Chilena de Nefrología.
En esta exposición presentaré parte del trabajo realizado durante mi estadía postdoctoral con el Dr. Maurice Burg (National Institutes of Health), además de otros estudios posteriores relacionados con los mecanismos de adaptación al estrés osmótico de las células de la médula renal.
Las células de la médula renal están sometidas a dos tipos de estrés; el primero es causado por la hipoperfusión relativa, que condiciona una baja tensión de oxígeno, y el segundo es el estrés osmótico, que permite la concentración de la orina.
Distintos autores han publicado experimentos reproducibles, diseñados para observar los cambios del gradiente corticomedular frente a distintas condiciones fisiológicas. En general, estos estudios han demostrado que la médula siempre es hipertónica, independientemente de la osmolaridad urinaria; incluso en condiciones de diuresis acuosa durante tiempos cortos, en un animal normal, la médula es hipertónica. La osmolaridad del intersticio renal se va adaptando al balance acuoso.
En ratas sometidas durante 24 horas a deprivación acuosa, se observa que, a medida que se va avanzando hacia el vértice de la papila, va aumentando la osmolaridad total, que en estas condiciones está dada por un aumento paulatino en las concentraciones de cloruro de sodio y urea. De esta forma se produce el gradiente corticomedular, que puede ser medido con métodos electrofisiológicos.
Si a un animal similar se le administra agua de manera forzada, con la intención de disminuir su osmolaridad urinaria, de todas formas presenta un gradiente hiperosmótico desde la médula externa hacia la papila, con menor contribución relativa de urea. En ambos casos la osmolaridad plasmática se mantiene constante en un animal normal, en estas condiciones.
En suma, independientemente del balance de agua y de los mecanismos homeostáticos que se pongan en juego para regular la excreción de agua por el riñón, la médula siempre es hiperosmótica, y los principales osmolitos son el cloruro de sodio y la urea.
De manera intuitiva, se piensa que el vivir en un ambiente hipertónico es poco amigable para la célula, pero también se sabe desde hace mucho tiempo que las células, sobre todo las de origen vegetal y los organismos unicelulares sometidos a estrés osmótico o desecación, tienen una serie de mecanismos que les permiten medir la osmolaridad de su medio externo e interno y adaptarse a los cambios percibidos.
Para estudiar el efecto del estrés osmótico sobre las células de la médula renal, se utilizó como modelo una línea celular de médula renal interna de epitelio de ratón, en la que se midió la proliferación celular en distintas condiciones osmóticas. Este estudio demostró que en un medio isotónico se produce un crecimiento celular exponencial y que, a medida que va aumentando la osmolaridad del medio, el número de células va disminuyendo.
Este experimento se repitió aumentando la osmolaridad del medio mediante la adición de urea, observándose un resultado similar: a mayor concentración de urea en el medio, menor número de células sobreviven con el paso del tiempo; aparentemente, la combinación de los solutos tiene un efecto aditivo. Estos resultados tendrían al menos dos posibles explicaciones: las células están muriendo a una velocidad muy acelerada, están proliferando a una velocidad menor que la normal, o existe alguna combinación de estas alternativas.
Se puede estudiar la inhibición de la proliferación celular renal, determinando si el ciclo celular se torna más lento. Normalmente las células está en G0, pasan por G1 cuando entran en el ciclo proliferativo, y mientras se mueven de G1 pasan por la fase S, que es la síntesis de nuevo ADN, y llegan a G2M con su ADN duplicado. Entonces, la progresión a través del ciclo celular se analiza midiendo el contenido de ADN.
Si se obtiene un citograma de las células en condiciones isotónicas, se puede ver que una proporción de ellas, que son las que están en G1, tienen un contenido 2n de ADN, mientras que las que están al final de G2M tienen 4n, es decir, el doble de ADN. Entre medio están todas las células que están sintetizando ADN para llegar a la fase replicativa, que es la mitosis.
La proporción de células en un citograma que está en cada una de las etapas del ciclo celular, depende de la velocidad con la cual salen de G1, sintetizan ADN y salen de G2M, es decir, completan la mitosis; por lo tanto, un enlentecimiento del ciclo celular se refleja en un aumento en la proporción de células en alguna de las fases del ciclo.
Cuando la célula es sometida al estrés osmótico con urea, aumenta la proporción de células en fase G2M, lo que indica que se están moviendo más lentamente a través del ciclo celular y se están quedando detenidas más tiempo en esta fase. Algo similar sucede cuando se someten a estrés hipertónico con cloruro de sodio o si se combinan ambos osmolitos.
La velocidad de tránsito por el ciclo celular se puede medir con distintas técnicas; se ha determinado que, en un medio adecuado, el paso desde G1 hasta el fin de G2M se demora alrededor de 12 a 16 horas, mientras que en un medio hiperosmótico esto se enlentece, lo que se observa también en medios hipertónicos con cloruro de sodio. La conclusión es que uno de los efectos del estrés hipertónico es enlentecer el movimiento a través del ciclo celular.
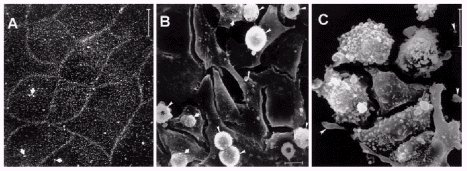
El otro efecto del estrés osmótico es la inducción de muerte celular, que ocurre principalmente por apoptosis. En la figura 1 se presenta una microscopía electrónica de barrido; en el cuadro A se observa el epitelio normal, el que, después de algún tiempo bajo condiciones hiperosmóticas con cloruro de sodio, presenta excrecencias y condensaciones típicas de la apoptosis (cuadros B y C).
Figura 1. A, células control. B, agregado de urea a 650 mosm/kg por 24 h, se ven células con distintos grados de tumefacción. C, agregado de urea más NaCl a 1000 mosm/kg por 24 h; células redondas, tumefactas, con cuerpos apoptóticos (flechas).
Este proceso se puede cuantificar mediante citometría de flujo o activación de caspasas, utilizando varios marcadores, con los que se puede ver que, a medida que va aumentando la tonicidad del medio, aumenta la proporción de células apoptóticas en el tiempo. La conclusión es que, además de producirse un enlentecimiento en el tránsito por el ciclo celular, se produce muerte celular, principalmente a través de apoptosis. Estos son los peores efectos que tiene el estrés hipertónico.
La literatura del año 2000 describe dos vías principales a través de las cuales se llega a la apoptosis:
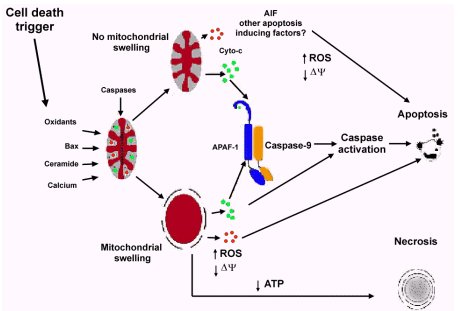
A priori, pensamos que era poco probable que la apoptosis fuera gatillada por un estímulo extracelular; lo más probable es que la causa fuera algo que sucedía en un organelo, como consecuencia del estrés osmótico, planteándose la hipótesis de que la hipertonicidad, o hiperosmolaridad, afectaba la función mitocondrial, gatillando la apoptosis por liberación de citocromo C, o de algún otro factor inductor de apoptosis, desde el espacio mitocondrial. La liberación de estos factores proapoptóticos desde la mitocondria ocurriría a través de un poro o por tumefacción de este organelo (véase figura 2).
Figura 2. Mitocondria y muerte celular.
Una de las predicciones que se desprenden de esta hipótesis es que las células sometidas al estrés hiperosmótico deberían tener una disminución en la concentración de ATP intracelular, aumentando la razón ADP/ATP. Para comprobar esto, se analizó la razón ADP/ATP en condiciones isotónicas e hipertónicas, y se vio que niveles leves de hiperosmolaridad eran bien tolerados, pero con niveles mayores, de 700 mosmoles, aumentaba la relación ADP/ATP en un tiempo relativamente corto, sugiriendo disfunción mitocondrial.
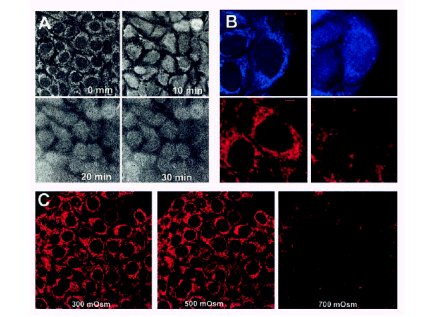
Para tener una idea más directa de la función mitocondrial, se midió la localización y la cantidad de NAD reducido, compuesto que se concentra principalmente en la mitocondria y tiene la característica de ser fluorescente, por lo que, al iluminar la célula con luz ultravioleta, se pueden observar las mitocondrias a una longitud de onda determinada.
En la figura 3 A se observa el control, en el que se ve el núcleo celular y, al lado, puntos que corresponden a las mitocondrias; en los siguientes cuadros del grupo A el cultivo de células renales ha sido puesto en condiciones hipertónicas, a 700 mosmoles, durante 10, 20 y 30 minutos, observándose que la señal que corresponde al NAD, que en condiciones normales se concentra en la mitocondria, difunde hacia el citosol. Al mirar con más aumento se observan las células antes y después del estrés, dando la impresión de que el NAD reducido se libera.
Otra manera de estudiar la función mitocondrial es observando lo que pasa con el potencial de membrana normalmente impuesto por la bomba de protones, que es muy hiperpolarizado (-175 miliV). Existe un colorante que se concentra en las mitocondrias, debido a este potencial negativo, dando un color rojo fluorescente. En el grupo B de la figura 3 se puede ver el control, con el núcleo celular y las mitocondrias a su alrededor, observándose cómo desaparece el colorante después de 10 minutos de estrés, lo que significa que las mitocondrias se despolarizaron, es decir, ya no lograron mantener un potencial mitocondrial normal. Esto depende de la magnitud del estrés osmótico. En el último experimento, que se muestra en la zona C de la figura 3, en condiciones isotónicas y con una concentración en el medio de hasta 500 mosmolar, no sucedió nada, pero con 700 mosmolar las mitocondrias dejaron de funcionar.
Figura 3. Estudio del daño mitocondrial inducido por hipertonicidad (explicación en el texto). Michea y cols 2002.
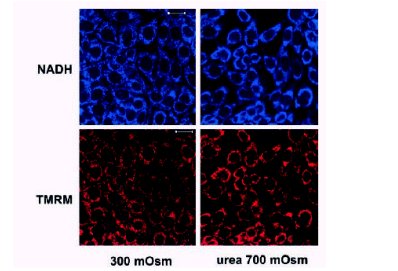
La conclusión de estos experimentos es que parte de los efectos dañinos del estrés hipertónico se produce a través de la interfencia con la función mitocondrial, y probablemente se afecta la permeabilidad, porque el NADH sale de la mitocondria y se concentra en el citosol; sin embargo, estos daños parecen ser secundarios sólo al cloruro de sodio, ya que en un experimento en el que se aumentó la osmolaridad del medio con urea, desde 300 a 700 mOsm, se observó un efecto aparentemente positivo en la función mitocondrial, ya que estos organelos se hiperpolarizaron o se concentraron (véase figura 4).
Figura 4. La hiperosmolaridad a base de urea no afecta la función mitocondrial.
Con respecto a la relación entre la disfunción endotelial y la cascada de control, la principal vía gatillante de apoptosis conocida hasta ese momento, era la liberación de citocromo C, que está adosado a la membrana interna de la mitocondria, en el espacio intermembranoso.
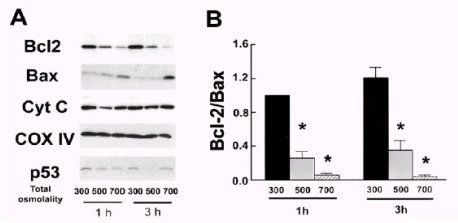
Para determinar si la exposición al estrés hipertónico por 1 a 3 horas producía liberación de citocromo C desde la mitocondria, se realizó una fracción mitocondrial y se midió el contenido de este citocromo con Western blot, el que no varió. Sin embargo, al estudiar otras moléculas que forman poros y están asociadas a la apoptosis mitocondrial, como bcl-2 (antiapoptosis) o bax (proapoptosis), se observó que bcl-2 va desapareciendo de la fracción mitocondrial con el estrés hipertónico, mientras que bax va aumentando, de modo que la razón entre ambas se va reduciendo, como se observa en la figura 5 A y B, lo que sugiere que estas dos moléculas, que son capaces de formar poros en la membrana mitocondrial, presentan cambios compatible con la inducción de apoptosis, aunque no se eleve el citocromo C.
Figura 5. Papel de la disfunción mitocondrial en la apoptosis por hipertonicidad.
Otras moléculas que podrían estar involucradas, como la p53 y la citocromooxidasa 4, que es un marcador mitocondrial, no mostraron variaciones, lo que refuerza el hecho de que el citocromo C realmente no se libera.
La conclusión de esta primera parte es que uno de los efectos deletéreos del estrés hipertónico por cloruro de sodio, se produce por compromiso de la función mitocondrial, probablemente a través de la liberación de algún factor inductor de apoptosis, diferente del citocromo C.
Otro hecho que llamaba la atención, además de la inducción de la apoptosis, era el retardo del ciclo celular. Los grupos dedicados al estudio de la carcinogénesis y al análisis de modelos de daño al ADN por radiación ultravioleta o gamma, habían establecido que normalmente el daño al ADN se asocia con mecanismos reparativos de la célula después de un daño, lo que enlentece el ciclo celular, y que existen puntos en el ciclo celular, llamados check points, en los cuales se produce el reconocimiento de este daño y su reparación.
Nuestros resultados iniciales sugerían que había activación de los check points, razón por la cual se encontraban las células concentradas antes de G2M. Para determinar si el estrés hipertónico produce daño en el DNA se diseñaron nuevas técnicas; en el año 2000 se publicó un trabajo en el que se utilizó la técnica comet (single-cell microgel electrophoresis), que se podría traducir como “el análisis del cometa”, en la cual se coloca una célula en crecimiento sobre un soporte y se le aplica un estímulo cualquiera, para después realizar una electroforesis, sometiendo el núcleo celular a un campo eléctrico. Esto hace que el ADN migre, y esta migración ocurre a mayor velocidad mientras más fraccionado esté el ADN, porque cada trozo tendrá un peso molecular relativo menor.
En la condición control prácticamente no hubo migración del ADN después de aplicar el campo eléctrico; en cambio, frente al estrés hiperosmótico se produjo una migración notable, originando una imagen similar a un cometa, que permite efectuar una medición semicuantitativa del daño del ADN. A medida que transcurre el tiempo bajo el estrés osmótico la “cola” se va alargando, indicando que el estrés dañó al ADN, y a medida que aumenta la osmolaridad también aumenta el largo de la cola, indicando que este daño es proporcional a la magnitud del estrés hipertónico.
Por otro lado, utilizando urea y midiendo el daño al ADN por otro método, se encuentra que, mientras que el cloruro de sodio es capaz de dañar al ADN con una osmolaridad relativamente baja, en términos fisiológicos (600 mosmolar), la urea no produce ningún daño.





 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sociedad Chilena de Nefrología.
 Expositor:
Luis Michea[1]
Expositor:
Luis Michea[1]

Citación: Michea L. Adaptation of renal medulla to osmotic stress: mitochondrial dysfunction, DNA damage and TonEBP (Part I). Medwave 2004 Dic;4(11):e2302 doi: 10.5867/medwave.2004.11.2302
Fecha de publicación: 1/12/2004

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión