Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión científica de la Sociedad Chilena de Nefrología.
En la actualidad existe gran controversia sobre la patogénesis de la hipertensión arterial (HTA) entre investigadores de distintas especialidades médicas: cardiólogos, nefrólogos y fisiólogos. La discusión se enfoca principalmente en la afirmación de que el riñón es el órgano más importante en el desarrollo de la HTA y quizás, el único causante.
Figura 1. Respuesta inmediata de los barorreceptores al aumento de la tensión arterial sistémica.
En el otro extremo del espectro está el riñón, que en condiciones normales, frente a un impulso hipertensivo es capaz de filtrar todo lo necesario hasta llevar la presión a niveles basales, porque es el único órgano con capacidad infinita de compensación. Esto lo demostró Guyton cuando midió la respuesta de algunos sistemas de compensación de la tensión arterial, entre ellos, los barorreceptores, los quimiorreceptores y el sistema de respuesta isquémica del sistema nervioso central, y encontró que todos estos sistemas respondían de manera rápida, pero estas respuestas se tendían a agotar y equilibrar (Fig. 3).
Figura 3. Grado de respuesta de algunos sistemas de regulación de la presión arterial.
El sistema renina angiotensina (SRA) se activa más tardíamente, a los dos o tres minutos, pero continúa actuando durante horas y luego tiende a estabilizarse, en tanto que la aldosterona es aún más lenta y persiste en el tiempo; el único sistema lento es el del riñón, aunque es rápido para eliminar agua. Esto llevó a Guyton a señalar que el riñón es responsable de muchos de los mecanismos que regulan la presión arterial, algunos de los cuales operan de manera rápida y otros, lentamente, pero sólo uno es capaz de compensar de manera infinita si se le da tiempo suficiente para que sus funciones reguladoras alcancen el estado de equilibrio o balance (1). A partir de esto estableció la curva de diuresis por presión (Fig. 4), que se obtiene al graficar la presión arterial media, en el eje de las abscisas, y la ingesta y excreción de sal, en el de las ordenadas. Cuando la presión arterial media es muy baja, entre 40 y 60 mm Hg, no hay flujo al riñón, pero en la medida en que la presión aumenta el flujo sanguíneo aumenta, hasta que llega a 90 ó 100 mm Hg. A partir de esta cifra el flujo sanguíneo se estabiliza, no importa cuánto aumente la presión arterial, debido a la constricción de las arteriolas aferentes, que se contraerán más en la medida en que la presión aumente, para mantener la autorregulación. Esta cualidad también la comparte el cerebro.
Figura 4. Curva de diuresis por presión.
Cuando la presión llega a niveles exagerados, lo que depende de cada individuo, por ejemplo en un niño de seis años pueden ser 150 ó 160 mmHg, mientras que en un adulto con HTA de larga data será mucho más, el flujo aumenta, lo que constituye la hipertensión maligna, que en el cerebro causa encefalopatía hipertensiva. Cuando la presión arterial está en niveles normales, cualquier aumento de ella produce aumento en la excreción de sal; en realidad, aumentos muy leves probablemente no se deban a cambios en la presión, sino a cambios de volumen que son sensados por receptores de baja presión presentes en las aurículas, receptores que detectan pequeños cambios de volumen, envían esta información al cerebro y éste ordena al riñón retener o eliminar sodio, para mantener la presión dentro de los niveles normales, aunque lo importante es mantener el flujo. El hipertenso tiene una curva similar a la normal, pero está desplazada a la derecha: para eliminar la misma cantidad de sal necesita 110 ó 120 mmHg en vez de 100, o sea, necesita mayores niveles de presión arterial para excretar la cantidad de sal que el normotenso excreta con mínimos cambios en su presión. La curva de diuresis por presión expresa la necesidad de aumentar la presión para mantener el balance salino, porque el riñón del hipertenso no elimina la sal como corresponde, con el consiguiente riesgo de congestión pulmonar. En la hipertensión maligna, los niveles tensionales necesarios para mantener el balance salino son muchísimo más altos.
El mismo grupo de Rettig utilizó ratas BB.1K, normotensas e histocompatibles, para evitar rechazos postrasplante (5). Ratas espontáneamemente hipertensas (SHR), con nefrectomía bilateral, recibieron riñones de estas ratas BB.1K, con lo cual disminuyeron sus niveles de presión arterial (Fig. 6).
En estudios más recientes se han ocupado las llamadas ratas congénicas, que son genéticamente idénticas, con excepción de un locus genético. Se sabe que el cromosoma 1 de rata tiene una región con un loci que influye sobre la presión arterial y se investigó si este loci media su efecto a través del riñón (6); para ello se utilizó un linaje congénico (WKY.SHR-Sa), que posee las regiones cromosómicas relevantes de las ratas espontáneamente hipertensas y su linaje parental, la rata WKY, ya que ambos linajes son histocompatibles. Se comparó el efecto de trasplantar un riñón de rata congénica o de WKY, en la quinta o sexta semana de vida, a ratas WKY con nefrectomía bilateral. La presión arterial fue significativamente mayor en las ratas con dos riñones WKY.SHR-Sa, en comparación con los WKY; esta diferencia relacionada con el genotipo se mantuvo en ratas nefrectomizadas en forma unilateral. Las ratas WKY que recibieron riñones de las WKY.SHR-Sa tuvieron cifras tensionales significativamente mayores que las que recibieron riñones de ratas WKY. Se concluyó que la mayor proporción del efecto sobre la presión arterial de este loci es mediado a través del riñón.
En el ser humano, el primer trabajo relacionado fue el de Curtis (7), que estudió a seis pacientes hipertensos con insuficiencia renal crónica terminal secundaria a HTA, por lo que fueron trasplantados con riñones de personas normotensas y luego del trasplante normalizaron su presión arterial (Fig. 7). El autor concluyó que los trasplantes de riñón de donantes normotensos a pacientes nefrectomizados normalizan la presión arterial.
Hubiese sido interesante ver los resultados inversos, pero no sería ético. Sin embargo, Guidi, en Italia, (8) consignó la procedencia de los riñones trasplantados y catalogó al donante como donante negativo si tenía presión arterial normal, o positivo si era hipertenso (Fig. 8). Al analizar los datos notó que en los pacientes con riñones de donantes negativos la incidencia de HTA era muy baja, mientras que un gran número de los que recibieron riñones de hipertensos, desarrollaron HTA. Luego separó a los que antes del trasplante eran normotensos y vio que, si le trasplantaban riñones normotensos, la mayoría seguían siendo normotensos, mientras que gran parte los que recibieron riñones de hipertensos se volvieron hipertensos. Lo mismo ocurrió en los casos inversos. Nuestro equipo realizó un estudio similar a éste y demostró lo mismo en un total de 22 pacientes normotensos o hipertensos que recibieron trasplante de donantes normotensos o hipertensos (Fig. 9).
En resumen, tanto los estudios en animales como en humanos demuestran claramente que se puede transportar la HTA con el riñón. El estudio de Tobian (9), en animales, demostró, mediante una curva de diuresis por presión, que a medida que aumenta la HTA aumenta la excreción de sodio. La rata espontáneamente hipertensa también aumenta la excreción de sodio en la medida que aumenta la HTA, pero de manera mucho más lenta; por ejemplo, una rata normal elimina 25 a 30 microequivalentes de sodio con 100 mmHg, mientras que una rata hipertensa con cifras tensionales de 130-135 mmHg elimina la misma cantidad de sodio. Cuando se comparan ambos grupos, lo primero que se encuentra es una diferencia en el flujo plasmático: en cualquier punto de la presión arterial media, el flujo plasmático renal de las ratas hipertensas es inferior al de las ratas normotensas; si tienen menos flujo puede haber obstrucción, hiperactividad vascular o enfermedad vascular. Una serie de trabajos demuestran que las ratas espontáneamente hipertensas tienen arteriolas eferentes más pequeñas, flujo plasmático renal y filtrado glomerular más bajo, curva de diuresis por presión anormal, niveles más altos de tromboxano B2 y reactividad vascular más alta.
En otro estudio se observó que inyecciones de aceltilcolina en dosis crecientes producen vasodilatación a nivel renal, pero esta vasodilatación es menor en ratas espontáneamente hipertensas. Ocurre lo mismo cuando se inyecta bradiquinina, que es un estimulante positivo de oxido nítrico (Fig. 10)
Figura 10. Efecto de aceltilcolina y de bradiquinina en flujo renal en ratas WKY y SHR en 8 semanas.
Los seres humanos se evalúan de otra manera. En el estudio de van Hooft (10) se comparó a personas con antecedentes familiares de HTA, que se sabe son potencialmente hipertensos, con personas sin estos antecedentes familiares. Para esto se estudiaron tres grupos: los que tenían ambos padres normotensos, los que tenían un padre normotenso y los que tenían ambos progenitores hipertensos; y se estudió el flujo plasmático a tres edades: a los 11, 18 y 27 años de edad. A los 11 años, los niños con ambos padres normotensos o un padre hipertenso tenían un flujo plasmático renal muy parecido, mientras que en los que tenían dos padres hipertensos el flujo plasmático renal desciendía bastante. A los 18 años los con sólo un padre hipertenso se diferenciaban claramente de los que no tenían ningún padre hipertenso y no había mayor diferencia entre tener uno o ambos padres hipertensos. A los 27 años las diferencias se mantenían. Esto significa que existe un defecto circulatorio que disminuye el flujo plasmático renal, que puede ser el origen de esta curva de diuresis por presión anormal (Fig. 11).
Figura 11. Flujo plasmático renal en etapa prehipertensiva. (van Hooft IM. N Engl J Med 1991).
Un ratón con un riñón trasplantado WKY (normotenso) tiene un balance bajo de sodio con una dieta de un 0,6% de sal, siendo el balance positivo. Esta situación ocurre en las ratas, pero no en los seres humanos, porque las ratas no dejan de crecer hasta el día que mueren, por lo que siempre están en balance positivo. A otro grupo de ratas les trasplantaron un riñón de rata espontáneamente hipertensa y también les dieron una dieta de 0,6% de sodio; este grupo acumuló mucho más sodio que el de las ratas con riñón WKY. Si a este grupo con riñón de rata hipertensa se le da una dieta baja en sodio (0,2%) se obtiene una curva similar a la de rata normotensa con dieta 0,6%. Entonces, el gran marcador de los hipertensos, sean trasplantados o no, es la menor capacidad para manejar la sobrecarga salina.
El Dr. St Lezin, en 1997, (13) desarrolló ratas congénicas a partir de ratas espontáneamente hipertensas (SHR), a las que sometió a una serie de cruces hasta que logró transferirles una porción del cromosoma 1 de la rata café noruega normotensa, con lo que obtuvo la rata congénica CSHR, que incluye el gen normotensivo, por lo que tiene la presión 15 mmHg más baja. Churchill, en 2001, (14) nefrectomizó ratas SHR y les trasplantó un riñón SHR, con lo cual la presión se mantuvo elevada; pero, cuando a una rata espontáneamente hipertensa le trasplantó un riñón congénico, la presión arterial bajó. Lo novedoso fue que cuando a una rata congénica le colocó un riñón hipertenso, la presión arterial también bajó, lo que se interpretó como que había algo fuera del riñón que bajaba la presión arterial y concluyeron que el riñón no es imprescindible para desarrollar HTA. El problema de este estudio es que las presiones arteriales que bajaron se mantuvieron dentro de los límites de autorregulación, por lo tanto, la perfusión no estaba comprometida y seguramente la rata retuvo un poco de sal. Esa autorregulación requiere una pequeña dilatación aferente, porque si no caería el flujo ante la menor presión arterial, lo cual permite bajar la excreción de sal. El balance de sodio se restableció a una menor presión arterial permitida por el riñón, porque no se afectó la perfusión. En suma, este estudio no demuestra que existan mecanismos extrarrenales que puedan causar o mantener la presión arterial.
Los seres humanos tienen angiotensina I (AT I), mientras que las ratas tienen AT1A y AT1B, siendo éstos los mayores responsables de los efectos de la angiotensina. En un trabajo del año 2005, que causó gran controversia, se eliminaron los receptores para angiotensina I en un grupo de ratones (15); a ratas normales se les trasplantó un riñón normal, para que sirvieran como grupo control, con una presión de 118 mmHg. Cuando a las ratas sin receptor se les trasplantaron riñones de ratas con receptor, la presión arterial bajó, lo que sugiere que algo causa la caída de la presión arterial, pero no está en la rata, porque el receptor de angiotensina está presente en el riñón. Se tomó una rata espontáneamente hipertensa y se le colocó un riñón sin receptores y también bajó la presión; sin duda, en este último caso el efecto lo causó el riñón, porque al no tener receptores la presión bajó porque no había efecto de angiotensina. En el primer caso el riñón sí tenía receptores y debería haber respondido, sin embargo, la presión bajó y en esto se basaron los autores para decir que no se necesita del riñón para bajar la presión arterial.
Mendelson publicó en 2005 (16) un trabajo en el cual se preguntó si el riñón siempre es el que provoca la hipertensión; ahora se puede decir que no es la única causa, pero es la más frecuente y la más importante. El hecho de que el riñón sea infinito en su capacidad de compensar se debe a que la regulación renal es física, depende de la filtración, en cambio en los vasos sanguíneos depende de respuestas metabólicas y neurohormonales que no pueden seguir para siempre; de hecho, si un vaso se contrae en forma permanente se necrosa. Por otro lado, la hipertensión podría ser resultado de anormalidades intrínsecas de la vasculatura, pero es difícil pensar que ésta tenga una maquinaria neurohumoral tan sofisticada; es probable que todo esto exista para mantener el flujo. No queda claro si el riñón sea el único responsable, pero un riñón normal debería compensar.
Frente a una ingesta de sal los organismos aumentan su volumen extracelular, pero un sujeto normal no se vuelve hipertenso, sólo presenta un leve aumento del retorno venoso al corazón; las aurículas, los ventrículos y los vasos pulmonares detectan ese aumento con los receptores de baja presión, informan al cerebro y éste induce diuresis por volumen; con estas adaptaciones, la presión arterial sigue normal y se alcanza el balance salino. Si el riñón tiene alguna alteración, como ocurre, por ejemplo, en obesos con altos niveles de insulina, se produce acumulación de sal, de modo que la diuresis por volumen resulta inadecuada, por lo que se hace necesario elevar la presión para inducir la diuresis por presión, que es característica de los hipertensos. Si ese paciente, a pesar de la diuresis por presión, no alcanza a eliminar suficiente sal, va a presentar congestión cardiopulmonar e insuficiencia cardiaca, la que va a compensar con una gran expansión del volumen extracelular para lograr que el riñón mantenga la diuresis. La pregunta que surge es si el aumento de la presión arterial produce aumento en la excreción de sodio y qué otro fin tiene la elevación de las cifras tensionales.

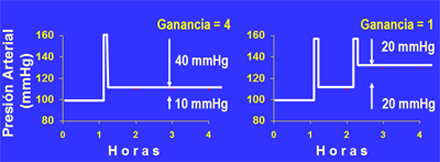 Figura 1. Respuesta inmediata de los barorreceptores al aumento de la tensión arterial sistémica.
Figura 1. Respuesta inmediata de los barorreceptores al aumento de la tensión arterial sistémica.

 Figura 2. Respuesta de los barorreceptores al aumento de la tensión arterial sistémica: reacomodación.
Figura 2. Respuesta de los barorreceptores al aumento de la tensión arterial sistémica: reacomodación.

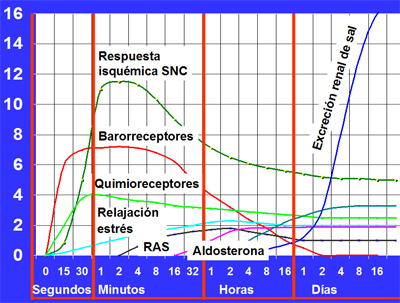 Figura 3. Grado de respuesta de algunos sistemas de regulación de la presión arterial.
Figura 3. Grado de respuesta de algunos sistemas de regulación de la presión arterial.

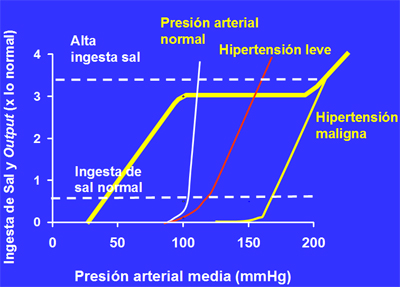 Figura 4. Curva de diuresis por presión.
Figura 4. Curva de diuresis por presión.

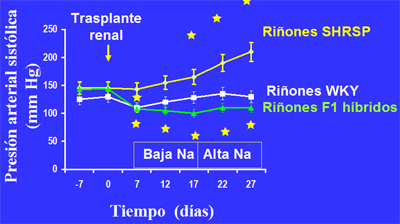 Figura 5. Presión arterial sistólica en receptores de riñón de donantes SHRSP, WKY y F1 (Rettig R. Am J Physiol 1989).
Figura 5. Presión arterial sistólica en receptores de riñón de donantes SHRSP, WKY y F1 (Rettig R. Am J Physiol 1989).

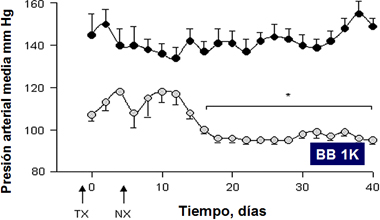 Figura 6. Disminución persistente de la presión arterial media en ratas SHR con nefrectomía bilateral receptoras de riñones de donantes BB.1K (Rettig R. Hypertension 2005).
Figura 6. Disminución persistente de la presión arterial media en ratas SHR con nefrectomía bilateral receptoras de riñones de donantes BB.1K (Rettig R. Hypertension 2005).

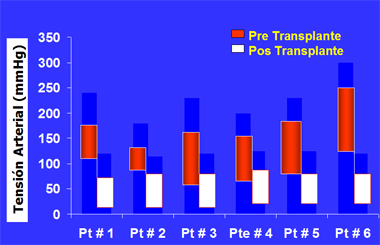 Figura 7. Presión arterial pre y postrasplante de riñones de donantes normotensos. (Curtis J. N Engl J Med 1983).
Figura 7. Presión arterial pre y postrasplante de riñones de donantes normotensos. (Curtis J. N Engl J Med 1983).

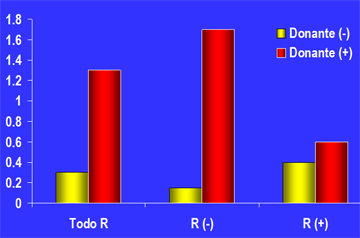 Figura 8. Trasplante de riñones con diferente familiaridad para HTA (Guidi E. J Am Soc Nephrol 1996).
Figura 8. Trasplante de riñones con diferente familiaridad para HTA (Guidi E. J Am Soc Nephrol 1996).

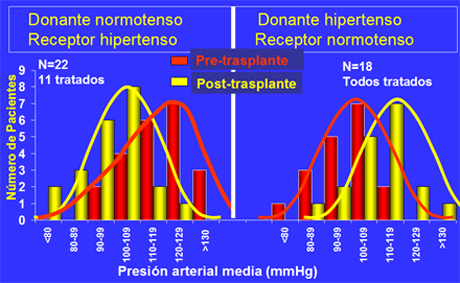 Figura 9. Distribución de presión arterial media antes de la hemodiálisis y 6 meses postrasplante renal. (Juncos L et al. I.A.S.H. 2005).
Figura 9. Distribución de presión arterial media antes de la hemodiálisis y 6 meses postrasplante renal. (Juncos L et al. I.A.S.H. 2005).

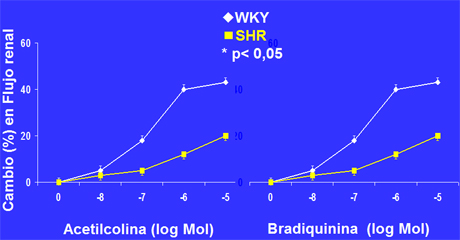 Figura 10. Efecto de aceltilcolina y de bradiquinina en flujo renal en ratas WKY y SHR en 8 semanas.
Figura 10. Efecto de aceltilcolina y de bradiquinina en flujo renal en ratas WKY y SHR en 8 semanas.

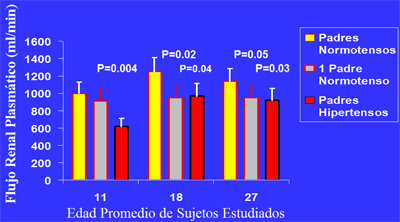 Figura 11. Flujo plasmático renal en etapa prehipertensiva. (van Hooft IM. N Engl J Med 1991).
Figura 11. Flujo plasmático renal en etapa prehipertensiva. (van Hooft IM. N Engl J Med 1991).

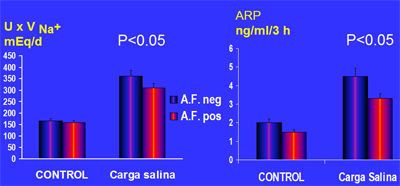 Figura 12. Tasa de excreción de sodio en normotensos con y sin antecedentes familiares de HTA esencial (Grim C. Hypertension 1980).
Figura 12. Tasa de excreción de sodio en normotensos con y sin antecedentes familiares de HTA esencial (Grim C. Hypertension 1980).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de una conferencia dictada en reunión científica de la Sociedad Chilena de Nefrología.
 Expositor:
Luis Juncos[1]
Expositor:
Luis Juncos[1]

Citación: Juncos L. Is the kidney essential in essential hypertension?. Medwave 2007 Abr;7(3):e2299 doi: 10.5867/medwave.2007.03.2299
Fecha de publicación: 1/4/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión