Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
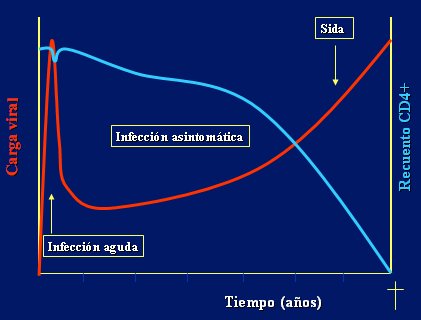
Figura 1. Historia natural de infección por VIH
El síndrome retroviral agudo se presenta en 50 a 90% de los pacientes, según las distintas series y aparece entre una a seis semanas luego de la exposición al virus, con un promedio de tres semanas. El cuadro clínico es relativamente inespecífico y se caracteriza por fiebre (96%), adenopatías (74%), faringitis (70%) y rash (70%); es un cuadro muy similar a un estado gripal y se puede confundir con un síndrome mononucleósico. Pueden existir manifestaciones propias o más típicas, de tipo dermatológicas: rash eritemato-macular rubeoliforme, alopecia, urticaria difusa, descamación; neurológicas: cefalea, meningoencefalitis, dolor retro-orbitario, neuropatía periférica, radiculopatía, síndrome de Guillain-Barré; gastrointestinales: candidiasis oral, náuseas, vómitos y diarrea. En cuanto ocurre la infección primaria se comienza a montar la respuesta específica, de modo que aumenta el recuento de linfocitos CD8, mientras que el recuento de CD4 disminuye transitoriamente, para luego tender a alcanzar los niveles previos a la infección; paralelamente la carga viral aumenta por sobre 100.000 copias/ml. En general, la seroconversión ocurre dos a seis semanas desde la exposición al virus, lapso que corresponde al período habitual de ventana, y que va desde que ocurre la infección y la seroconversión.
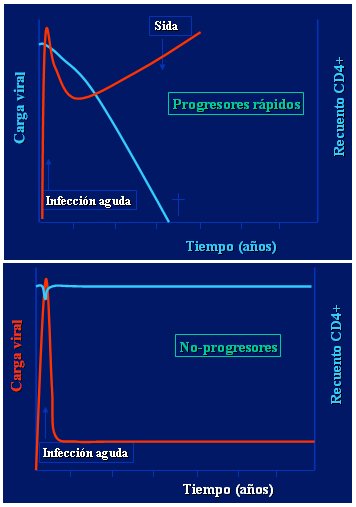
La infección asintomática es un largo período, durante el cual la replicación viral es constante, particularmente en los tejidos linfoides, que constituyen el mayor reservorio del virus. La producción diaria de partículas virales es de 10 elevado a 9 y la vida media aproximada de éstas en el plasma es de 6 horas. En esta fase asintomática, cada día se recambian entre 6% y 7% de los linfocitos CD4, a pesar de lo cual disminuye el recuento total de estas células en 50 células/mm3/año (rango entre 30 y 90) y se produce un aumento progresivo de la carga viral. Algunos pacientes presentan adenopatías que, si no tienen otra causa aparente, se ubican en dos o más sitios extra inguinales y persisten por más de tres a seis meses, constituyen la linfadenopatía crónica persistente. Esta etapa es de duración variable, entre 5 y 11 años, dependiendo principalmente de la edad del paciente en el momento de la seroconversión: a mayor edad, peor pronóstico. La velocidad de progresión hacia la etapa de SIDA es variable entre los individuos y se relaciona con aspectos del virus y propios del hospedero. Según esto, los individuos pueden ser: progresores rápidos, que en menos de cinco años evolucionan con cargas virales altas, caída de los CD4 y manifestaciones de inmunodeficiencia; progresores típicos, que evolucionan con linfocitos CD4+ bajos y carga viral alta en un periodo de siete a diez años; y no progresores, que se mantienen estables y permanecen asintomáticos, con recuentos de CD4 normales, por periodos mayores de diez a quince años. En este último grupo se encuentra entre 4 y 7% de los infectados, los que se caracterizan por presentar carga viral baja, arquitectura conservada de los ganglios linfáticos, actividad citolítica de CD8 aumentada, variedad de VIH no formadora de sincicio y respuesta celular potente específica contra el virus (Fig. 2).
Figura 2. Historia natural de la infección por VIH: progresores rápidos y no progresores
La infección sintomática precoz se inicia cuando los linfocitos CD4 descienden por debajo de 500 células/mm3 y se manifiesta por la aparición de los llamados síntomas B, de la clasificación de la infección por VIH de 1993 del Center for Disease Control (CDC), que son candidiasis oral, displasia de cuello uterino y angiomatosis bacilar, entre otros. La carga viral aumenta progresivamente y se correlaciona bastante bien con el descenso de los linfocitos CD4.
La infección avanzada o SIDA se caracteriza por síntomas de la categoría C, que tienen relación con la patología indicadora. Las infecciones y neoplasias ocurren, en general, cuando el recuento de CD4 desciende por debajo de 200 células/mm3 y el tipo de cuadro oportunista dependerá principalmente de la virulencia del agente. A medida que disminuyen los linfocitos CD4 por debajo de las 200 células/mm3, la patología indicadora va variando: primero se presenta candidiasis oral y esofágica, luego tuberculosis pulmonar o extra pulmonar, después neumonía por Pneumocystis jiroveci, toxoplasmosis y, cuando se llega a menos de100 ó 50 CD4/mm3 aparecen patologías como enfermedad por citomegalovirus y meningitis criptocócica, entre otras.
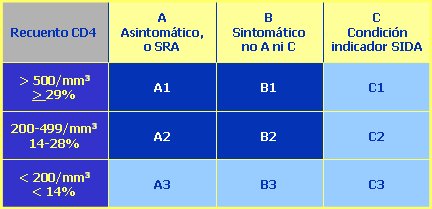
Tabla I. Categorías clínicas de SIDA
La categoría A corresponde a la fase asintomática, al síndrome retroviral agudo, y a la linfadenopatía generalizada persistente; la categoría B, a síntomas que no se incluyen en las categorías A y C, como, por ejemplo, la candidiasis oral; y la categoría C es la etapa indicadora de SIDA.
La categoría B incluye: endocarditis bacteriana, meningitis o sepsis; candidiasis oral o vaginal persistente; consunción, fiebre de origen desconocido, diarrea prolongada o pérdida de peso, debilidad invalidante; Herpes Zoster multi-dermatomas; listeriosis; mielopatía; nocardiosis; leucoplaquia vellosa, enfermedad pelviana inflamatoria; neuropatía periférica; púrpura trombocitopénico idiopático.
Los cuadros de la categoría C son: candidiasis bronquial, esofágica, pulmonar o traqueal; cáncer cervical invasivo; criptococosis extrapulmonar; criptosporidiosis de más de un mes de duración; citomegalovirus diferente de hepático, esplénico o ganglionar; encefalopatía por VIH; infección por virus Herpes simple, en forma de úlceras de más de un mes de duración, esofagitis, bronquitis o neumonitis; histoplasmosis diseminada o extrapulmonar; isosporiasis de más de un mes de duración; sarcoma de Kaposi; linfoma de Burkitt inmunoblástico o primario del cerebro; infección por Mycobacterium avium complex diseminado o extrapulmonar; infección por M. kansasii diseminado o extra-pulmonar; M. tuberculosis diseminado o extra-pulmonar; infección por Pneumocystis jiroveci; leucoencefalopatía multifocal progresiva, que tiene muy mal pronóstico, independiente de la respuesta a la terapia; septicemias recurrentes por Salmonella; toxoplasmosis cerebral; síndrome consuntivo, que corresponde a más de 10% de pérdida de peso, más otra enfermedad debilitante o fiebre prolongada de origen desconocido.
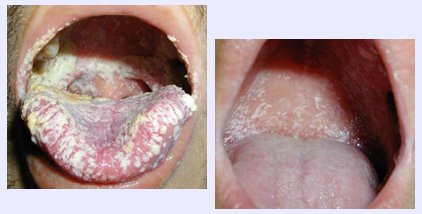
La candidiasis oral se presenta como manchas algodonosas en la región de la lengua, de la mucosa oral, del paladar duro y del paladar blando. Si el paciente refiere disfagia se debe realizar endoscopía, en búsqueda de candidiasis esofágica (Fig. 3).
Figura 3. Candidiasis oral
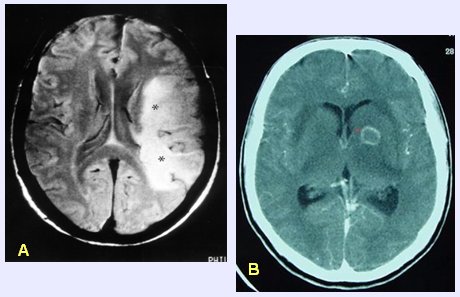
En la Fig. 4, la tomografía axial computada (TC) muestra una encefalopatía multifocal progresiva, cuyas lesiones suelen progresar con tanta rapidez que en pocos días pueden llegar a ocupar un hemisferio cerebral completo, y de muy mal pronóstico (A); la otra imagen (B) corresponde a un caso de toxoplasmosis cerebral, en la TAC de cerebro la lesión se observa con un halo de reforzamiento periférico.
Figura 4. Lesiones cerebrales en el SIDA. A: Encefalopatía multifocal progresiva. B: Toxoplasmosis cerebral
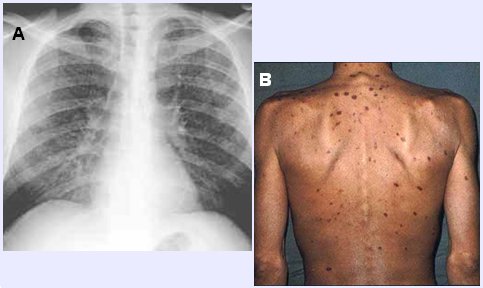
En la Fig. 5 se observa la imagen radiológica de una neumonía por Pneumocystis jiroveci, que corresponde a una neumonía alvéolo-intersticial difusa, de curso larvado, y que, en general, responde bastante bien al tratamiento cuando el paciente no presenta insuficiencia respiratoria (A). También se muestran las lesiones cutáneas típicas del sarcoma de Kaposi, que son solevantadas, de color rojo vinoso y se ubican principalmente en tronco y extremidades; estos casos presentan muy buena respuesta a la terapia antirretroviral, que con frecuencia logra la regresión de las lesiones, lo que no ocurre en casos de sarcoma de Kaposi con lesiones viscerales. Las lesiones cutáneas se pueden ulcerar, aunque esto es raro en la actualidad y también puede haber lesiones en cualquier parénquima, lo que determina un pronóstico mucho más ominoso.
Figura 5. A: Radiografía de tórax, neumonía por Pneumocystis jiroveci. B: Lesiones cutáneas del sarcoma de Kaposi
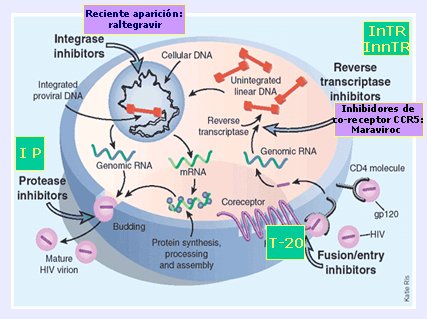
Figura 6. Sitios de acción de los fármacos antirretrovirales
Los objetivos de la TARV son, en primer lugar, lograr la reducción de la viremia; así, la eficacia de un fármaco se mide por el éxito virológico, que se determina a través de la carga viral, la que debe ser indetectable a las ocho semanas de haber comenzado el tratamiento. Los otros objetivos son: lograr la reconstitución del sistema inmune, lo que va a depender del momento en que se inicia la terapia, ya que si el sistema inmune está muy deteriorado, la reconstitución será deficiente; lograr la reducción de la morbimortalidad; y, evidentemente, mejorar la calidad de vida de los pacientes.
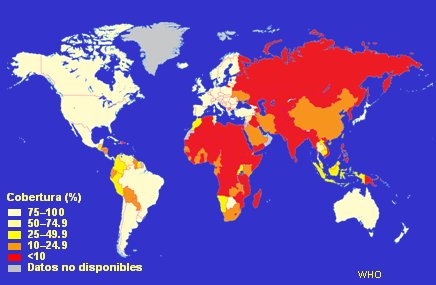
El acceso al tratamiento es variable en las distintas regiones del mundo. En los Estados Unidos, América del Norte, Europa, Australia, Brasil, Argentina y Chile la situación es privilegiada, desde este punto de vista: en Chile hay 100% de cobertura y acceso a la terapia en el sistema público, y no menor a 80% en el sistema privado, la infección por VIH/SIDA es patología GES y corresponde al plan AUGE. África y Asia son los lugares donde hay menor acceso a la terapia, por lo que en estas dos regiones geográficas la epidemia ha ido creciendo cada vez más (Fig. 7).
Figura 7. Acceso a tratamiento contra el SIDA en distintas regiones del mundo
El éxito de la TARV depende de factores del paciente, de la droga y del virus. Entre los factores del paciente están la adhesión al tratamiento, el nivel de inmunodeficiencia con que se comienza la terapia y la edad, ya que en las edades extremas de la vida existe con frecuencia una inmunodeficiencia secundaria asociada. Desde el punto de vista del fármaco, influyen en el éxito de la terapia la toxicidad, la potencia del medicamento y los niveles plasmáticos, que se pueden medir para mejorar la eficacia terapéutica. La toxicidad se puede traducir en eventos adversos precoces, que se presentan al inicio del tratamiento y duran dos a tres semanas, o eventos adversos tardíos, que son los que se ven en la actualidad. Desde el punto de vista del virus, importa la carga viral, los reservorios y la resistencia, la que ha ido en aumento cada día, esto se ve favorecido por la alta tasa de replicación del virus y la alta tasa de error de la enzima transcriptasa reversa.
La presión selectiva de estos medicamentos ha condicionado el desarrollo de mutaciones asociadas a resistencia, las que han ido en aumento, a tal punto que en Chile, 0,5% de los pacientes que están en tratamiento presentan multirresistencia, es decir, resistencia completa a todos los medicamentos. En 20 años de terapia ha habido 27 drogas o formulaciones disponibles; el primer fármaco que apareció fue la zidovudina o AZT en 1987; después fueron apareciendo los otros análogos de nucleósidos. La etapa de monoterapia y biterapia se prolongó hasta 1996, en que comenzó la era TARV, o era de la terapia antirretroviral altamente efectiva, que se basa en la triterapia.
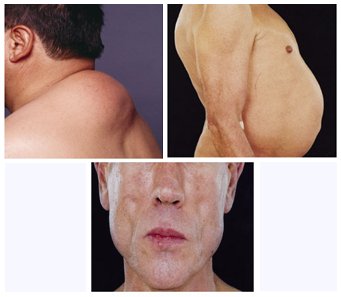
Los datos chilenos obtenidos de la cohorte nacional muestran que desde el año 2002, el acceso expandido a la terapia ha ido aumentando en este país y hoy existen más de 6000 pacientes en tratamiento a lo largo de todo Chile, según datos de julio de 2007. Un trabajo publicado en julio de 2006 (1) por la Fundación Arriarán, demuestra que en Chile la mortalidad anual ha tenido la misma evolución que a nivel internacional: la monoterapia no sirvió mucho, la biterapia la redujo levemente y la triterapia la disminuyó en forma considerable. Sin embargo, la terapia no está exenta de complicaciones, y su éxito depende en gran medida de la adhesión al tratamiento. Algunos fármacos, en especial los inhibidores de la proteasa, causan, a largo plazo, dislipidemia, enfermedad cardiovascular e incluso resistencia a la insulina, con tendencia a la diabetes. Los medicamentos también pueden producir toxicidad hepática, toxicidad mitocondrial, alteraciones gastrointestinales y lipodistrofia, condición que en general se asocia a los IP y a algunos NRTI, y se caracteriza por acumulación grasa en el dorso cervical y en abdomen y un adelgazamiento muy característico de cara y extremidades (Fig. 8).
Figura 8. Síndrome de lipodistrofia asociado a TARV
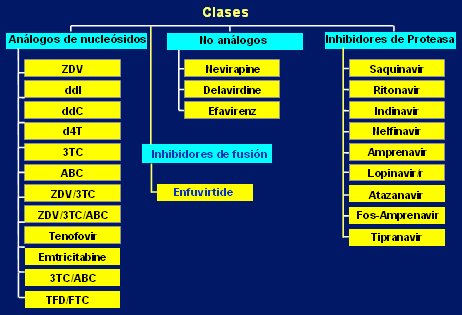
Los fármacos disponibles para la terapia anti VIH son numerosos; en la Fig. 9 se muestra una lista de todos los fármacos aprobados por la FDA a julio de 2005, que son los mismos que hay en Chile. La patente de nelfinavir se retiró hace algunos meses, por un problema con un contaminante en su metabolización. El AZT fue el primer medicamento en aparecer, y recién en 1991 apareció el segundo medicamento antirretroviral. Entre los más nuevos están Reyataz (atazanavir) y Emtriva (emtricitabina), que aparecieron en junio de 2003; Lexiva (fosamprenavir), en octubre 2003; Aptivus (tipranavir), en junio 2005; Prezista (darunavir), en junio 2006; maraviroc, un inhibidor de CCR5, aprobado en agosto de 2007 y raltegravir, inhibidor de la integrasa, en octubre de 2007.
Figura 9. Fármacos contra el SIDA aprobados por la FDA
Existen combinaciones fijas de antirretrovirales aprobadas por la FDA a agosto de 2007; de ellas, la que se ha usado con más frecuencia desde 1997 es Combivir, que corresponde a AZT más 3TC. También está Trizivir, desde 2000, que corresponde a una asociación entre AZT más 3TC más Abacavir y se utiliza muy poco, porque lo forman tres análogos de nucleósidos que tienen el mismo sitio de acción, de modo que no es tan potente, pero asegura una buena adhesión, ya que con dos tabletas se obtiene la triterapia. Otras combinaciones son: Epzicom, que existe en Chile desde 2004 con el nombre de Kivexa y corresponde a la asociación de 3TC más Abacavir, muy útil en pacientes que desarrollan anemia secundaria a AZT; Truvada, que apareció después de los anteriores, en 2004 y es una asociación entre Tenofovir y FTC (emtricitabina); por último, Atripla, que apareció en 2006, aún está por llegar a Chile, es una asociación entre Efavirenz, TDF y FTC , además de ser muy eficaz, el paciente debe ingerir una tableta, una vez al día.
Entre los efectos adversos se describen: AZT puede causar anemia, neutropenia y alteraciones gastrointestinales; didanosina (DDI) puede causar polineuropatía y pancreatitis; zalcitabina (DDC) se relaciona con polineuropatía; stavudina (D4T) se relaciona con polineuropatía, en cuyo caso se debe suspender de inmediato, y pancreatitis; lamivudina (3TC) puede causar náuseas y vómitos, es relativamente poco tóxico; y Abacavir, fármaco que puede causar rash, náuseas, vómitos e hipersensibilidad, y que puede llegar a ser muy grave e incluso causar la muerte. En el grupo de los NNRTI se encuentran nevirapina, que puede causar rash y hepatitis; efavirenz, que se relaciona con rash, vómitos y cefalea; Delavirdina, que produce rash moderado y cefalea, y que prácticamente no se usa. En cuanto a los IP, al comienzo los efectos adversos son los mismos: náuseas, vómitos, cefalea; algunos, como indinavir, se relacionan con nefrolitiasis y alteraciones hepáticas. Los efectos adversos de estos medicamentos duran, en general, dos a tres semanas, y hay que procurar que los pacientes no suspendan el tratamiento a causa de ellos, ya que generalmente ceden espontáneamente en ese período.
Las recomendaciones internacionales y también en nuestro país para iniciar TARV, son las siguientes:
En el futuro próximo se espera la aparición de una serie de nuevas terapias, tanto con inhibidores de la transcriptasa reversa como con inhibidores de la proteasa; y otras con distintos mecanismos de acción como bloqueadores de CCR5 y CXCR4; inhibidores de integrasa, e inhibidores de la maduración, que son un nuevo grupo de medicamentos en desarrollo.
Las exigencias a la terapia han ido aumentando: al principio se consideraba importante la potencia y lograr que la carga viral se redujera; en la actualidad, las nuevas terapias no sólo deben cumplir con el requisito de la potencia, sino que además deben tener una buena y sostenida tolerabilidad, comodidad de uso y alta barrera genética ante la resistencia, entendiendo barrera genética como el número de mutaciones que requiere un medicamento para provocar resistencia. Por ejemplo, con efavirenz se requiere una sola mutación para causar resistencia; en cambio, otros fármacos, como los inhibidores de la proteasa, tienen la barrera genética mucho más alta y se requiere gran número de mutaciones para que aparezca resistencia.
La forma de iniciar el tratamiento es con dos análogos de nucleósidos, normalmente combivir, que tiene AZT y 3TC, y un no análogo de nucleósido, como efavirenz, salvo que se trate de una mujer en edad fértil, en cuyo caso se prefiere la Nevirapina. También se puede comenzar con dos análogos de nucleósidos y un inhibidor de la proteasa. En la actualidad, el inhibidor de la proteasa se usa sólo en los pacientes que tienen sarcoma de Kaposi o un trastorno neuropsiquiátrico demostrado, por lo que se prefiere generalmente el uso de lopinavir/ritonavir a efavirenz.
Hay ciertas decisiones estratégicas en el tratamiento: la terapia se debe cambiar cuando hay fracaso virológico, es decir, cuando la carga viral comienza a aumentar y frente a toxicidad, según el tipo de toxicidad que se presente. Si hay fracaso virológico y no se cuenta con otras opciones terapéuticas, se debe mantener la terapia y jamás suspender el tratamiento, porque de todos modos éste bloquea las cepas susceptibles o cepas salvajes, que son las que tienen mayor capacidad replicativa y mayor virulencia; cuando hay fracaso virológico la carga viral del paciente aumenta, pero lo hace sobre la base de las cepas resistentes, que en general son menos virulentas y tienen menor capacidad replicativa, lo que corresponde en caso de falla virológica, es solicitar un test de genotipificación, para determinar las mutaciones asociadas a resistencia de las diferentes drogas, y así optimizar una mejor terapia
El síndrome inflamatorio secundario a la terapia antirretroviral es un fenómeno muy importante. Se debe a hipersensibilidad del sistema inmune, que puede aparecer asociada con la terapia, se denomina síndrome de reconstitución inmune (SIRI) y se activa frente a agentes como: el complejo Micobacterium avium, que producen una linfadenitis focal y masa granulomatosa; el citomegalovirus, que ocasiona vitritis, retinitis y enfermedad extraocular; el Criptococcus neoformans, que produce una meningitis con gran leucocitosis en el líquido cefalorraquídeo; y el Herpes zoster, que en general da una presentación clínica leve, no complicada.
El fracaso del tratamiento se relaciona con falta de adherencia por parte del paciente, resistencia a las drogas, toxicidad e interacción con otros medicamentos. En los pacientes que están en tratamiento con terapia antirretroviral hay que tener precaución con ciertos fármacos hipolipemiantes, benzodiazepinas o antiinflamatorios, pues sus interacciones pueden aumentar o disminuir los niveles plasmáticos de los antirretrovirales.
El test de genotipificación es el primer examen que se realiza de rutina a los pacientes en quienes fracasa la TARV, ya que permite identificar las mutaciones asociadas a la resistencia, como se indicó anteriormente. Es una especie de antivirograma, que permite saber cuál tratamiento se debe usar, pero no hay que olvidar que la resistencia es irreversible; por lo tanto, si se suspende el tratamiento a un paciente, estas mutaciones se esconden, debido a que las cepas se multiplican poco, de modo que no se van a ver en el test de resistencia, pero cuando se vuelva a instaurar el tratamiento las mutaciones volverán a aparecer y la terapia fracasará. Por eso, frente a este examen siempre se debe considerar el historial del tratamiento del paciente, ya que pueden existir mutaciones ocultas, porque sólo aparecen las que están bajo la presión selectiva del tratamiento. También existe el concepto de resistencia primaria o transmitida, en pacientes que aún no han iniciado la terapia antirretroviral. En países desarrollados, entre 7% y 15% de la población presenta resistencia primaria, lo que ha llevado a cambiar las guías terapéuticas, y en la actualidad se realiza un test de resistencia antes de comenzar el tratamiento en estos países, siempre y cuando la infección sea reciente, de no más de dos años, porque si han pasado muchos años desde la infección las mutaciones estarán escondidas, dado que la cepa que predomina es la de alta replicación, que no tiene mutaciones.
En un estudio sobre resistencia primaria, publicado en la Revista Médica de Chile en 2005 (2), se demostró que en Chile hay muy baja resistencia. En la actualidad estamos realizando un protocolo ministerial en un grupo mayor de pacientes, con enfoque en los de seroconversión reciente, para detectar el grado de resistencia primaria; si ésta es mayor de 5 a10% también se deberá incorporar en las guías chilenas la norma de realizar un test de resistencia antes de comenzar el tratamiento.
La combinación de vacunas es una posibilidad muy interesante. Se ha logrado identificar cinco anticuerpos con capacidad neutralizante importante y ya hay un estudio terminado, en macacos, utilizando vectores como modelos de vacunas y usando un boost de DNA, o con vector o con péptidos recombinantes. También hay estudios fase III iniciados hace algún tiempo, combinadas utilizando vectores vivos y subunidades recombinantes como prime boost. Si bien ha habido avances en este tema, no debiera aparecer una vacuna anti VIH eficaz antes de 2015 para su uso en seres humanos.










 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
 Expositor:
Alejandro Afani[1]
Expositor:
Alejandro Afani[1]

Citación: Afani A. Update on HIV / AIDS II: Clinical presentation, treatment, and prevention. Medwave 2007 Dic;7(11):e2539 doi: 10.5867/medwave.2007.11.2539
Fecha de publicación: 1/12/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión