Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
Los primeros datos sobre el empleo de Cannabis sativa en el tratamiento de enfermedades provienen de la medicina china. En el Asia Central, en 2800 AC se utilizó esta planta para tratar la malaria, la constipación, las artralgias y la dismenorrea; posteriormente su uso se extendió a India (2500 AC), Oriente Medio (2400 AC) y luego al resto del Asia y África (2000 AC), llegando a Sudamérica en 1600 DC; en el siglo XIX se introdujo con fines terapéuticos en Europa y a principios del siglo XX, la reina Victoria de Inglaterra la utilizó con frecuencia para el manejo de la dismenorrea. En 1912, la conferencia de La Haya sometió su tráfico internacional a un control estricto (1); en 1925, la convención de Génova incluyó a Cannabis como narcótico y el año 1961, la convención de Viena de las Naciones Unidas la declaró como “una sustancia de alto potencial de abuso y sin efecto terapéutico”.
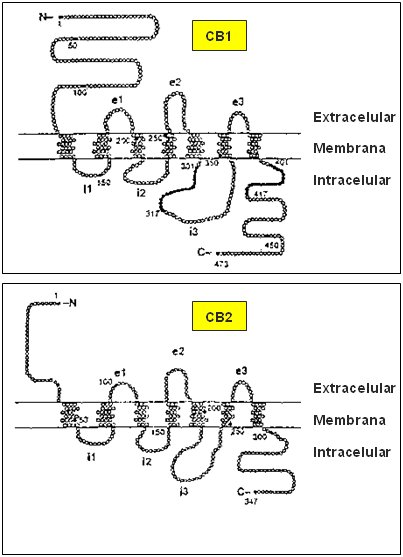
Cannabis sativa posee más de cuatrocientos componentes, que forman dos grupos: 1) los canabinoides, dentro de los cuales los más conocidos son el tetrahidrocannabinol (THC), el cannabidiol y el cannabinol y 2) el grupo de los flavonoides, cuyo rol aún no está establecido. Recién en el año 1964, Mechoulam y Gaoni describieron el principal canabinnoide natural psicotrópicamente activo: el delta 9 tetrahidrocannabinol, cuyo efecto sobre el sistema nervioso central se atribuyó durante muchos años a su alta liposolubilidad, hasta que Mechoulam descubrió el receptor CB1, en 1990 y el receptor CB2, en 1993, diferentes ambos tanto en su estructura molecular como en su distribución en el organismo humano. La disposición de estos receptores es similar en las distintas especies y no ha variado a lo largo de la evolución, lo que sugiere que poseen un rol fisiológico importante (Fig. 1).
Figura 1. Estructura molecular de los receptores CB1 y CB2
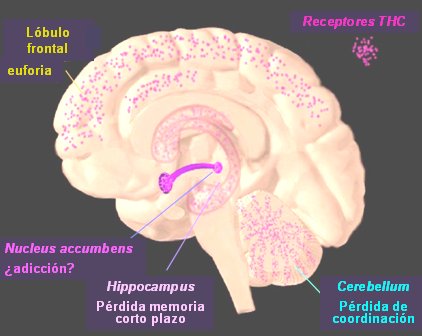
Los receptores CB1 se distribuyen en el SNC en los núcleos basales, cerebelo, hipocampo y en la corteza motora, en el lóbulo frontal; además, se encuentran en el asta dorsal de la médula espinal y en las neuronas de los ganglios dorsales. En términos funcionales, en estas áreas se localiza la función nociceptiva y lo que se relaciona con emociones, motricidad, coordinación, memoria y aprendizaje. La distribución de los receptores CB2 es netamente periférica, en bazo, amígdalas y todas las células del sistema inmune: macrófagos, células B, natural killer, monocitos, neutrófilos y células T, lo que indica que estos receptores se relacionan con los procesos inflamatorios e inmunitarios y con la presencia de tumores (Fig. 2).
Figura 2. Mapa de los receptores CB1 en el sistema nervioso central
En el año 1992, Mechoulam encontró una sustancia generada en el organismo llamada anandamida, que activa los receptores cannabinoides. Tres años después describió el 2-araquinodin-glicerol (2-ARA-gly), que también reacciona frente a estos receptores. Tal como ocurrió en los años 60 cuando se descubrió el sistema opioide endógeno, actualmente se habla del sistema endocannabinoide, cuya función está en estudio, pero se sabe que cuenta con neurotransmisores y/o neuromoduladores que tienen semejanzas y diferencias entre sí. En cuanto a las semejanzas son sintetizados y liberados a partir de las neuronas; activan y se unen a los receptores de membrana y son inactivados por recaptación y degradación enzimática. En cuanto a las diferencias, no son almacenados al interior de las vesículas sinápticas, sino que se encuentran en un estado de premoléculas; sólo son sintetizados y liberados en el momento en que el organismo lo requiere; tienen una vida media muy corta y rápidamente son recaptados por un transportador que aún no se ha identificado claramente, pero se sabe que los introduce a la célula, donde son inactivados mediante hidrólisis intracelular, generando ácido araquidónico y etanolamina. Este descubrimiento data del año 1997.
Este nuevo sistema de neuromodulación central y periférica aumenta la actividad dopaminérgica de la vía mesolímbica, mediante dos posibles de acciones: la inhibición directa de las terminaciones gabaérgicas o la interacción con el sistema de betaendorfinas; de hecho, la presencia de cannabinoides se acompaña de un aumento, tanto de la síntesis como de la liberación, de estas sustancias.
La experiencia clínica disponible hasta el momento es insuficiente, porque las características de esta especie vegetal, especialmente su olor típico, impiden que se realicen estudios clínicos controlados, doble ciego y replicables. Se han hecho estudios con compuestos sintéticos similares a THC, pero en muy pocos de ellos se ha utilizado una metodología apropiada.
A continuación se resumen los principales elementos de la farmacocinética del THC:
La detección urinaria del metabolito depende del tiempo de consumo; si el individuo fuma durante un solo día, se puede detectar el metabolito en la orina durante 1 a 3 días; si fuma diariamente durante un mes, es posible detectarlo durante 10 días. El naproxeno y el ibuprofeno pueden dar falsos positivos y la dilución, los diuréticos y la contaminación pueden ocasionar falsos negativos, pero el hecho de que se pueda buscar el compuesto en el pelo es una ventaja, a diferencia de lo que ocurre con la cocaína.
Las personas consumen Cannabis por los efectos psicotrópicos que provoca inicialmente: euforia, sensación de bienestar, hilaridad, locuacidad y aumento de la sociabilidad. Siempre se pensó que el deporte y el sexo producían sensación de felicidad a través de la liberación de betaendorfinas, pero hoy se sabe que este efecto se debe a la activación del sistema endocannabinoide. Posteriormente se produce una sensación de relajación y reflexión, seguida de un estado de somnolencia en el que se pueden presentar crisis de pánico o accesos depresivos o paranoides breves. También hay alteraciones motoras y del tiempo de reacción, lo que favorece los accidentes automovilísticos, de la misma forma que el uso de alcohol.
Otros efectos son aumento de la sensopercepción; aumento del apetito y la sed; alteraciones en la percepción del tiempo, espacio y distancia; alteraciones cognitivas, con pérdida de la memoria inmediata y alteraciones emocionales, que pueden llegar a la psicosis cannabinoide. Cuando una persona presenta este cuadro frente al primer consumo de Cannabis, se debe hospitalizar de inmediato para manejo con benzodiazepínicos y se le debe advertir que tiene riesgo de que se le desencadene una psicosis permanente si vuelve a utilizar el producto.
Entre los efectos importantes desde el punto de vista médico, están: efecto analgésico; efecto antiemético; taquicardia, hipotensión y vasodilatación; hiperemia conjuntival, nistagmo y midriasis, que suelen delatar a quien ha consumido marihuana; disminución de la presión intraocular y broncodilatación. Estos últimos efectos se están investigando ampliamente en la actualidad.
Cannabis sativa es la droga ilegal de mayor venta en el mundo. El consumo se suele iniciar entre los 8 y 10 años de edad y ocasiona cambios en la sensopercepción y alteraciones leves del humor que llevan a estos niños a consumir cada vez más, debido a que son emocionalmente inmaduros, hasta que estos efectos les parecen insuficientes y siguen con la coca, el crack y otras sustancias similares, a través de las cuales se vinculan con el mundo del narcotráfico, con las consiguientes consecuencias deletéreas para su salud física, mental y social. Esta es la razón por la cual no se puede legalizar el consumo y venta de Cannabis. La exposición abusiva genera deterioro del aprendizaje, la capacidad de concentración y la memoria a permanencia, pero es muy difícil determinar si esto se debe sólo a la Cannabis, porque los jóvenes afectados que llegan a los centros de rehabilitación suelen ser consumidores, además, de crack, pasta base y cocaína. Finalmente, se ha descrito que la población que consume Cannabis tiene una incidencia de psicosis seis veces mayor que la población general.
Los estudios que se efectuaron en los individuos de la época de Woodstock, en los años 60, demuestran que 90% de quienes participaron en esa experiencia llegaron a ser profesionales exitosos a pesar de que muchos de ellos han continuado consumiendo Cannabis, pero no en forma habitual, sino una o dos veces al año.
Los cannabinoides activan a todos los receptores CB1 centrales y también a los que se ubican en el asta dorsal de la médula presináptica, y cualquier activación de los CB1 se acompaña de los efectos psicotrópicos. En forma adicional activan a los CB2, es decir, modulan todo el proceso inflamatorio periférico.
En una investigación sobre dolor agudo se hizo una revisión sistemática de las bases de datos y se encontró que los estudios eran muy incompletos, de modo que sólo se consiguió hacer una descripción cualitativa; fue imposible hacer un metaanálisis. En esa revisión se encontró que la efectividad de THC para el manejo del dolor agudo es similar a la de la codeína y que 5 y 10 mg de THC sintético equivalen a 60 y 120 mg de codeína, es decir, a 6%. Ésta es una dosis opioide extremadamente baja y no es posible aumentar la ingesta de THC sin causar efectos secundarios importantes, como marcada amnesia anterógrada y alteración de la coordinación, por lo tanto, THC no serviría para tratar el dolor agudo.
En el caso del dolor oncológico THC tendría buen efecto, a través de mejorar el estado de ánimo. Si el paciente consume el equivalente a 120 mg de codeína y con eso mejora su ánimo, siente mayor bienestar y deja de pensar en la situación catastrófica que está viviendo, sin duda que el efecto es positivo.
La mayor utilidad de Cannabis estaría en el manejo del dolor crónico. Muchos trabajos realizados en modelos experimentales de dolor neuropático, en ratas, han demostrado que THC es un agente hiperalgésico muy potente y eficaz (2, 3, 4, 5). Esto es importante, porque el dolor neuropático es difícil de manejar y se ve en forma cada vez más frecuente, debido al fenómeno del envejecimiento poblacional. Este efecto se podría deber al hecho de que las fibras aferentes primarias A beta y A delta, que son las principales responsables de transmitir el dolor crónico, poseen alta densidad de receptores cannabinoides y muy baja densidad de receptores opioides; además, se ha planteado que THC inhibiría la neurosecreción del péptido relacionado con el gen de la calcitonina, lo que explicaría la mejoría del estado de ánimo (6).
Se han descrito efectos positivos en pacientes con esclerosis múltiple, enfermedad de Parkinson, alteraciones del movimiento y pacientes con enfermedad de Tourette, en quienes los tics vocales mejorarían en forma muy importante con el uso de Cannabis.
En un trabajo efectuado con buena metodología y publicado en The Lancet, se demostró que el tratamiento de la espasticidad y otros síntomas relacionados con la esclerosis múltiple mejoraban claramente. Se trata de un trabajo serio, multicéntrico, aleatorio y doble ciego que se hizo en el Reino Unido, donde se comparó el efecto de THC extraído de Cannabis y placebo en 630 pacientes, lo que lo convierte en el mayor estudio que se ha hecho en pacientes con esclerosis múltiple. La variable principal fue la puntuación en la escala de Ashworth y las variables secundarias fueron: la movilidad, según el test de caminar diez minutos y el Rivermed Mobility Index; la discapacidad, según una escala especializada; la calidad de vida y la toxicidad. También se evaluaron variables secundarias subjetivas con escalas categóricas: irritabilidad, depresión, astenia, temblor, dolor, calidad del sueño y espasmos musculares, entre otras. El análisis de los resultados no mostró diferencias entre los grupos, en cuanto a la variable principal; sin embargo, el grupo que recibió tratamiento activo refirió mejoría del dolor, los espasmos musculares y la calidad del sueño y hubo clara mejoría de la espasticidad: 61% en los que usaron extracto de Cannabis, 60% en los que usaron THC y 46% en quienes recibieron placebo (7).
En este momento están disponibles:
Entre los usos autorizados están:
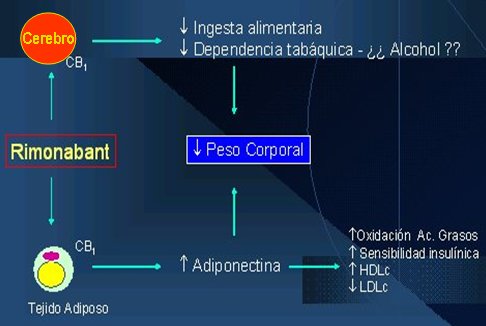
Este compuesto inhibe los receptores CB1, por lo tanto no sólo disminuye la ingesta alimentaria por disminución del apetito, sino que también podría ser útil en el manejo del alcoholismo, el tabaquismo y otras adicciones a drogas. Actúa sobre los receptores CB1 centrales y sobre los que están en la membrana de los adipocitos, que son muy ricos en receptores CB1, aumentando la producción de adiponectina, sustancia que se encuentra disminuida en los pacientes obesos y en los portadores de diversos grados de insulinorresistencia. Ambos efectos permitirían reducir el peso corporal, pero lo más importante es que el aumento de la adiponectina se acompaña de un marcado incremento en la oxidación de los ácidos grasos del tejido graso y muscular, lo que mejora la sensibilidad insulínica y el perfil lipídico (Fig. 3).
Figura 3. Mecanismo de acción de rimonabant
Este fármaco ha motivado un gran estudio, multinacional, multicéntrico, doble ciego y aleatorio. Se trata del estudio RIO (Rimonabant in Obesity), que ya tiene cuatro ramas en fase 3: RIO Lipids, RIO Europe, RIO North America y RIO-Diabetes, que reunieron, entre todos, 6600 pacientes obesos que se trataron con placebo ó 5 y 20 mg/día de rimonabant durante 2 años, con el objetivo de determinar el perfil de seguridad, eficacia y tolerancia del fármaco (8).
En el estudio RIO Lipids se incluyeron 1036 pacientes portadores de obesidad abdominal y perfil lipídico anormal, que se asignaron a tres grupos y recibieron, respectivamente, 5 mg de rimonabant, 20 mg del mismo o placebo, durante un año. Los resultados fueron muy semejantes a los de otros estudios: con la administración de rimonabant en dosis de 20 mg, 65% de los pacientes disminuyó su peso en 10% del valor inicial y no presentaron rebote, es decir, no volvieron a aumentar de peso, aunque hubieran dejado de fumar. La circunferencia de cintura, que es un indicador de la cantidad de grasa intraabdominal, disminuyó en casi 10% y, lo más importante, hubo una clara modificación del perfil lipídico, con aumento de HDL y disminución de triglicéridos. También disminuyó la producción de insulina (22%) y la PCR (27%) y se observó aumento de los niveles de adiponectina y reducción de los niveles de interleuquinas, es decir, mejoraron los factores de protección cardiovascular. Los efectos adversos también fueron muy semejantes en los cuatro estudios: entre los transitorios, hubo náuseas en 12,7% de los pacientes que recibieron 20 mg y en 3,2% de los que recibieron 5 mg y mareos, en 10,4% y 6,7% respectivamente. Abandonaron el tratamiento 15% de los pacientes, pero 7% de los que estaban en el grupo placebo tuvieron sintomatología (9).
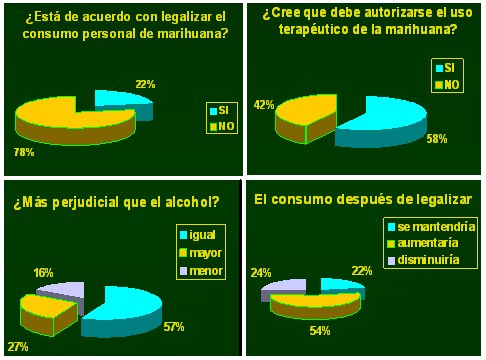
En Chile, la Universidad Diego Portales, en conjunto con la empresa Publimetro, hizo una encuesta en mayo del año 2005, cuyos resultados se grafican en la Fig. 4 y se resumen como sigue:
Figura 4. Resultados de la encuesta sobre el uso terapéutico de la marihuana (Chile, 2005; Universidad Diego Portales y Publimetro)
Los desafíos actuales para los investigadores de la industria farmacéutica son: continuar la investigación sobre el sistema endocannabinoide y su rol en la neuromodulación central y periférica; sintetizar moléculas incapaces de atravesar la barrera hematoencefálica, sin modificar la eficacia analgésica global; sintetizar moléculas selectivas, sin los efectos psicotrópicos; sintetizar productos sinérgicos opioides-cannabinoides, para emplearlos como analgésicos.
Los investigadores están dedicados intensamente a estos aspectos. Por ejemplo, en Canadá se invertirán hasta 10 millones de dólares entre los años 2004 y 2010 en estos estudios y existe bastante optimismo, a raíz de los resultados de las últimas investigaciones con rimonabant. Se dice que, si los demás estudios tienen resultados similares, Cannabis sativa se trasformará en “la Aspirina del siglo XXI”.




 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
 Expositora:
Juanita Jaque[1]
Expositora:
Juanita Jaque[1]

Citación: Jaque J. Present and future of cannabinoids in medicine. Medwave 2007 May;7(4):e2540 doi: 10.5867/medwave.2007.04.2540
Fecha de publicación: 1/5/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión