Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
Paciente de sexo femenino, de 31 años de edad, con antecedente de alergia a mariscos durante los últimos cinco años. Tuvo un hijo cuatro meses antes del cuadro actual, que se inició en forma repentina con náuseas y vómitos persistentes, por lo que consultó al servicio de urgencia, donde ingresó con frecuencia cardiaca de 80 latidos/minuto y presión arterial de 107/53 mmHg, sin hallazgos significativos en el examen físico. Se inició hidratación con NaCl al 0,9% más 8 mg del antiemético ondasentrón. La paciente refirió una sensación semejante al cuadro alérgico previo, por lo que se administró clorfenamina 4 mg por vía endovenosa en bolo; a los 7 minutos de iniciada la administración la paciente presentó dificultad respiratoria grave, seguida de convulsiones tónico-clónicas generalizadas, hasta quedar en apnea y sin pulso. En el monitor apareció el trazado que se observa en la Fig. 1.
Figura 1. Electrocardiograma con fibrilación ventricular.
Se reanimó a la paciente y se la trasladó a la Unidad de Tratamiento Intensivo del centro asistencial. A las 24 horas del paro, lo más llamativo del electrocardiograma (ECG) fue el intervalo QT prolongado (Fig. 2).
Figura 2. Electrocardiograma 24 horas post paro cardiorrespiratorio. QT corregido = 0,59 segundos.
En resumen, mujer joven, intervalo QT prolongado, muerte súbita recuperada. El QT se normalizó al tercer día de evolución y en la actualidad la paciente está viva y se le implantó un desfibrilador automático.
Ante este caso clínico surge la pregunta: ¿cómo es posible que una mujer de 31 años, frente a circunstancias determinadas, presente una arritmia ventricular maligna? En primer lugar, para saber si una persona es susceptible a presentar este cuadro se debe contar con un electrocardiograma (ECG) basal, pero no todas las personas se han realizado este examen alguna vez. Luego viene uno de los principales problemas de la electrocardiografía, que es la medición del intervalo QT. En el gráfico de la Fig.3 se resume el resultado de comparar la medición automatizada versus la medición manual del intervalo QT, en 8.000 ECG; se puede ver que la dispersión es enorme, por lo que no se debe confiar en la medición del QT hecha por una máquina; lo ideal es que el segmento QT lo mida una persona.
La máquina automática corta el trazado según la morfología de la onda T (Fig. 4); en consecuencia, la máquina puede cortar antes o después del lugar donde se haría el corte manual y, por lo mismo, las máquinas automatizadas suelen cometen errores que podrían ser importantes.
Además, en el mismo individuo, el intervalo QT es distinto en las distintas derivaciones del ECG; por lo tanto, se debe medir el promedio del intervalo QT de las 12 derivaciones y no sólo de una. El intervalo QT representa la repolarización ventricular y por tanto, depende de la frecuencia cardiaca; sin embargo, existe un fenómeno denominado histéresis, que consiste en que este intervalo cambia 2 a 3 minutos después de que cambia la frecuencia cardiaca, de modo que lo que se observa en el ECG en un momento dado no se correlaciona con la frecuencia cardiaca de ese momento, sino con la que tenía el sujeto 2 ó 3 minutos antes. Habría que corregir el intervalo QT con la frecuencia cardiaca que el paciente tenía 3 minutos atrás, pero como ese dato no se conoce, se supone que la frecuencia cardiaca del sujeto es la misma todo el tiempo, lo que no es cierto. Cuando se toma un ECG en el policlínico, lo más probable es que la frecuencia cardiaca del sujeto aumente, debido a una descarga adrenérgica causada por el ambiente del centro asistencial; luego, el ECG no reflejaría el verdadero intervalo QT del sujeto. Por otra parte, el intervalo QT se mide por convención en DII, pero no hay ninguna base científica para hacerlo; si no se ve bien en DII se mide en V5, lo que constituye un error, puesto que este procedimiento no está estandarizado con base en un análisis científico que establezca cuál es la mejor derivación. Por eso, los expertos recomiendan que se saque un promedio de todas las derivaciones de cada paciente.
El intervalo QT es el reflejo del potencial de acción de la célula, fundamentalmente de la célula ventricular, que tiene las siguientes fases: Fase 0: depolarización; Fase 1: inicio de la repolarización; Fase 2: plateau; Fase 3: repolarización propiamente tal: Fase 4: período de reposo (véase Fig. 5). Esto corresponde, en el ECG, al complejo QRS con onda T. Detrás de ese intervalo QT hay varios canales iónicos relacionados con la conductancia a diversos aniones y cationes, que determinan la morfología y duración de este potencial de acción; modificaciones en la conductancia de distintos iones van a provocar cambios en el potencial de acción y, en consecuencia, en el ECG. Se han descrito genes, que en su mayoría ya han sido clonados, asociados con la conductancia a estos cationes. Para que una persona con intervalo QT prolongado adquirido presente taquicardia ventricular con riesgo vital no basta con que se prolongue el intervalo QT; también se deben cumplir ciertas condiciones electrofisiológicas que se denominan ciclo corto-largo-corto. El ciclo largo es una pausa; después hay un ciclo corto, que es una extrasístole y entonces sobreviene la taquicardia. Para que se genere la taquicardia debe haber un cambio en la conducción eléctrica cardiaca: no basta la prolongación del intervalo QT para que ocurra una arritmia ventricular maligna.
Figura 5. Potencial de acción del ECG.
La causa más frecuente de intervalo QT prolongado adquirido son los fármacos. La lista de medicamentos que prolongan el intervalo QT es muy larga, pero la lista de medicamentos que además provocan arritmia ventricular maligna o torsades de pointes (torsión de punta) es más breve:
Es importante recalcar que no todos los fármacos que prolongan el QT son arritmogénicos.
En 2003 se realizó un estudio poblacional retrospectivo que abarcó a 4.800.000 pacientes (1), en el que se comprobó que 1.097.871 pacientes recibieron al menos un medicamento, prescrito por un médico, que prolongaba el QT. La edad promedio de este grupo fue de 49 años y la mayoría eran mujeres, lo que es importante, porque el intervalo QT prolongado adquirido es más frecuente en personas mayores y en mujeres. En otras palabras, no sólo se indicó medicamentos que prolongan el intervalo QT, sino que se los indicó a la población en la que es más frecuente esta alteración. Los medicamentos prolongadores del intervalo QT recetados con mayor frecuencia fueron antibióticos, como macrólidos y levofloxacino, y antidepresivos, como fluoxetina, amitriptilina, etc.
Si se sabe que ciertos fármacos prolongan el QT, ¿por qué los médicos los prescriben, especialmente a la población más susceptible? En varios estudios poblacionales se ha visto que los factores de riesgo de presentar QT prolongado adquirido por fármacos son los siguientes: sexo femenino; hipokalemia o hipomagnesemia; bradicardia; insuficiencia cardiaca; conversión reciente de fibrilación auricular e interacción entre medicamentos, en la cual un fármaco eleva la concentración de otro. Por ejemplo, en la mayoría de los casos de QT largo y torsión de punta por terfenadina, que fue retirada del mercado, el paciente tomaba en forma concomitante un macrólido; ambos fármacos se metabolizan en el citocromo 2D6, el macrólido inhibe este citocromo, por lo que las concentraciones plasmáticas de la terfenadina aumentan y se prolonga el intervalo QT. Cuando la terfenadina se metaboliza normalmente no es proarrítmica, porque su metabolito no prolonga el QT. En la población estudiada por polimorfismo, 7% de los casos son pobres en citocromo 2D6; luego, si se les da terfenadina sus niveles serán más altos que en el resto de la población. En la mayoría de los casos con torsión de punta, el paciente recibe polifarmacia.
Otros factores de riesgo son la hipertrofia ventricular izquierda y la administración en bolo de ciertos medicamentos intravenosos; en el caso clínico descrito, la paciente recibió un bolo de clorfenamina. La reacción se ha descrito con bolos de omeprazol, famotidina y ranitidina es decir, con la inyección rápida de un fármaco. Si la concentración elevada de un fármaco es un factor de riesgo, esto afecta también el metabolismo del paciente y, en ese sentido, se debe considerar la función hepática y renal; de hecho, la mayoría de los pacientes que presentaron torsión de punta con cisaprida tenían insuficiencia renal, además de una interacción farmacológica.
Las células miocárdicas difieren entre sí y una de las diferencias más notables es que, en el mismo segmento ventricular, las células epicárdicas son distintas a las células del endocardio, en cuanto a la duración del potencial de acción. Lo anterior se debe a una expresión génica diferencial de los distintos canales, lo que produce un gradiente transmural de repolarización entre el epicardio y el endocardio. Más importante que la prolongación del QT es la exacerbación de esta dispersión normal de la repolarización, en el desarrollo de arritmias; por eso es que algunos medicamentos que prolongan el QT no producen arritmia y otros sí. Por ejemplo, en una dispersión de la repolarización de 42 milisegundos en el control (Fig. 6), cuando se administra una sustancia que bloquea un canal se prolonga sólo hasta 46 milisegundos, lo cual no es significativo; pero si además se agrega isoproterenol, la dispersión se prolonga mucho más. Este es un ejemplo in vitro de lo que puede ocurrir in vivo; coexisten dos factores: descarga adrenérgica y bloqueador.
Figura 6. Dispersión de la repolarización ventricular.
Siglas de la Figura 6: A: control; B: administración de bloqueador de canal (293B); C: administración conjunta de 293B e isoproterenol
Uno de los QT congénitos prolongados más frecuentes es el de tipo 1, inducido por ejercicio. El modelo anterior explica que este tipo de QT prolongado ocurre porque en estos pacientes, en el ejercicio, ocurre un cambio en la dispersión transmural de la repolarización.
¿Por qué sobreviene la arritmia? La célula en la que se acortó el intervalo QT estimula a la otra, que está en un periodo vulnerable, surge un fenómeno de reentrada entre el endocardio y el epicardio y sobreviene la fibrilación y la muerte. Por eso el gradiente de repolarización es crítico para que ocurra este fenómeno. Por ejemplo, si a un control se le bloquea un canal de potasio en forma progresiva, se altera la repolarización paulatinamente, pero si se bloquea otro canal, ocurre una alteración mayor. Este es el concepto de la polifarmacia o de la necesidad de múltiples factores para causar una dispersión en el periodo de refractariedad.
Hay un sustrato genómico para estas alteraciones. Se han investigado diversos canales causantes de los síndromes de QT largo congénito en las personas que prolongan el QT con fármacos; se ha visto que, en su mayoría, los medicamentos que prolongan el QT interactúan con las proteínas del canal de potasio, que origina el QT de tipo 2, aunque algunos fármacos también interactúan con el canal que origina el QT de tipo 1. Ciertos fármacos retirados del mercado interactúan con distintos segmentos del canal (Fig. 7).
Este canal es susceptible a la unión de medicamentos, porque por su residuo de tirosina tiene un espacio mayor entre sus asas, lo cual permite alojar una sustancia; es decir, es más fácil que un medicamento se aloje entre las hebras de este canal que entre las de otro, debido a su estructura tridimensional. Si se bloquea el canal debido a un fármaco, la reserva de repolarización se consume, esto es, debido a la acción de un medicamento determinado, ese paciente, frente a otro episodio, no va a poder modificar ni tolerar el cambio en la repolarización. Es decir, el bloqueo del canal por sí solo no explicaría los problemas, sino que tiene que concurrir otro factor para que luego sobrevengan las torsades de pointes (2). Por ejemplo, un paciente que tomó amiodarona presentó torsades de pointes; se hizo un análisis parental y se descubrió que el paciente era portador de polimorfismo en un canal de sodio, debido a lo cual era más susceptible, porque modificaba la función del canal y reducía su reserva de repolarización: la velocidad de conducción del canal de sodio era 30% menor que la de las personas que no portan este polimorfismo (3). En consecuencia, en ese paciente, frente a un fármaco que bloquea otro canal, disminuye la capacidad de reserva de repolarización y se prolonga en forma desmesurada el QT. El bloqueo del canal por sí solo no provoca el problema; el daño está en otro canal, lo que aumenta la susceptibilidad del paciente a este fenómeno. Si aumenta el porcentaje de bloqueo de un canal el intervalo también se prolonga, pero si a lo anterior se agrega que el paciente tiene un polimorfismo, que significa que tiene un canal más débil, el efecto es mucho mayor que el bloqueo por sí solo. Se ha visto que 4% de la población caucásica tiene un polimorfismo del canal de potasio del QT de tipo 2 (canal HERG) y que el polimorfismo del canal de sodio está presente en 3% de la población afroamericana de Estados Unidos. En Chile no se conocen las cifras.
Como ya se dijo, ciertos medicamentos prolongan el intervalo QT, pero no provocan torsión de punta; el ejemplo más típico es el pentobarbital, que prolonga el QT, pero el gradiente transmural del periodo refractario de la repolarización no cambia, aunque tiende a acortarse (4), es decir, el pentobarbital prolonga el intervalo QT, pero no produce torsión de punta. Esto se debe a que el pentobarbital bloquea varios canales cuya expresión es distinta entre el epicardio y el endocardio, con lo cual se prolonga el QT, pero el gradiente transmural se mantiene e incluso se reduce. Algo similar ocurre con la amiodarona.
Es posible graficar la dispersión transmural de la refractariedad y el intervalo QT (4). Algunos fármacos, como sotalol, dofetilide y eritromicina en dosis altas provocan un aumento lineal de la dispersión y del intervalo, lo cual conduce a un umbral sobre el cual aparece la torsión de punta; en cambio, con otros medicamentos, al aumentar la concentración disminuye este fenómeno. Por ejemplo, la quinidina puede provocar torsión de punta con una primera dosis, porque en dosis bajas bloquea un canal, pero en dosis altas bloquea más canales, lo que prolonga el QT, pero el gradiente transmural se mantiene. Otros medicamentos, como el pentobarbital, la amiodarona y la ranolazina rara vez provocan torsión de punta, porque, si bien con dosis mayores aumenta el intervalo QT, el gradiente transmural no aumenta (4).
Al analizar la incidencia de torsión de punta versus prolongación del intervalo QT, se ha visto que la amiodarona prolonga el intervalo QT en 70 milisegundos en promedio, pero la incidencia de torsión de punta es bajísima; lo mismo ocurre con el sotalol. La dronedarona, que prolonga el intervalo QT a 110 milisegundos, presenta una incidencia importante de torsión de punta. En el caso de las quinolonas, si a una rata se le administra moxifloxacino se prolonga el potencial de acción (5); si se asocia otro bloqueador se prolonga aún más y. si se elimina el moxifloxacino, se acorta nuevamente. Este efecto corresponde a la concurrencia de más de un factor. La presencia de heterogeneidad intrínseca del sujeto disminuye la reserva de repolarización y se dispersa la repolarización asociada con una prolongación del intervalo QT; lo anterior, frente a actividad desencadenada por extrasístoles, va a producir torsión de punta (4).
Entonces, un fármaco o su metabolito tienen como blanco molecular un canal de potasio; los efectos que tendrá pueden ser: prolongación del QT, supresión de arritmias o torsión de punta. La farmacocinética y la farmacodinamia, es decir, el metabolismo y los efectos que causa el fármaco, interactúan con variantes genéticas que pueden modificar el efecto, como polimorfismos de enzimas metabolizantes y transportadores, debido a lo cual el efecto último del fármaco es variable y puede ser impredecible (Fig. 8).
Figura 8. Farmacogenética y arritmias inducidas por medicamentos (Roden DM. Cardiovasc Res 2001).
Hoy se sabe que sólo alrededor de 10% de las personas que han sufrido una torsión de punta debida a medicamentos tienen algún polimorfismo o alguna alteración genética de los canales. En un estudio japonés se vio que, más que el intervalo QT, lo que predice significativamente el riesgo de torsión de punta es el QTDc (QT dispersion corrected) (6), como se denomina al intervalo que va desde el peak de la onda T hasta el final de ésta. Los investigadores analizaron a los pacientes cuyo QT se prolongó, compararon el grupo que tuvo arritmias con el que no las tuvo y concluyeron que lo que realmente predecía la probabilidad de arritmia era este índice. La onda T de alguien que ha tenido torsades de pointes no es normal, porque la onda T refleja la diferencia que hay entre endocardio y epicardio al término del potencial de acción. La línea entre el ECG y los potenciales de acción, desde el peak de la onda T hasta el final de la onda T, es fiel reflejo de la diferencia entre epicardio y endocardio en el punto final del potencial de acción. Ese gradiente de dispersión es lo importante, porque cuanto más se prolongue este segmento, mayor será la dispersión entre epicardio y endocardio; por lo tanto, este paciente será susceptible de desarrollar arritmia ventricular maligna o torsión de punta.
El riesgo de arritmia, en un individuo con predisposición genética, va aumentando a medida que se suman factores de riesgo, como estrés, remodelación cardiaca secundaria a infarto agudo de miocardio o a insuficiencia cardiaca, iatrogenia. Los estudios genéticos para pesquisar polimorfismos tienen algún rendimiento, según el número de genes identificados y el número de bases del polimorfismo.

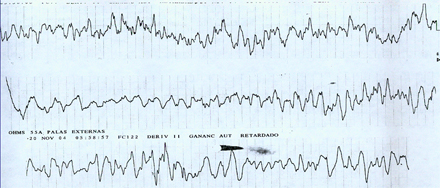 Figura 1. Electrocardiograma con fibrilación ventricular.
Figura 1. Electrocardiograma con fibrilación ventricular.

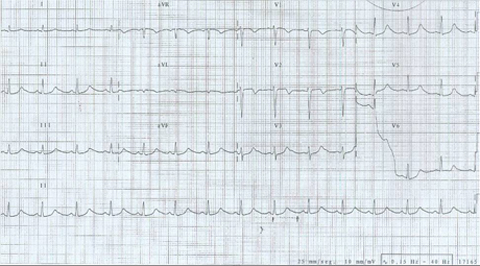 Figura 2. Electrocardiograma 24 horas post paro cardiorrespiratorio. QT corregido = 0,59 segundos.
Figura 2. Electrocardiograma 24 horas post paro cardiorrespiratorio. QT corregido = 0,59 segundos.

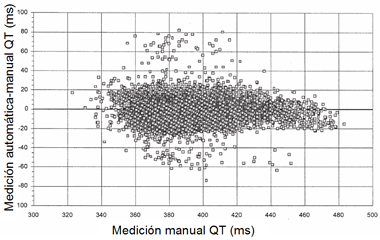 Figura 3. Comparación de la medición automatizada y manual del intervalo QT en 8.000 ECG (Malik M. J Electrocardiol 2004).
Figura 3. Comparación de la medición automatizada y manual del intervalo QT en 8.000 ECG (Malik M. J Electrocardiol 2004).

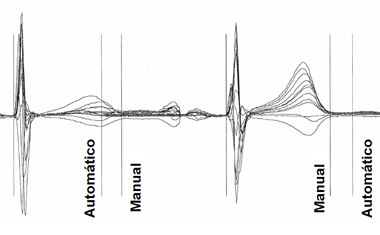 Figura 4. Diferencias en el corte del complejo QT: automático versus manual (Malik M. J Electrocardiol 2004).
Figura 4. Diferencias en el corte del complejo QT: automático versus manual (Malik M. J Electrocardiol 2004).

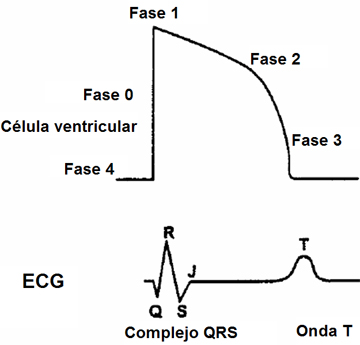 Figura 5. Potencial de acción del ECG.
Figura 5. Potencial de acción del ECG.

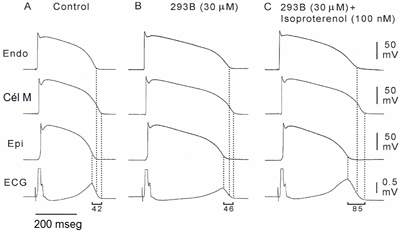 Figura 6. Dispersión de la repolarización ventricular.
Figura 6. Dispersión de la repolarización ventricular.

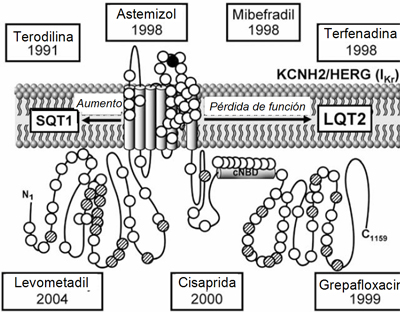 Figura 7. Interacción de distintos fármacos con el canal de potasio KCHN2 o HERG (Human ether-a-go-go-Related).
Figura 7. Interacción de distintos fármacos con el canal de potasio KCHN2 o HERG (Human ether-a-go-go-Related).

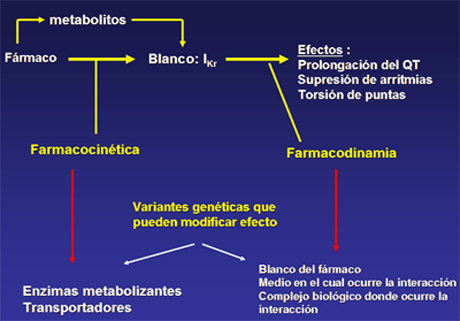 Figura 8. Farmacogenética y arritmias inducidas por medicamentos (Roden DM. Cardiovasc Res 2001).
Figura 8. Farmacogenética y arritmias inducidas por medicamentos (Roden DM. Cardiovasc Res 2001).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
 Expositor:
Mauricio Cereceda[1]
Expositor:
Mauricio Cereceda[1]

Citación: Cereceda M. Acquired long QT syndrome: beyond the electrocardiogram. Medwave 2007 Mar;7(2):e2545 doi: 10.5867/medwave.2007.02.2545
Fecha de publicación: 1/3/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión