Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
El cáncer es la segunda causa de muerte en Chile; la morbilidad y letalidad son importantes en la mayoría de las etapas y en casi todos los tumores. Frente a esto, la terapia oncológica ha mostrado grandes avances y en la actualidad consiste en un tratamiento multidisciplinario, que se basa en dos pilares: las terapias locales, representadas por dos alternativas terapéuticas: la cirugía y la radioterapia; y las terapias sistémicas: quimioterapia, terapias target, inmunoterapia y hormonoterapia. Todas ellas tienen su indicación precisa en determinadas situaciones oncológicas.
En Chile sólo hay estudios de mortalidad, no de morbilidad, por lo que las causas de muerte por cáncer se conocen por los certificados de defunción (Figs. 1 y 2). En mujeres, la primera causa de mortalidad es el cáncer de vesícula y vía biliar, seguido por el cáncer de mama, estómago, cervicouterino, pulmón, que ha aumentado en relación con el hábito tabáquico, y otros. En el hombre, la primera causa de muerte por cáncer aún es el cáncer gástrico, aunque ha disminuido un poco en los últimos años, seguido por el cáncer de pulmón y próstata; en cambio, la incidencia de cáncer de vía biliar en varones es mucho menor en Chile, de modo que su importancia como causa de muerte es muy inferior; después vienen esófago, linfomas, colon y otros.
Figura 1. Principales causas de muerte por cáncer en la mujer, Chile 2001 (Fuente: MINSAL).
Figura 2. Principales causas de muerte por cáncer en el hombre, Chile 2001 (Fuente: MINSAL).
En la Tabla I aparece un resumen de las principales causas de muerte. En el caso de próstata y mama, la tasa es específica por sexo, pero el cáncer de estómago es la principal causa de muerte por cáncer, seguido por el de próstata en varones y el de mama en mujeres. Después viene el cáncer de pulmón y vía biliar y más abajo quedan el cáncer cervicouterino, linfoma y otros.
El diagnóstico precoz permite realizar un tratamiento con más impacto y eficacia, lo que cambiaría la evolución natural de la enfermedad, pero también influyen otros aspectos, como el tipo de tumor, su origen y la histología. Por ejemplo, en ciertos tumores avanzados el tratamiento altera muy poco la evolución, con algunas excepciones, como el cáncer testicular, en el cual es posible lograr curaciones incluso en etapas muy avanzadas.
Para tener una idea de la importancia que se le asigna en la actualidad a todo lo que se relaciona con el cáncer, se hizo una revisión en Pubmed con el objetivo de determinar cuántos artículos se habían publicado en Medline sobre diferentes temas en los últimos 5 y 10 años; y se encontraron más de 100.000 artículos sobre diabetes; alrededor de 150.000 artículos sobre enfermedades renales, más de 200.000 sobre corazón y 650.000 sobre cáncer (Fig. 3).
Figura 3. Investigación publicada en los 5 y 10 últimos años.
Al analizar el último año, la tendencia es similar: hay alrededor de 70.000 publicaciones sobre cáncer y las cifras son mucho menores en las otras áreas. El cáncer de mama representa una cantidad muy importante de estas publicaciones. Por otra parte, no todas las publicaciones tienen la misma importancia; al buscar por estudios clínicos aleatorios en el último año, se encontraron 100 publicaciones sobre insuficiencia renal y casi 200 sobre cáncer de mama, que sólo fue sobrepasado por la cardiopatía coronaria, con 300 publicaciones.
A continuación se revisarán algunos ejemplos emblemáticos, por los avances que ha habido en su tratamiento.
El cáncer gástrico tiene alta prevalencia en Chile y alta letalidad, incluso en etapas precoces; en algunas series se describe que cuando el paciente tiene cuatro o más ganglios comprometidos, la probabilidad de sobrevida libre de enfermedad al año es prácticamente cero. El mejor tratamiento siempre ha sido la cirugía; hubo múltiples intentos de tratamientos adyuvantes, pero ninguno de ellos logró buenos resultados, hasta que en New England Journal of Medicine, en 2001, se publicó el estudio Macdonald, llamado así por el primer autor del artículo (1), en el que se comparó el resultado de la quimio-radioterapia después de la cirugía versus la cirugía sola, para determinar si los pacientes operados con intención curativa podrían mejorar su sobrevida, con tratamiento adicional. Macdonald incluyó casi todos los estadios TNM en que la cirugía es curativa y excluyó sólo las etapas metastásicas. En la figura 4, la curva de Kaplan-Meier muestra la diferencia entre las curvas de sobrevida de los pacientes que recibieron quimio-radioterapia adicional, y los que se trataron solamente con cirugía (Fig. 4).
En cáncer de colon también ha habido avances notables, dentro del ambiente de la oncología. Respecto a la sobrevida, hace varios años se demostró que el tratamiento adyuvante con quimioterapia, con base en 5-fluoracilo, después de una cirugía con intención curativa, mejora la sobrevida global de los pacientes; también mejora la sobrevida global en pacientes con enfermedad metastásica que reciben tratamiento con quimioterapia, con intención paliativa. Aunque aún se utiliza la clasificación de Dukes, según la clasificación TNM la sobrevida a cinco años de los pacientes en etapa IV es 5% a 7%. En un metaanálisis de ocho artículos sobre el efecto de la quimioterapia basada en 5-fluoracilo, se evaluó si la adyuvancia con quimioterapia mejoraba la sobrevida libre de enfermedad y la global, y se vio que casi todos los subgrupos se beneficiaban, siendo la excepción el caso de los pacientes que no tienen ganglios comprometidos. De hecho, aún hay controversia acerca de si hacer o no hacer quimioterapia en este grupo de pacientes.
Otro avance es la aparición de nuevas drogas, entre las cuales se cuentan tres citotóxicos: irinotecan, oxaliplatino y capecitabina, siendo esta última una forma de fluoracilo de administración oral; y dos anticuerpos monoclonales: bevacizumab y cetuximab. En 2004 se publicó en N Engl J Med un estudio sobre el uso de oxaliplatino, realizado por investigadores del grupo MOSAIC (Multicenter International Study of Oxaliplatin/5-Fluorouracil/Leucovorin in the Adjuvant Treatment of Colon Cancer) con el objetivo de determinar si la administración de oxaliplatino, cuyo costo es elevado, sumada al fluoracilo, mejoraba la sobrevida de los pacientes (2). Se comprobó que en la etapa III hay un beneficio evidente en cuanto a sobrevida libre de enfermedad, pero en etapa II el beneficio no es tan claro. Se supone que a largo plazo, la mejoría en la sobrevida libre de enfermedad se traduce en mejoría de la sobrevida global, que es lo que interesa a los pacientes.
La vasculatura cambia en los procesos tumorales, en los cuales existe mayor cantidad de vasos sanguíneos, pero además aparecen vasos tortuosos, lo cual conlleva un mecanismo importante de resistencia a los medicamentos citotóxicos. El bevacizumab (Avastin) es un anticuerpo monoclonal, cuyo blanco es el factor de crecimiento vascular endotelial; su uso hace que la vasculatura tumoral disminuya y las tortuosidades anormales desaparezcan, lo que mejora la llegada de la quimioterapia. En un estudio de laboratorio se encontró que los cambios en la vasculatura aparecían a los tres días de la administración de este medicamento (Fig. 5).
Figura 5. Microfotografía. Cambios en la vasculatura tras la administración de bevacizumab.
Estos datos se llevaron a la práctica en 2004 en otro estudio, publicado en N Engl J Med (3), en el que se adicionó esta molécula a irinotecan, fluoracilo y leucovorina en pacientes con cáncer de colon metastásico. Como se sabe, las terapias nuevas se prueban primero en pacientes con cáncer metastásico, porque tienen menos que perder, y después se trata de extrapolar esa experiencia a la adyuvancia. La adición de bevacizumab generó un impacto significativo en la sobrevida global.
El EGFR (Epidermal Growth Factor Receptor) es un receptor de membrana con dominio extracelular, transmembrana e intracelular. Mediante la fosforilación y una serie de otros mecanismos, este receptor se sobreexpresa en las células tumorales, lo que hace que se activen genes de progresión del ciclo celular, aumentando la proliferación, la sobrevida, la angiogénesis y la capacidad de generar metástasis. Un anticuerpo monoclonal podría limitar todo este proceso, al igual que moléculas pequeñas que a nivel intracelular inhiban una etapa específica. El estudio de este receptor permitió diseñar un anticuerpo monoclonal dirigido contra él, el cetuximab, que se probó inicialmente en pacientes refractarios a la quimioterapia con irinotecan, que es el tratamiento de primera línea en cáncer de colon metastásico. Si bien se evidenció un pequeño beneficio con la adición de cetuximab en pacientes no respondedores a irinotecan, se presume que hay un mecanismo adicional, que está en estudio, mediante el cual esta molécula haría que las células tumorales que habían dejado de responder, recuperen la sensiblilidad a este fármaco.
En resumen, cuando sólo existía tratamiento quirúrgico, la sobrevida media en cáncer de colon metastásico era de seis meses; después de la aparición de quimioterapia con fluoracilo, la sobrevida llegó a 10 ó 12 meses. Al agregar algún fármaco citotóxico nuevo, como irinotecan u oxaliplatino, la sobrevida media aumentó a entre 14 y 16 meses. En la actualidad, con la combinación secuencial de fármacos citotóxicos más terapias target, la sobrevida es superior a 20 meses.
Es un tumor maligno, más frecuente en adultos, que tiene una sobrevida media de un año desde el momento del diagnóstico y una mortalidad cercana a 100% antes de dos años. El tratamiento estándar es la cirugía y la radioterapia, a lo que se ha agregado la adyuvancia con nitrosureas desde hace varios años, tanto en los Estados Unidos como en Chile, aunque ningún trabajo de fase 3 aleatorio ha demostrado que esta quimioterapia adyuvante mejore la sobrevida. En 2005 se publicó en N Engl J Med un artículo sobre radioterapia y terapia adyuvante con temozolomide en glioblastoma multiforme (4), en el que se encontró una diferencia importante en la sobrevida total de los pacientes sometidos a tratamiento asociado, en comparación con el grupo que recibió tratamiento estándar, que es sólo radioterapia (Fig. 6).
Una de las críticas frecuentes que se hace a la oncología es que obliga a los pacientes a gastar grandes sumas de dinero para lograr discretas mejorías en la sobrevida; por ejemplo, en el estudio anterior la sobrevida media con la terapia estándar fue de doce meses, mientras que con la radioterapia más temozolomide fue de catorce meses, diferencia que muchos pueden estimar de poca cuantía. Sin embargo, si se analiza desde otra perspectiva, sólo 20% de los pacientes tratados con radioterapia están vivos, cifra que alcanza a casi 40% entre los pacientes que recibieron tratamiento asociado. Por eso, en la FDA de los Estados Unidos aprobó este tratamiento y nadie lo cuestiona mayormente, salvo en el aspecto económico, porque además la toxicidad de la terapia es bastante baja en el tratamiento oral.
Antes, el tratamiento estándar de este tipo de cáncer era la cirugía radical, porque se decía que este tumor era quimiorrefractario. Los pacientes con esta patología tienen una sobrevida relativamente larga, porque no es un cáncer tan agresivo como otros; sin embargo, es una sobrevida de mala calidad, por la patología ósea que se genera en forma secundaria. Hoy se sabe que la radioterapia es una alternativa terapéutica como tratamiento primario; es decir, la radioterapia es un excelente tratamiento en algunos pacientes como alternativa a la cirugía, dado que las tasas de sobrevida son bastante parecidas. Lo anterior es válido, sobre todo, en pacientes añosos en quienes la cirugía puede ser bastante complicada. En pacientes que se han sometido a cirugía curativa radical, pero persisten con márgenes positivos o tienen otros factores de riesgo, la radioterapia coadyuvante postoperatoria cumple un papel fundamental. Por otro lado, en algunos estudios se describe que el uso de bifosfonatos reduce el dolor y el riesgo de episodios óseos en pacientes con enfermedad basal. La hormonoterapia también es un tratamiento potente y eficaz en el manejo de los tumores hormonosensibles.
Hay interacciones entre las células metastásicas prostáticas, los osteoclastos y los osteoblastos: las células tumorales estimulan, a través de citoquinas, el crecimiento osteoblástico y osteoclástico, con lo que se altera el equilibrio, aumenta la actividad osteoblástica y, a su vez, las mismas citoquinas que liberan los osteoblastos estimula el crecimiento de las células tumorales. Al principio se usaron bifosfonatos de primera generación en pacientes con metástasis, pero no se consiguió un alivio significativo con ninguna de estas sustancias. El ácido zoledrónico tiene más ventajas que el pamidronato, pero éste es el que más se utiliza, por razones de costo. El zolendronato reduce el riesgo de fracturas y de dolor óseo.
Antes se consideraba al cáncer de próstata como un tumor quimiorresistente y su tratamiento estándar era mitoxantrona con prednisona, porque esta combinación mejoraba la calidad de vida de los pacientes, aunque no la sobrevida, hasta fines de 2004, en que se publicó un estudio en el que se describió una diferencia significativa en la sobrevida global al asociar docetaxel, cada tres semanas, a la combinación mitoxantrona más prednisona (5). Entonces, en la era actual el cáncer de próstata se considera quimiosensible y se han desarrollado quimioterapias capaces de mejorar la sobrevida global. Una crítica frecuente a los tratamientos oncológicos se refiere a la calidad de vida; en este caso, como el tratamiento quimioterápico estándar era mitoxantrona-prednisona, se evaluó la calidad de vida mediante un cuestionario y se encontró que la asociación con docetaxel mejoraba la calidad de vida en forma significativa, en comparación con el tratamiento estándar.
El tratamiento clásico del cáncer de mama ha sido la cirugía. En 1976 apareció el primer trabajo que mostraba que la sobrevida era superior cuando la paciente ingresaba a una poliquimioterapia después de la cirugía (6). En la era moderna, ciertos metaanálisis demuestran la superioridad del uso de antraciclinas respecto a las quimioterapias antiguas, como CMF (ciclofosfamida, metotrexato y fluorouracilo). En la actualidad han aparecido los taxanos, una nueva familia de fármacos que ha demostrado una mejoría pequeña, pero significativa, frente a la quimioterapia con antraciclinas. En el mayor estudio aleatorio sobre adyuvancia en cáncer de mama, se encontró que la adición de taxanos, en este caso paclitaxel y docetaxel, mejora en forma sigificativa la sobrevida global, en comparación con las terapias estándar basadas en antraciclinas. También se han estudiado tratamientos neoadyuvantes, es decir, tratamientos preoperatorios; si bien no se ha demostrado una sobrevida global mayor como en la adición de taxanos, sí mejora la tasa de respuesta local, lo que permite realizar cirugías más completas o menos radicales.
Para estimar los beneficios de las quimioterapias en pacientes con cáncer, existen bases de datos lo bastante grandes para saber lo que pasa cuando se usa uno u otro tratamiento, o cuando no se indica tratamiento, en tres tipos de cáncer. Para cáncer de mama se puede consultar el sitio www.adyuvantonline.com, cuya base de datos es de los Estados Unidos. La quimioterapia adyuvante depende de la decisión del paciente y de su percepción del beneficio y la toxicidad de la quimioterapia. En los Estados Unidos se entrevistó a un grupo de pacientes con cáncer antes de empezar tratamiento, para saber con qué porcentaje de vida libre de enfermedad a 10 años ellos se someterían a un tratamiento cuya toxicidad no era despreciable. Se encontró que cuando se ofrecía un beneficio de más de 10% todos los pacientes decidían tratarse, a pesar de la toxicidad; con cifras menores de 5% ó 3% los pacientes rechazaban el tratamiento y con valores intermedios la respuesta era variable. Esto confirma nuestra postura, en el sentido de que la decisión de efectuar un tratamiento adyuvante o paliativo debe ser tomada por el paciente; el médico siempre va a querer hacer el tratamiento, pero tanto los beneficios como la toxicidad de éste recaerán sobre el paciente, de modo que el deber del médico es entregarle en la mejor forma posible la información disponible, con cifras y datos objetivos, para que pueda tomar su decisión.
En la Figura 7 se muestra un ejemplo de cómo cualquier persona puede estimar los beneficios de una quimioterapia adyuvante, por ejemplo, en cáncer de mama. Se muestra el caso de una mujer de 60 años, sin comorbilidad significativa, con receptores de estrógeno positivos y grado tumoral 3, en un tumor de 2,5 cm, es decir, pequeño, T2, con seis ganglios positivos. El riesgo de recaída de esta paciente a 10 años es de 84%; el riesgo de muerte por cáncer a 10 años es de 63%. En verde se muestran las pacientes que van a estar vivas a diez años; en rojo, los que van a haber muerto de cáncer en ese lapso; y en azul, las muertes por otras causas. La hormonoterapia entrega un beneficio de 12,7%; la quimioterapia, de 10% y el tratamiento combinado, de 21,4%. Además del cáncer de mama, esta base de datos también existe para cáncer de colon y para melanoma; así se puede ofrecer al paciente un dato objetivo y preguntarle si por ese beneficio está dispuesto a tratarse, en este caso, con la quimioterapia citotóxica. La decisión y la recomendación de hacer quimioterapia es más objetiva de lo que algunas personas creen.
Trastuzumab (Herceptin) es un anticuerpo monoclonal que ha revolucionado la adyuvancia y el cáncer de mama metastásico. Esta molécula bloquea el receptor HER2 (Human Epidermal Growth Factor Receptor-2), cuyo oncogen está amplificado en 40% de los casos de cáncer de mama. Es probable que el factor de crecimiento epidérmico, ligando de este receptor, genere multiplicación celular, metástasis, supervivencia de la célula y bloquee la vía de la apoptosis. En 2001 se vio que la adición de trastuzumab en pacientes con cáncer de mama metastásico que recibían quimioterapia mejoraba significativamente la sobrevida, en comparación con la quimioterapia sola (7). En 2005 apareció un estudio (8) en el que se evaluaron pacientes con cáncer de mama con HER2 positivo, con cirugías curativas, es decir, pacientes no metastásicas, para ver si este anticuerpo mejoraba la sobreviva. El informe inicial, que fue publicado en tiempo récord, demostró que la sobrevida libre de enfermedad era significativamente mayor después de un año de uso de trastazumab, en comparación con las pacientes que usaron sólo la terapia estándar con quimioterapia.
En el cáncer de mama se ha comenzado a explorar una serie de alternativas terapéuticas; cada una de estas moléculas no es la solución del cáncer, pero aporta un porcentaje de beneficio que se suma al de los tratamientos existentes.
El tratamiento estándar del cáncer de pulmón de células no pequeñas fue, hasta hace poco tiempo, la cirugía. En múltiples trabajos se ha tratado de demostrar el beneficio de hacer quimioterapia adyuvante a estos pacientes; un metaanálisis de 1995 demostró que había un pequeño beneficio, pero no era significativo; los italianos, en un estudio mundial que incluyó a muchos pacientes tratados con cisplatino, publicaron que podía haber un beneficio de 4% a 5%, muy discreto, pero estadísticamente significativo. En un estudio publicado en New England Journal of Medicine se encontró un aumento en la sobrevida global en los pacientes operados con cáncer pulmonar en etapa II, de células no pequeñas, si recibían cisplatino y vinorelbine, con un beneficio de 15% (9). La sobrevida global siempre depende de cisplatino, que sigue siendo la piedra angular en la terapia del cáncer de pulmón de células no pequeñas. El estudio CALGB 9633, que abarcó un número importante de casos, demostró que la combinación carboplatino y paclitaxel genera un 12% de beneficio; y el estudio ANITA (Adjuvant Navelbine International Trialist Association), que utilizó nabelvine-cisplatino, demostró un 8,6% de beneficio.
La guía oncológica actual es obra de la NCCN (National Comprehensive Cancer Network), de los Estados Unidos y exige un nivel de evidencia importante para modificar un estándar de tratamiento. En 2006, en cáncer de pulmón, la NCCN consideró que la quimioterapia adyuvante en etapa II y III está en categoría uno, es decir, una recomendación de primera línea. En Chile todavía estamos lejos de esa realidad.
Los avances en oncología ocurren a una velocidad vertiginosa, lo que exige una actualización constante. La cantidad de información se ha potenciado con la respuesta de las industrias farmacéuticas, que han producido nuevos fármacos y han generado una gran cantidad de información, aunque lamentablemente, muchas veces los adelantos no se pueden financiar en países como Chile. Existen importantes avances en el manejo del cáncer en todas las áreas; en esta conferencia se mostraron algunos ejemplos, pero también se podría hablar de cáncer de ovario, cabeza y cuello, testículo, cevicouterino, renal, tiroides, páncreas, etc.
La cirugía todavía es el pilar fundamental en el tratamiento, pero es posible que pronto ceda su lugar a la oncología médica. Por ejemplo, antes, el estándar de tratamiento del cáncer de ano era la cirugía de Miles, que dejaba al paciente colostomizado de por vida, pero ahora se hace tratamiento con quimiorradioterapia, la cual permite mantener el esfínter, con tasas de respuesta equivalentes. En la medida en que la oncología siga avanzando, es probable que esta situación se extrapole a otros tumores.
El tratamiento integral sigue siendo fundamental. Muchas veces se ven pacientes que han sido evaluados por un médico que no se dedica a cáncer y que realiza indicaciones inadecuadas, con lo que marcan el pronóstico del paciente; también hay médicos que sólo hacen el diagnóstico de cáncer, pero no se dedican a hacer el seguimiento ni a conocer la respuesta. El primer tratamiento del cáncer es fundamental para definir el pronóstico del paciente; por eso, siempre se debe presentar el caso a los oncólogos médicos y a un comité multidisciplinario que se haya constituido especialmente para diagnosticar y tratar el cáncer, para así recomendarle al paciente la mejor alternativa terapéutica.

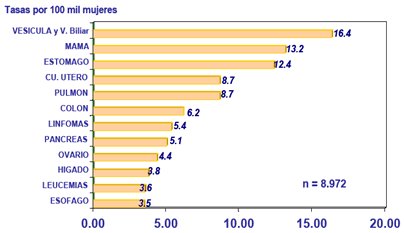 Figura 1. Principales causas de muerte por cáncer en la mujer, Chile 2001 (Fuente: MINSAL).
Figura 1. Principales causas de muerte por cáncer en la mujer, Chile 2001 (Fuente: MINSAL).

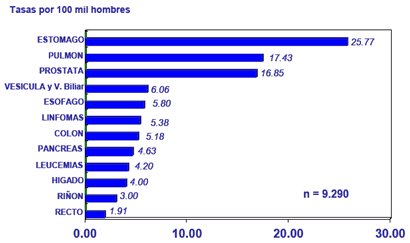 Figura 2. Principales causas de muerte por cáncer en el hombre, Chile 2001 (Fuente: MINSAL).
Figura 2. Principales causas de muerte por cáncer en el hombre, Chile 2001 (Fuente: MINSAL).

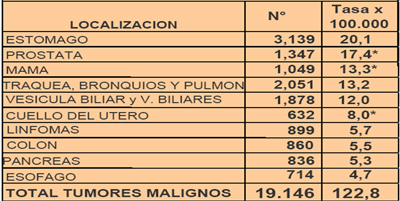 Tabla I. Número y tasa de mortalidad por cáncer: 10 principales localizaciones, Chile 2002 (Fuente: INE DEIS MINSAL Unidad de Cáncer).
Tabla I. Número y tasa de mortalidad por cáncer: 10 principales localizaciones, Chile 2002 (Fuente: INE DEIS MINSAL Unidad de Cáncer).

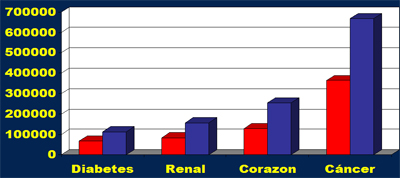 Figura 3. Investigación publicada en los 5 y 10 últimos años.
Figura 3. Investigación publicada en los 5 y 10 últimos años.

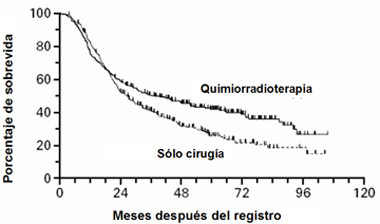 Figura 4. Sobrevida global entre todos los pacientes elegidos, según el grupo de tratamiento asignado (Macdonald JS. N Engl J Med 2001).
Figura 4. Sobrevida global entre todos los pacientes elegidos, según el grupo de tratamiento asignado (Macdonald JS. N Engl J Med 2001).

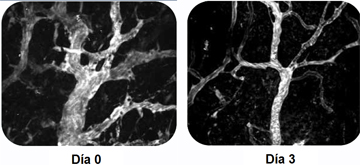 Figura 5. Microfotografía. Cambios en la vasculatura tras la administración de bevacizumab.
Figura 5. Microfotografía. Cambios en la vasculatura tras la administración de bevacizumab.

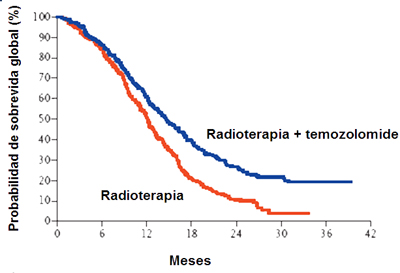 Figura 6. Estimación de sobrevida global de pacientes con glioblastoma multiforme, según tipo de tratamiento (Stupp R. N Engl J Med 2005).
Figura 6. Estimación de sobrevida global de pacientes con glioblastoma multiforme, según tipo de tratamiento (Stupp R. N Engl J Med 2005).

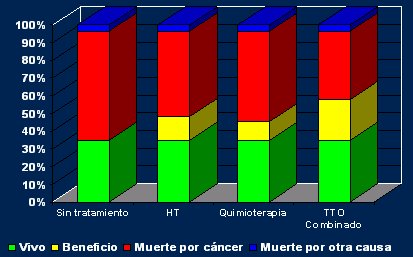 Figura 7. Estimación de riesgo de muerte y beneficio de tratamiento a 10 años (Fuente: www.adyuvantonline.com).
Figura 7. Estimación de riesgo de muerte y beneficio de tratamiento a 10 años (Fuente: www.adyuvantonline.com).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada de una conferencia dictada en reunión clínica del Departamento de Medicina, Hospital Clínico Universidad de Chile. La publicación de estas actas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile. El director del Departamento de Medicina es el Dr. Alejandro Cotera.
 Expositor:
Claudio Painemal[1]
Expositor:
Claudio Painemal[1]

Citación: Painemal C. Advances in cancer treatments. Medwave 2007 Ene;7(1):e2541 doi: 10.5867/medwave.2007.01.2541
Fecha de publicación: 1/1/2007

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión