 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
Los corticoides se suelen considerar como última herramienta terapéutica y se utilizan en muchas patologías. En esta presentación se analizará la evidencia que avala su uso.
Las interacciones de los corticoides a nivel celular son muy complejas. Actúan a nivel de un receptor de glucocorticoides citoplasmático que ejerce sus efectos sobre el complejo MAP-kinasa, inhibiendo la formación de citoquinas, a nivel del factor nuclear kappa-B y a nivel de la vía del ácido araquidónico. Los corticoides tienen distintas acciones según la dosis que se utilice; a veces su acción es favorable, como cuando causan un efecto antiinflamatorio, pero en ciertas dosis pueden activar un factor que sería fundamental en la génesis de la insuficiencia orgánica múltiple.
A su vez, el organismo produce una serie de citoquinas capaces de modificar al receptor de glucocorticoides y a los blancos sobre los cuales actúa. La interacción es tan compleja, que el tratamiento con corticoides viene a ser un arte, una sutileza, porque las dosis excesivas suelen determinar más daño que beneficio y las dosis bajas pueden ser beneficiosas o insuficientes; en consecuencia, se requieren estudios muy extensos para determinar si son útiles y en qué dosis el costo-beneficio justifica su uso.
Se ha demostrado la utilidad de los corticoides en pacientes con status asmático, que están a punto de caer en ventilación mecánica o que ya en están ella; estos pacientes requieren corticoides en forma precoz, pues la latencia entre la administración y el efecto es de seis horas. También se ha demostrado que son útiles en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) exacerbada grave, que llegan a los servicios de cuidados intermedios o intensivos (UCI), pero de nuevo aparece un aspecto sutil, ya que son necesarios en la EPOC, pero si su administración se prolonga por más de 14 días comienzan a ser deletéreos, es decir, los corticoides sirven sólo en EPOC en situación aguda, no en el estado crónico, por lo que en la actualidad es muy raro el uso crónico de corticoides en EPOC. En los otros casos mencionados, los corticoides cumplen un papel indudable.
En cuanto a los cuadros de insuficiencia respiratoria aguda, se han utilizado corticoides, con mayor o menor base científica, en el síndrome de distrés respiratorio agudo (SDRA); en la neumonía grave adquirida en la comunidad; y en un distrés sin causa desencadenante hasta el momento, aunque exista la posibilidad de que la causa sea un germen atípico.
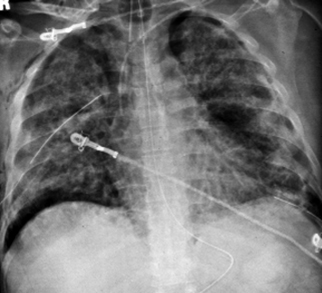
Estos pacientes se manejan, en la práctica, en forma intuitiva; nadie puede asegurar si el enfermo está infectado ni qué tipo de infiltrado se produce. Es un desastre, porque se trata de un paciente intubado, ventilado, con evidencias de barotrauma, neumomediastino, neumotórax, etc., a causa de un pulmón rígido que determina una gran dificultad para ventilar los escasos alvéolos disponibles para la insuflación (Fig. 1).
Figura 1. Radiografía de tórax posteroanterior de paciente con SDRA.
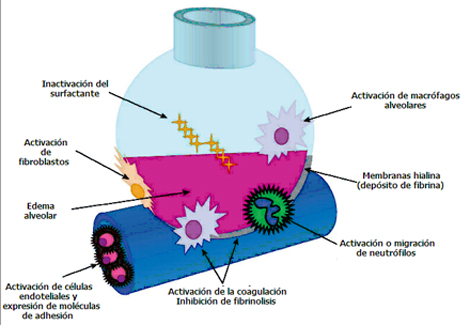
El distrés respiratorio es un cuadro inflamatorio y las dos principales células involucradas son la célula endotelial y la célula alveolar (Fig. 2). Se desarrolla una panendotelitis que, además de los pulmones, afecta otros órganos, como riñón, intestino, etc., lo cual genera liberación de citoquinas y expresión de moléculas de adhesión. El blanco siguiente son las células epiteliales, que cambian su permeabilidad y generan factores de crecimiento y de activación, que favorecen la llegada de una serie de células: macrófagos, neutrófilos y fibroblastos, que actúan como efectores, pero que no son imprescindibles para que el distrés ocurra; las únicas células imprescindibles para que ocurra el SDRA son la célula endotelial y la alveolar.
Surgen alteraciones en el surfactante, lo que genera atelectasias progresivas en las ventilaciones sucesivas, sobre todo si el paciente ventila en forma espontánea. Además, el trastorno de la permeabilidad genera un contenido hialino que es una mezcla de proteínas y glóbulos rojos. Por lo tanto, en el desarrollo de este proceso el factor fundamental es la inflamación descontrolada, a tal punto que el factor desencadenante deja de ser trascendental en el desarrollo posterior del cuadro.
Figura 2. Alteraciones a nivel de célula endotelial y alveolar que participan en el proceso inflamatorio del SDRA.
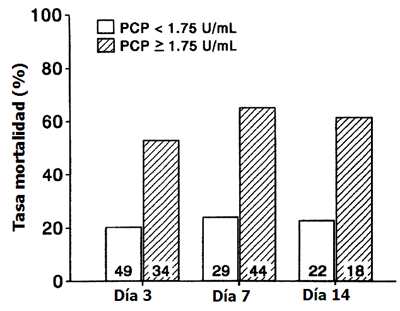
En 1995, Clark realizó un estudio clásico (1) en el cual se utilizó como marcador el procolágeno III, que es un marcador de destrucción de fibroblastos y actúa como precursor del depósito de colágeno en pacientes con distrés respiratorio; y encontró que los pacientes que fallecieron tenían altos niveles de procolágeno en el lavado broncoalveolar, fuera precoz o tardío, lo que sugiere que los fibroblastos se activan al tercer día, o incluso antes. Actualmente se habla de que la fase fibroproliferativa puede comenzar a las 48 horas de ocurrida la agresión inicial. De este modo, el autor estableció un nivel de corte de procolágeno en el lavado broncoalveolar de 1,75 U/mL, ya que sobre ese nivel la mortalidad, tanto precoz como tardía, era 60% mayor que la mortalidad histórica (Fig. 3). En la actualidad la mortalidad ha disminuido a 40%, pero ese nivel se sigue manteniendo en los mayores de 65 años.
El estudio de mortalidad se realizó con un análisis multivariado, excluyendo la etiología del distrés. Se podría plantear que el procolágeno está relacionado con el factor desencadenante que generó el distrés, pero esto no ocurre; sin embargo, se podría decir que los enfermos que mueren son los que tienen una inflamación exuberante, descontrolada, que genera depósito de colágeno y que perpetúa el fenómeno inflamatorio del estrés; en cambio, los enfermos que no pasan a la fase proliferativa tienen un mejor pronóstico, con mortalidad de 20% (Fig. 3).
Figura 3. Tasas de mortalidad en pacientes con síndrome de distrés respiratorio del adulto, según la concentración de procolágeno III en el lavado broncoalveolar. El número de pacientes en cada categoría está indicado dentro de la barra. (Fuente: Clark JG. Ann Intern Med 1995; 122(1): 17-23).
La primera experiencia con relación al uso de corticoides en distrés respiratorio fue publicada por Meduri en la revista JAMA, en 1998 (2). El autor asignó en forma aleatoria a los pacientes, a razón de dos por uno, para recibir metilprednisolona (dos pacientes) o solución fisiológica (SF) pura (uno), con un total de 24 pacientes. Con el tratamiento estándar, al décimo día mejoraron los parámetros de 2 de 8 pacientes que reciberon SF, mientras que de los que recibieron metilprednisolona, mejoraron 16 de 16. El parámetro evaluado fueron la PaFi, es decir, el coeficiente entre presión arterial de oxígeno y fracción inspirada de oxígeno, es decir, el intercambio gaseoso.
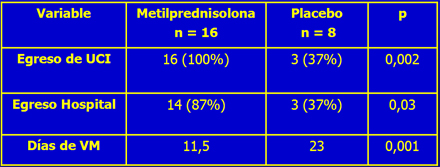
Los efectos adversos fueron similares en los dos grupos: aparición de Candida y hemorragia digestiva alta, sin mayor fuga de pacientes. Se demostró que los pacientes con corticoides tenían más probabilidades de salir de la UCI y del hospital y menor duración de la ventilación mecánica (Tabla I). Además, este investigador cruzó a los enfermos que no respondieron con SF hacia la rama de metilprednisolona, en el día 10, sin encontrar beneficio para estos pacientes, por lo que concluyó que el uso de corticoides debe ser precoz. Esto concuerda con los hallazgos publicados anteriormente en otro estudio.
Tabla 1. Metilprednisolona en SDRA (Fuente: Meduri GU. JAMA 1998; 280(2): 159-165).
El estudió de Meduri despertó el interés científico; se pensó que se había hallado el tratamiento médico del distrés respiratorio y comenzaron a aparecer otras experiencias, como la de Lee (3), que analizó un grupo de pacientes en forma retrospectiva y utilizó como grupo control a pacientes de cirujanos de tórax, en Corea. El autor observó que los pacientes que sufrían distrés respiratorio luego de lobectomías, neumonectomías o cirugías de cáncer esofágico tenían una mortalidad muy elevada; de hecho, se sabe que los pacientes que presentan distrés respiratorio después de una cirugía torácica tienen un pronóstico ominoso, con al menos 70% de mortalidad, especialmente en caso de neumonectomías y cirugías de esófago. Se cree que la manipulación de los pulmones genera una gran liberación de citoquinas, lo que causaría un distrés devastador.
Lee y su grupo analizaron a un grupo de 12 pacientes con distrés respiratorio postcirugía tratados, a los que trataron con dosis bajas de metilprednisolona, como en el estudio de Meduri (2 mg/kg de peso, fraccionado cada seis horas) y los compararon en forma retrospectiva con 8 pacientes tratados en forma convencional, y encontraron que los pacientes tratados con corticoides ingresaban menos a la UCI, tenían menor mortalidad y necesitaban menos ventilación mecánica que los controles históricos. A estos enfermos se les administró metilprednisolona al séptimo día de operados, previo descarte de una complicación infecciosa. Esto apoya la postura de que los corticoides podrían ser beneficiosos en pacientes con distrés respiratorio.
Más interesante es un trabajo en que se hizo un análisis post hoc (4) de la famosa serie de Annane de corticoides en shock séptico, publicada en JAMA en 2002 (5), separando a los pacientes en dos grupos, con distrés y sin distrés, y en respondedores o no respondedores al test de Synacthen (ACTH exógena), que evaluaba la producción de cortisol. Los respondedores tenían glándulas suprarrenales capaces de producir cortisol en respuesta a este estímulo, en cantidad superior a 9 nanog/ml; los no respondedores producían niveles inferiores a esa concentración, es decir, en teoría tenían insuficiencia suprarrenal subclínica en condiciones de shock séptico. En los pacientes con shock séptico y distrés respiratorio se administró hidrocortisona en dosis bajas, alrededor de 200 mg/día, junto con un mineralocorticoide (Florinef). Ajustado por mortalidad, en el grupo de pacientes no respondedores se redujo la mortalidad a los 28 días y además se redujo la mortalidad en la UCI, lo que no ocurrió en los respondedores ni en los enfermos con shock séptico sin distrés respiratorio. Es importante recalcar que el trabajo original no se diseñó para evaluar estos aspectos, sino para ver la utilidad de los corticoides en el shock séptico (Annane et al Crit Care Med 2006;34:22-30).
Con estos antecedentes surgió la necesidad de realizar un estudio aleatorio, multicéntrico, tarea que fue emprendida por Steinberg et al en un estudio que duró desde 1997 hasta 2005 (6). En este estudio se evaluaron 4.100 enfermos; la mayoría de ellos fueron eliminados por inmunosupresión o por otros criterios de exclusión, quedando al final sólo 5% de esta población, es decir, 180 enfermos, de los cuales 89 recibieron metilprednisolona en bolos de 200 mg, seguido de 0,5 mg/kg cada seis horas los 14 primeros días para luego disminuir las dosis; y 91 recibieron placebo (solución glucosada). Se comprobó que los pacientes del grupo de metilprednisolona salían con mayor rapidez de la ventilación mecánica, pero volvían a necesitarla con mayor frecuencia debido a miopatía esteroidal o polineuropatía del paciente crítico. De los 26 pacientes que volvieron a ventilación mecánica, 20 pertenecían al grupo de metilprednisolona. Los pacientes con placebo también sufrieron en cierto grado de polineuropatía, pero nunca con la gravedad que se presentó en el grupo de metilprednisolona. La mortalidad a 60 días fue igual en ambos grupos, 28% y 29%, pero el número de días libres de ventilación mecánica fue significativamente mayor en el grupo de metilprednisolona, el que no tuvo mayor incidencia de infecciones que el grupo placebo.
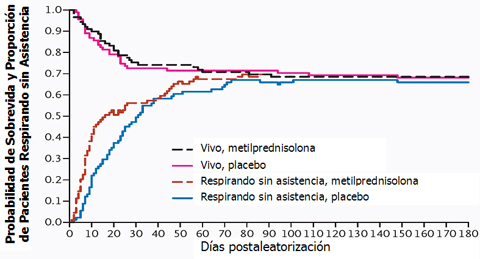
Existe una asociación entre el uso de corticoides, relajantes musculares y el control metabólico estricto, y la incidencia de miopatía y neuropatía de pacientes críticos; por lo tanto, aunque los enfermos salían de ventilación mecánica, no hubo impacto en la mortalidad. Estos resultados se obtienen cuando se evalúa mortalidad a largo plazo; en trabajos que se evalúa la mortalidad a 30 días, puede que no se alcance a discriminar este efecto. Además, es interesante destacar que en los enfermos con más de 14 días de evolución del distrés respiratorio que recibieron corticoides, la tasa de mortalidad fue mayor. Por lo tanto, la mortalidad no cambia con placebo o metilprednisolona. Aunque al principio los pacientes con corticoides salen precozmente de ventilación mecánica, al pasar más tiempo, las dos curvas de Kaplan-Meier tienden a unirse (Fig. 4). Luego, la metilprednisolona no tiene un impacto positivo, en términos de mortalidad, en los pacientes conectados a ventilación mecánica.
Figura 4. Probabilidad de sobrevida y proporción de pacientes con síndrome de distrés respiratorio agudo persistente que pudieron respirar sin asistencia durante los 180 primeros días después de la aleatorización (Fuente: Steinberg KP. N Engl J Med 2006; 354(16): 1671-84).
Como conclusión, la metilprednisolona no se debe administrar en bolos de 500 mg y luego 500 mg al otro día, como se hizo por mucho tiempo, porque no sirve. Quizás el matiz esté en las dosis bajas, aunque no está claro cuáles serían esas dosis, pero se sabe que las dosis bajas reducen los días de ventilación mecánica. Los corticoides aumentan la incidencia de miopatía esteroidal, efecto que sólo se puede ver a largo plazo; y no disminuyen la mortalidad global, lo que probablemente se derive de este fenómeno. Tal vez algunos subgrupos podrían beneficiarse con corticoides, como los pacientes con distrés respiratorio y shock séptico, según lo demostró Annane, pero habría que estudiar dirigidamente estos dos grupos.
En cuanto a la cirugía torácica, en la serie presentada se utilizó un control histórico, lo que no necesariamente es correcto, porque podría haber mejorado la técnica quirúrgica, por ejemplo. El límite en este artículo fueron 14 días y es probable que el uso de corticoides en forma tardía aumente la mortalidad. Entonces, es importante considerar los matices en la indicación de corticoides: dosis y momento de uso.
El problema del estudio encabezado por Steinberg es su larga duración: se inició en 1997 y terminó en 2005. Durante ese lapso se ha aprendido mucho sobre el manejo del distrés respiratorio, mediante, por ejemplo, el uso de volúmenes corrientes bajos en la ventilación, para no perpetuar la liberación de citoquinas y reducir la mortalidad; y se ha desarrollado el concepto de la importancia del control metabólico de estos pacientes, porque si no se hace un control estricto aumenta la frecuencia de miopatía y polineuropatía del paciente crítico. También se sabe que se debe despertar a los pacientes todos los días para evaluar la posibilidad de retiro del ventilador. Todas estas maniobras que han tenido impacto en la mortalidad se desarrollaron en el transcurso de estos años, por lo que es difícil saber si se tomaron en cuenta al analizar los resultados de este trabajo.
En mi opinión, no aplicaría pena de muerte a los corticoides, pero sí libertad condicional.
Las neumonías comunitarias graves tienen un efecto desastroso y, en general, el problema radica más en el huésped que en el microorganismo. Los pacientes que mueren de neumonía tienen una curva bimodal: o mueren rápidamente de shock séptico o tardíamente, como consecuencia del efecto devastador sobre el sistema inmune, la nutrición, etc. Estudios preliminares realizados por el grupo de Barcelona (7) demostraron que los niveles de citoquinas inflamatorias eran significativamente mayores en los pacientes que morían, en comparación con los que sobrevivían; y desde antes se sabía que después de la administración de penicilina a pacientes con sífilis aparecía una reacción paradójica, con mayor fiebre, vasodilatación e hipotensión, que se atribuían a la liberación masiva de material antigénico de las paredes celulares de las bacterias, debido al mecanismo de acción de los antibióticos, en particular los betalactámicos, que provocan la destrucción masiva de los microorganismos.
En un paciente que está al límite de sus funciones vitales, esto puede romper su equilibrio. Por ejemplo, cuando se indica un antibiótico para manejar la neumonía, si este antibiótico actúa sobre las PBP (proteínas ligadoras de penicilina) de la pared celular bacteriana, destruye a las bacterias y se producen cientos de fragmentos de ellas, que pasan a la circulación, generan un trastorno inflamatorio y descompensan al paciente. Se ha descrito que el tipo de antibiótico utilizado puede influir en la mortalidad de los enfermos, cuando se comparan antibióticos activos contra la bacteria; por ejemplo, en pacientes politraumatizados el uso de ceftriaxona genera destrucción celular, con múltiples fragmentos, a diferencia del imipenem, que provoca un cambio de conformación en la bacteria, porque actúan sobre diferentes PBP, lo cual tiene impacto en la mortalidad.
En un estudio realizado por Bauer (8) se demostró que frente a mayor injuria pulmonar, aumentaba el TNF-alfa, por lo que se planteó que el uso de antibióticos en enfermos graves provoca la última agresión, pero como es indispensable administrarlos, se debería bloquear esta respuesta exagerada, por ejemplo, con corticoides. La primera experiencia al respecto fue publicada en 2005 por Confalonieri (9), que utilizó hidrocortisona en un bolo de 200 mg, seguido de una infusión continua de 10 mg/hora por siete días, y evaluó la respuesta en pacientes con neumonía grave, según los criterios de la ATS (American Thoracic Society). Se evaluaron 121 pacientes, pero sólo entraron al estudio 48, porque la mayoría no cumplía con los criterios de inclusión, usaban corticoides por otro motivo (EPOC, asma) o tenían evidencias de inmunosupresión.
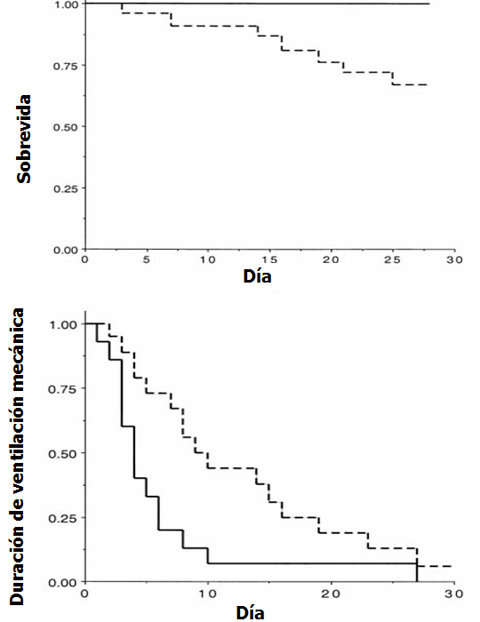
Siempre es importante mencionar a los pacientes que se retiran de los estudios y analizar el intento de tratar, lo que en la mayoría de los trabajos, aunque vengan de revistas muy prestigiosas, se suele dejar de lado, alterando el análisis posterior. 24 recibieron hidrocortisona y otros 24, placebo y se encontró una mortalidad significativamente menor en el grupo que recibió corticoides, a tal punto que el comité de ética del hospital obligó a detener el estudio; lo mismo ocurrió con la duración de conexión a ventilación mecánica (Fig. 5). En resumen, la mortalidad en UCI, la mortalidad hospitalaria y la mortalidad a 60 días fue significativamente menor en el grupo con hidrocortisona, lo mismo que la estadía en UCI, la estadía hospitalaria y la duración de la ventilación mecánica.
La crítica a este trabajo es que, por defecto de aleatorización, casi todos los enfermos que estaban en ventilación mecánica se incluyeron en el grupo placebo; por lo tanto, 17 de 24 enfermos del grupo placebo estaban en ventilación mecánica en el momento de la aleatorización y sólo 7 en el grupo con hidrocortisona. Es evidente que la ventilación mecánica es un factor de riesgo de mortalidad, puesto que los pacientes que caen a ventilación mecánica como consecuencia de una neumonía tienen una mortalidad de 50% lo que puede haber influido en los resultados. Los autores dijeron que realizaron un análisis multivariado, con el que evitaron ese aspecto de la ventilación mecánica.
Figura 5. Curvas de sobrevida (arriba) y tiempo de duración de ventilación mecánica (abajo) en pacientes aleatorizados a hidrocortisona y placebo. La línea punteada representa al grupo placebo y la línea continua, al grupo tratado con hidrocortisona. Un paciente del grupo placebo que desarrolló SDRA fue extubado el día 44. (Fuente: Confalonieri M. Am J Respir Crit Care Med 2005; 171(3): 242-248).
Con estos resultados reapareció el entusiasmo por usar corticoides en las neumonías comunitarias graves. En la actualidad se usan y, aunque no se han analizado en forma estricta los resultados, la impresión es que los enfermos muestran mejoría: mejoran los parámetros de intercambio gaseoso, disminuyen las presiones de insuflación y mejora la hemodinamia. A pesar de ello, por lo general tendrían una evolución tórpida.
El uso de corticoides en la neumonía comunitaria grave permanece aún como recomendación de especialistas y posiblemente tenga utilidad en la neumonía adquirida en la comunidad asociada a shock séptico, pero falta un estudio multicéntrico, aleatorio y doble ciego, en el que se evalúe la mortalidad a los 60 y 180 días, para contar con evidencia suficiente.






 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
 Expositor:
Mauricio Ruiz[1]
Expositor:
Mauricio Ruiz[1]

Citación: Ruiz M. Corticosteroids in acute respiratory failure. Medwave 2006 Nov;6(10):e2535 doi: 10.5867/medwave.2006.10.2535
Fecha de publicación: 1/11/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Clark JG, Milberg JA, Steinberg KP, Hudson LD. Type III procollagen peptide in the adult respiratory distress syndrome. Association of increased peptide levels in bronchoalveolar lavage fluid with increased risk for death. Ann Intern Med. 1995 Jan 1;122(1):17-23. | PubMed |
Clark JG, Milberg JA, Steinberg KP, Hudson LD. Type III procollagen peptide in the adult respiratory distress syndrome. Association of increased peptide levels in bronchoalveolar lavage fluid with increased risk for death. Ann Intern Med. 1995 Jan 1;122(1):17-23. | PubMed | Meduri GU, Headley AS, Golden E, Carson SJ, Umberger RA, Kelso T, et al. Effect of prolonged methylprednisolone therapy in unresolving acute respiratory distress syndrome: a randomized controlled trial. JAMA. 1998 Jul 8;280(2):159-65. | CrossRef | PubMed |
Meduri GU, Headley AS, Golden E, Carson SJ, Umberger RA, Kelso T, et al. Effect of prolonged methylprednisolone therapy in unresolving acute respiratory distress syndrome: a randomized controlled trial. JAMA. 1998 Jul 8;280(2):159-65. | CrossRef | PubMed | Lee HS, Lee JM, Kim MS, Kim HY, Hwangbo B, Zo JI. Low-dose steroid therapy at an early phase of postoperative acute respiratory distress syndrome. Ann Thorac Surg. 2005 Feb;79(2):405-10. | CrossRef | PubMed |
Lee HS, Lee JM, Kim MS, Kim HY, Hwangbo B, Zo JI. Low-dose steroid therapy at an early phase of postoperative acute respiratory distress syndrome. Ann Thorac Surg. 2005 Feb;79(2):405-10. | CrossRef | PubMed | Annane D, Sebille V, Bellissant E; Ger-Inf-05 Study Group. Effect of low doses of corticosteroids in septic shock patients with or without early acute respiratory distress syndrome. Crit Care Med. 2006 Jan;34(1):22-30. | CrossRef | PubMed |
Annane D, Sebille V, Bellissant E; Ger-Inf-05 Study Group. Effect of low doses of corticosteroids in septic shock patients with or without early acute respiratory distress syndrome. Crit Care Med. 2006 Jan;34(1):22-30. | CrossRef | PubMed | Annane D, Sébille V, Charpentier C, Bollaert PE, François B, Korach JM, et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA. 2002 Aug 21;288(7):862-71. | CrossRef | PubMed |
Annane D, Sébille V, Charpentier C, Bollaert PE, François B, Korach JM, et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA. 2002 Aug 21;288(7):862-71. | CrossRef | PubMed | Steinberg KP, Hudson LD, Goodman RB, Hough CL, Lanken PN, Hyzy R, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med. 2006 Apr 20;354(16):1671-84. | CrossRef | PubMed |
Steinberg KP, Hudson LD, Goodman RB, Hough CL, Lanken PN, Hyzy R, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med. 2006 Apr 20;354(16):1671-84. | CrossRef | PubMed | Monton C, Torres A, El-Ebiary M, Filella X, Xaubet A, de la Bellacasa JP. Cytokine expression in severe pneumonia: a bronchoalveolar lavage study. Crit Care Med. 1999 Sep;27(9):1745-53. | CrossRef | PubMed |
Monton C, Torres A, El-Ebiary M, Filella X, Xaubet A, de la Bellacasa JP. Cytokine expression in severe pneumonia: a bronchoalveolar lavage study. Crit Care Med. 1999 Sep;27(9):1745-53. | CrossRef | PubMed |