 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
El hantavirus no es tan reciente como parece; existen datos que sugieren su presencia en Asia y Europa desde 1930. La enfermedad clínica como tal, fiebre hemorrágica con compromiso renal, fue descrita en soldados de la guerra de Corea. En 1993, luego de que el CDC (Centers for Disease Control and Prevention) de los Estados Unidos describiera la aparición de una enfermedad aguda, febril, que afectaba a jóvenes y conducía rápidamente a edema pulmonar, shock y muerte, se identificó el hantavirus, que en ese momento se denominó virus Sin Nombre o virus Canyon Muerto. Desde 1994 han aparecido nuevos brotes en América Latina: Argentina, Brasil, Bolivia, Chile, Panamá y Paraguay, en forma sucesiva.
El hantavirus es un virus ARN de la familia Bunyaviridae, que comprende cinco géneros: bunyavirus, phlebovirus, nairovirus, tospovirus y hantavirus. La diferencia principal del hantavirus, respecto a los otros géneros, es que el reservorio es un roedor. Estos virus se encuentran en todo el mundo y la presentación clínica está dividida en dos sectores: en Asia y Europa se presenta como fiebre hemorrágica con compromiso renal; en las Américas, el órgano blanco es el pulmón, sin mayor compromiso renal ni de la coagulación, al menos en las primeras descripciones realizadas.
Una característica importante del hantavirus es que su reservorio varía según la zona en que se encuentre: por ejemplo, en Brasil, el virus Juquitiba reside en el Calomys laucha; en cambio, en Chile, el virus Andes tiene al ratón colilargo como reservorio principal. En Chile se han identificado cinco reservorios: Abrothrix longipilis, Abrothrix olivaceus, Loxodontomys micropus, Phyllotis darwini, todos ellos de poca importancia, y Oligoryzomys longicaudatus, el ratón colilargo, que es el más importante (Fig. 1). El hábitat de este último se extiende desde el extremo sur del desierto de Atacama hasta la XI región. La presencia del roedor en su hábitat, permite que sea potencialmente factible desarrollar la enfermedad.
Figura 1. Oligoryzomys longicaudatus (ratón colilargo)
La enfermedad por hantavirus es una antropozoonosis, es decir, depende de la interacción del hombre con el reservorio, que es un roedor. El ratón colilargo se caracteriza por tener hábitos silvestres; vive en zonas donde hay terrenos con 70% de malezas o arbustos y cercanas a una fuente de agua (a no más de 20 metros). La infección aparece cuando el hombre invade el territorio del roedor o viceversa, lo cual sucede cuando se urbanizan áreas rurales, cuando se trabaja en el campo o con las actividades turísticas. La infección se transmite principalmente por la inhalación de partículas virales que se desprenden como resultado de la desecación de secreciones del roedor (orina, fluidos y excretas); una forma más rara de adquirir la enfermedad es por mordedura del ratón.
En Argentina se describió un caso de transmisión persona a persona de virus Andes, en 1997, pero es el único caso comunicado en la literatura con este virus específico, que afecta a Chile y Argentina; en la actualidad no hay evidencia de transmisión de virus hanta de persona a persona. En un estudio de Castillo, publicado en 2004 (1), se evaluaron 215 contactos de 20 casos índice de síndrome cardiopulmonar por hanta: 106 parientes y 109 miembros del equipo de salud. La seroprevalencia en parientes fue de 1,9%, lo que se podría explicar por el contacto con el mismo antígeno, con los roedores de la zona; en cambio, en los trabajadores de la salud la seroprevalencia fue de 0%.
Esta infección se caracteriza por ser una enfermedad de tipo profesional. De los pacientes que habían adquirido la enfermedad por hantavirus hasta el año 2001, 40% tenían alguna relación con el área agrícola, eran trabajadores agroforestales; otro grupo considerable de pacientes realizaban actividad pesquera o eran turistas. Como grupo, la mayoría son hombres (71%) y jóvenes (promedio de edad, 30 años). Hasta agosto del año 2005 se habían comunicado 39 casos, con un total acumulado de 434 infectados, según datos retrospectivos disponibles desde 1975.
La enfermedad por hantavirus se presenta en forma estacional, endémica y con brotes que alcanzan un peak entre noviembre y abril, disminuyendo su incidencia el resto del año. La letalidad ha bajado sustancialmente, desde 60% en 1997 hasta 30% en 2003, según el último informe disponible. Es probable que esta disminución se deba a que el acceso de los pacientes a los centros de salud y a las Unidades de Cuidados Intensivos (UCI) ha mejorado, y a que se conoce mejor la enfermedad, lo que ha permitido que se diagnostiquen casos de menor gravedad.
El grado de compromiso orgánico de la enfermedad por hantavirus depende de: la susceptibilidad del huésped; la especie de virus; el tamaño del inóculo viral; y la exposición al virus. La exposición previa al virus es un dato relevante, que fue estudiado por Bharadwaj (2), quien observó que, de los pacientes con enfermedad leve, ninguno presentó títulos de anticuerpos neutralizantes menores de 1:800, mientras que la mayoría de los pacientes que desarrollaron enfermedad grave tenían títulos de 1:800 o menores. Este punto podría ser importante en la inmunidad pasiva, pensando en el desarrollo de estrategias de tratamiento.
El virus infecta las células de la mucosa respiratoria, que es la principal vía de ingreso, y después pasa al torrente sanguíneo; las células del endotelio vascular constituyen el blanco fundamental del virus y, probablemente, producen allí una alteración funcional. Los receptores que interactúan con el hantavirus son las integrinas beta 3, presentes en las células endoteliales, plaquetas y macrófagos. Las integrinas beta 3 son importantes en la regulación de la permeabilidad vascular y en la función plaquetaria, y la interacción hantavirus-integrinas sería fundamental en la patogénesis. El virus se reproduce en el citoplasma sin destruir las células, pero provoca una gran liberación de citoquinas; por lo tanto, la alteración de la permeabilidad vascular sería mediada por citoquinas y no tanto secundaria a citopatología viral; participan moléculas de adhesión, linfocitos CD4, CD8, etc. En suma, se produce viremia y una extensa replicación viral; luego se induce filtración de plasma: las células endoteliales se abren, pero no se pierden, es un efecto transitorio; y, por último, sobreviene shock clínico y hemorragia, con mortalidad variable.
La enfermedad por hantavirus puede ser asintomática, sintomática, con síntomas generales similares a influenza o se puede manifestar como un síndrome cardiopulmonar por hantavirus (SCPH), que se puede catalogar como leve, moderado o grave. El SCPH leve se define como enfermedad por hantavirus con infiltrados pulmonares bilaterales e insuficiencia respiratoria moderada, sin necesidad de ventilación mecánica; el SCPH moderado corresponde a la misma definición, a la cual se agrega necesidad de ventilación mecánica; en el SCPH grave se agrega compromiso cardiovascular con shock.
La caracterización de la enfermedad está muy clara. En Chile se hizo un seguimiento de 21 adultos en la IX Región, entre 1997 y 2000 (3) y se observó que la enfermedad presenta cinco estadios, similares a los que describió Duchin en 1994 (4): incubación, período prodrómico, fase cardiopulmonar, fase de recuperación (poliúrica) y convalecencia. La fase cardiopulmonar, que es la más grave, dura entre 6 y 9 días. En un estudio de Vial (5) se determinó el tiempo de incubación del virus Andes en 20 pacientes, porque sólo se contaba con datos de los virus Juquitiba, Muerto Canyon y Sin Nombre, y se observó que el promedio de incubación del virus Andes era de 18 días, aunque oscilaba entre 48 horas y 49 días.
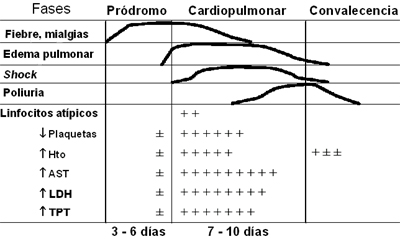
En un gráfico publicado por Ferreira (6) aparecen las fases de la enfermedad, que el autor redujo a tres (Fig. 2). La fase prodrómica dura entre 2 y 7 días y en ella el paciente presenta un síndrome tipo influenza, caracterizado por fiebre, calofríos y mialgias, que se identifica en casi 100% de los pacientes. Siguen en frecuencia síntomas gastrointestinales bajos, náuseas, vómitos, dolor abdominal y diarrea y con menor frecuencia (40-60%) se presentan disnea, mareos, artralgias, dolor lumbar y diaforesis. Este período, que dura en promedio 6 días, precede al SCPH. En este momento no se puede distinguir de cualquier otra enfermedad, pero existe un detalle importante en los exámenes de laboratorio, que es el hallazgo de trombocitopenia.
Figura 2. Progresión clínica del síndrome cardiopulmonar por hantavirus. Hto=hematocrito; AST=aspartato aminotransferasa; LDH=deshidrogenasa láctica; TPT= tiempo parcial de tromboplastina (Ferreira MS. Rev Soc Bras Med Trop 2003; 36(1): 81-96).
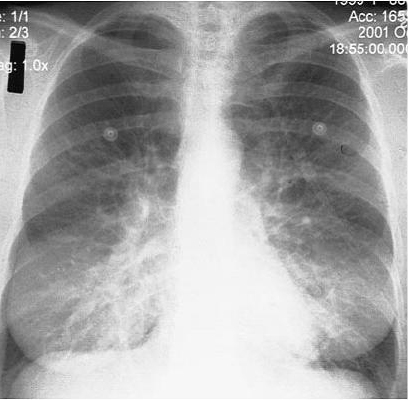
La fase cardiopulmonar se caracteriza por una insuficiencia respiratoria rápidamente progresiva. El paciente presenta tos y disnea progresiva, que evoluciona hasta necesitar ventilación mecánica y deficiencia respiratoria catastrófica, incluso durante el mismo día en que el paciente ingresa al servicio de urgencia. El mecanismo es un edema pulmonar no cardiogénico, mediado por alteraciones en la permeabilidad de la barrera alveolo-capilar. Los cambios radiológicos son rápidos y progresivos, desde infiltrados intersticiales difusos con signos de condensación bibasales (Fig. 3), hasta infiltrados mixtos, en el contexto de un paciente conectado a ventilación mecánica con PaFi menor de 60.
Figura 3. Radiografía póstero-anterior de tórax, paciente con hantavirus. Imágenes de condensación bibasales.
Otra característica de los pacientes en fase cardiopulmonar del SCPH es el compromiso hemodinámico: 50%-60% de los pacientes presentan, en el momento del ingreso, shock de tipo cardiogénico, que se caracteriza por resistencias vasculares elevadas y depresión miocárdica, con índice cardíaco menor de 2,5; el estado circulatorio de ese momento conduce a acidosis láctica. De 15 casos estudiados en Chile, la hipotensión y el shock estuvieron presentes en 72% de los pacientes y hubo shock refractario, definido como aquél que persiste por más de una hora, pese a la reanimación con volumen y fármacos vasoactivos, en 29% de los casos. La causa de muerte en esta fase es la disociación electromecánica y el paro en asistolía.
Las descripciones clásicas de la infección por hantavirus en Europa y Asia hablan de síndrome febril hemorrágico con nefropatía; en cambio, en América se habla de síndrome cardiopulmonar. Sin embargo, 64% de los pacientes estudiados por Riquelme y colaboradores (7), en el sur de Chile, presentaron algún grado de hemorragia: pulmonar, en sitios de punción, hematuria, petequias, gingivorragia, metrorragia, hemorragia subaracnoidea, etc. Existe una relación entre la gravedad del sangrado y la mortalidad, pero el grado de trombocitopenia no se correlaciona con la mortalidad ni con la sobrevida de los pacientes con SCPH. Al parecer, la coagulopatía no está dada sólo por la trombocitopenia, porque también se prolonga el TTPK (tiempo de tromboplastina parcial activado con kaolin) y el tiempo de protrombina. Por lo tanto, es probable que el síndrome o enfermedad por hantavirus no sea sólo el SCPH, ya que cuando se analizó a los pacientes hospitalizados en la Región Metropolitana, se observó que el compromiso pulmonar alcanzaba a 100% y el compromiso hemodinámico, a 76%, pero además, 86% de estos pacientes presentaba compromiso de la coagulación y 80%, compromiso renal.
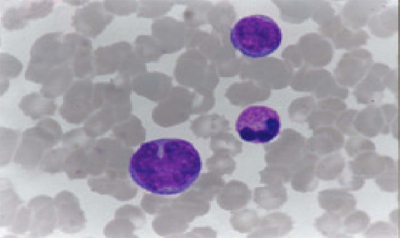
El hemograma presenta resultados de laboratorio característicos en la enfermedad por hantavirus y el SCPH. Básicamente, se encuentran cinco elementos: trombocitopenia, habitualmente bajo 100.000/mm3; leucocitosis; desviación a izquierda intensa, con mielocitos mayor de 10%; hemoconcentración; y la presencia de inmunoblastos (linfocitos atípicos) mayor de 10% (Fig. 4). La presencia de 4 de estos 5 elementos en el hemograma tiene una sensibilidad de 96% y una especificidad de 99%. El único parámetro que se altera en la fase prodrómica, en los primeros dos a seis días, son las plaquetas.
Figura 4. Linfocitos atípicos o inmunoblastos.
En el grupo de pacientes estudiados por Riquelme (7), la mediana de hematocrito fue de 49,8%, con un mínimo de 39% y un máximo de 69%. El mecanismo de este fenómeno es la alteración de la membrana capilar, con salida rápida de líquido hacia el intersticio. Los pacientes se deshidratan gravemente, pero se hidratan los pulmones. En estos pacientes se produjo leucocitosis mayor de 10.000/mm3, aunque también puede haber leucopenia; insuficiencia renal, con creatinina media de 1,38 mg/dl, y algún grado de disfunción en las pruebas de coagulación y las pruebas hepáticas. La PaFi de ingreso de este grupo de pacientes fue siempre baja: de todos los pacientes estudiados por SCPH, el mínimo fue de 32 y el máximo 131 (la PaFi normal es de 400).
La única manera de confirmar el diagnóstico es mediante la determinación de IgG e IgM para hantavirus, por ELISA. La IgM se eleva durante el período de estado o de enfermedad propiamente tal y la IgG se eleva después del período de estado, pero persiste elevada en el tiempo, lo que permite realizar estudios retrospectivos en pacientes con SCPH leve. La reacción en cadena de polimerasa (PCR) está aprobada en la actualidad y sirve como método rápido, porque es instantáneo; además, cuando no se dispone de muestras sanguíneas, se pueden realizar en biopsias.
Cuando ingresa un paciente con hantavirus, los principales factores que determinan el pronóstico son: APACHE, PaFi, acidosis, insuficiencia renal, coagulopatía, frecuencia respiratoria y frecuencia cardíaca. El puntaje APACHE fue utilizado como predictor de mortalidad en el estudio de Riquelme (7), en el cual no falleció ningún paciente con APACHE menor de 12 y, en cambio, murieron 10 de 15 pacientes con APACHE mayor de 12. Lo más importante es la sospecha diagnóstica, que debe surgir ante todo paciente que vive o ha visitado un área rural durante la primavera o el verano, con el antecedente de exposición a roedores o presencia de roedores, y que presenta un cuadro clínico sugerente.
No existe un tratamiento específico para el SCPH. Se aplican técnicas de aislamiento estándar y respiratorio y se traslada al paciente en forma urgente a un hospital con UCI, para recibir soporte ventilatorio, soporte hemodinámico y, eventualmente, oxigenación con membrana extracorpórea (ECMO). No está clara la utilidad de la administración de corticoides o ribavirina.
El soporte ventilatorio en enfermedad por hantavirus es una ventilación protectora, la misma que se otorgaría al paciente con neumonía grave; se debe considerar que la insuficiencia respiratoria es grave y plantear el uso de circulación extracorpórea precozmente, si está disponible.
El manejo hemodinámico debe considerar el hecho de que se trata de un shock cardiogénico, con resistencias elevadas y mala performance o trabajo ventricular; por lo tanto, el tratamiento dependerá del estado hemodinámico en que ingrese el paciente, si bien 50 a 60% de los casos ingresan en shock.
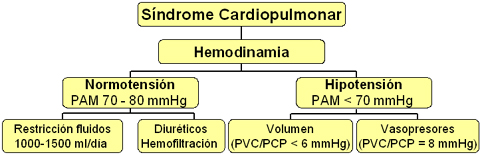
Si el paciente ingresa normotenso, se restringen los fluidos (1000 a 1500 ml/día), porque la permeabilidad vascular está muy alterada y la administración excesiva de líquidos puede ser perjudicial, a diferencia de lo que ocurre en el shock séptico, que es el diagnóstico diferencial más importante. En un paciente que es capaz de orinar, si no se consiguen balances hídricos neutros, está en insuficiencia respiratoria y se desea obtener un balance hídrico negativo, porque se ha agotado la posibilidad de aumentar el aporte del ventilador, en términos de fracción inspirada de oxígeno, se debe administrar diuréticos. Si el paciente tiene insuficiencia renal o no orina, se debe considerar precozmente la hemofiltración.
Si el paciente está hipotenso y tiene una presión capilar o venosa menor de 6 mmHg, se debe administrar volumen en forma cuidadosa, especialmente coloides o cristaloides, en bolos de 200 a 250 ml, con la precaución de medir las presiones de enclavamiento pulmonar antes y después de la administración de volumen; si el paciente tiene una presión de enclavamiento pulmonar mayor o igual a 8 mm Hg, no se debe administrar líquidos, sino fármacos vasopresores, ya que esto indica que el paciente está en shock (Fig. 5).
Figura 5. Manejo hemodinámico del síndrome cardiopulmonar por hantavirus en paciente sin ventilación mecánica.
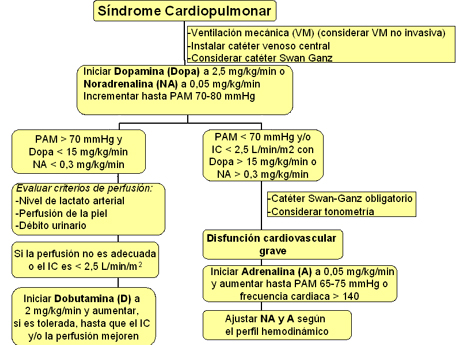
Si el paciente ya está en ventilación mecánica, se debe apoyar la hemodinamia con medicamentos vasopresores; la droga de elección es la dopamina, por su efecto beta-adrenérgico, con la noradrenalina como segunda opción. Según los resultados, la evolución del paciente y los criterios de perfusión, se puede agregar un medicamento inotrópico, como la dobutamina, considerando que el shock de estos pacientes es de tipo cardiogénico. En casos catastróficos, en que, pese al tratamiento, el paciente continúa en shock y con presiones muy bajas, o sea, tiene una disfunción cardíaca grave, se debe considerar el uso de adrenalina (Fig. 6).
Figura 6. Manejo hemodinámico del síndrome cardiopulmonar por hantavirus, en paciente con ventilación mecánica.
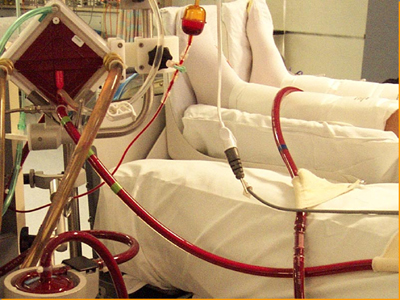
El uso de circulación extracorpórea se encuentra disponible en el Hospital Clínico de la Universidad de Chile, la técnica está implementada y se ha utilizado en una o dos oportunidades (Fig. 7). Los criterios para conectar a un paciente a ECMO están claramente establecidos: presencia de PaFi menor de 50 con FiO2 de 100; persistencia de acidosis láctica; y que el paciente no mejore en las primeras 48 horas, a pesar de estar con la terapia completa. Aunque no se ha demostrado el beneficio de la ECMO en neumonía ni en enfermedad por hantavirus, su uso se justifica por el hecho de que se trata de un paciente joven, probablemente sin comorbilidad, en el cual el período de SCPH durará entre cuatro y seis días y tiene todas las probabilidades de evolucionar favorablemente, si supera esta fase.
Figura 7. Paciente en oxigenación con membrana extracorpórea (ECMO).
El tratamiento con metilprednisolona es controvertido. En un estudio de Riquelme (7), 10 de 25 pacientes recibieron metilprednisolona; la mortalidad fue 20% entre quienes la recibieron, versus 53% entre quienes no la recibieron, pero el p-value no fue significativo, debido al tamaño reducido de la muestra. En otro estudio (5) se midió la carga viral en plasma, tráquea y orina en pacientes que recibieron y no recibieron metilprednisolona y no se encontraron diferencias significativas. En la Universidad del Desarrollo, en Chile, y la Universidad de Nuevo México, en Estados Unidos, hay un estudio en curso, dirigido por Vial, en fase II, aleatorio, controlado, doble ciego, que pretende reunir a 60 pacientes. En la actualidad se han reclutado 34 pacientes con SCPH, que han recibido metilprednisolona.
La ribavirina endovenosa fue utilizada primero por Huggins y colaboradores (8), que en 1991 describieron una respuesta positiva y mejoría de la sobrevida en 7 veces, en pacientes con hantavirus de tipo asiático; sin embargo, un estudio de Mertz (9), publicado en 2004, se tuvo que suspender porque no se demostró un efecto benéfico y se concluyó que el antiviral era bien tolerado, pero ineficaz, en pacientes con SCPH. Un último informe, publicado en Respir Care Clin N Am en 2005 (10), demostró que la administración de ribavirina se asocia con anemia hemolítica, supresión de la hematopoyesis y pancreatitis. Por lo tanto, la evidencia actual no recomienda su uso.
Los factores de riesgo de enfermedad por hantavirus son claros, identificables y prevenibles: época del año, exposición y tipo de pacientes. Hay diferentes formas de presentación clínica: se puede presentar sólo con manifestaciones de tipo influenza (prodrómicas), lo que ocurre en menos de 10% de los casos; como SCPH leve, en pacientes que no necesitan ventilación mecánica, presentan infiltrados intersticiales difusos, sin compromiso hemodinámico; o como SCPH moderado a grave, con compromiso hemodinámico y shock.
El diagnóstico diferencial es amplio en las fases iniciales, por lo que la sospecha clínica es fundamental. Existen manifestaciones hemorrágicas precoces y graves. Tal vez en América Latina ya no se debería llamar SCPH, sino síndrome hemorragíparo cardiopulmonar con compromiso renal, ya que no es infrecuente el compromiso renal.
Dr. Latorre: El contagio persona a persona es muy raro. ¿Eso se extrapola al cuidado del médico tratante del paciente?
Dr. Sequeiros: Castillo publicó un estudio que abarcó a 106 parientes de personas infectadas y a 109 trabajadores de salud. Estos trabajadores de salud eran personas en contacto directo con el paciente: lo aspiraban, aseaban y realizaban procedimientos; y en estas personas, la probabilidad de transmisión de virus Andes, al medir IgG, fue cero, no así en los parientes, lo que se explica por la exposición ambiental al mismo virus.
Dr. Latorre: ¿Qué cuidados debe tener el personal al respecto?
Dr. Sequeiros: Precauciones respiratorias y de contacto.
Dr. Cortés: Nosotros hicimos, hace años, una exposición sobre hantavirus que no difiere mucho de la realizada ahora, salvo en el número de casos. En esa ocasión le dimos mucha importancia al hemograma como recurso diagnóstico y a la técnica para diferenciar inmunoblastos. En esto se capacita a la gente de regiones, tecnólogos y trabajadores de laboratorios, con el fin de hacer el diagnóstico en forma precoz.¿Qué hace una persona que se enfrenta a un paciente como éste? ¿Adónde envía la muestra?
Dr. Sequeiros: En Chile, el ISP es la entidad que crea las normas y controles. La Universidad Austral de Valdivia y la Universidad del Desarrollo, mediante el convenio con la Clínica Alemana, poseen la técnica para realizar ELISA de determinación de hantavirus.
Dr. Cortés: ¿Qué haces con el paciente: se hospitaliza, se observa, se envía a su casa?
Dr. Sequeiros: El paciente debe quedarse en el servicio de urgencia y ser trasladado inmediatamente a un lugar que tenga UCI, porque 70% de los casos fallecen en las primeras 24 horas, muchos de ellos en el servicio de urgencia, por insuficiencia respiratoria catastrófica progresiva. El paciente consulta respirando bien, pero pronto necesita naricera y mascarilla y muere en urgencia.
Pregunta: ¿Cuál es el mecanismo de la trombocitopenia?
Dr. Sequeiros: Se desconoce el mecanismo inicial. Los resultados de varios estudios han llevado a planetar que las citoquinas, especialmente la interleuquina 8, inhibirían la trombopoyetina y que éste sería uno de los mecanismos directos que participan en la trombocitopenia grave de estos pacientes. También hay pérdidas por consumo, ya que presentan hemorragias considerables.
Pregunta: ¿Cómo es la inmunidad posterior del paciente que se enferma? Si mejora y vuelve a exponerse, ¿qué sucede?
Dr. Sequeiros: No se han descrito casos. La inmunidad pasiva es un tema en estudio. En su estudio, Bharadwaj (2) observó que los pacientes que desarrollaban una enfermedad grave tenían menor cantidad de anticuerpos IgG que los que presentaban SCPH leve. Es decir, los individuos crónicamente expuestos desarrollan una enfermedad más leve, pero no se han descrito casos de enfermedad de novo.








 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
 Expositor:
Luis Alberto Sequeiros P.[1]
Expositor:
Luis Alberto Sequeiros P.[1]

Citación: Sequeiros LA. Hantavirus. Medwave 2006 May;6(4):e2495 doi: 10.5867/medwave.2006.04.2495
Fecha de publicación: 1/5/2006

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Castillo C, Villagra E, Sanhueza L, Ferres M, Mardones J, Mertz GJ. Prevalence of antibodies to hantavirus among family and health care worker contacts of persons with hantavirus cardiopulmonary syndrome: lack of evidence for nosocomial transmission of Andes virus to health care workers in Chile. Am J Trop Med Hyg. 2004 Mar;70(3):302-4. | PubMed |
Castillo C, Villagra E, Sanhueza L, Ferres M, Mardones J, Mertz GJ. Prevalence of antibodies to hantavirus among family and health care worker contacts of persons with hantavirus cardiopulmonary syndrome: lack of evidence for nosocomial transmission of Andes virus to health care workers in Chile. Am J Trop Med Hyg. 2004 Mar;70(3):302-4. | PubMed | Bharadwaj M, Nofchissey R, Goade D, Koster F, Hjelle B. Humoral immune responses in the hantavirus cardiopulmonary syndrome. J Infect Dis. 2000 Jul;182(1):43-8. Epub 2000 Jun 27. | CrossRef | PubMed |
Bharadwaj M, Nofchissey R, Goade D, Koster F, Hjelle B. Humoral immune responses in the hantavirus cardiopulmonary syndrome. J Infect Dis. 2000 Jul;182(1):43-8. Epub 2000 Jun 27. | CrossRef | PubMed | Castillo C, Naranjo J, Ossa G. Síndrome cardiopulmonar por hantavirus en 21 adultos en la IX Región de Chile. Rev Chil Infectol 2000; 17(3): 241-247. | Link |
Castillo C, Naranjo J, Ossa G. Síndrome cardiopulmonar por hantavirus en 21 adultos en la IX Región de Chile. Rev Chil Infectol 2000; 17(3): 241-247. | Link | Duchin JS, Koster FT, Peters CJ, Simpson GL, Tempest B, Zaki SR, et al. Hantavirus pulmonary syndrome: a clinical description of 17 patients with a newly recognized disease. The Hantavirus Study Group. N Engl J Med. 1994 Apr 7;330(14):949-55. | CrossRef | PubMed |
Duchin JS, Koster FT, Peters CJ, Simpson GL, Tempest B, Zaki SR, et al. Hantavirus pulmonary syndrome: a clinical description of 17 patients with a newly recognized disease. The Hantavirus Study Group. N Engl J Med. 1994 Apr 7;330(14):949-55. | CrossRef | PubMed | Vial PA, Valdivieso F, Mertz G, Castillo C, Belmar E, Delgado I, et al. Incubation period of hantavirus cardiopulmonary syndrome. Emerg Infect Dis. 2006 Aug;12(8 ):1271-3. | CrossRef | PubMed |
Vial PA, Valdivieso F, Mertz G, Castillo C, Belmar E, Delgado I, et al. Incubation period of hantavirus cardiopulmonary syndrome. Emerg Infect Dis. 2006 Aug;12(8 ):1271-3. | CrossRef | PubMed | Riquelme R, Riquelme M, Torres A, Rioseco ML, Vergara JA, Scholz L, et al. Hantavirus pulmonary syndrome, southern Chile. Emerg Infect Dis. 2003 Nov;9(11):1438-43. | PubMed |
Riquelme R, Riquelme M, Torres A, Rioseco ML, Vergara JA, Scholz L, et al. Hantavirus pulmonary syndrome, southern Chile. Emerg Infect Dis. 2003 Nov;9(11):1438-43. | PubMed | Huggins JW, Hsiang CM, Cosgriff TM, Guang MY, Smith JI, Wu ZO, et al. Prospective, double-blind, concurrent, placebo-controlled clinical trial of intravenous ribavirin therapy of hemorrhagic fever with renal syndrome. J Infect Dis. 1991 Dec;164(6):1119-27. | CrossRef | PubMed |
Huggins JW, Hsiang CM, Cosgriff TM, Guang MY, Smith JI, Wu ZO, et al. Prospective, double-blind, concurrent, placebo-controlled clinical trial of intravenous ribavirin therapy of hemorrhagic fever with renal syndrome. J Infect Dis. 1991 Dec;164(6):1119-27. | CrossRef | PubMed |