 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
A pesar de que se realice una historia clínica y examen físico adecuados, además de la evaluación con exámenes de laboratorio, en sólo 73% de los casos se llega al diagnóstico, es decir, en un tercio de ellos no se logra, por lo tanto, se debe considerar el diagnóstico clínico como presuntivo y es mejor confirmarlo. Por ejemplo, muchos pacientes llegan con diagnóstico de “probable exacerbación EPOC”, se tratan como tales mientras están hospitalizados y se le indica una espirometría ambulatoria, pero muchos de ellos nunca regresan y, por otra parte, cuando a los pacientes con diagnóstico de probable EPOC se les realiza una espirometría durante la hospitalización, suele resultar normal. Por lo tanto, es importante complementar con exámenes básicos de función pulmonar el diagnóstico presuntivo, o con exámenes dirigidos a lo que se sospecha.
A continuación se analiza el valor de distintos elementos:
Aparte de determinar si un paciente tiene disnea, es importante cuantificarla, para discriminar la severidad de la disnea entre distintos individuos y para evaluar los cambios de la disnea en un individuo determinado, especialmente en relación a la terapia, ya que no se puede inferir la magnitud de disnea de otros exámenes y, por otra parte, este síntoma tiene una relación muy importante con la calidad de vida.
Una forma simple de hacer esto es indagando cuándo se produce la disnea o cuántas cuadras puede caminar, de manera de poder comparar su evolución en las consultas siguientes. Aparte de clasificar la disnea de manera general, se debe describir en cada consulta, para ver la mejoría, porque mejorías leves son importantes para los pacientes. Es importante destacar que la clasificación de la New York Heart Association (NYHA) para las disneas de origen cardíaco no se aplica a los pacientes con enfermedad respiratoria.
Es recomendable medir la disnea por medio de escalas, para discriminar su gravedad entre los distintos individuos. En los pacientes con enfermedad obstructiva, un VEF1 de 30%, por ejemplo, no indica que va a tener una disnea de una magnitud determinada, ni que un VEF1 más bajo se asocie a una disnea distinta; se ha demostrado que no existe una relación estrecha entre ambos parámetro, como tampoco existe una relación estrecha entre disnea y difusión de monóxido de carbono.
Por lo tanto, para poder discriminar la gravedad de la disnea entre los distintos individuos y para poder evaluar los cambios de la disnea en un individuo determinado en forma progresiva, debido al impacto de la terapia, se utilizan escalas de disnea, para ver si mejora o empeora, porque no se puede inferir la magnitud de la disnea a partir de otros exámenes. Este síntoma es la causa más frecuente de consulta de los pacientes respiratorios crónicos, y es el que más afecta su calidad de vida.
Existen dos tipos de escalas de medición. El primero son las indirectas, que miden el impacto de la disnea en las actividades de la vida diaria, que es lo que más le importa al paciente (entre ellas están la del MRC (Medical Research Council); el Diagrama de Costo de Oxígeno; la escala de Mahler (BDI/TDI), que es multidimensional; y los cuestionarios de calidad de vida, como el SQRC). El segundo tipo son las directas, que miden la tolerancia al ejercicio y son más objetivas, porque se le solicita al paciente que realice un ejercicio y se cuantifica la disnea (entre ellas están la escala de Borg y la escala visual análoga (VAS).
La escala MRC (Medical Research Council), dentro de las escalas indirectas, se utilizó inicialmente para estudiar la neumoconiosis, pero después se ha ido modificando. De origen inglés, tiene valor pronóstico, porque en la actualidad se ha visto que el índice BODE es mejor para predecir el riesgo de morir que el VEF1 solo, en la EPOC, y el BODE incorpora la escala MRC, la caminata de 6 minutos, el VEF1, el estado nutricional y la edad.
Antes, la escala MRC iba de 1 a 5, pero ahora la ATS recomienda una escala que está incorporada en el BODE y que mide principalmente la magnitud de la tarea que le produce disnea al paciente. Los grados son:
Lo malo de esta escala es que mide una sola dimensión, que es la magnitud de la tarea que produce la disnea, y sería poco sensible para detectar cambios, porque tal vez muchos pacientes podrían sentirse un poco mejor sin cambiar de nivel en la escala. Sin embargo, se ha demostrado que estos índices, incluso el BODE, de todas maneras tienen impacto.
Por otra parte, se ha demostrado que no existe buena correlación entre el VEF1 y esta escala. En un estudio realizado en pacientes con EPOC, que se clasificaron según esta escala, el grado 5 equivale al grado 4 actual y no hubo una correlación significativa entre el VEF1, como porcentaje del predicho, y la gravedad de la escala de disnea, aunque sí hubo correlación con la capacidad vital forzada, lo cual puede deberse a la hiperinsuflación pulmonar, porque a medida que ésta aumenta, el paciente se ve más limitado para tomar aire, por lo tanto, lograr eliminar menos aire, aunque la velocidad con que lo hacen, que se mide con el índice VEF1, no cambia tanto.
Los cuestionarios que relacionan la disnea con la calidad de vida, que son varios; algunos de ellos han establecido una correlación significativa con índices de ansiedad y depresión. Entre ellos están el SCRG (St. George’s Respiratory Questionnaire); el CRQ (Chronic Respiratory Questionnaire; el HAD (Hospital Anxiety and Depression score) y el FVC (Forced Vital Capacity).
El Diagrama de Costo de Oxígeno puede ser práctico para que el sujeto escoja solo, sin un encuestador, pero no ha sido totalmente validado, no se utiliza mucho y yo no tengo experiencia en su uso.
La escala de Mahler se desarrolló a partir de la escala MRC, ya que ésta tiene escasa sensibilidad y sólo mide una dimensión. En la escala de Mahler es más difícil conseguir la información y es más lenta, pero es más fina, porque tiene un índice basal y mide los cambios después de una intervención, por lo que se utiliza en investigación. Tiene 3 subescalas para evaluar la intensidad de la disnea:
Por ejemplo, en el caso de un compromiso funcional moderado, o grado 2, el paciente mantiene su trabajo y las horas de trabajo, pero ha abandonado completamente una de las tareas, o ha cambiado de trabajo por uno menos extenuante, porque su disnea interfiere con el trabajo. En el caso de un paciente grado 1, prácticamente deja de trabajar y corresponde a la peor clasificación.
La escala de Borg es la que más se utiliza. Los cardiólogos también la han incorporado en sus intervenciones y programas de rehabilitación, ya que es una forma directa de evaluar la disnea. Al paciente se le ofrece una escala en una cartilla y debe calificar con una nota su dificultad para respirar. Tiene la ventajas de que se ayuda con descripciones a los lados, lo que permite comparar mejor entre distintos pacientes, a diferencia de otras escalas.
La escala de Borg establece los siguientes grados de dificultad para respirar:
0 : NADA
1 : MUY POCO
2 : POCO
3 : REGULAR
4 : ALGO MARCADO
5 : MARCADO
6 :
7 : MUY MARCADO
8 :
9 : MUY MARCADO, CASI MAXIMO
10 : MAXIMO
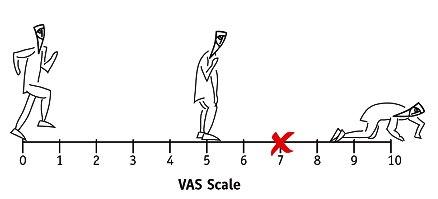
La escala VAS se ha utilizado mucho, porque es muy gráfica, pero la Borg tiene mejor correlación entre un sujeto y otro. Es muy buena para un paciente antes y después; al mismo paciente se le pregunta qué dificultad tiene en este momento, se le pide que le ponga nota y él mismo dibuja el asterisco donde cree que está. Tiene 10 cm de largo (Figura 1).
Figura 1. Escala VAS.
La caminata de 6 minutos se utiliza habitualmente para evaluar la disnea con el ejercicio, en protocolos de investigación, para evaluar la respuesta a una terapia, para clasificar a los pacientes con EPOC, para la evaluación de los candidatos a trasplante pulmonar y para evaluar los pacientes cardiópatas. Requiere de un pasillo largo, de 30 a 35 m y está todo estandarizado; incluso, algunas normas establecen que cada 1 minuto se le debe decir al paciente: “Buen trabajo, lo está haciendo bien”. Se le debe explicar todo al paciente y se le debe interrogar antes y después sobre la nota que le pone al cansancio que siente para respirar y sobre el malestar o cansancio que siente en las piernas; se le mide la saturación arterial y la frecuencia cardíaca y se le hace caminar. A los 6 minutos, aunque si el paciente no logra este tiempo se interrumpe antes, se registra la peor saturación y la nota que le puso a la disnea.
Se han desarrollado otras formas cuantitativas para evaluar el impacto de la disnea en la calidad de vida relacionada con la salud de los pacientes.
El cuestionario de Saint George, validado en España, es uno de los más utilizados y se caracteriza por ser auto administrado, aunque en nuestro servicio ha sido imposible hacerlo así, porque muchos pacientes tienen dificultades para responderlo solos debido a que se deben elegir alternativas y verdadero o falso, de manera que el médico se lo debe leer al paciente, tratando de no inducir las respuestas. Contestarlo demora alrededor de 20 minutos, consta de 76 preguntas y mide síntomas, actividad e impacto en la vida diaria.
El primer estudio en que se demostró su validez fue realizado en 1982, por Jones y también se encontró que no había correlación significativa con el VEF1, pero sí la hubo con la disnea de otras formas y con otros índices de ansiedad, depresión o impacto físico y psicosocial. En los pacientes que tenían una disnea progresiva, el cuestionario mostraba un aumento del puntaje de Saint George, en el cual, de 4 puntos para arriba se considera que tiene relevancia desde el punto de vista de deterioro (1).
La magnitud de los síntomas se evalúa en la pregunta 7: “Durante el último año ¿cuántos días a la semana fueron buenos? ", con respecto a los problemas respiratorios. Las posibilidades son:
En el cuestionario de Saint George se evalúa el impacto en las actividades con la pregunta 12, que enuncia las siguientes situaciones, en las que se debe optar por Verdadero o Falso:
Para determinar el impacto en la vida diaria aparece en el cuestionario: “A continuación, ¿podría marcar sólo una frase que usted crea que describe mejor cómo le afectan sus problemas respiratorios?" Y las alternativas son:
Esta última pregunta del cuestionario de Saint George es bastante gráfica sobre cómo afecta al paciente su enfermedad respiratoria crónica. Los pacientes optimistas tienden a tener mejor respuestas que los pesimistas, y a veces con el mismo VEF1.
Cuando persisten las dudas, se podría realizar el test de ejercicio cardiopulmonar, que permite evaluar la disnea que no se pudo identificar con los exámenes convencionales y la clínica. También se puede evaluar la magnitud de la disnea a través del consumo de oxígeno, del umbral láctico, etc., que en el hospital no está disponible.
Una vez que se identifica la enfermedad que causa la disnea, independientemente de los resultados del estudio funcional, se debe tratar dicha enfermedad según corresponda. Por ejemplo, es fundamental cumplir los objetivos planteados en pacientes con asma o cardiópatas; en el EPOC, la terapia broncodilatadora disminuye la disnea, aunque no modifique el VEF1. Además, existen tratamientos sintomáticos que están relacionados con los mecanismos fisiopatológicos, los que pueden ser atacados y controlados a través de distintas intervenciones.
Se recomienda orientar la terapia según los mecanismos fisiopatológicos. Muchas intervenciones están validadas y otras están en cuestionamiento o son parte de líneas de investigación. Por ejemplo, la terapia con oxígeno está muy normada en los pacientes con EPOC y se indica en ciertas condiciones como insuficiencia respiratoria crónica y cor pulmonale, debido a que disminuye la mortalidad; sin embargo, actualmente se están desarrollando varios protocolos. Si un paciente con EPOC tiene alteración del intercambio gaseoso con el ejercicio, éste le va a producir disnea, la que, a su vez, va a limitar su actividad física y va a conducir, a largo plazo, a un desentrenamiento o descondicionamiento; probablemente estos pacientes se beneficiarían, en cuanto a su disnea, si se les indicaran protocolos de oxigenoterapia con el ejercicio.
Se debe mejorar el aporte nutricional, porque los pacientes respiratorios crónicos, sobre todo los pacientes con EPOC, mientras más graves están, más alteraciones nutricionales tienen. Se supone que su musculatura está sometida a condiciones de intercambio gaseoso y factores metabólicos que son perjudiciales y a lo mejor se podría intervenir a este nivel. Hay protocolos al respecto, pero no existe nada muy concluyente sobre el impacto de la nutrición.
La terapia broncodilatadora, que es la piedra angular del tratamiento del EPOC, logra disminuir la información aferente, mejorando las condiciones ventilatorias e incluso el intercambio gaseoso, actuando a través de distintos mecanismos.
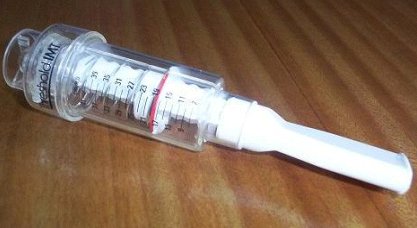
El entrenamiento de los músculos respiratorios (EMI) fue evaluado por nuestro equipo en un proyecto de investigación clínica titulado “Efecto del EMI sobre la función muscular, disnea, tolerancia al ejercicio y calidad de vida en pacientes con EPOC avanzada”. Como antecedentes para este estudio, el EMI era controvertido en EPOC, ya que el GOLD no lo considera en rehabilitación y las guías ACCP/AACVPR lo recomiendan “sólo en pacientes que persisten sintomáticos a pesar de una óptima terapia broncodilatadora”. El EMI se puede aplicar con distintas modalidades: hiperventilación isocápnica, cargas respiratorias inspiratorias o entrenamiento con válvula umbral. (Figura 2).
Figura 2. Válvula umbral.
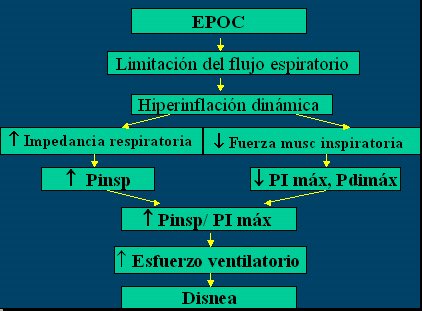
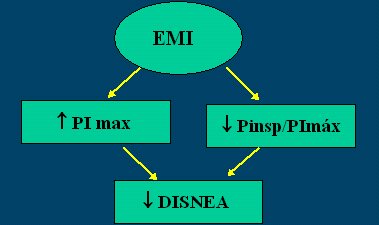
En la Figura 3 se resumen las alteraciones de la mecánica respiratoria propias de la EPOC y en la Figura 4 se esquematiza el mecanismo de acción del EMI.
Figura 3. Mecánica respiratoria en EPOC.
Figura 4. Mecanismo de acción del EMI en EPOC.
La hipótesis del estudio era que el EMI produce mejoría clínica en pacientes con EPOC avanzada y que los los beneficios clinicos inducidos por el EMI se relacionan con la fuerza muscular inspiratoria y la hiperinflación pulmonar dinámica (cambio en patrón respiratorio). Para comprobar esto, se diseñó un estudio clínico aleatorio, controlado por placebo, doble ciego en 40 pacientes (20 por grupo), que recibieron EMI con válvula umbral. El período de estudio fue de 10 semanas, se hizo control semanal de PIMS y ajuste de carga en válvula umbral y se efectuó evaluación funcional y clínica al inicio y término de las 10 semanas.
Los resultados en cuanto a la disnea: el EMI se asoció a mejoría significativa de este síntoma en ambos grupos de pacientes. Después de 6 semanas el índice de transición de Mahler fue +2,7±1,8 puntos en los entrenados con una carga de 30%, y de +2,8±1,8 puntos en los entrenados con una carga de 10% de la PImax. Esto significa que después de EMI los pacientes pudieron reasumir alguna actividad que habían abandonado por disnea y además, realizar esfuerzos mayores y más rápidos sin disnea.
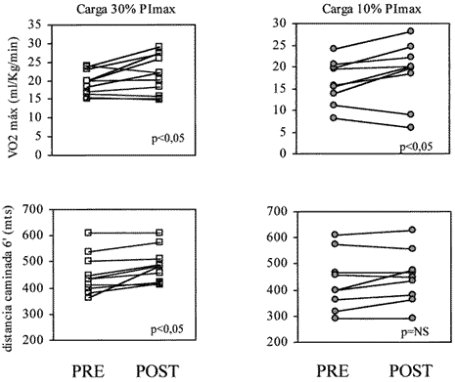
En cuanto a capacidad funcional, el VO2max mejoró significativamente con ambos protocolos de EMI. En los entrenados con carga de 30% de la PImax el VO2max subió desde 19±3 a 21,6±5 ml/Kg/min, p<0,05 y en los entrenados con carga de 10% de la PImax, subió desde 16±5 a 18,6±7 ml/Kg/min, p<0,05. La distancia recorrida en 6 min, en cambio, mejoró significativamente sólo entre los pacientes entrenados con carga de 30% de la Pimax, quienes aumentaron la DR6 desde 451±78 a 486±68 metros (p<0,05). En los pacientes entrenados con carga baja, la DR6 no se modificó (430±110 a 449±102 m).
Los cambios individuales del VO2max y de la DR6, según protocolo de entrenamiento, se grafican en la Figura 5.
Figura 5. Valores individuales del V02max y distancia caminada en 6’, antes y después del entrenamiento, según carga utilizada.
Con ninguno de los protocolos de EMI se observaron cambios en la respuesta ventilatoria frente al ejercicio evaluada por la pendiente de la relación VE/VCO2.
En lo que se refiere a función de los músculos inspiratorios, en los pacientes entrenados con carga de 30% de la PImax se observó un aumento tanto de la fuerza muscular como de la resistencia a la fatiga de los músculos inspiratorios. En estos pacientes la PImax aumentó desde 78±22 a 99±22 cmH2O (p<0,01), la PIMS desde 63±18 a 90±22 cmH2O (p<0,01) y la CMS desde 120±67 a 195±47 grs (p<0,01). En los entrenados con carga baja los cambios fueron comparativamente menores (p<0,05), pero también alcanzaron significación. El incremento en la distancia caminada en 6minutos, que experimentaron los pacientes de ambos grupos, se correlacionó con los cambios de la PImax (r=0,66, p<0,01) y de la PIMs (r=0,588, p<0,05). El aumento del VO2max, en cambio, no se correlacionó con la mejoría de la función de los músculos respiratorios.
Con ninguno de los protocolos de entrenamiento se demostraron cambios en la función ventricular, índices de congestión, índices de perfusión o actividad neurohumoral.
El hallazgo más importante de este estudio es que el EMI en pacientes con ICC se asocia a una mejoría significativa de la función de los músculos inspiratorios, disminución de la disnea y aumento de la capacidad funcional. Estos resultados son similares a los comunicados previamente en otros estudios.
Para terminar, Marguerite Yourcenar recopila los pensamientos de Adriano cuando se siente aliviado de sus dolencias: “Me hubiera gustado la profesión de médico; su espíritu no difiere en esencia del que traté de aplicar a mi oficio de emperador”. “Tengo la suerte de ser el mejor atendido por los médicos”. “Hermógenes acabó por diagnosticar un comienzo de hidropesía del corazón”. “Mis amigos se maravillaban de un restablecimeinto al parecer tan completo”.
Estos pensamientos son totalmente opuestos a los que expresa cuando la enfermedad ha avanzado: “Los medicamentos ya no actúan”. “No me enojo ya con los médicos; sus tontos remedios me han condenado, pero nosotros tenemos la culpa de su presunción y su hipócrita pedantería…”





 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
 Expositora:
Laura Mendoza I.[1]
Expositora:
Laura Mendoza I.[1]

Citación: Mendoza L. Study of patients with dyspnea II: clinical evaluation and laboratory. Medwave 2005 Nov;5(10):e2533 doi: 10.5867/medwave.2005.10.2533
Fecha de publicación: 1/11/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Jones PW, Quirk FH, Baveystock CM, Littlejohns P. A self-complete measure of health status for chronic airflow limitation. The St. George's Respiratory Questionnaire. Am Rev Respir Dis. 1992 Jun;145(6):1321-7. | PubMed |
Jones PW, Quirk FH, Baveystock CM, Littlejohns P. A self-complete measure of health status for chronic airflow limitation. The St. George's Respiratory Questionnaire. Am Rev Respir Dis. 1992 Jun;145(6):1321-7. | PubMed | Martínez A, Lisboa C, Jalil J, Muñoz V, Díaz O, Casanegra P, et al. Entrenamiento selectivo de los músculos respiratorios en pacientes con insuficiencia cardíaca crónica. Rev Med Chil. 2001 Feb;129(2):133-9. | PubMed |
Martínez A, Lisboa C, Jalil J, Muñoz V, Díaz O, Casanegra P, et al. Entrenamiento selectivo de los músculos respiratorios en pacientes con insuficiencia cardíaca crónica. Rev Med Chil. 2001 Feb;129(2):133-9. | PubMed |