La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
El tema de las dislipidemias comprende gran parte de las especialidades de la medicina y ha ido evolucionando rápidamente en los treinta últimos años. A continuación revisaremos aspectos básicos y fisiopatológicos, para luego dar un enfoque más práctico sobre el tratamiento de estos pacientes.
La isquemia es el gran asesino de la época actual; a pesar de que en los países desarrollados ya han logrado disminuir la prevalencia de enfermedad cardiovascular; la mortalidad y las complicaciones por esta causa siguen elevadas, de manera que es importante conocer los factores de riesgo cardiovascular, los que se pueden clasificar en modificables, no modificables y emergentes.
Los factores de riesgo no modificables son edad avanzada, sexo masculino, problemas cardiovasculares, historia familiar y personalidad tipo A, y es poco o nada lo que se puede hacer para cambiarlos.
Sobre los factores de riesgo modificables, en cambio, se puede intervenir. Entre ellos, la dislipidemia es uno de los más importantes, ya que representa 50% del riesgo cardiovascular; por lo tanto, corregir el trastorno lipídico en un paciente que ha tenido una patología cardiovascular es muy importante. Otros factores modificables son tabaquismo, sedentarismo, obesidad, hipertensión y diabetes.
Entre los factores de riesgo emergentes están: fibrinógeno, homocisteína, déficit de antioxidantes, C. Pneumoniae y PCR muy sensible. En nuestro hospital se ha estudiado el papel de la homocisteína en pacientes diabéticos y se ha encontrado una relación clara entre las complicaciones cardiovasculares de la diabetes y los niveles de homocisteína; y en el último tiempo se ha dado mucha importancia a la PCR como factor predictor de infarto al miocardio, por lo que hay que considerar este hecho.
El estudio de Framingham, que es uno de los estudios más serios en el ámbito cardiovascular, permitió desarrollar tablas para asignar un puntaje a los distintos factores de riesgo (edad, nivel de colesterol, tabaquismo, HDL, presión arterial sistólica); sumando estos puntajes se obtiene el riesgo de episodio cardiovascular en los diez años próximos. Cuando es superior a 20 puntos se multiplica varias veces el riesgo de sufrir un infarto, en mujeres y hombres (NCEP-ATP III. JAMA 2001; 285: 2486).
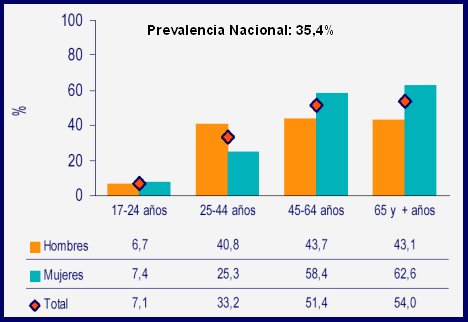
En escala nacional, existe un estudio publicado por el Ministerio de Salud en el que se describe una prevalencia nacional de hipercolesterolemia de 35,4%; el problema va aumentando con la edad, sobre todo pasados los 40 años, y se observa en ambos sexos, aunque en los hombres se presentaría a más temprana edad que en las mujeres; en ellas, la prevalencia aumenta especialmente sobre los 45 años (véase Figura 1).
Figura 1. Hipercolesterolemia en Chile: Encuesta Nacional de Salud – MINSAL, 2004.
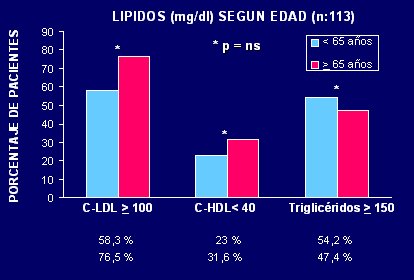
En pacientes diabéticos, los trastornos lipídicos son importantes. En nuestro policlínico hemos cuantificado este aspecto y se observa que los niveles de colesterol LDL alcanzan un porcentaje superior a 60% en personas mayores y menores de 65 años. Los niveles bajos de colesterol HDL son menos frecuentes. La hipertrigliceridemia que, según la literatura, corresponde al trastorno lipídico de mayor prevalencia en pacientes diabéticos, está presente en 50% a 60% de la población, independiente de la edad (véase Figura 2).
Figura 2. Dislipidemia en pacientes diabéticos del Hospital Clínico U. de Chile (Lahsen y cols., XV Congreso Endocrinología 2004).
El desarrollo de la biología molecular ha permitido conocer nuevos aspectos que regulan el metabolismo lipídico, a un nivel genético molecular.
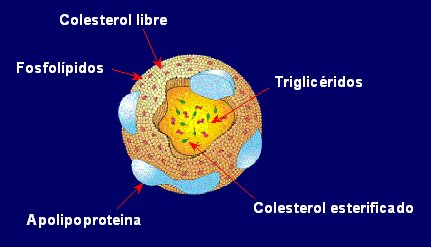
En la figura 3 se puede ver que la lipoproteína es una estructura esférica compuesta por un núcleo, donde están los triglicéridos y el colesterol esterificado, y una corteza, donde están los fosfolípidos, el colesterol libre y las distintas apolipoproteínas. Esta esfera es un invento de la naturaleza para transportar sustancias apolares en un medio polar, lo que permite que este transporte sea tan fluido y tan importante. El hecho de que las partículas sean esféricas determina un intercambio con membranas mucho más intenso que en el caso de las lipoproteínas.
Figura 3. Estructura de las lipoproteínas.
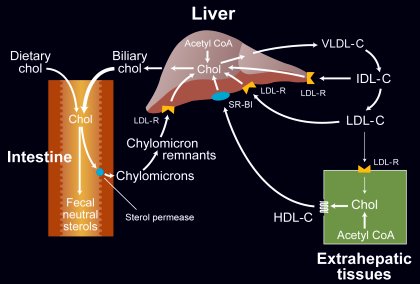
Los lípidos provenientes de la dieta son degradados por las enzimas en el intestino; posteriormente, la célula intestinal los absorbe, pasan por los conductos quilíferos y dan origen a los quilomicrones, moléculas esféricas de gran tamaño (sobre 1000 A) que el organismo depura rápidamente mediante la acción de la lipoproteinlipasa, sistema enzimático sumamente activo, ubicado en los capilares de la musculatura y el tejido adiposo, que degrada y remueve los ácidos grasos, los que se constituyen en fuente de energía para el músculo y otras células.
Un receptor específico hepático, que es muy similar al receptor de LDL, capta los remanentes de los quilomicrones. Las sustancias incluidas dentro del remanente de quilomicrón se degradan a nivel hepático y se sintetizan las VLDL (lipoproteínas de muy baja densidad), ricas en triglicéridos. Este proceso depende de la actividad y cantidad de insulina, y del estado metabólico del individuo. La síntesis de VLDL produce lipoproteínas que son degradadas por la lipasa hepática, muy similar a la lipoproteinlipasa, que las convierte en lipoproteínas de densidad intermedia y, por último, dan origen a las lipoproteínas de baja densidad (LDL), principales causantes o determinantes de la aterosclerosis.
Curiosamente, loa macrófagos endoteliales no captan las LDL en forma natural, sino una vez que están oxidadas, acetiladas y glicosiladas. Hay estudios extraordinariamente interesantes en los que se demuestra que, al cultivar LDL naturales con fibroblastos en ratas, aquéllos sólo captan la LDL cuando está modificada. Capta las LDL un receptor ubicado en todas las células, incluso las hepáticas; así, el colesterol retorna hacia el hígado y llega a las células. El colesterol intracelular compite con la síntesis de colesterol y el colesterol libre es captado por HDL, que lo lleva al hígado y traslada otras lipoproteínas, con lo que el colesterol libre es excretado del organismo. Por lo tanto, el sistema HDL es muy útil para eliminar colesterol libre y pasarlo a un sistema que permita excretarlo. Lo descrito se ilustra en la figura 4.
Figura 4. Metabolismo de las lipoproteínas.
En cuanto al papel de las LDL en el proceso aterogénico, inicialmente ocurre un daño endotelial; en este momento se debate este aspecto, ya que se ha planteado que el daño endotelial no sería necesario y bastaría exclusivamente un cierto incremento o replicación de las células endoteliales. Habría una alteración del tono vascular y una recolección de monocitos y macrófagos, los que aumentan la captación de LDL mediante un receptor (uno o más) scavenger. Este fenómeno induce factores de crecimiento que aumentan la agregación plaquetaria y se forman anticuerpos contra LDL oxidado, los que incrementan el proceso aterogénico y el tamaño de la placa.
En términos clínicos, las dislipidemias se pueden clasificar en primarias o secundarias, y en aisladas o combinadas.
El aumento de los niveles de LDL, que es la dislipidemia más característica, ocurre en dos entidades: la hipercolesterolemia familiar y el defecto de la Apo B-100, ambas de frecuencia 1/500. La primera es una patología muy grave, que en su forma homocigota puede determinar que un individuo nazca con niveles de 400 a 500 mg/dl de colesterol y que tenga un infarto agudo al miocardio a los 15 años de edad. La forma heterocigota se encuentra en 1% a 2% de los pacientes menores de 60 años que presentan un infarto. La Apo B defectuosa, por su parte, se debe a una mutación en el gen de la Apo B, que impide el normal acoplamiento de LDL a su receptor celular.
El aumento de lipoproteína A es una patología mucho más rara, que se encuentra en infartados jóvenes. En ellos, la lipoproteína A, en una combinación con Apo A, molécula parecida al plasminógeno, se une a LDL y forma una macromolécula. Es importante saber, desde el punto de vista clínico, que se puede tener niveles normales de lípidos y sin embargo tener un aumento de la lipoproteína A, que es aterogénica y riesgosa. El tratamiento no es igual que en las dislipidemias, sino que responde exclusivamente a los derivados de la niacina o del ácido nicotínico.
El aumento de triglicéridos y LDL se ve en la hiperlipidemia combinada familiar, patología bastante más frecuente, de causa no bien conocida; se cree que tiene alguna relación con la insulinorresistencia y con ciertas alteraciones de la lipoproteinlipasa, y en la disbetalipoproteinemia familiar o tipo 3; ésta es mucho más rara y se diagnostica exclusivamente con electroforesis de lipoproteínas, en la que da una banda ancha característica. Es una entidad muy agresiva desde el punto de vista cardiovascular.
El aumento de triglicéridos se encuentra en la hipertrigliceridemia familiar y puede obedecer a causas primarias y secundarias, como fármacos, hipotiroidismo y diabetes, que pueden combinarse con el defecto familiar.
La disminución de HDL se ve en enfermedades raras, algunas de las cuales pueden determinar riesgo aterogénico. Entre ellas están la mutación de Apo A1, que se ha descrito en distintas partes del mundo; incluso hay una mutación específica de Apo A1 descrita en Milán, que no se asocia a aterogénesis; el déficit de LCAT (Lecitín Acil Colesterol Transferasa) , que es la enzima que esterifica el colesterol en las HDL. Por lo tanto, al tener libre el colesterol, éste se deposita en las membranas del glóbulo rojo a nivel del glomérulo y causa anemias normocíticas y glomerulopatías que pueden llevar a la insuficiencia renal y, desde el punto de vista lipídico, a disminución de HDL.
La enfermedad de Tangier es más rara;, se da en países del Mediterráneo y vascos y, finalmente, la deficiencia de HDL familiar y los defectos de CETP también son infrecuentes y se deben al déficit de una proteína que permite el transporte de ésteres de colesterol, de lipoproteínas como la HDL a los remanentes de quilomicrones, lo que causa disminución de HDL (Davignon, Endocrinol Metab Clin N Am 1998; 27: 521).
El aumento de LDL se puede ver en el hipotiroidismo, en el cual la depuración de las LDL está disminuida. El hipotiroidismo se asociaría con mayor riesgo aterogénico, pero no con un aumento de la incidencia de infarto al miocardio, lo que se debería a una disminución del consumo de oxígeno miocárdico.
El síndrome nefrótico también causa un aumento de la LDL, por un mecanismo que no está bien determinado, aunque se cree que la disminución de la presión oncótica y la pérdida de ciertas proteínas tendría que ver con el aumento de la síntesis de LDL.
La anorexia nerviosa y la colestasia intrahepática también se asocian con incremento en los niveles de LDL, al igual que con fármacos como las tiazidas y las progestinas.
El aumento de VLDL y triglicéridos se observa en ciertas enfermedades y cuadros, como la diabetes, la insuficiencia renal crónica, el embarazo, el alcoholismo (el alcohol incrementa el NADH y de esa manera puede aumentar los niveles de VLDL), la obesidad, gamapatías monoclonales, resistencia insulínica, infecciones por VIH y sus tratamientos.
También se ve con el uso de fármacos como las tiazidas: mediante un incremento de la insulinorresistencia, pueden aumentar los niveles de VLDL y la LDL en forma secundaria. Las progestinas y estrógenos también pueden inducir algún tipo de dislipidemia, igual que los betabloqueadores, como el propanolol y los secuestrantes de ácidos biliares. Los glucocorticoides también se han asociado con un incremento de VLDL y LDL.
El efecto de los estrógenos ha sido muy estudiado y se ha demostrado que tienen una doble acción a nivel lipídico: por un lado aumentan los niveles de HDL, pero por otro pueden elevar las VLDL, especialmente en pacientes con hipertrigliceridemia familiar. Curiosamente, se puede usar estrógenos en la dislipidemia tipo 3, ya que, mediante la inhibición de los receptores de LDL, reducen los niveles de estas lipoproteínas.
La disminución de HDL se ve en cuadros como tabaquismo, sedentarismo y resistencia insulínica, y con el uso de fármacos como betabloqueadores, esteroides anabólicos (Green ML. Prim Care Clin Office Pract 2003; 30: 641).
En la historia, es importante preguntar por los antecedentes personales y familiares de dislipidemia, diabetes, diabetes gestacional, hipertensión arterial, síndrome de ovario poliquístico y enfermedad cardiovascular, y por los antecedentes personales de pancreatitis recurrente o de obesidad abdominal (si es que no aparece actualmente). Todos estos factores son importantes como causa de dislipidemias secundarias, o bien aumentan la incidencia de patologías relacionadas con la aterosclerosis.
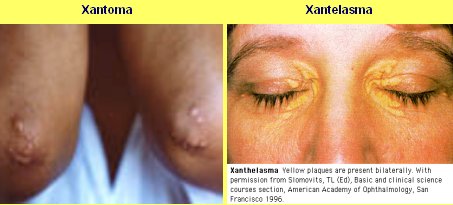
En el examen físico, se debe buscar xantomas, xantelasmas, arco senil y hepatomegalia; en el fondo de ojo, el signo de isquemia retinal habla de un aumento de los quilomicrones, que causan una coloración anaranjada muy característica. Los xantomas generalmente están en la superficie extensora; los de tipo tendinoso son característicos de la hipercolesterolemia familiar, tanto hetero como homocigota. Los de tipo eruptivo son más característicos de las hiperquilomicronemias y dislipidemias tipo 3, lo que podría orientar, pero lamentablemente los xantomas son muy raros y, en el caso del xantoma eruptivo, pueden confundirse con acné, porque la lesión mide 1 cm o menos y es de coloración roja, con centro más claro. Los xantelasmas son frecuentes y aunque en 20 a 30% de los casos no se deben a dislipidemia, su presencia plantea la necesidad de medir los lípidos. En la figura 5 se observa un ejemplo de ambas lesiones.
Figura 5. Xantomas y xantelasmas.
Los exámenes de elección son: colesterol total, HDL y triglicéridos con doce horas de ayuno. Esto último es necesario, porque con menos de doce horas se pueden observar falsas disminuciones de LDL, al activarse la proteína transportadora de ésteres de colesterol; y porque pueden aparecer quilomicrones que afectan globalmente las mediciones.
El nivel de colesterol LDL se mide con la fórmula = Co(ColLDL l total-(ColHDL+Tg/5), o sea, colesterol total menos colesterol HDL más los triglicéridos divididos por cinco, fórmula que es válida siempre y cuando los niveles de triglicéridos estén bajo 400 mg/dl. Si los niveles de triglicéridos están sobre 400, se debe observar el plasma decantado a 4º C, para detectar hiperquilomicronemia. El plasma lechoso se aprecia dejando que decante durante la noche y su presencia orienta fuertemente a hiperquilomicronemia; un aspecto algo lechoso puede aparecer en algunas hipertrigliceridemias muy graves, pero nunca es tan “cremoso”.
Junto con esto, es vital detectar patologías secundarias con T4 y TSH y buscando fármacos, diabetes, síndrome nefrótico, etc. Otros exámenes han quedado obsoletos, salvo para situaciones específicas; la electroforesis de proteínas se reserva para el caso de sospecha de dislipidemia tipo 3, porque es la única forma de diagnosticarla.
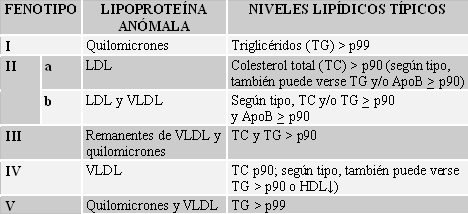
La antigua clasificación de Fredrickson, basada en la anormalidad de las lipoproteínas, aún es válida para hacer un diagnóstico preventivo de riesgo cardiovascular y para dar el tratamiento adecuado. Esta clasificación sigue siendo válida y debe utilizarse en familias con trastornos lipídicos y en pacientes con los lípidos muy elevados. Comprende seis fenotipos, cuyo detalle se aprecia en la Tabla I.
Tabla I. Clasificación de Fredrickson de los trastornos lipídicos (adaptada de Fredrickson DS, Ann Intern Med 1971; 75: 471).
La síntesis de colesterol se inhibe con la HMG CoA reductasa, lo que disminuye el colesterol intracelular y aumenta los receptores de LDL. Así lo describieron Joseph Goldstein y Michael Brown, ganadores del Premio Nobel por sus descubrimientos relativos a la regulación del metabolismo del colesterol. En la medida en que baja el colesterol intracelular, aumenta la captación de LDL y bajan los niveles plasmáticos de LDL.
Las estatinas afectan la síntesis de colesterol, tanto en las células como en el hígado, lo que incrementa los receptores de quilomicrones, LDL e IDL. Este aumento de receptores elimina los remanentes de quilomicrones y los LDL a nivel celular. Existe además un paso enterohepático de colesterol hacia la vía biliar, se produce una reabsorción de colesterol a la vía biliar, por lo que, al disminuir la reabsorción de colesterol, éste se puede excretar. Con estatinas se logra disminuir el LDL en 18% a 55%, los triglicéridos en 7% a 30% y el colesterol HDL, mucho menos que con fibratos o derivados del ácido nicotínico.
Con fibratos disminuyen los niveles de triglicéridos y con derivados del ácido nicotínico disminuyen los triglicéridos y, en cierto grado, las LDL; los secuestrantes de ácidos biliares, como la colestiramina, se reservan para aumentos de LDL en casos muy especiales.
Por lo tanto, no todos los pacientes se benefician con estatinas; en un paciente con trigliceridemia es recomendable comenzar con fibratos, y si tiene lipoproteína A elevada, lo ideal es comenzar con derivados del ácido nicotínico.






 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
 Expositor:
Claudio Liberman[1]
Expositor:
Claudio Liberman[1]

Citación: Liberman C. Basic aspects of lipid metabolism. Medwave 2005 Abr;5(3):e2526 doi: 10.5867/medwave.2005.03.2526
Fecha de publicación: 1/4/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión