La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
Los objetivos de esta presentación son dar a conocer:
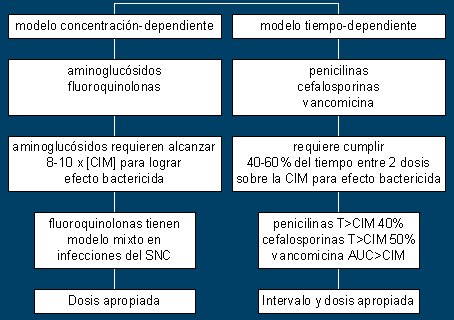
Lo que sigue se refiere a la relación íntima entre el antimicrobiano y la bacteria. Una cosa es la farmacocinética y otra cosa es cómo se ejerce el efecto sobre el microorganismo; esto último ocurre según dos grandes modelos vigentes: el modelo concentración dependiente y el modelo tiempo dependiente.
El primero establece que, para eliminar una bacteria, basta que se aseguren altas concentraciones, muy por sobre la CIM, en un solo impacto; es el modelo de las quinolonas y de los aminoglucósidos. Clínicamente, lo anterior significa que se debe respetar la dosis, cuidando de sobrepasar varias veces la CIM; en el caso de los aminoglucósidos debe ser 10 veces mayor.
Otra aplicación es el uso de monodosis diarias de aminoglucósidos. Como la toxicidad depende de la permanencia, pero el efecto depende de la presencia puntual, la administración en una sola dosis asegura el éxito y elimina la toxicidad, aunque los metaanálisis no han confirmado esto último; en todo caso, cuesta menos inyectar gentamicina una vez al día que tres veces al día. Amikacina y gentamicina son ejemplos de administración de una dosis diaria (aunque con ciertas restricciones).
El segundo modelo es tiempo dependiente; lo que importa es que la mayor parte del tiempo el antibiótico esté por encima de la CIM y de esa manera, por presencia continua, eliminará la bacteria. Aquí, el intervalo y la dosis son elementos críticos; por eso la penicilina se administra cada cuatro horas y no cada seis horas, pues los betalactámicos son ejemplos típicos de tiempo dependencia. No se necesita estar todo el tiempo entre las dosis arriba de la CIM, sino sólo un porcentaje del tiempo, como se señala en la Figura 1.
Figura 1. Modelos de acción bactericida.
Las dosis e intervalos dependerán del antimicrobiano; la penicilina tiene una vida muy corta, de media hora; en ese caso, el aumento de la dosis no aumenta la concentración ni el área bajo la curva, como ocurre cuando la vida media es más larga, como es el caso de la ceftriaxona, que se podría usar en dosis de 2 g cada 12 horas, como dosis de carga o en infecciones muy graves, por ejemplo en la meningitis; luego 1 g cada 12 horas, según la situación clínica.
Entre los compuestos bactericidas están la mayor parte de los más utilizados: penicilinas, cefalosporinas, glicopéptidos, quinolonas, aminoglucósidos, rifampicina, trimetropin-sulfametoxazol y metronidazol. Con respecto a los bacteriostáticos, los clásicos son la tetraciclina, el cloranfenicol, el linezolid y las sulfas; pero se usan poco, ya que los bactericidas los han desplazado.
Algunos antibióticos son a veces bactericidas y a veces bacteriostáticos. El cloramfenicol, clasificado como bacteriostático, tiene un efecto bactericida sobre los tres agentes de la meningitis y por eso se utilizaba, en pediatría, como tratamiento empírico inicial de las meningitis, lo que ya no se hace por la resistencia. La clindamicina se comporta como bactericida sobre agentes cutáneos y respiratorios, y como bacteriostático en sepsis abdominal, pero eso no importa, porque si se elimina el foco se acaba el problema.
El metronidazol es bactericida siempre y la eritromicina tiene un efecto variable, que depende de la especie, concentración e inóculo bacteriano (una concentración baja de eritromicina tendrá un efecto bacteriostático ante un inóculo grande). Por último, hay situaciones especiales en que participan los macrólidos y lincosamidas, como fenómenos variables.
Las causas por las que se combinan los antimicrobianos son las siguientes:
La combinación de antimicrobianos se debe plantear cuando hay que obtener sinergia, para mejorar el efecto; para ampliar el espectro antimicrobiano, como en infecciones abdominales, neumonías aspirativas e infecciones graves donde inicialmente no se conoce el agente, o prevenir la aparición de resistencia, como en el caso de la terapia antiretroviral en VIH y en el tratamiento antituberculosis. Entre todos, el motivo principal del uso combinado, en este momento, es la ampliación del espectro.
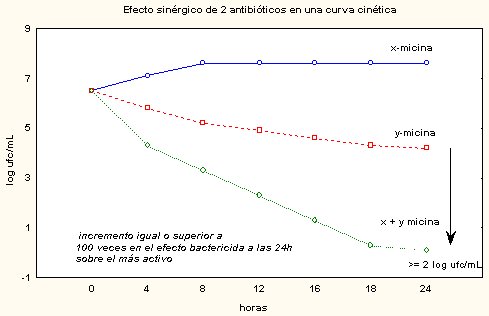
El efecto sinérgico se puede determinar mediante la confección de curvas cinéticas en laboratorio, seguida de comparación de las pendientes, para ver si aumentan. Si con la asociación se logra incrementar el efecto más de 100 veces, en relación con el efecto de cada fármaco por separado, se considera que existe un efecto sinérgico, el que se visualiza como la potenciación de la pendiente de la curva cinética. En la Figura 2 se observa que se presentan más de dos unidades logarítmicas de incremento, que es lo típico que ocurre con ampicilina y gentamicina para el enterococo. La sinergia es el incremento de esta actividad y el modelo clásico es el enterococo.
Figura 2. Efecto sinérgico de dos antibióticos en una curva cinética.
La combinación sinérgica es útil en ciertas infecciones graves, lo que no significa que haya que utilizarla siempre. La bacteremia por enterococo, la endocarditis por estreptococo (en la que se usa penicilina-gentamicina), la infección grave por Pseudomona aeruginosa (ceftazidima-amikacina) y la endocarditis por Staphylococo aureus, son ejemplos de casos en que los datos de laboratorio se traspasan al ambiente clínico para lograr un mejor efecto bactericida. En la Figura 2, en enterococo, con la gentamicina y la ampicilina se obtienen curvas más bien bacteriostáticas; pero en endocarditis interesa erradicar, por lo que una endocarditis por enterococo se trata con la combinación descrita; esta diferencia también es clínica.
Sin embargo, se debe recordar que las combinaciones de antimicrobianos son la antesala del uso irracional de los antibióticos; con frecuencia se hacen en forma indebida, lo que aumenta los costos, selecciona resistencia, incrementa la toxicidad y da una falsa sensación de seguridad, con menoscabo del criterio clínico.
Una interacción olvidada es la de los alimentos. Entre los medicamentos que se debe tomar con el estómago vacío, o sea, que no se debe administrar hasta dos horas después o una hora antes de comer, se cuentan la ampicilina (no la amoxicilina), cloxacilina, rifampicina, tetraciclina (no la doxiciclina), eritromicina y azitromicina (no la claritromicina); esto hay que saberlo de memoria. Muchos creen que hay que administrar los medicamentos junto con los alimentos para disminuir los efectos adversos y mejorar la tolerancia, pero, en realidad, se producen subconcentraciones y fracaso de tratamientos; se deben evitar con alimentos, para tener una buena biodisponibilidad, asegurar la absorción y obtener niveles plasmáticos adecuados, no para mejorar la tolerancia.
Los antimicrobianos que obligatoriamente hay que tomar con alimentos son cefuroxima (Curocef), nitrofurantoína e itraconazol. Es importante recordar que el alcohol tiene, como problemas potenciales, el efecto antabús con metronidazol y la inducción del sistema microsomal, por lo que puede causar la metabolización más rápida de algunos antibióticos que pasan por el hígado, no así los que sólo se excretan por vía renal.
Un buen ejercicio es pensar en el caso de un paciente que recibe tratamiento con levofloxacino oral (o ciprofloxacino) por una infección urinaria y que utiliza tabletas antiácidas, sulfato ferroso por una anemia ferropriva, calcio para la osteoporosis, multivitamínicos y famotidina. ¿Cuáles deben ser contraindicados? Esta situación es frecuente cuando se prescribe antimicrobianos.
Las quinolonas se contraponen con los quelantes. Un medicamento que contenga cationes bivalentes en tabletas, no como alimentos, impedirá la absorción de las quinolonas; antes de recetarlas, se debe preguntar al paciente si está tomando medicamentos para la osteoporosis, sulfato ferroso para la anemia, antiácidos o multivitamínicos, los que hay que consumir con cuatro horas de diferencia con las quinolonas, porque contienen calcio, hierro, aluminio, magnesio y zinc, respectivamente. No es un problema de pH, por lo que la famotidina no tiene ninguna importancia.
En la interacción con otros medicamentos, habrá dificultades cuando ambos se metabolizan en el hígado; si uno de ellos se excreta por vía renal, habrá menor interacción con el otro. Por lo tanto, la dificultad se presentará con algunos antibióticos que se metabolizan en el hígado, como la rifampicina, que actúa como inductor citocromático y aumenta la velocidad de metabolización de lo que pase por ese sistema, de modo que acelera la degradación de otros compuestos, acorta su vida media y favorece un efecto subterapéutico. En la terapia de VIH, la rifampicina y los inhibidores de proteasas no se pueden administrar juntos.
El efecto opuesto se observa con tres familias de antimicrobianos, que inhiben lo que la rifampicina acelera, por lo que la vida media, los valores plasmáticos y el riesgo de toxicidad de otros compuestos aumentan cada vez que se utilizan concomitantemente con quinolonas, macrólidos, en grado variable, y triazoles (fluconazol, itraconazol, voriconazol). Se puede ver un resumen de lo expuesto en la Figura 3.
Figura 3. El problema de las interacciones con otros medicamentos inductores e inhibidores citocromales.
Entre los fármacos que se metabolizan en el hígado y cuya degradación se puede inhibir con estas tres familias de antimicrobianos (con el consiguiente riesgo de efectos tóxicos) se cuentan warfarina, anticonvulsivantes, benzodiazepinas, teofilina, estatinas, bloqueadores de calcio, drogas inmunosupresoras (tacrolimus, ciclosporina A), digoxina y otros antiarrítmicos, todos fármacos que se utilizan en patologías crónicas. La interacción entre eritromicina y sistema microsomal es muy intensa, muy inhibitoria, efecto que se va perdiendo a medida que avanza la generación de macrólidos. La claritromicina tiene efecto intermedio y la azitromicina tiene sólo un pequeño efecto inhibitorio sobre el metabolismo de la digoxina; es el macrólido más seguro en el aspecto hepático.
En cuanto a las consecuencias terapéuticas, ante el uso de antimicrobianos inhibidores del sistema citocromal hepático, algunas situaciones comunes son las siguientes:
No se trata de una innovación cronológica, sólo coincide con ella; la generación es básicamente un concepto de espectro, de actividad. Se habla de nuevas generaciones porque ha cambiado y aumentado la actividad, o se ha producido un cambio sustantivo en el espectro de actividad de una familia de compuestos. Eso es lo que marca una generación y se aplica a cuatro familias: las quinolonas, los macrólidos, las cefalosporinas y los triazoles.
Las quinolonas llevan, actualmente, tres generaciones: la primera corresponde al ácido nalidíxico (nombre comercial Wintomylon), que es un quimioterapéutico urinario; la segunda generación es el ciprofloxacino; y la tercera generación, las quinolonas respiratorias. Las generaciones tienen ventajas e inconvenientes, ya que si bien aumenta el espectro, también aumenta el costo, y algunas no se pueden aplicar porque no tienen el espectro necesario. En las quinolonas de segunda generación, el espectro aumenta hacia los gramnegativos y, en las de tercera generación, hacia las bacterias grampositivas, incluso los microorganismos respiratorios. Algunas quinolonas de tercera generación, como moxifloxacino y gatifloxacino, actúan sobre bacterias anaerobias.
Los macrólidos son dos grupos: la eritromicina y los nuevos macrólidos, o macrólidos mejorados, que son la claritromicina y la azitromicina, que aumentan el efecto sobre gramnegativos y tienen una farmacocinética mejorada y menos interacción con otros medicamentos, en comparación con la eritromicina.
Las cefalosporinas se han desarrollado hasta la cuarta generación, con aumento del efecto hacia los gramnegativos, sin perder el efecto hacia los grampositivos. Las cefalosporinas de tercera generación tienen llegada al sistema nervioso central, cosa que no pueden hacer las de primera y segunda. Las de segunda y tercera tienen estabilidad ante las betalactamasas comunitarias y, en ciertos casos, ante betalactamasas nosocomiales (como cefipime, que es de cuarta generación) y componentes antipseudomónicos específicos, en las de tercera y cuarta (ceftazidima).
Los triazoles son dos grupos: el fluconazol y los nuevos triazoles, cuyo marcador más reciente es el voriconazol. El fluconazol actúa sobre levaduras, pero no mata los hongos filamentosos como Aspergillus, en cambio, la nueva generación sí los mata.
Los factores que limitan la eficacia clínica de un tratamiento antimicrobiano pueden estar relacionados con el microorganismo, con el paciente o con la atención médica. A continuación se describen las principales causas, pero es muy importante recordar que se puede pesquisar y corregir muchas de ellas con gran facilidad, antes de cambiar el antibiótico.
Factores relacionados con el microorganismo:
Factores asociados con el paciente:
Factores asociados con la atención médica:
Cada vez que se utiliza mal un antibiótico se causa un daño ecológico irreparable que puede terminar generando un verdadero holocausto biológico: el compuesto mata fácilmente 10 mil y hasta 100 mil millones de bacterias, pero otros microorganismos tomarán su lugar en poco tiempo o bien puede quedar una bacteria que nuevamente comenzará el ciclo y colonizará a la persona, pero esta vez con una “R” en el antibiograma. Además, hay riesgo de sobreinfecciones, de reacciones adversas y problemas de costo.
En resumen, los antibióticos no son los ansiolíticos de la terapia médica, no se los puede usar para aliviar la angustia del médico tratante.




 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y el Departamento de Medicina del Hospital Clínico Universidad de Chile.
 Expositor:
Alberto Fica C.[1]
Expositor:
Alberto Fica C.[1]

Citación: Fica A. Basics about antimicrobial agents II. Medwave 2005 Mar;5(2):e2523 doi: 10.5867/medwave.2005.02.2523
Fecha de publicación: 1/3/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión