 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sección de Gastroenterología del Hospital Clínico Universidad de Chile.
Los trastornos motores considerados funcionales a nivel del tubo digestivo se pueden agrupar en 4 tipos: la dispepsia no ulcerosa, el dolor retroesternal no cardíaco, la diskinesia biliar y el síndrome de intestino irritable. Dado que las alteraciones motoras afectan tanto al intestino delgado como al colon, esta alteración se debe denominar, en propiedad, intestino irritable y no colon irritable, que se refiere sólo a compromiso del colon.
Los desórdenes funcionales del intestino corresponden a síndromes cuyos síntomas se atribuyen al tubo digestivo en todos sus segmentos. Dada la ausencia de marcadores biológicos en esta enfermedad, se han desarrollado criterios de síntomas positivos para el diagnóstico, mediante la anamnesis como patrón de la inclusión de pacientes en estudios clínicos. El diagnóstico debe basarse en hallazgos positivos y no plantearse después de extensas y costosas investigaciones para excluir otros desórdenes.
Es un complejo cuadro de síntomas crónicos y recurrente, con exacerbaciones y remisiones, que se caracteriza por la presencia de dolor abdominal y alteración del tránsito intestinal, en forma de diarrea y constipación, o la alternancia de ambas.
Es, sin duda, la causa más frecuente de consulta ambulatoria, con mayor preponderancia en mujeres, mayores de 30 años (2/1). Aproximadamente, 50% de las consultas gastroenterológicas tienen esta causa. En la población general, hay muchas personas sanas con síntomas similares, que no consultan médico. La explicación de la diferencia, entre pacientes con SII y pacientes sanos sintomáticos, puede estar en que los primeros pueden tener un umbral más bajo de tolerancia a los síntomas, especialmente al dolor, y disponer de acceso más fácil a algún tipo de atención médica.
Su apelativo de funcional se debe, principalmente, a que no se ha podido documentar una lesión morfológica, anatómica o bioquímica. Más aun, no se ha precisado si en este cuadro existe: a) una función normal con una percepción exagerada; b) una función motora alterada, con percepción normal; o bien c) combinación de ambas alteraciones. Hasta ahora se acepta que es un cuadro “bio-psico-social”, aunque nuevos datos han comenzado a aclarar algo la situación y ponen en duda al apelativo de funcional, por cuanto se ha propuesto que la serotonina tiene un papel en la fisiopatología de este desorden y existen evidencias que apoyan mecanismos biofisiológicos subyacentes.
El tubo digestivo tiene una rica inervación sensorial aferente. Su control neural abarca cinco niveles básicos de organización jerárquico-integrativa. El primer nivel es el sistema nervioso entérico ( SNE); el segundo nivel es el ganglio simpático; los niveles tercero y cuarto son centros simpáticos y parasimpáticos, dentro de la médula oblonga, que representan vías para la transferencia de información desde el sistema nervioso central (SNC) hacia el intestino; y el quinto nivel comprende centros cerebrales altos que proporcionan información descendente desde el SNC, en relación con la percepción de sensaciones gastrointestinales y manifestaciones de factores psicogénicos, tales como estrés físico y emocional.
En pacientes con SII se han observado anormalidades del SNE que se pueden relacionar con hiperactividad motora intestinal. La importancia y complejidad del SNE, que se ha llamado “el pequeño cerebro”, se ha estudiado y definido en la última década, y se ha comenzado a entender mejor su relación con el SNC o “gran cerebro”. Las terminaciones nerviosas son ricas en péptidos, como la serotonina (5 HT), la sustancia P, los opioides y el ácido gama amino butírico, entre otros. Estos actúan como neurotransmisores y modifican la actividad interneuronal, estimulan contracciones y relajaciones de la musculatura lisa digestiva.
La serotonina o 5-HT media la transferencia química de información dentro del circuito neural de la mayoría de los niveles integrativos de esta organización. De hecho, 95 % de la 5-HT está en el intestino. Las dos fuentes paracrinas de 5-HT en el tubo digestivo son las células enterocromafines y los mastocitos entéricos. La cantidad de 5-HT que se libera en el intestino se incrementa tras una comida. La serotonina activa las aferentes esplácnicas, las cuales transmiten las señales al SNC, probablemente con exclusión de niveles de conciencia. En casos de inflamación, sin embargo, las aferentes llegan a sensibilizarse y la 5-HT liberada lleva a una cascada sensorial exagerada que involucra circuitos integrados espinales. Este tipo de información alcanza niveles que se manifiestan como molestia o dolor. Los mastocitos inducen reacciones de sensibilización a alimentos o infecciones, por liberación de 5-HT. De hecho hay evidencias de que, en un subgrupo de pacientes, las infecciones intestinales y la inflamación pueden ser claves en la presencia de síntomas tipo SII, en uno de cada cuatro pacientes que sufre un cuadro infeccioso intestinal agudo.
Los receptores 1 y 4 de la 5-HT modulan las reacciones de hipersensibilidad del intestino, como hipersecreción y episodios motores propulsivos. La inhibición presináptica (posiblemente mediada por los receptores 4 a la 5-HT) en la sinapsis nicotínica es un importante mecanismo por el cual la 5-HT afecta la función entérica. Así, la evidencia de que los receptores de la 5-HT afectan los procesos tanto sensoriales como motores digestivos plantea que ellos son blancos prometedores para nuevos agentes farmacológicos. En la actualidad, múltiples trabajos intentan demostrar una alteración motora en el tracto gastrointestinal. Efectivamente, numerosos nuevos fármacos, hoy en desarrollo, actúan en los desórdenes de la motilidad
Diagnóstico
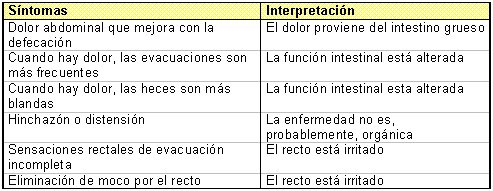
En 1978, Manning y colaboradores identificaron seis síntomas que eran significativamente más comunes en los pacientes con SII que en los que tenían enfermedad digestiva orgánica. En posteriores reuniones de consenso se afinaron los criterios diagnósticos de aplicación clínica relativos a los desórdenes funcionales intestinales (Tabla I).
Tabla I. Criterios de Manning y su interpretación.
Otros síntomas están presentes con frecuencia y, aunque no son esenciales para el diagnóstico, pueden apoyarlo. Permiten además identificar el subgrupo de SII y localizan el cuadro como de origen digestivo (Tabla II).
Tabla II. Síntomas adicionales que apoyan el diagnóstico de SII.
La aplicación de los criterios de Roma permite realizar con confianza un diagnóstico positivo de SII. Sin embargo, este diagnóstico no tiene que ser exclusivo También puede coexistir con enfermedades digestivas orgánicas. Por ejemplo, en la mayoría de los casos, los pacientes con enfermedad intestinal inflamatoria, si se aplican los criterios mencionados, tienen un grado de SII coexistente. No obstante, en la práctica clínica, el hecho de que el SII coexista con patología orgánica y la semejanza de algunos síntomas con los de enfermedad orgánica deben tomarse en cuenta. Cuando el índice de sospecha de la presencia de un cáncer o enfermedad intestinal inflamatoria es alto, se necesita la investigación adecuada para excluir estas enfermedades.
Los síntomas son de carácter crónico o recurrente. El dolor abdominal es variable, en cuanto a localización y aparición, y tiende a aliviarse tras la defecación. La diarrea y constipación pueden alternarse. Los síntomas pueden estar relacionados con estrés y el comienzo del cuadro sigue algunas veces a una gastroenteritis infecciosa. Los hallazgos del examen físico habitualmente son normales. Puede estar presente una sensibilidad abdominal inespecífica o un colon sigmoides tenso y palpable. La distensión abdominal es menos frecuente en los hombres.
La motilidad intestinal está influida por el SNC y estas interacciones se ven amplificadas en situaciones de estrés emocional. Se ha observado, además, que las alteraciones motoras no se circunscriben sólo al intestino sino que abarcan otros órganos, como la vejiga urinaria, el útero, y otras alteraciones más vagas, como cefaleas de tipo migraña o variaciones transitorias de la presión arterial. Estas evidencias plantean que los pacientes con intestino irritable tienen una anormalidad más generalizada en la sensibilidad y en la contractibilidad de las fibras musculares lisas.
Es necesario realizar siempre un hemograma, VHS, proteína C–reactiva, estudio de función tiroídea, de función hepática, examen de deposiciones por leucocitos fecales, parásitos y eventualmente realizar cultivo. Ciertos resultados pueden constituir señales de alarma que aconsejan algún otro estudio. El comienzo de los síntomas en ancianos, la pérdida de peso, el antecedente familiar de cáncer o enfermedad inflamatoria intestinal, la anemia, leucocitosis, leucocitos fecales positivos son algunos ejemplos de esta situación. La ecotomografía abdominal no es útil.
Se debe reevaluar a los pacientes luego de un corto lapso, si los síntomas no mejoran. El diagnóstico diferencial comprende una amplia gama de trastornos y enfermedades, cuyos síntomas se pueden confundir con el SII, entre ellos factores dietéticos, síndromes de mala absorción, infecciones, la enfermedad inflamatoria intestinal y cuadros psicológicos.
Tratamiento
Establecer una óptima relación médico-paciente, explicar las características benignas del desorden y educar son principios fundamentales en el manejo de este cuadro crónico. El paciente típico ha visto deteriorada significativamente su calidad de vida, con frecuencia está angustiado y temeroso respecto de la posibilidad de una enfermedad maligna, presente o futura, en su aparato digestivo.
No hay una dieta especifica que indicar. Estudios prospectivos de exclusión y ensayo alimentarios, dirigidos a identificar alimentos que provoquen o exacerben síntomas no han logrado concordar en señalar algún alimento causante. Parece razonable excluir aquellos alimentos conocidos que provocan síntomas y evaluar. En un grupo significativo de pacientes, la intolerancia a la lactosa a menudo se confunde con SII. Lo mismo vale respecto de otros alimentos, como los ricos en grasas, bebidas gaseosas, cafeína, edulcorantes artificiales y excesos de fibra.
La terapia psicológica puede ayudar. Se ha comunicado que tanto la hipnoterapia como la psicoterapia son útiles. Sin embargo, ciertos defectos metodológicos, particularmente la carencia de grupos controles, impiden llegar a conclusiones definitivas. La actitud atenta y afectuosa del médico puede promover una reducción del flujo simpático y, en consecuencia, mejorar los síntomas. Los medicamentos apropiados dependerán del síntoma predominante.
En los pacientes que se presentan con predominio de diarrea, la loperamida puede ser útil, en particular cuando se administra antes de situaciones reconocidas que precipitan el síntoma. La colesteramina tiene su principal indicación en la diarrea asociada a mala absorción de ácidos biliares. Su lugar en el manejo de pacientes con SII es discutible y probablemente sólo identificará a los portadores de este cuadro infrecuente. Se ha comunicado ocasionalmente su utilidad en la colitis microscópica y en la diarrea postcolecistectomía.
La diarrea predominantemente postprandial puede responder tal vez al uso de inhibidores de la bomba de protones. La causa de tal efecto no se conoce.
La cisaprida, que es antagonista 5–HT3 y agonista 5–HT4, se utiliza ampliamente en el tratamiento de desórdenes de la motilidad gastrointestinal, particularmente RGE. Es eficaz en el tratamiento de la dispepsia funcional, pero menos eficaz en el tratamiento del SII con predominio de constipación. Intensifica la acomodación y vaciamiento gástrico, además de la percepción en estado de ayuno. Su utilidad se ha puesto en duda recientemente, dado que puede perjudicar la función cardíaca por prolongación del intervalo QT.
Según comunicaciones anecdóticas e informes de ensayos controlados y aleatorios, criticables en su calidad, parecería que los antidepresivos tricíclicos y los inhibidores selectivos de la recaptación de serotonina podrían tener efectos benéficos en los síntomas de estos pacientes, por reducción de la hipersensibilidad visceral y por sus propiedades relajantes del tubo digestivo. El mecanismo de acción no está aclarado y su lugar exacto en el manejo de pacientes con SII aguarda futuros estudios. En general, se reservan para los casos más difíciles, en que predomina el síntoma dolor.
Se espera con interés la formulación y el desarrollo de nuevos fármacos. Los adelantos en la fisiopatología del síndrome de intestino irritable indican que es improbable que se encuentre un agente que trate por sí solo, eficazmente, todos los síntomas. Revisaremos aquí los nuevos agentes que se están investigando para el tratamiento del SII, algunos de los cuales ya están con los estudios terminados y están entrando en el mercado.
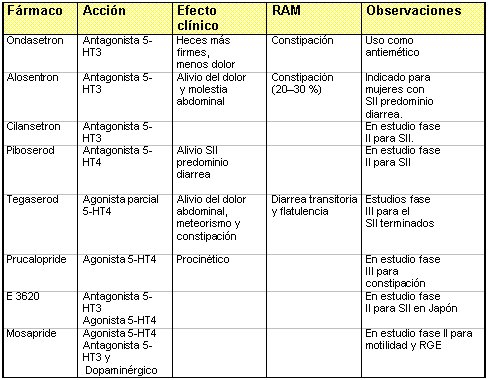
En el pasado, la farmacoterapía del dolor y de las molestias del SII se concentró en restaurar los patrones normales de motilidad, con antiespasmódicos, agentes estimuladores del peristaltismo o agentes procinéticos. Ahora último, el papel de una vía neural aferente que surge desde el intestino ha ofrecido otro enfoque de tratamiento. Para muchos pacientes, probablemente, se necesita una aproximación multifacética. Sin embargo, cualquiera que sea el enfoque, el objetivo principal debe ser la mejoría de los síntomas y de la calidad de vida de los pacientes. En los últimos años se han formulado algunos fármacos potenciales que son selectivos para ciertos tipos de receptores específicos de serotonina (5-HT). El objetivo de formular estos fármacos es lograr efectos moduladores sobre la función gastrointestinal (Tabla III).
Tabla III. Nuevos fármacos que modulan la acción de la 5-HT.
Las neuronas intrínsecas que contienen los receptores 5-HT tienen un papel en el control de la motilidad gastrointestinal y, probablemente, en la modulación de la función sensorial visceral. El aumento de las concentraciones de 5-HT, que se puede detectar en la circulación sistémica después de una comida, puede ser fisiológicamente relevante en el control de los movimientos gastrointestinales. Las anormalidades en el patrón de liberación de 5-HT, luego de una comida, pueden explicar algunos de los síntomas postprandiales asociados con el SII.
Los efectos de la 5-HT son mediados por un subtipo o más de receptor 5-HT. Se han identificado al menos seis subtipos principales de receptores 5-HT, aunque, en el tracto gastrointestinal, los subtipos 3 (5-HT3 y 4 (5-HT4) parecerían los más importantes. Estos subtipos de receptores están particularmente asociados con los efectos de la 5-HT sobre la motilidad y el tránsito gastrointestinal, y la sensibilidad visceral. Las funciones de los receptores 5-HT3 no están comprendidas, pero pueden participar tal vez en la modulación de la motilidad del colon y de la sensibilidad dolorosa visceral. Se ha sugerido que los antagonistas 5-HT3 podrían reducir algunos síntomas del SII, como el dolor, mediante la disminución de la reactividad de los nervios sensoriales entéricos. En pacientes con SII, las señales que se envían al cerebro se perciben como molestia o dolor abdominal.
La activación de los receptores 5-HT4 tiene un efecto pronunciado sobre el tono muscular liso, la secreción de electrolitos en las mucosas y el reflejo peristáltico. La 5-HT liberada en respuesta a la estimulación de la mucosa, que actúa vía receptores 5-HT4, causa hiperexcitación del SNE y de las neuronas motoras entéricas. Esto facilita las funciones propulsora y contráctil del intestino, y promueve urgencia anormal por evacuar, aumento en la frecuencia y el volumen de evacuación, y diarrea. Los receptores 5-HT4 mediarían los efectos sensibilizadores de la 5-HT sobre las funciones secretora y motora gastrointestinales y se ha demostrado que varios agonistas del receptor 5-HT4 aumentan la motilidad intestinal.
Los antagonistas 5-HT3 producen constipación y tránsito lento en el colon, además de inhibir la respuesta gastrocolónica. Los antagonistas 5-HT3, como ondansentron, granisetron y tropisetron (Novartis), los que actualmente se comercializan para el tratamiento de los vómitos y las náuseas debidos a la quimioterapia, afectan la función normal del intestino grueso y promueven la constipación. Pueden facilitar la absorción de sodio y agua desde el intestino delgado, lo que mejora la consistencia de las heces.
Ondansentron es un antagonista selectivo 5-HT3 que mejora los síntomas del SII. En un estudio clínico, el uso de ondansentron se asoció con importantes efectos sobre el intestino y disminución del dolor.
Alosetron es un antagonista selectivo 5-HT3, que está en estudio para su uso en sujetos con SII, no constipados, y para tratar el dolor abdominal mediante el aumento de la capacidad de distensión del colon. En un estudio se demostró beneficio del alosetron sobre el placebo sólo en pacientes mujeres con SII, predominio de diarrea. En 70% de los casos, los pacientes que recibieron 1 mg de alosetron dos veces al día comunicaron un alivio adecuado de la molestia y dolor abdominales, en al menos seis de las doce semanas del estudio, en comparación con sólo 30% de los pacientes que recibieron placebo. El aumento en la proporción de pacientes que comunicaron un alivio adecuado de los síntomas, con alosetron, se observó a partir de la tercera semana de tratamiento y se mantuvo durante las doce semanas que duró el estudio. El efecto colateral más común fue la constipación, la que se comunicó en 23% de los pacientes.
Cilansetron es un antagonista selectivo 5-HT3 que se encuentra actualmente en investigación clínica para su uso en el SII. En estudios preclínicos, disminuyó la respuesta contráctil del colon a la distensión.
Los antagonistas 5-HT4 reducen la hipersensibilidad nerviosa entérica inducida por 5-HT, sin afectar en forma importante la función normal del intestino. De acuerdo con esto, dichos agentes pueden reducir los síntomas del SII directamente, con disminución de la incidencia de defecación y diarrea, e indirectamente, por reducción de la constipación “de rebote", la molestia y el dolor postprandial asociados con la hiperreactividad gastrointestinal.
Un significativo grupo de pacientes con SII tiene síntomas con predominio de constipación. Los agentes aumentadores de volumen, los laxantes y la cisaprida se usan comúnmente, pero los resultados obtenidos son subóptimos.
Tegaserod es un compuesto representante de una nueva clase química, los indoles aminoguanidina, agonista parcial con alta especificidad y potencia frente al receptor 5-HT4. Estudios clínicos han demostrado que el Tegaserod acelera el tránsito colónico y mejora los síntomas de la constipación, el dolor abdominal y el meteorismo en pacientes con SII, sin tener, aparentemente, la toxicidad cardíaca asociada a la cisaprida. Datos de ensayos clínicos con tegaserod, en pacientes con SII con constipación predominante, demostraron que el fármaco estuvo asociado a una mejoría en el dolor abdominal, el meteorismo y la constipación. Los pacientes que recibieron 2 mg de tegaserod dos veces al día mostraron una mejoría significativamente mayor frente a los que recibieron placebo. Los efectos colaterales más comunes fueron diarrea (transitoria) y flatulencia. Mueller–Lissner y col., en estudio multicéntrico aleatorio, en 881 pacientes con SII constipación predominante compararon 4 mg o 12 mg de tegaserod v/s placebo y encontraron que ambas dosis de tegaserod fueron significativas y modestamente más eficaces que el placebo en el segundo y tercer mes de tratamiento. El desarrollo de la acción del tegaserod demoró una semana y fue generalmente bien tolerado.
Prucalopride es el primer agente de una nueva clase de compuestos, los benzofuranos. Es un agonista 5-HT4 con propiedades procinéticas. En dosis de 2 mg y 4 mg, una vez al día, ha demostrado que induce un aumento en el número de movimientos espontáneos del intestino y mejora otros síntomas de la constipación crónica. Además, se ha visto que una dosis diaria de 2 mg de prucalopride aumenta la motilidad gastrointestinal y produce una mejoría subjetiva en pacientes con esclerodermia y compromiso gastrointestinal evidente.
Fedotozina es un agonista selectivo y potente que aumenta el umbral de percepción de la distensión colónica en pacientes con SII, sin modificar la capacidad de distensión del colon. En un estudio clínico, la fedotozina se demostró significativamente mejor que el placebo, en el tratamiento del dolor abdominal y el meteorismo. Por algún motivo, la autoridad de salud de Francia rechazó el producto y la empresa que lo formuló abandonó su desarrollo posterior.
Somatostatina y sus análogos tienen efectos analgésicos sobre el dolor visceral y somático. Octreotide, análogo de la somatostatina, tiene efectos sobre la función gastrointestinal, incluso la reducción de la secreción y el retardo del tránsito gastrointestinal. Se ha demostrado que prolonga el tiempo de tránsito boca-ciego en más de dos veces, en individuos sanos y en pacientes con SII con diarrea predominante, lo que plantea que puede tener beneficios en el SII. Está disponible sólo como formulación inyectable, lo que limita su utilización como tratamiento diario en pacientes con SII. Sin embargo, una formulación de depósito y aplicación parenteral (IM) podría, en teoría, tener aceptación desde el punto de vista terapéutico.
Los antagonistas muscarínicos M3 selectivos corresponden a un nuevo enfoque en el tratamiento del SII, ya que su uso no está asociado con los efectos colaterales de los anticolinérgicos, de modo que ofrece mayor flexibilidad en las dosis.
Zamifenacin es un potente antagonista muscarínico M3 selectivo en el intestino, que está actualmente en estudio para el tratamiento del SII. En un estudio clínico multicéntrico, controlado y aleatorio, una dosis única de 40 mg de zamifenacin redujo la motilidad del colon sin producir efectos antimuscarínicos significativos.
Leuprorelin es un agonista análogo de la hormona liberadora de gonadotrofina (GnRH), conocida como leuprolide. Si el leuprorelin se administra continuamente, se produce un cambio de efecto, de agonista a antagonista, y, en consecuencia, los niveles de hormona luteinizante (LH) y folículo-estimulante quedan suprimidos; esto lleva, por último, a una reducción en los niveles circulantes de hormonas sexuales. Leuprorelin es 15 veces más potente que GnRH y su potencial utilización en el manejo del SII se propuso sobre la base de que este síndrome ocurre con más frecuencia en mujeres, en quienes los síntomas tienden a asociarse con la fase postovulatoria del ciclo menstrual. Un estudio clínico controlado comprobó que esta hipótesis es válida. Las náuseas, vómitos, meteorismo, dolor abdominal, saciedad temprana y síntomas generales mejoraron más con leuprorelin que con placebo. Sin embargo, pese a estos resultados preliminares favorables, los médicos podrían ser renuentes a recetar un fármaco tan fuerte como el leuprorelin, aun en casos de SII moderadamente grave.




 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sección de Gastroenterología del Hospital Clínico Universidad de Chile.
 Expositora:
Ana María Madrid Silva[1]
Expositora:
Ana María Madrid Silva[1]

Citación: Madrid AM. Irritable bowel. Medwave 2002 Ago;2(7):e2331 doi: 10.5867/medwave.2002.07.2331
Fecha de publicación: 1/8/2002

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Gershon MD. Roles played by 5-hydroxytryptamine in the physiology of the bowel. Aliment Pharmacol Ther 1999; 13(suppl 2):15-30 (10).
Gershon MD. Roles played by 5-hydroxytryptamine in the physiology of the bowel. Aliment Pharmacol Ther 1999; 13(suppl 2):15-30 (10).  Gwee KA, Leong YL, Graham C, McKendrick MW, Collins SM, Walters SJ, et al. The role of psychological and biological factors in postinfective gut dysfunction. Gut. 1999 Mar;44(3):400-6. | CrossRef | PubMed | PMC |
Gwee KA, Leong YL, Graham C, McKendrick MW, Collins SM, Walters SJ, et al. The role of psychological and biological factors in postinfective gut dysfunction. Gut. 1999 Mar;44(3):400-6. | CrossRef | PubMed | PMC | Manning AP, Thompson WG, Heaton KW, Morris AF. Towards positive diagnosis of the irritable bowel. Br Med J. 1978 Sep 2;2(6138):653-4.
| CrossRef | PubMed | PMC |
Manning AP, Thompson WG, Heaton KW, Morris AF. Towards positive diagnosis of the irritable bowel. Br Med J. 1978 Sep 2;2(6138):653-4.
| CrossRef | PubMed | PMC | Thompson WG, Creed F, Drossman DA, Heaton KW, Mazzacca G. Functional bowel disease and functional abdominal pain. Gastroenterology International 1992; 5:75-91
Thompson WG, Creed F, Drossman DA, Heaton KW, Mazzacca G. Functional bowel disease and functional abdominal pain. Gastroenterology International 1992; 5:75-91  Thompson WG. Gastrointestinal symptoms in the irritable bowel compared with peptic ulcer and inflammatory bowel disease. Gut. 1984 Oct;25(10):1089-92. | CrossRef | PubMed | PMC |
Thompson WG. Gastrointestinal symptoms in the irritable bowel compared with peptic ulcer and inflammatory bowel disease. Gut. 1984 Oct;25(10):1089-92. | CrossRef | PubMed | PMC | Shuster M. Gastrointestinal Disorders of Function: The Therapeutic Potential of Serotonin Gastroenterology Treatment Updates 2000 Medscape, Inc
Shuster M. Gastrointestinal Disorders of Function: The Therapeutic Potential of Serotonin Gastroenterology Treatment Updates 2000 Medscape, Inc  Neal KR, Hebden J, Spiller R. Prevalence of gastrointestinal symptoms six months after bacterial gastroenteritis and risk factors for the development of the irritable bowel syndrome: a postal survey of patients. BMJ. 1997 Mar 15;314(7083):779-82. | PubMed | PMC |
Neal KR, Hebden J, Spiller R. Prevalence of gastrointestinal symptoms six months after bacterial gastroenteritis and risk factors for the development of the irritable bowel syndrome: a postal survey of patients. BMJ. 1997 Mar 15;314(7083):779-82. | PubMed | PMC | Smith RC, Greenbaum DS, Vancouver JB, Henry RC, Reinhart MA, Greenbaum RB, et al. Gender differences in Manning criteria in the irritable bowel s�ndrome. Gastroenterology. 1991 Mar;100(3):591-5. | PubMed |
Smith RC, Greenbaum DS, Vancouver JB, Henry RC, Reinhart MA, Greenbaum RB, et al. Gender differences in Manning criteria in the irritable bowel s�ndrome. Gastroenterology. 1991 Mar;100(3):591-5. | PubMed | Thompson WG, Heaton KW, Smyth GT, Smyth C. Irritable bowel syndrome in general practice: prevalence, characteristics and referral. Gut. 2000 Jan;46(1):78-82. | CrossRef | PubMed | PMC |
Thompson WG, Heaton KW, Smyth GT, Smyth C. Irritable bowel syndrome in general practice: prevalence, characteristics and referral. Gut. 2000 Jan;46(1):78-82. | CrossRef | PubMed | PMC | Shaw AD, Davies GJ. Lactose Intolerance: Problems in Diagnosis and Treatment.[Review]. J Clin Gastroenterol. J Clin Gastroenterol. 1999 Apr;28(3):208-16. | CrossRef | PubMed |
Shaw AD, Davies GJ. Lactose Intolerance: Problems in Diagnosis and Treatment.[Review]. J Clin Gastroenterol. J Clin Gastroenterol. 1999 Apr;28(3):208-16. | CrossRef | PubMed | Guthrie E, Creed F, Dawson D, Tomenson B. A randomised controlled trial of psychotherapy in patients with refractory irritable bowel syndrome Br J Psychiatry. 1993 Sep;163:315-21. | CrossRef | PubMed |
Guthrie E, Creed F, Dawson D, Tomenson B. A randomised controlled trial of psychotherapy in patients with refractory irritable bowel syndrome Br J Psychiatry. 1993 Sep;163:315-21. | CrossRef | PubMed | Aggarwal A, Cutts TF, Abell TL, Cardoso S, Familoni B, Bremer J, et al. Predominant symptoms in irritable bowel syndrome correlate with specific autonomic nervous system abnormalities. Gastroenterology. 1994 Apr;106(4):945-50. | PubMed |
Aggarwal A, Cutts TF, Abell TL, Cardoso S, Familoni B, Bremer J, et al. Predominant symptoms in irritable bowel syndrome correlate with specific autonomic nervous system abnormalities. Gastroenterology. 1994 Apr;106(4):945-50. | PubMed | Palsson O, Turner M, Johnson D. Hypnotherapy for irritable bowel syndrome: symptom improvement and autonomic nervous system effects. Program and abstracts of Digestive Disease Week 2000 May: 21-24.
Palsson O, Turner M, Johnson D. Hypnotherapy for irritable bowel syndrome: symptom improvement and autonomic nervous system effects. Program and abstracts of Digestive Disease Week 2000 May: 21-24.  Efskind PS, Bernklev T, Vatn MH. A double?blind, placebo?controlled trial with loperamide in irritable bowel syndrome. Scand J Gastroenterol. 1996 May;31(5):463-8.
| CrossRef | PubMed |
Efskind PS, Bernklev T, Vatn MH. A double?blind, placebo?controlled trial with loperamide in irritable bowel syndrome. Scand J Gastroenterol. 1996 May;31(5):463-8.
| CrossRef | PubMed | Galatola G, the Italian SeHCAT Multicentre Study Group, The prevalence of the bile acid malabsorption in irritable bowel syndrome and the effect of cholestyramine: an uncontrolled open multicentre study. Eur J Gastroenterol Hepatol. 1992;4:533-37.
Galatola G, the Italian SeHCAT Multicentre Study Group, The prevalence of the bile acid malabsorption in irritable bowel syndrome and the effect of cholestyramine: an uncontrolled open multicentre study. Eur J Gastroenterol Hepatol. 1992;4:533-37.  O'Malley PG, Jackson JL, Santoro J, Tomkins G, Balden E, Kroenke K. Antidepressant therapy for unexplained symptoms and symptom syndromes. J Fam Pract. 1999 Dec;48(12):980-90. | PubMed |
O'Malley PG, Jackson JL, Santoro J, Tomkins G, Balden E, Kroenke K. Antidepressant therapy for unexplained symptoms and symptom syndromes. J Fam Pract. 1999 Dec;48(12):980-90. | PubMed | Camilleri M. Clinical evidence to support current therapies of irritable bowel syndrome. Aliment Pharmacol Ther. 1999 May;13 Suppl 2:48-53. | CrossRef |
Camilleri M. Clinical evidence to support current therapies of irritable bowel syndrome. Aliment Pharmacol Ther. 1999 May;13 Suppl 2:48-53. | CrossRef | Thompson WG, Longstreth GF, Drossman DA, Heaton KW, Irvine EJ, Müller-Lissner SA. Functional bowel disorders and functional abdominal pain. Gut. 1999 Sep;45 Suppl 2:II43-7. | CrossRef | PubMed | PMC |
Thompson WG, Longstreth GF, Drossman DA, Heaton KW, Irvine EJ, Müller-Lissner SA. Functional bowel disorders and functional abdominal pain. Gut. 1999 Sep;45 Suppl 2:II43-7. | CrossRef | PubMed | PMC | American Gastroenterological Association. Medical position statement: Irritable bowel syndrome. Gastroenterology. 1997 Jun;112(6):2118-9. | CrossRef | PubMed |
American Gastroenterological Association. Medical position statement: Irritable bowel syndrome. Gastroenterology. 1997 Jun;112(6):2118-9. | CrossRef | PubMed | Tack J, Vos R, Broekaert D, et al. Influence of citalopram, a selective serotonin reuptake inhibitor, on colonic tone and sensitivity in man. Program and abstracts of Digestive Disease Week 2000 May:21-24.
Tack J, Vos R, Broekaert D, et al. Influence of citalopram, a selective serotonin reuptake inhibitor, on colonic tone and sensitivity in man. Program and abstracts of Digestive Disease Week 2000 May:21-24.  Sanger GJ. 5-Hydroxytryptamine and functional bowel disorders. Neurogastroenterol Motil. 1996 Dec;8(4):319-31. | CrossRef |
Sanger GJ. 5-Hydroxytryptamine and functional bowel disorders. Neurogastroenterol Motil. 1996 Dec;8(4):319-31. | CrossRef | Banner SE, Smith MI, Bywater D, Gaster LM, Sanger GJ. Increased defecation caused by 5-HT4 receptor activation in the mouse. Eur J Pharmacol. 1996 Jul 18;308(2):181-6. | CrossRef |
Banner SE, Smith MI, Bywater D, Gaster LM, Sanger GJ. Increased defecation caused by 5-HT4 receptor activation in the mouse. Eur J Pharmacol. 1996 Jul 18;308(2):181-6. | CrossRef | Grider JR, Foxx-Orenstein AE, Jin JG. 5-Hydroxytryptamine 4 receptor agonista initiate the peristaltic reflex in human, rat and guinea pig intestine Gastroenterology. 1998 Aug;115(2):370-80. | CrossRef |
Grider JR, Foxx-Orenstein AE, Jin JG. 5-Hydroxytryptamine 4 receptor agonista initiate the peristaltic reflex in human, rat and guinea pig intestine Gastroenterology. 1998 Aug;115(2):370-80. | CrossRef | Gralla RJ, Navari RM, Hesketh PJ, Popovic W, Strupp J, Noy J, et al. Single-dose oral granisetron has equivalent antiemetic efficacy to intravenous ondansetron for highly emetogenic cisplatin-based chemotherapy. J Clin Oncol. 1998 Apr;16(4):1568-73. | PubMed |
Gralla RJ, Navari RM, Hesketh PJ, Popovic W, Strupp J, Noy J, et al. Single-dose oral granisetron has equivalent antiemetic efficacy to intravenous ondansetron for highly emetogenic cisplatin-based chemotherapy. J Clin Oncol. 1998 Apr;16(4):1568-73. | PubMed | Talley NJ, Phillips SF, Haddad A, Miller LJ, Twomey C, Zinsmeister AR, et al. GR 38032F (ondansetron), a selective 5HT3 receptor antagonist, slows colonic transit in healthy man. Dig Dis Sci. 1990 Apr;35(4):477-80. | CrossRef | PubMed |
Talley NJ, Phillips SF, Haddad A, Miller LJ, Twomey C, Zinsmeister AR, et al. GR 38032F (ondansetron), a selective 5HT3 receptor antagonist, slows colonic transit in healthy man. Dig Dis Sci. 1990 Apr;35(4):477-80. | CrossRef | PubMed | Von der Ohe MR, Hanson RB, Camilleri M. Serotonergic mediation of postprandial colonic tonic and phasic responses in humans Gut. 1994 Apr;35(4):536-41. | CrossRef | PubMed | PMC |
Von der Ohe MR, Hanson RB, Camilleri M. Serotonergic mediation of postprandial colonic tonic and phasic responses in humans Gut. 1994 Apr;35(4):536-41. | CrossRef | PubMed | PMC | Goldberg PA, Kamm MA, Setti-Carraro P, van der Sijp JR, Roth C. Modification of visceral sensitivity and pain in irritable bowel syndrome by 5-HT3 antagonism (ondansetron) Digestion. 1996 Nov-Dec;57(6):478-83.
| CrossRef | PubMed |
Goldberg PA, Kamm MA, Setti-Carraro P, van der Sijp JR, Roth C. Modification of visceral sensitivity and pain in irritable bowel syndrome by 5-HT3 antagonism (ondansetron) Digestion. 1996 Nov-Dec;57(6):478-83.
| CrossRef | PubMed | Northcutt AR, Camilleri M, Mayer EA et al. Treatment of female irritable bowel syndrome patients with alosetron, a 5-HT3 receptor antagonist. Abstract presented at Digestive Disease Week, 1999 May:15-19.
Northcutt AR, Camilleri M, Mayer EA et al. Treatment of female irritable bowel syndrome patients with alosetron, a 5-HT3 receptor antagonist. Abstract presented at Digestive Disease Week, 1999 May:15-19.  Miner PB Jr., Nichols T, Silvers DR, Joslyn A, Woods M. The efficacy and safety of prucalopride in patients with chronic constipation. Abstract 22190 En: Digestive Disease Week, 1999 May:15-19
Miner PB Jr., Nichols T, Silvers DR, Joslyn A, Woods M. The efficacy and safety of prucalopride in patients with chronic constipation. Abstract 22190 En: Digestive Disease Week, 1999 May:15-19  Broeckxstaens GE, Bartelsman JF, Lauwers L, Tytgat GN. Effect of prucalopride on GI motility in scleroderma. Abstract G4179 En: Digestive Disease Week, 1999 May:15-19
Broeckxstaens GE, Bartelsman JF, Lauwers L, Tytgat GN. Effect of prucalopride on GI motility in scleroderma. Abstract G4179 En: Digestive Disease Week, 1999 May:15-19  Farup PG, Hovdenak N, Wetterhus S, Lange OJ, Hovde O, Trondstad R. The symptomatic effect of cisapride in patients with irritable bowel syndrome and constipation. Scand J Gastroenterol. 1998 Feb;33(2):128-31. | CrossRef |
Farup PG, Hovdenak N, Wetterhus S, Lange OJ, Hovde O, Trondstad R. The symptomatic effect of cisapride in patients with irritable bowel syndrome and constipation. Scand J Gastroenterol. 1998 Feb;33(2):128-31. | CrossRef | Cann PA, Rovati LC, Smart HL, Spiller RC, Whorwell PJ. Loxiglumide, a CCK-A antagonist, in irritable bowel syndrome: a pilot multicentre clinical study. Ann N Y Acad Sci. 1994 Mar 23;713:449-50. | CrossRef | PubMed |
Cann PA, Rovati LC, Smart HL, Spiller RC, Whorwell PJ. Loxiglumide, a CCK-A antagonist, in irritable bowel syndrome: a pilot multicentre clinical study. Ann N Y Acad Sci. 1994 Mar 23;713:449-50. | CrossRef | PubMed | Delvaux M, Louvel D, Lagier E, Scherrer B, Abitbol JL, Frexinos J. The kappa agonist fedotozine relieves hypersensitivity to colonic distention in patients with irritable bowel s�ndrome. Gastroenterology. 1999 Jan;116(1):38-45. | CrossRef |
Delvaux M, Louvel D, Lagier E, Scherrer B, Abitbol JL, Frexinos J. The kappa agonist fedotozine relieves hypersensitivity to colonic distention in patients with irritable bowel s�ndrome. Gastroenterology. 1999 Jan;116(1):38-45. | CrossRef |