La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sección de Gastroenterología del Hospital Clínico Universidad de Chile.
Desde el descubrimiento del Helicobacter pylori (HP) en 1982, por Warren y Marshall, en forma incidental, el diagnóstico y tratamiento de la úlcera péptica y linfoma MALT han sufrido un cambio trascendental.
El (HP) es una bacteria espiral, gramnegativa, móvil, microaerófila, de crecimiento lento y productora de ureasa (Figura 1).
Figura 1. Estructura del Helicobacter pylori.
La localización del HP en el estómago es predominantemente antral y corporal, aunque se ha comunicado en intestino delgado proximal.
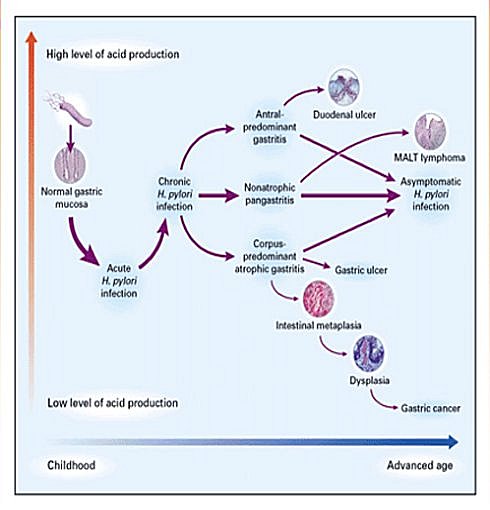
La bacteria está asociada con lesiones gastroduodenales, como: úlcera gástrica, úlcera duodenal, gastritis aguda superficial, gastritis crónica atrófica, cáncer gástrico y linfoma MALT (Figura 2).
Figura 2. Asociaciones frecuentes.
Además, el HP se asocia con otras enfermedades:
La infección por HP está muy extendida; hay una distribución bimodal, esto es, un pequeño grupo de países tienen incidencias entre 20 y 40 %, que son países desarrollados, y un numeroso grupo de países tienen incidencias entre 70% y 90%, que son países en desarrollo.
En Chile oscila entre 60% y 75%, según la población estudiada. La infección se adquiere típicamente en la infancia. En países subdesarrollados, la mayoría de los niños están infectados antes de los 10 años, pero, en países desarrollados, hay un claro incremento relacionado con la edad: a mayor edad, mayor incidencia. Junto con la edad, el principal factor de riesgo de infección es el nivel socioeconómico, que se relaciona con hábitos, condiciones de higiene y alimentación. Los seres humanos son la mayor fuente de contagio, pero la ruta exacta y la fuente de infección son todavía motivos de controversia. Dado que la bacteria se puede cultivar de las heces, la propagación fecal oral es muy probable, pero la propagación oral también tendría importancia. Se ha encontrado también HP en el agua y en gatos domésticos, lo que plantea que estos animales podrían contribuir a hospedar la infección. Para prevenir la transmisión, debemos entender mejor estos modelos.
La susceptibilidad genética a la infección también se ha confirmado con estudios en gemelos monocigotos, criados aparte o juntos, quienes tienen un alto índice de concordancia de la infección frente a gemelos dicigotos de la misma edad.
El HP habita en la mucosa gástrica y su adaptación a este nicho es tan notable que se hace difícil encontrarlo en otro punto del tracto digestivo. Es una bacteria móvil, a expensas de un grupo de flagelos localizados en uno de sus extremos.
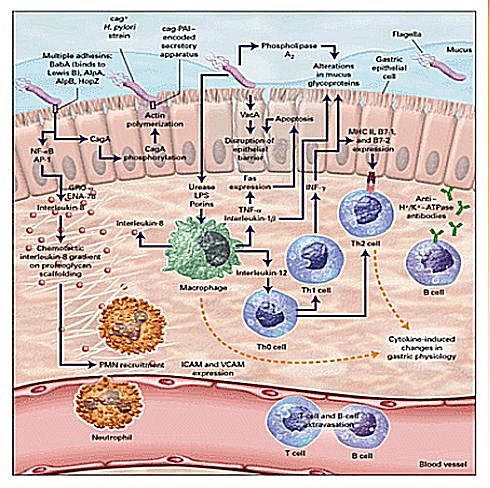
La bacteria ha desarrollado diversas capacidades para colonizar con éxito la mucosa. El primer paso en la infección es la colonización, proceso que dura una semana. Para esto, el HP resiste el ambiente ácido local, atraviesa la capa mucosa, se adhiere a los receptores de las células epiteliales y se adapta a la hostilidad del medio. Lo anterior se explicaría por la gran movilidad que da la forma helicoidal y la presencia de flagelos, lo que permite que la bacteria escape de la acción del jugo gástrico, se sitúe bajo la cubierta mucosa, donde la presencia de varias proteínas específicas facilitan su adaptación, como las proteasas que desdoblan inmunoglobulinas del huésped, mucinasa, que le permite desplazarse en la capa mucosa, y adhesinas, que favorecen su unión con receptores de las uniones estrechas entre células epiteliales. No obstante, la acción de la enzima ureasa es la que le confiere la mayor capacidad de residir en el estómago, por cuanto, en presencia de urea, iones hidrógeno y agua, esta enzima es capaz de inducir la producción de amonio y bicarbonato, lo que permite que la bacteria cree un microambiente que la protege del ácido circundante; así queda unida a la mucosa sin penetrar en la submucosa. Además, por la irritación e inflamación que causa el amonio al retrodifundirse a capas más profundas, promueve una persistente reacción inflamatoria local.
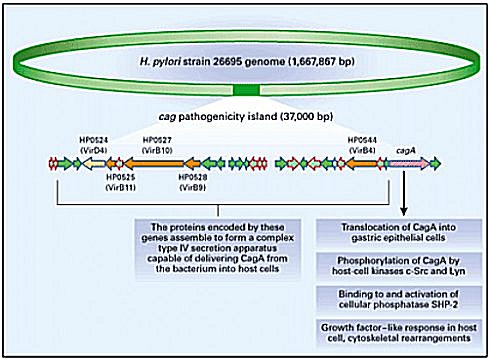
Una vez producida la colonización, el HP evita la reacción inmune local del huésped, debido a la presencia de la Ig A secretora; esto se suma al hecho de que el lipopolisacárido de su membrana, a diferencia de la gran mayoría de los gramnegativos, tiene bajo poder inmunogénico y escasa actividad biológica, lo que no permite que el huésped genere una respuesta defensiva que consiga el clearance bacteriano. Además, se sabe que 60% de las cepas tienen la capacidad de producir toxinas, específicamente la toxina vacuolizante Vac-A y la citotoxina Cag-A, componentes diferenciales de virulencia, que producen toxicidad directa en las células epiteliales del huésped.
La adherencia de la mucosa antral por HP produce una reacción inflamatoria aguda con el consiguiente daño en las células epiteliales. Ciertos productos quimiotácticos se liberan desde la bacteria mientras las células epiteliales producen interleuquina-8 y se genera una activación local de polimorfonucleares. Esta respuesta se ve potenciada por otros factores del huésped, como las citoquinas proinflamatorias, IL–1 y TNF alfa, con la posterior producción de enzimas proteolíticas y radicales libres de oxígeno por parte de los neutrófilos. La reacción inflamatoria daña, evidentemente, el epitelio y las células adoptan una forma cuboidea, con pérdida de la continuidad de las uniones estrechas intercelulares, y se conforman los cambios típicos de una gastritis aguda antral. Este proceso dura dos semanas.
En la medida que la respuesta inflamatoria aguda se va atenuando, comienzan a llegar los linfocitos y monocitos, y se inicia en esta forma una reacción inflamatoria crónica, puesto que la respuesta humoral por medio de la formación de anticuerpos es incapaz de eliminar la bacteria. Esto explica que no haya erradicación espontánea de HP (Figura 3).
Figura 3. Patogénesis de infección por H pylori.
La infección por HP es un factor clave en la etiología de la enfermedad ácido- péptica, pero el mecanismo preciso que permite transitar desde la infección hasta la úlcera no está completamente dilucidado.
Los estudios demuestran:
La infección por HP generaría los siguientes cambios fisiopatológicos:
Incremento de la secreción ácida
La infección crónica por HP lleva a un incremento de la secreción basal y post estimulación del ácido gástrico, por un aumento de la gastrina, la que ejerce una acción trófica sobre las células parietales y una mayor liberación de histamina desde las células enterocromafines.
Normalmente, la secreción gástrica está controlada por un inhibidor de la gastrina, que es la somatostatina. En pacientes con infección por HP, la concentración de somatostatina está disminuida. Tras la erradicación del HP, los niveles de gastrina disminuyen y los de somatostatina aumentan, de tal manera que se consigue un equilibrio en la secreción ácida gástrica.
Metaplasia gástrica
Es la presencia de epitelio gástrico en la primera porción del duodeno y se debe a la excesiva exposición de la mucosa duodenal al medio ácido. Esta metaplasia cumpliría un papel en el desarrollo de la duodenitis (88% de los pacientes con duodenitis presentan metaplasia gástrica). El HP se puede encontrar en las biopsias de la metaplasia gástrica, acompañado de infiltrado polimorfonuclear. Su presencia conlleva una mayor injuria de este tejido metaplásico y aumenta el riesgo de ulcera duodenal.
Respuesta inmune
El HP estimula al sistema inmune y produce citoquinas (IL-1,6,8; TNF alfa), las cuales conllevan una serie de reacciones y estímulo de células que terminan por causar daño de la mucosa. Es importante la estimulación prolongada de los linfocitos B en la patogenia del linfoma MALT.
Factores de defensa de la mucosa
El HP es capaz de alterar los mecanismos de defensa porque:
Otros factores
Sólo 10%-15% de los pacientes con HP tienen úlcera duodenal; por lo tanto, otros factores cumplen algún papel, como son:
Los pacientes con úlcera duodenal y HP positivo deben recibir tratamiento de erradicación. Con esto se logra lo siguiente:
Antes de causar úlcera gástrica, el HP se desplaza desde el antro hacia el cuerpo gástrico, en forma multifocal; esto causa atrofia grave y baja la secreción de ácido. Además, la inflamación que ocasiona la bacteria altera las defensas de la mucosa y facilita la formación de la úlcera.
Se debe considerar el reflujo duodeno gástrico, que contribuye a lesionar la mucosa por la presencia de sales biliares y existe un vaciamiento gástrico retardado.
Definición
Es un linfoma tipo B extranodal del tejido linfoídeo asociado con la mucosa. Se define también como linfoma de células B de la zona marginal extranodal tipo MALT. Representa 7,6 % de los linfomas no Hodgkin. El linfoma MALT gástrico representa entre 1% y 7 % de las neoplasias gástricas, afecta más a hombres y la incidencia es de 1 caso/10.000 habitantes/año.
Otra especie de Helicobacter, el H. Heilmanii se encuentra en animales y en el hombre se ha asociado con linfoma MALT y cáncer gástrico.
El linfoma MALT se clasifica como sigue:
El mecanismo más aceptado en la patogénesis del linfoma MALT es que los linfocitos B y T son reúnen en la mucosa como parte de la respuesta inmune contra el HP. Los estudios señalan que la proliferación de los linfocitos B es secundaria a la activación específica de linfocitos T, dada la presencia del HP y la producción de citoquinas. Aún no está claro si esta proliferación de los linfocitos B necesita la presencia constante del HP como un factor antigénico, o si se debe a un mecanismo autoinmune indirecto. El estímulo inmunológico que dan los linfocitos T de la mucosa explica la tendencia que muestra el linfoma MALT de bajo grado a permanecer localizado y regresar después de erradicar el HP. Las alteraciones genéticas se mantienen hasta que se alcanza una etapa de crecimiento autónomo que culmina, finalmente, en la transformación de un linfoma de bajo grado en un linfoma de alto grado primario originado sin una etapa de transformación. Además, el hecho de que una minoría de los pacientes infectados por HP lleguen a tener un linfoma MALT, permite plantear que ciertos factores, ya sean ambientales, genéticos: mutación, deleción, t (11;18) (q 21;q21) o bacteriológicos (Cag-A), puedan tener un papel en su patogenia.
Numerosos estudios han demostrado una asociación entre infección por HP y linfoma MALT, con las conclusiones siguientes:
El cáncer gástrico es la segunda causa más frecuente de muerte relacionada con cáncer. Esta neoplasia, según su ubicación, se divide en gastroesofágica, proximal y distal. Los dos primeros tipos con un mecanismo patogénico diferente del distal. Más de 90 % de los tumores son adenocarcinomas, otros son linfoma, carcinoide y GIST.
El adenocarcinoma gástrico puede ser de tipo intestinal o difuso. El primero presenta varias etapas: gastritis superficial, gastritis atrófica crónica, metaplasia intestinal, displasia y cáncer.
Hay fuerte evidencia de que el HP incrementa el riesgo de adenocarcinoma gástrico y desde 1994 está clasificado como carcinógeno tipo I (definitivo), principalmente con base en los estudios seroepidemiológicos de casos - control. La evidencia adicional acumulada incluye modelos animales. En un reciente estudio prospectivo de 1526 pacientes japoneses, el cáncer gástrico se desarrolló en 2,9% de 1246 pacientes con infección por HP sobre 7,8 años; en cambio, se observó cáncer no gástrico en 280 pacientes controles no infectados. Lo más importante es que no se detectó ningún caso de cáncer en un subgrupo de 253 pacientes infectados, quienes recibieron terapia de erradicación.
Los mismos investigadores demostraron que la erradicación del HP previene la recaída después de la resección endoscópica del cáncer gástrico temprano.
Los resultados de los estudios de intervención para erradicar el HP en la incidencia del cáncer gástrico pueden tener mayores consecuencias para las políticas globales, en el tratamiento y la prevención de la infección por HP.
El mecanismo patogénico del HP es, probablemente, una progresión de la gastritis crónica superficial hacia la atrofia, con extensión más profunda de las células inflamatorias y atrofia de las glándulas propias antrales y del cuerpo; la aparición temprana en la vida y la persistencia de la infección por HP; el consumo deficiente de verduras frescas y frutas ricas en vitaminas antioxidantes pueden ser factores contribuyentes. Las vitaminas C y E, retinol, betacaroteno, ácido ascórbico y tocoferol comparten, con tioles no proteicos y las enzimas superanión dismutasa y glutatión peroxidasa, la capacidad para disminuir la concentración de radicales libres en los tejidos. La infección por HP disminuye la concentración gástrica de ácido ascórbico. La ingestión excesiva de sal, nitratos u otros irritantes de la mucosa y el bajo consumo de antioxidantes pueden ser determinantes para la gastritis crónica atrófica y las lesiones premalignas en el cáncer de tipo intestinal.
La gastritis crónica atrófica puede llevar al pH básico que favorece el sobrecrecimiento bacteriano y, como consecuencia, a niveles aumentados de nitritos y compuestos N-nitroso mutagénicos y carcinogénicos en el lumen gástrico.
La incidencia de gastritis crónica asociada con HP con metaplasia intestinal es alta en los países en vías de desarrollo y aumenta con la edad.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sección de Gastroenterología del Hospital Clínico Universidad de Chile.
 Expositores:
Ivonne Orellana[1], Jaime Poniachik[1]
Expositores:
Ivonne Orellana[1], Jaime Poniachik[1]

Citación: Orellana I, Poniachik J. Infection with Helicobacter pylori. Medwave 2003 May;3(4):e2337 doi: 10.5867/medwave.2003.04.2337
Fecha de publicación: 1/5/2003

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión