 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sección de Gastroenterología del Hospital Clínico Universidad de Chile.
Definición
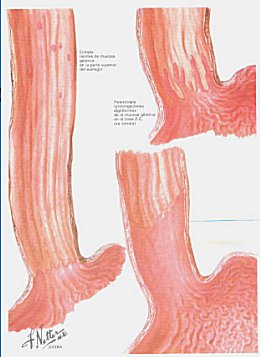
El esófago de Barrett (EB) es la condición en la cual se reemplaza el epitelio escamoso estratificado que se encuentra en el esófago distal por un epitelio columnar anormal (Figura 1). Se desarrolla cuando el reflujo gastroesofágico, debido a hiperacidez, daña el epitelio escamoso de la mucosa; el daño producido se repara posteriormente mediante metaplasia.
Figura 1. Esófago de Barrett.
Diagnóstico
El diagnóstico se basa en los hallazgos endoscópicos y se confirma con la histología, la que demuestra presencia de metaplasia intestinal especializada, es decir, células caliciformes.
Epidemiología
Es más frecuente en pacientes cuya edad fluctúa entre 55 y 65 años, hombres caucásicos, obesos, fumadores, con RGE crónico de larga evolución, trastornos de motilidad esofágica distal, sobre todo incompetencia del esfínter esofágico inferior, alteración en el vaciamiento gástrico y hernia hiatal de gran tamaño.
La presencia de EB es factor de riesgo para la génesis de adenocarcinoma esofágico. En algunas series, la incidencia de cáncer en esta población es de 0,5% por año.
Clínica
Es asintomático. La mayoría de los pacientes consulta al gastroenterólogo por los síntomas asociados a RGE: pirosis, regurgitación y disfagia. El RGE puede complicarse con ulceración, estenosis, hemorragia y EB.
El EB obvio a la endoscopía se puede ver en 10% de los pacientes con RGE. La fiabilidad de este examen para detectar EB es cercana a 80%. El diagnóstico definitivo es histológico.
Hay controversia, porque el concepto teórico del EB no es fácil de trasladar al criterio práctico; si consideramos, por ejemplo, que no hay márgenes que delimiten con precisión el final del esófago. La unión gastroesofágica recibe una definición diferente según anatomistas, radiólogos, fisiólogos, patólogos y endoscopistas, por lo que la ubicación de esta unión, según el criterio que se utilice, puede variar en algunos centímetros.
Endoscopía
A la endoscopía, el epitelio columnar se aprecia de color rojizo, con textura aterciopelada, distinto del epitelio escamoso, que presenta un color pálido, brillante o lustroso (blanco nacarado). A veces, se observa prolongaciones del EB que se extienden desde la unión escamocolumnar o áreas continuas en el esófago distal, o hay islotes en la mucosa escamosa, aparentemente normal.
Los autores han formulado clasificaciones arbitrarias para incluir a los pacientes en diferentes estudios y se han utilizado dos términos para describir la presencia de metaplasia intestinal en el esófago distal:
Barrett de segmento corto
Este término se usa en los pacientes que tienen menos de tres centímetros de revestimiento con metaplasia intestinal especializada en el esófago distal.
La incidencia del EB de segmento corto es mayor que la del EB largo. Un estudio, en 889 pacientes sometidos a endoscopía, demostró una incidencia global de 13,2%; EB largo 1,6%; EB corto 6,4%; metaplasia de la unión 5,6%.
El riesgo de displasia de alto grado y adenocarcinoma, en EB corto, es bajo. En un estudio se demostró que los pacientes con EB corto presentan baja incidencia de displasia, porque tienen menos mucosa comprometida (6% a 8% frente a 15% a 24%, en pacientes con EB largo, en un seguimiento de 40 meses). El riesgo de adenocarcinoma es dos a quince veces mayor en pacientes con EB largo.
El manejo tiene tres objetivos:
Tratamiento del reflujo gastroesofágico
El propósito de la terapia antirreflujo es aliviar los síntomas del RGE, mejorar sus signos y prevenir complicaciones. Esto significa suprimir la secreción ácida mediante la administración de antagonistas de los receptores de histamina 2 (H2), o los inhibidores de la bomba de protones (ambos aprobados por la FDA).
Antagonistas del receptor de histamina 2 (H2): Los pacientes con EB corto a menudo presentan esofagitis leve (grado 0-1); en estos casos, los antagonistas H2 (ranitidina 300 mg/día) pueden ser suficientes y se logra 50% a 70% de eficacia. Los estudios demuestran que los síntomas de estos pacientes pueden mejorar. Cuanto más prolongada es la terapia, mejor es la respuesta, la que resulta inversamente proporcional al daño previo de la mucosa. Cuanto menos daño haya, mejor será la respuesta, pero, como es una patología crónica, la suspensión del tratamiento significará que los síntomas recidiven. En este aspecto, el manejo es controvertido. No se puede definir un tiempo límite de administración del tratamiento. La resolución de los síntomas no se correlaciona bien con la curación de la mucosa. Los dos aspectos son directamente proporcionales al tiempo de tratamiento.
Inhibidores de la bomba de protones: Los pacientes con esofagitis moderada, grado 2 a 4, se beneficiarían con el uso de inhibidores de la bomba de protones: omeprazol 20 mg/día, lanzoprazol 30 mg/día, que reducen la secreción ácida en más de 90%, pero si se efectúa pHmetría de 24 horas se verá que el reflujo ácido continúa y se necesita, además de la dosis nocturna de bloqueador H2, un inhibidor de la bomba de protones dos veces al día, para lograr la aclorhidria casi completa.
La conveniencia de esta terapia es debatible, en cuanto al tiempo y el fármaco que se debe usar, si se considera que no está probada para disminuir el riesgo de adenocarcinoma esofágico. Algunos estudios han demostrado aparente regresión, pero la histología señala áreas de metaplasia, a veces con displasia, cubierta por epitelio escamoso.
Cirugía
Es una alternativa al manejo del reflujo. Se ha realizado fundoplicatura-Nissen con buena respuesta; 90% de los pacientes se mantienen asintomáticos a tres años. Si se realiza seguimiento a largo plazo, estos pacientes pueden recidivar. Algunos autores plantean que la fundoplicatura puede ser más eficaz que la terapia antisecretora, para prevenir la muerte por cáncer en EB. En un estudio aleatorio con asignación a tratamiento médico o quirúrgico, en 247 pacientes con RGE complicado, el adenocarcinoma esofágico se desarrolló en 4 pacientes entre los 165 pacientes del grupo médico (2,4%) y en 1 entre 82 pacientes del grupo quirúrgico (1,2%), durante 10 a 13 años de seguimiento: No hubo diferencia estadísticamente significativa.
Alternativas de tratamiento
Otras opciones terapéuticas son las técnicas ablativas de electrocoagulación multipolar o coagulación térmica con argón plasma (APC). Se aplican en varias sesiones y dan buenos resultados para erradicar la mucosa de tipo Barrett, en general sin recaídas a largo plazo; necesitan hospitalización; se realizan por segmentos y su costo es alto. La técnica con APC presenta más efectos adversos (dolor torácico y disfagia, ambos transitorios). Se recomienda mantener el bloqueo de la secreción ácida con inhibidores de la bomba de protones, después de la ablación y, al mes de tratamiento, se debe hacer control con biopsias. Las biopsias anteriores y posteriores al tratamiento son fundamentales para descartar neoplasia o EB subterráneo.
Las terapias ablativas permanecen en fase experimental. Estas modalidades se pueden considerar, siempre y cuando se realicen como parte de protocolos establecidos.
Vigilancia endoscópica
Se basa en el supuesto de que el EB influye inversamente en la sobrevida, porque está asociado con la presencia de adenocarcinoma. El objetivo es diagnosticar la presencia de adenocarcinoma en etapas tempranas, prolongar la sobrevida del paciente y reducir la mortalidad por esta causa, pero el beneficio no está demostrado en estudios prospectivos aleatorios, los que se podrían prohibir por su larga duración y costo elevado. Además, el diseño experimental aumentaría los problemas éticos y prácticos.
Se estima que la incidencia anual de cáncer en pacientes con EB fluctúa entre 0,2% y 2%.
Puede influir en este cálculo el sesgo de las publicaciones. Una incidencia anual cercana a 0,5% puede ser más precisa si se ajusta este defecto. El riesgo de presentar cáncer esofágico es 30 veces mayor en los pacientes con EB que en la población general.
A pesar de esta mayor incidencia, el cáncer no aparece como causa frecuente de muerte en pacientes con EB; por ejemplo, los ancianos fallecen de otras enfermedades antes de presentar cáncer. No hay estudios en poblaciones jóvenes portadoras de EB; en ellas se debe realizar vigilancia, la que aportaría información para el tratamiento, en especial si consideramos que el cáncer esofágico ha aumentado en las dos últimas décadas.
Displasia
La variable más importante es el grado de displasia; según ella se realiza el programa de vigilancia. La displasia como marcador de riesgo presenta varios problemas, entre ellos:
En la historia natural de la displasia de alto grado, ella puede persistir durante años sin desarrollar cáncer y es menos probable que regrese.
Consenso sobre manejo de EB
Un consenso de la Sociedad Americana de Gastroendoscopía y el Colegio Americano de Gastroenterología plantea que los pacientes con EB deben someterse a EDA y biopsias de los cuatro cuadrantes, por cada dos centímetros de longitud del área de epitelio metaplásico, para detectar presencia de displasia (Figura 2).
En los pacientes con EB sin displasia, en dos endoscopías separadas por tres a seis meses, se recomienda vigilancia endoscópica cada tres a cinco años.
En los casos de displasia de bajo grado, la endoscopía debe realizarse cada seis meses durante un año, y luego anualmente.
Si hay displasia de alto grado, se debe analizar cada caso en particular. Hay tres opciones de manejo: esofagectomía, terapia ablativa y vigilancia endoscópica cada tres meses. La esofagectomía, que puede impedir la progresión a cáncer invasor, se asocia con una mortalidad que fluctúa entre 3% y 12%, y complicaciones quirúrgicas entre 30% y 50%. La terapia ablativa usa energía térmica o fotoquímica para destruir el epitelio metaplásico. Un estudio de seguimiento de 19 meses no reveló displasia y sólo hubo efectos perjudiciales menores; la estenosis esofágica se presentó en un tercio de los pacientes. Esta terapia es de alto costo y a veces no logra erradicar todo el tejido displásico.
Figura N° 2. Algoritmo en esófago de Barrett.
Alternativas de vigilancia
Por las dificultades de los programas de vigilancia endoscópica, en presencia de displasia, se estudia la utilización de marcadores biológicos y nuevas técnicas, entre las que se encuentran las siguientes:
Hay un número anormal de cromosomas en varios tipos de cáncer. Se pueden detectar por citometría de flujo y son marcadores de la progresión histológica en esófago de Barrett.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La publicación de estas Actas Científicas ha sido posible gracias a una colaboración editorial entre Medwave y la Sección de Gastroenterología del Hospital Clínico Universidad de Chile.
 Expositora:
Ivonne Orellana Narváez[1]
Expositora:
Ivonne Orellana Narváez[1]

Citación: Orellana I. Barrett's esophagus. Medwave 2003 Ago;3(7):e2341 doi: 10.5867/medwave.2003.07.2341
Fecha de publicación: 1/8/2003

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Shaheen NJ, Crosby MA, Bozymnski EM, Sandler RS. Is there publication bias in the reporting of cancer risk in Barrett's esophagus? Gastroenterology. 2000 Aug;119(2):333-8. | CrossRef | PubMed |
Shaheen NJ, Crosby MA, Bozymnski EM, Sandler RS. Is there publication bias in the reporting of cancer risk in Barrett's esophagus? Gastroenterology. 2000 Aug;119(2):333-8. | CrossRef | PubMed | Lagergren J, Bergstrom R, Lindgren A, Nyrén O. Symptomatic gastro-esophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med. 1999 Mar 18;340(11):825-31. | CrossRef | PubMed |
Lagergren J, Bergstrom R, Lindgren A, Nyrén O. Symptomatic gastro-esophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med. 1999 Mar 18;340(11):825-31. | CrossRef | PubMed | Sharma P, Morales TG, Sampliner RE. Short segment Barrett's esophagus- the need for standardization of the definition and of endoscopic criteria. Am J Gastroenterol. 1998 Jul;93(7):1033-6. | PubMed |
Sharma P, Morales TG, Sampliner RE. Short segment Barrett's esophagus- the need for standardization of the definition and of endoscopic criteria. Am J Gastroenterol. 1998 Jul;93(7):1033-6. | PubMed | Spechler SJ. Clinical practice. Barrett's Esophagus. N Engl J Med. 2002 Mar 14;346(11):836-42. | CrossRef | PubMed |
Spechler SJ. Clinical practice. Barrett's Esophagus. N Engl J Med. 2002 Mar 14;346(11):836-42. | CrossRef | PubMed | Jensen D. Esófago de Barrett: ¿Tratamiento ablativo? Gastr Latinoam 2003; Vol 14, Nº 1: 22-25 | Link |
Jensen D. Esófago de Barrett: ¿Tratamiento ablativo? Gastr Latinoam 2003; Vol 14, Nº 1: 22-25 | Link |